El objetivo de este trabajo es analizar los hallazgos en resonancia magnética testicular (RMt) y el tipo histopatológico de las lesiones para determinar qué características relacionadas con las imágenes pueden constituir predictores de malignidad.
Materiales y métodosSe analizaron de manera retrospectiva 46 pacientes con lesiones testiculares, a quienes se evaluó inicialmente con ultrasonido (US) y luego con RMt empleando un equipo de 1,5 teslas. Los estudios de resonancia magnética (RM) fueron analizados por un radiólogo con 8 años de experiencia en RMt. Los hallazgos en las imágenes como el tamaño de la lesión, la intensidad de señal en secuencias T1, T2, y el realce tras la administración de contraste se correlacionaron con el diagnóstico de anatomía patológica (AP). Se estudió la sensibilidad, la especificidad, el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN).
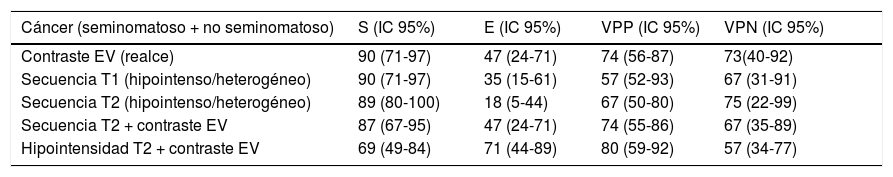
ResultadosEl realce tras administración de contraste fue el hallazgo de mejor performance con una sensibilidad, especificidad, VPP y VPN de 90 (71-97), 47 (24-71), 74 (56-87) y 73 (40-92), respectivamente. Los resultados para las lesiones hiperintensas, hipointensas o heterogéneas en secuencias ponderadas en T2 y con realce con el contraste endovenoso fueron de 87 (49-84), 47 (44-89), 74 (55-86) y 67 (35-89), respectivamente (sensibilidad, especificidad, VPP y VPN).
ConclusiónEl hallazgo de una lesión testicular de baja intensidad de señal y/o heterogénea en secuencias T2, con realce con contraste EV representa un valioso predictor de malignidad. Siendo esta última característica la más sensible como predictor de malignidad en las imágenes.
The purpose of our study is to analyze the imaging findings described in MRI and the histopathologic type of testicular lesions to determine which findings are the best predictors of malignancy.
Materials and methodsForty six (46) patients with testicular lesions were initially studied with ultrasound (US) and with testicular MRI (tMRI) on a 1.5-T magnet. MRIs were reviewed by a radiologist with 8 years of experience and imaging findings such as the size of the lesion, the signal intensity in T1, T2 weighted sequences, and the enhancement after endovenous contrast administration, were correlated with the histopathologic diagnosis. Sensitivity, specificity, positive predictive value (PPV) and negative predictive value (NPV) were analyzed.
ResultsThe enhancement after administration of contrast was the finding of better performance with a sensitivity, specificity, PPV and NPV of 90 (71-97), 47 (24-71), 74 (56-87) and 73 (40-92), respectively. Meanwhile, the results for hypointense/heterogeneous lesions in T2 weighted sequences and with enhancement with intravenous contrast were 87 (49-84), 47 (44-89), 74 (55-86) y 67 (35-89), respectively.
ConclusionThe finding of a testicular lesion of low signal intensity and heterogeneous in T2 weighted sequences, with IV contrast enhancement represents a valuable predictor of malignancy. The latter being the most sensitive as a predictor of malignancy.
El cáncer testicular es una enfermedad frecuente en pacientes jóvenes con una alta tasa de éxito en su tratamiento1. La prevalencia reportada en Argentina para el año 2019 es de 7,3 casos cada 100.000 habitantes, según The International Agency for Research on Cancer (IARC)2. Los métodos por imágenes han adquirido cada vez más importancia para un diagnóstico temprano y oportuno, una evaluación más precisa de las características tumorales y el grado de extensión a estructuras adyacentes, facilitando tratamientos más precisos y conservadores permitiendo, además, en algunos casos, evitar intervenciones innecesarias3.
El ultrasonido (US) en modo B acompañado de examen Doppler color continúa siendo el método de elección para comenzar en el estudio con imágenes de enfermedad testicular, permite distinguir entre lesiones intra y extratesticulares, si se trata de una formación sólida o quística, además de valorar la vascularización de la lesión y extensión a tejidos circundantes4,5.
Sin embargo, en algunos casos donde los hallazgos ecográficos no son concluyentes o resultan inespecíficos (incongruencia entre cuadro clínico/laboratorio/US) o, en lesiones no palpables detectadas por US, la resonancia magnética (RM) es un método suplementario de gran valor1,4–6.
Mediante el análisis de las características tisulares en las diferentes secuencias y el comportamiento con el contraste endovenoso (EV), la resonancia magnética testicular (RMt) puede caracterizar lesiones benignas en las que el US puede no ser concluyente; puede mejorar la caracterización de las lesiones malignas intratesticulares, así como diferenciar lesiones intra, para o extratesticulares, donde el US resulta insuficiente5.
Tsili et al.3, en su trabajo con la Sociedad Europea de Radiología Urogenital en el año 2018, avalan la utilización de la RM, como método complementario en el diagnóstico y planificación terapéutica de la enfermedad tumoral3,5.
El objetivo de este trabajo es analizar qué características de las imágenes en la RMt tienen mejor performance para detección y caracterización de lesiones malignas.
Material y métodosEstudio retrospectivo, observacional y analítico-descriptivo, que incluye pacientes mayores de 18 años con tumor testicular confirmado por anatomía patológica que tengan RM realizadas en nuestro hospital entre enero del 2010 y 31 de marzo de 2018.
El estudio se realizó Conforme a la Ley Nacional de Protección de Datos Personales 25.326 y con la autorización del Comité de Ética en los Protocolos de Investigación (CEPI) de nuestra institución
Técnica de resonancia magnéticaLa adquisición de RMt con gadolinio se realizó en equipos 1,5 tesla (Magnetom Avanto y Essenza Siemens, Erlangen, Alemania). Se obtuvieron secuencias potenciadas en T2 turbo spin eco (T2-TSE) en planos axial, sagital y coronal, potenciadas en T1-TSE con supresión grasa en plano axial, sin contraste EV, para posicionar estas secuencias se empleó como referencia el eje longitudinal del testículo.
Se emplearon secuencias potenciadas en T1 TSE volumétricas coronales con supresión grasa pre y post administración intravenosa de 0.1ml/kg de contraste de gadolinio (Gadobutrol, Gadovist: Bayer, Berlín, Alemania) seguido de 10ml de solución fisiológica con adquisición de imágenes dinámicas con valoración de la sustracción, y posterior secuencias axiales y sagitales T1 STE.
Además, se realizó secuencia coronal T2 TSE orientada al retroperitoneo (de arterias renales a bifurcación aórtica para la búsqueda de formaciones ganglionares).
Análisis de las imágenes de resonancia magnéticaLas RM fueron analizadas por un médico radiólogo con experiencia de 8 años (JO) en imágenes urogenitales.
Estándar de referenciaPara fines de validación, todos los diagnósticos de lesiones testiculares mediante RM fueron confirmados con los resultados de la anatomía patológica de la pieza quirúrgica.
Análisis estadísticoLas variables continuas se resumen como su mediana y rango (r). Las variables categóricas se expresan como su valor absoluto y porcentaje (%). En todos los casos se calculó sensibilidad (S), especificidad (E), valor predictivo positivo y negativo (VPP y VPN) con sus respectivos intervalos de confianza al 95% (IC 95%). El software empleado fue el SPSS® 18.0 (r).
ResultadosDe 46 pacientes, la edad promedio de presentación de enfermedad fue de 41 (18-69) años, el tamaño promedio de lesión fue de 10,4mm (considerándose lesión palpable mayor a 15mm) y 28 (61%) localizadas en testículo derecho.
Veintinueve pacientes (63%) presentaron lesiones malignas. De estos, 17 (59%) se reportaron como seminomas y 12 (41%) como neoplasias no seminomatosas.
La sensibilidad, especificidad, VPP y VPN para lesiones malignas (comportamiento en secuencia T1, secuencia T2, contraste EV y variables combinadas) seminomatosas y las no seminomatosas se especifíca en la tabla 1.
Análisis de la sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo para cáncer seminomatoso y no seminomatoso
| Cáncer (seminomatoso + no seminomatoso) | S (IC 95%) | E (IC 95%) | VPP (IC 95%) | VPN (IC 95%) | |
|---|---|---|---|---|---|
| Contraste EV (realce) | 90 (71-97) | 47 (24-71) | 74 (56-87) | 73(40-92) | |
| Secuencia T1 (hipointenso/heterogéneo) | 90 (71-97) | 35 (15-61) | 57 (52-93) | 67 (31-91) | |
| Secuencia T2 (hipointenso/heterogéneo) | 89 (80-100) | 18 (5-44) | 67 (50-80) | 75 (22-99) | |
| Secuencia T2 + contraste EV | 87 (67-95) | 47 (24-71) | 74 (55-86) | 67 (35-89) | |
| Hipointensidad T2 + contraste EV | 69 (49-84) | 71 (44-89) | 80 (59-92) | 57 (34-77) |
E: especificidad; EV: endovenoso; IC 95%: intervalo de confianza del 95%; S: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Los tumores testiculares representan aproximadamente el 1% de las neoplasias en hombres, siendo la más común en jóvenes (18-35 años)1,7. El manejo quirúrgico y adyuvante es considerado un éxito oncológico por las altas tasas de curabilidad8.
Las 2 principales categorías histológicas son tumores de células germinales, incluyendo seminomas y no seminomas (90-95%), y tumores de estroma del cordón sexual (5%)7.
En la actualidad el examen físico y el US con transductores de alta frecuencia y Doppler color son las herramientas recomendadas en la evaluación inicial de la enfermedad testicular, no obstante, existe un grupo de pacientes en que los resultados ultrasonográficos y del examen físico son subóptimos, discordantes o no concluyentes, lo que puede conducir a procedimientos o cirugías innecesarias. La RMt puede aportar información de gran utilidad en la toma de decisiones o conductas terapéuticas; es particularmente útil en los pacientes con lesiones no palpables (tamaño menor a 1,5cm). La información brindada por este método es de gran ayuda al especialista (urólogo, andrólogo) en la toma de decisión terapéutica, así como en el consejo al paciente9,10.
La RMt representa una valiosa herramienta complementaria para el estudio de las masas intratesticulares, ha demostrado ser precisa y es recomendada como una técnica de segunda línea en la resolución de problemas diagnósticos en pacientes con lesiones testiculares.
Sus principales ventajas incluyen una detallada resolución anatómica, la precisa identificación de la ubicación tumoral y relación con la túnica albugínea, valiosa información morfológica y excelente capacidad para determinar la composición y caracterización de tejidos: grasa, restos hemáticos, fibrosis, líquido, reemplazo hialino y tejido granulomatoso. Además, el comportamiento con el contraste facilita la diferenciación de lesiones benignas y malignas9–11.
Los tumores de células germinales no seminomatosos y estromales generalmente presentan isointensidad de señal en secuencias ponderadas en T17; hallazgo de bajo VPP y señal baja y heterogénea en secuencias ponderadas en T2. Estos tumores, rara vez poseen quistes o calcificaciones y realzan en forma heterogénea tras la administración de contraste endovenoso con «washout» progresivo7,12. Pueden evidenciar zonas de hemorragia, necrosis y signos de extensión a la túnica albugínea, espacios paratesticulares o cordones espermáticos. En el comportamiento reportado de tumores seminomatosos encontramos, a diferencia de los no seminomatosos, una hipointensidad de señal en secuencias T2, bordes lobulados, realce homogéneo, bandas y septos hipointensos que realzan con mayor avidez tras la administración de contraste. Dichos hallazgos en nuestro grupo son coincidentes con lo reportado (tabla 2).
Diferencias entre tumores seminomatosos o no seminomatosos en resonancia magnética
| Resonancia magnética | Seminomatoso | No seminomatoso |
|---|---|---|
| Secuencia T1 | Isointenso | Isointenso |
| Secuencia T2 | Hipointenso | Hipointenso/heterogéneo |
| Contraste endovenoso | Homogéneo + «wash out» incompleto | Heterogéneo + «wash out» completo |
| Hemorragia /necrosis | Sía | Si |
| Septos/tabiques/lobulaciones | Sí | Inconstante |
RM: resonancia magnética; NS: no seminomatoso; S: seminomatoso.
*Sujeto a velocidad y tiempo de crecimiento en tamaño del tumor.
Es necesario tener en cuenta que el aumento progresivo del tamaño o lesiones voluminosas son propensas a presentar necrosis o áreas de hemorragia, transformando estas lesiones homogéneas en heterogéneas, incluso en tumores seminomatosos1,6,13,14 (figs. 1 y 2fig. 2).
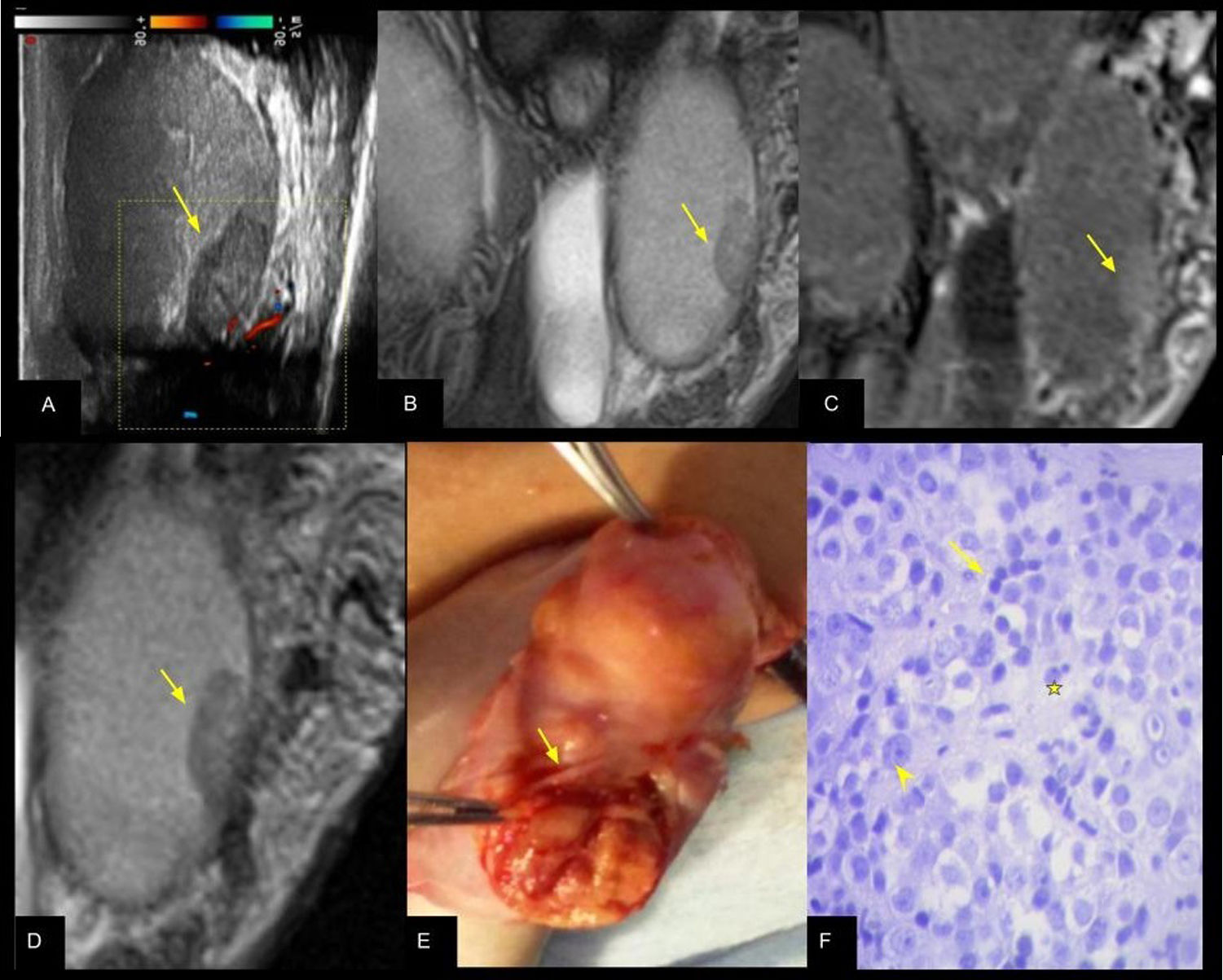
Seminoma espermatocítico: A) US testicular con transductor lineal y Doppler color, que evidencia lesión nodular levemente hipoecogénica y en contacto con la albugínea del polo inferior del testículo izquierdo sin vascularización (flecha). RMt secuencia T2 coronal (B) y secuencia T1 saturación grasa con contraste EV (C), que muestra la misma formación hipointensa y con realce homogéneo (flechas en B y C). D) Magnificación en secuencia T2 y (E) correlación con exposición quirúrgica luego de seleccionada la albugínea. F) Microscopía, tinción H&E ×100. El análisis histopatológico en (F) muestra los tipos celulares característicos de este tipo de tumor: células pequeñas seudolinfocitas (flecha), células intermedias (estrella) y células grandes dispersas de uno o más núcleos (cabeza de flecha).
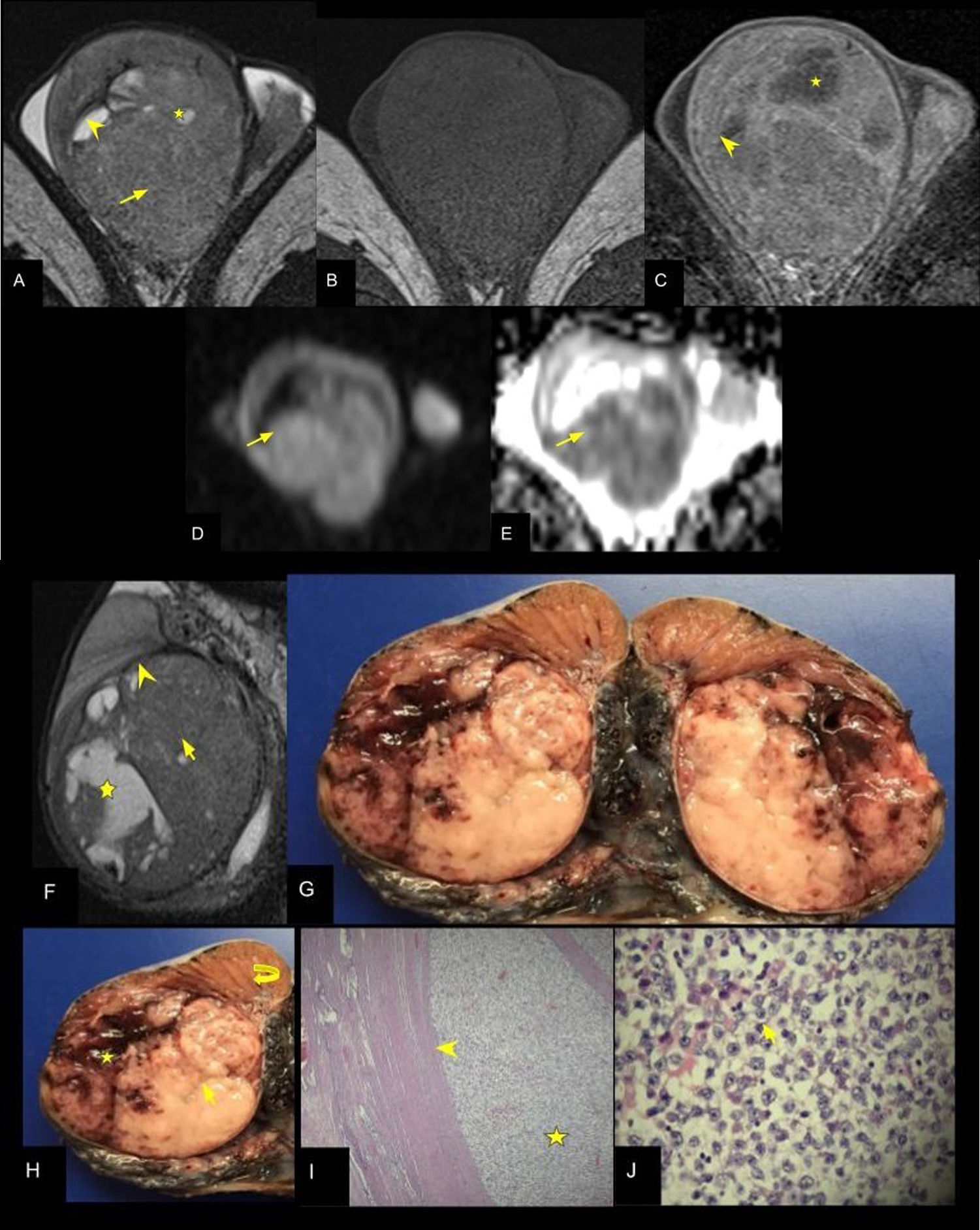
Seminoma clásico: RMt (A) Secuencia axial T2. B) Secuencia axial T1 saturación grasa sin y (C) con contraste EV. D) Secuencia DWI 800. E) Mapa ADC en el mismo plano, que evidencian testículo derecho aumentado de tamaño a expensas de imagen heterogénea con predominio de sectores hipointensos sólidos (flecha) respecto al parénquima testicular, seudocápsula (cabeza de flecha) y áreas hiperintensas atribuibles a necrosis (estrella). Las secuencias de difusión muestran restricción de los sectores sólidos (flechas). F) Secuencia sagital T2 en (G-H) correlación macroscópica de pieza quirúrgica (orquiectomía total) seccionada en el plano sagital. I) Microscopía, tinción H&E ×100. J) Microscopía, tinción H&E ×400. La concordancia entre la RMt en (F) y superficie de corte de la pieza muestra la coincidencia: sectores sólidos (flecha), seudocápsula (cabeza de flecha) y áreas de necrosis (estrella). La microscopía muestra en (I) la rete testis (flecha curva) y adyacente un área de proliferación celular (estrella) que forma acinos y en (J) células de citoplasma claro y núcleos prominentes (flecha) características de seminoma.
Entre los diagnósticos diferenciales con las lesiones benignas se mencionan orquitis con absceso, infartos, hematomas y esclerohialinosis. Estas entidades suelen coexistir y pueden resultar indistinguibles de las lesiones malignas en US, ya que dependiendo del momento de evolución, su ecogenicidad y señal Doppler pueden variar, por lo cual la RMt tiene indicación como método de segunda línea con la finalidad de excluir enfermedad tumoral maligna testicular6 (fig. 3).
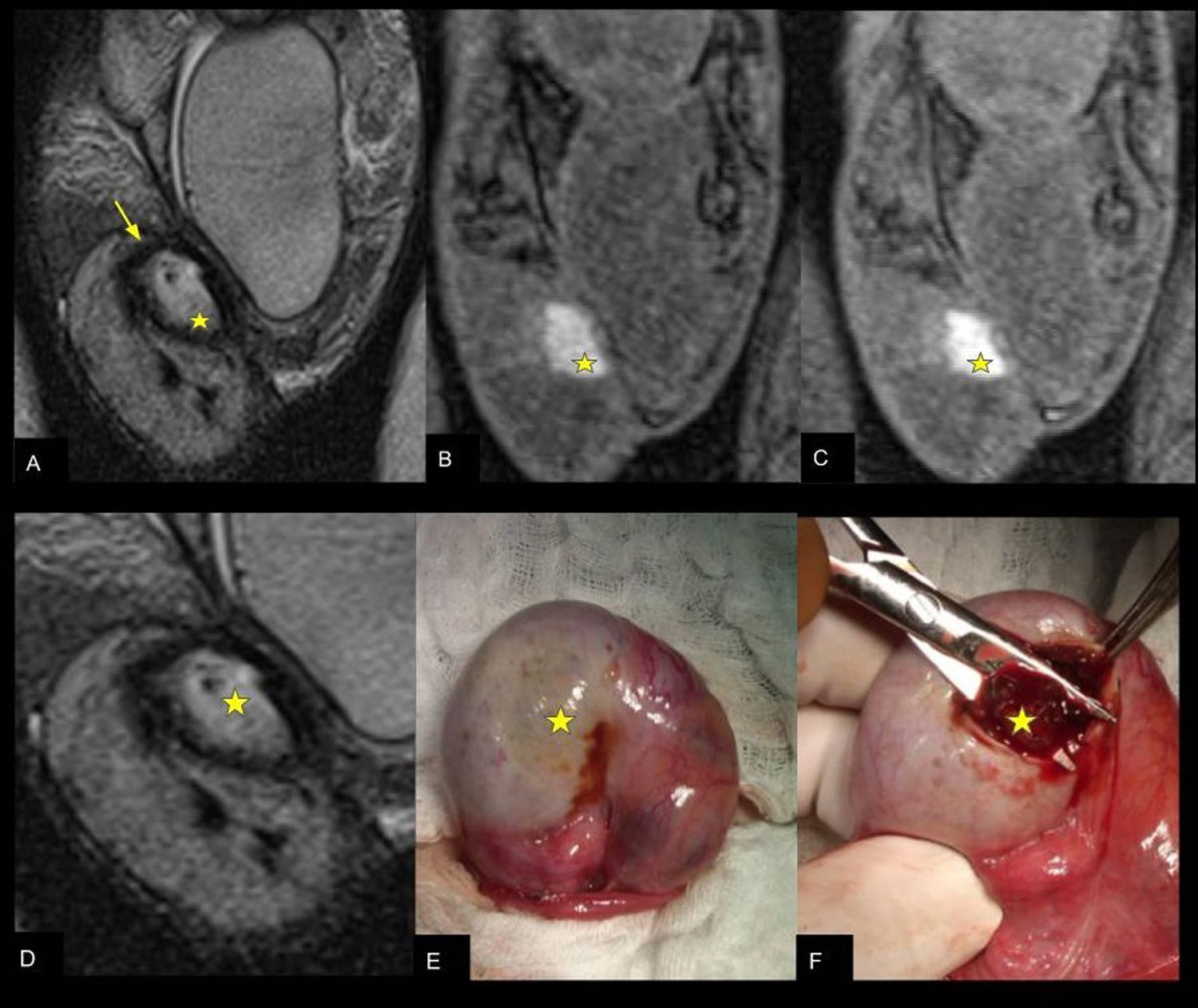
Hematoma intratesticular: RMt (A) secuencia T2 coronal (B) T1 coronal saturación grasa sin contraste y (C) con contraste EV. Se evidencia formación hiperintensa en secuencia T2 y T1 en el polo superior del testículo derecho (estrella) con halo hipointenso circundante en secuencia T2 (flecha en A) sin realce. D) Ampliación T2 coronal y (E) correlación intraquirúrgica previo a la apertura de la túnica albugínea donde puede apreciarse por transparencia el hematoma y (F) posterior a la sección de la túnica albugínea durante la evacuación del mismo (estrella en D-F).
Dentro de dichos diagnósticos diferenciales destacamos la esclerohialinosis que representa un proceso de reemplazo de parénquima testicular por fibrosis y ocupación de los túbulos seminíferos por material hialino, es el estadio final secuelar en relación con diferentes causas como trauma, infección, infarto o inflamación, se asocia con atrofia testicular y comportamiento variable en el US y power Doppler debido a la alternancia de sectores de parénquima testicular conservado y otros reemplazados por esclerohialinosis. La RMt y particularmente el comportamiento con el contraste, hallazgo aislado más sensible en nuestro análisis, permiten diferenciar con alta seguridad esclerohialinosis de neoplasia1,10 (fig. 4).
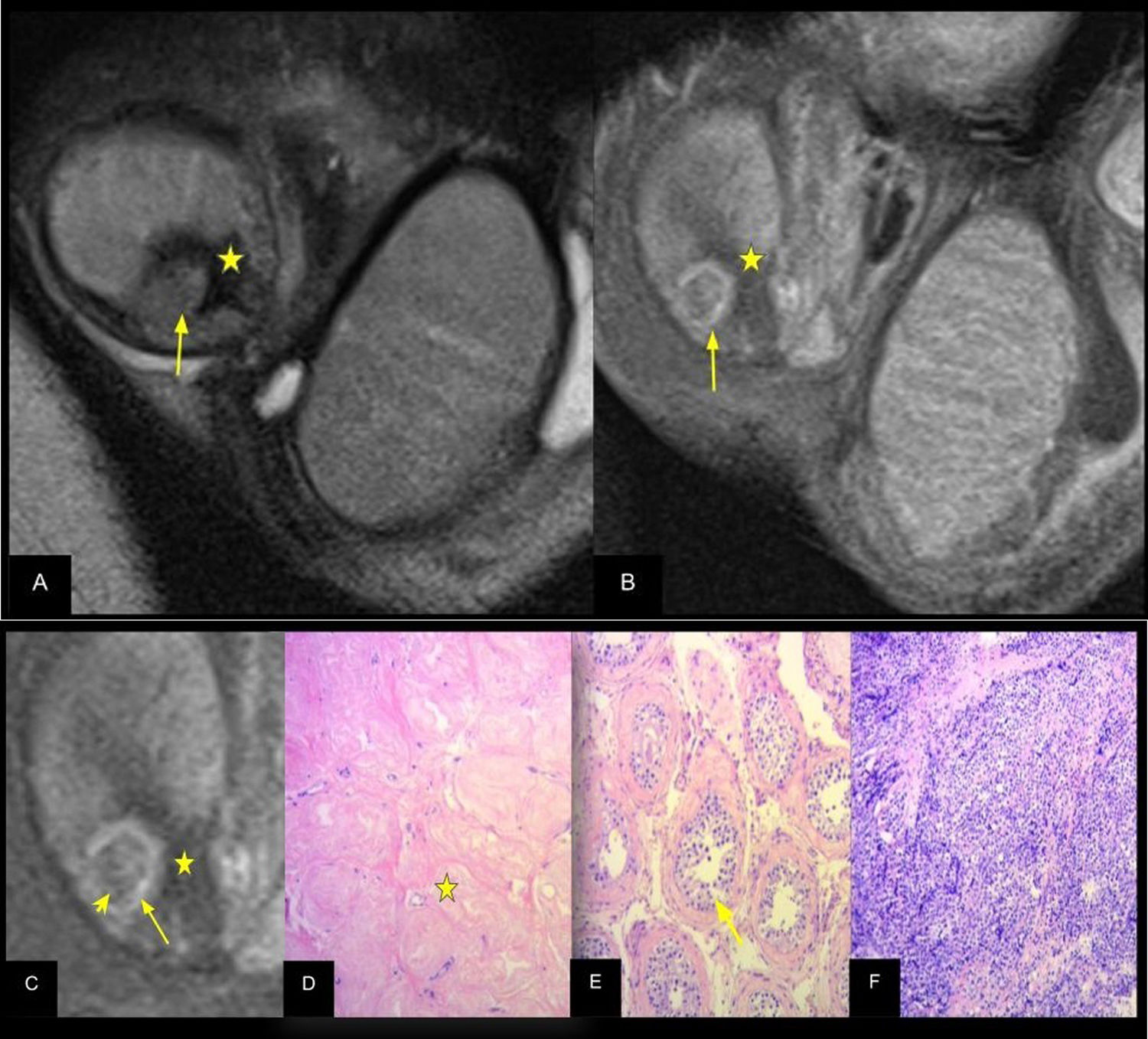
Esclerohialinosis y seminoma. A) RMt secuencia T2 coronal y (B) T1 coronal saturación grasa con contraste EV que evidencia área hipointensa (estrella) circundante a formación nodular de intensidad de señal intermedia (flecha), con contraste EV el área hipointensa no presenta realce (estrella) sin embargo la formación nodular presenta captación de contraste predominantemente en su periferia (flecha). C) Magnificación secuencia T1 coronal con contraste. D) Microscopía, tinción H&E ×10. E) Microscopía, tinción H&E ×100. F) Microscopía, tinción H&E ×100. La magnificación muestra áreas de realce periférico (flecha) y central (cabeza de flecha), el área hipointensa sin realce corresponde a esclerohialinosis que se muestra en (D) donde se aprecia extensa ocupación de la luz tubular por material hialino (estrella), mientras que las áreas de realce centrales y periféricas del nódulo (flecha y cabeza de flecha en C) corresponden a áreas de neoplasia germinal intratubular que se caracteriza por la proliferación atípica de células dentro de túbulos seminíferos con citoplasma claro y nucléolos prominentes (flecha en E) y seminoma clásico con proliferación que forma acinos de células con citoplasma claro (F).
Manganaro et al.15 reportó un 86% de exactitud entre los hallazgos entre RMt y el tipo histológico por anatomía patológica (AP). Con una sensibilidad del 95,6% para detectar lesiones malignas. Tsili et al.7 informó un 91% entre los hallazgos imagenológicos para cáncer testicular y el análisis histopatológico respectivamente. Resultados similares con una sensibilidad del 87% en nuestro análisis. Además, ambos describen la utilidad de este método imagenológico como herramienta de diagnóstico de segunda línea para diferenciar múltiples enfermedades no aclaradas por US16.
Una de las limitaciones de nuestro trabajo es el tamaño muestral, la falta de comparación entre el rédito diagnóstico de las lesiones malignas y las benignas, además la naturaleza retrospectiva del estudio y ausencia de análisis cuantitativo de perfusión y el valor de ADC, esta última secuencia fue incorporada a nuestro protocolo a partir del año 2017 en base a lo recomendado por la European Society of Urogenital Radiology (ESUR)3.
Entre las fortalezas cabe mencionar que, aunque es un tamaño muestral pequeño, el número de pacientes estudiados es similar al de trabajos publicados a la fecha y en nuestro conocimiento la primera casuística comunicada con correlación de AP e histología en habla hispana.
La alta sensibilidad mostrada por la RMt en la caracterización de lesiones malignas testiculares la convierte en una herramienta muy útil en la caracterización de las mismas y particularmente para diferenciarla de las lesiones benignas cuando el US no resulta concluyente, o cuando se trata de lesiones no palpables.
ConclusiónAnte la discordancia entre cuadro clínico, hallazgos de laboratorio y US, la RMt está indicada en la evaluación de enfermedad testicular. El realce con contraste resultó la característica imagenológica más sensible como predictor de malignidad.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.