La candidemia es una de las micosis oportunistas más frecuentes en todo el mundo. El escaso número de estudios epidemiológicos llevados a cabo en América Latina indica que las tasas de incidencia en esta región son mayores que las descritas en el hemisferio norte. A menudo el diagnóstico de la infección se establece tardíamente, lo que afecta al inicio del tratamiento antimicótico. Por esta razón, para el diagnóstico y el manejo de la candidemia está justificada una estrategia más científica, basada en parámetros específicos.
Recomendaciones para el diagnóstico y manejo de la candidemia constituye una serie de artículos preparados por miembros del grupo Latin America Invasive Mycosis Network. Su objetivo es proporcionar las mejores evidencias disponibles para el diagnóstico y el manejo de la candidemia.
El presente artículo, Recomendaciones para el manejo de la candidemia en adultos en América Latina, ha sido redactado con el objetivo de orientar a los profesionales de la salud en el manejo de los pacientes adultos que padecen, o pueden padecer, candidemia.
Mediante la base de datos PubMed se emprendió una búsqueda informatizada de los estudios publicados. Los miembros del grupo revisaron y analizaron exhaustivamente los datos. El grupo también se reunió en dos ocasiones para proponer preguntas, abordar los puntos de vista conflictivos y deliberar sobre las recomendaciones terapéuticas.
Recomendaciones para el manejo de la candidemia en adultos en América Latina está orientado al tratamiento de pacientes neutropénicos y no neutropénicos, e incluye aspectos sobre la profilaxis, el tratamiento empírico, el tratamiento de la candidemia confirmada, el seguimiento del paciente después del diagnóstico de la candidemia, la duración del tratamiento y el manejo del catéter venoso central.
Esta publicación es la segunda de los artículos de esta serie dedicada al diagnóstico y tratamiento de las candidiasis invasoras. Otras publicaciones de esta serie son Recomendaciones para el diagnóstico de la candidemia en América Latina, Recomendaciones para el manejo de la candidemia en niños en América Latina, y Recomendaciones para el manejo de la candidemia en neonatos en América Latina.
Este artículo está publicado en inglés en este mismo número. Puede encontrarlo enhttp://dx.doi.org/10.1016/j.riam.2013.05.007
Candidemia is one of the most frequent opportunistic mycoses worldwide. Limited epidemiological studies in Latin America indicate that incidence rates are higher in this region than in the Northern Hemisphere. Diagnosis is often made late in the infection, affecting the initiation of antifungal therapy. A more scientific approach, based on specific parameters, for diagnosis and management of candidemia in Latin America is warranted.
‘Recommendations for the diagnosis and management of candidemia’ are a series of manuscripts that have been developed by members of the Latin America Invasive Mycosis Network. They aim to provide a set of best-evidence recommendations for the diagnosis and management of candidemia.
This publication, ‘Recommendations for the management of candidemia in adults in Latin America’, was written to provide guidance to healthcare professionals on the management of adults who have, or who are at risk of, candidemia.
Computerized searches of existing literature were performed by PubMed. The data were extensively reviewed and analyzed by members of the group. The group also met on two occasions to pose questions, discuss conflicting views, and deliberate on a series of management recommendations.
‘Recommendations for the management of candidemia in adults in Latin America’ includes prophylaxis, empirical therapy, therapy for proven candidemia, patient work-up following diagnosis of candidemia, duration of candidemia treatment, and central venous catheter management in patients with candidemia.
This manuscript is the second of this series that deals with diagnosis and treatment of invasive candidiasis. Other publications in this series include: ‘Recommendations for the diagnosis of candidemia in Latin America’, ‘Recommendations for the management of candidemia in children in Latin America’, and ‘Recommendations for the management of candidemia in neonates in Latin America’.
This article is also published in English in this issue. It can be found inhttp://dx.doi.org/10.1016/j.riam.2013.05.007
La candidemia es una de las micosis oportunistas más frecuentes en todo el mundo74. La epidemiología de la candidemia en América Latina no ha sido estudiada tan ampliamente como en el hemisferio norte14,62. El Brazilian Network Candidemia Study presenta información de un estudio prospectivo, de vigilancia epidemiológica, basada en datos de laboratorio y llevado a cabo en 11 hospitales de atención terciaria de Brasil; la incidencia global de candidemia para estos hospitales fue de 2,49 casos por cada 1.000 admisiones hospitalarias14. Recientemente se llevó a cabo un estudio similar con encuesta prospectiva, basada en datos de laboratorio, en 22 hospitales de 8 países de América Latina; en este estudio se encontró una incidencia de 0,98 casos por 1.000 admisiones hospitalarias, con una amplia variación entre los países (por ejemplo, de 0,32 en Chile hasta 1,75 en Argentina)57. Estos datos contrastan con las menores tasas de incidencia de candidemia comunicadas en EE. UU. (de 0,28 a 0,96 casos por 1.000 admisiones)7,35,80,109 y Europa (de 0,20 a 0,38 casos por cada 1.000 admisiones)93.
Especies de Candida en América LatinaLas especies que más comúnmente causan candidemia en América Latina son Candida albicans (40-50%), seguida de Candida tropicalis y Candida parapsilosis (20-25%). De manera similar, en la encuesta realizada por la Latin America Invasive Mycosis Network, las especies más frecuentes fueron C. albicans (42%), Candida tropicalis (21%), C. parapsilosis (19%) y Candida glabrata (7%)57. La distribución de estas especies es consistente con lo hallado en otros estudios realizados en Brasil4,5,18 y en otros países de América Latina20,87,88,91.
Se debe observar que en América Latina la frecuencia de candidemia debida a C. glabrata es relativamente baja (4-7%)15,57,73. Sin embargo, algunas publicaciones, concretamente un estudio retrospectivo hecho en Brasil, informó de un incremento de la incidencia en forma progresiva, desde 3,5% en el período 1995-2003 hasta 10,6% en el período 2005-2007. En este estudio se encontraron incidencias más elevadas de candidemia debidas a C. glabrata en los centros con consumo elevado de fluconazol71. El incremento de la incidencia de candidemia por C. glabrata tiene importantes implicaciones clínicas, dado que esta especie característicamente es menos susceptible a fluconazol. En este último estudio hecho en América Latina, las cepas aisladas de C. glabrata muestran menor frecuencia de resistencia a fluconazol (10,6 a 13,2%), comparadas con los aislamientos de EE. UU. (18%)74. Además de lo observado con C. glabrata, se han encontrado tasas elevadas de resistencia a fluconazol en cepas aisladas de Candida guilliermondii y Candida rugosa en un estudio de vigilancia global llevado a cabo entre 1997 y 200316,21,76. Respecto a C. glabrata, aunque las concentraciones inhibitorias mínimas de voriconazol son más bajas que las de fluconazol, existe la posibilidad de una resistencia cruzada66. Por otra parte, Candida krusei es intrínsecamente resistente a fluconazol27,75, pero sensible a voriconazol77. La incidencia de candidemia debida a C. krusei en América Latina es baja (1,7%)75.
Impacto del diagnóstico temprano de la candidemiaEl pronóstico en el tratamiento de los pacientes con candidemia se relaciona de forma directa con el momento de inicio y el acierto en la selección de una terapia apropiada30. Por lo tanto, se han desarrollado estrategias para diagnosticar tempranamente la candidemia.
La candidemia afecta a pacientes de todas las edades, pero las tasas más elevadas se observan en lactantes de menos de un año de edad y en adultos de más de 65 años33,36. Los principales factores de riesgo de la candidiasis invasiva son el uso de antibióticos de amplio espectro, el uso de un catéter venoso central (CVC), la admisión en la Unidad de Cuidados Intensivos (UCI), la cirugía mayor, la nutrición parenteral, la terapia de reemplazo renal, la neutropenia, el implante de dispositivos protésicos y el uso de terapias inmunosupresoras (incluyendo corticoides, fármacos quimioterápicos e inmunosupresores)48,68,93,94,99,110.
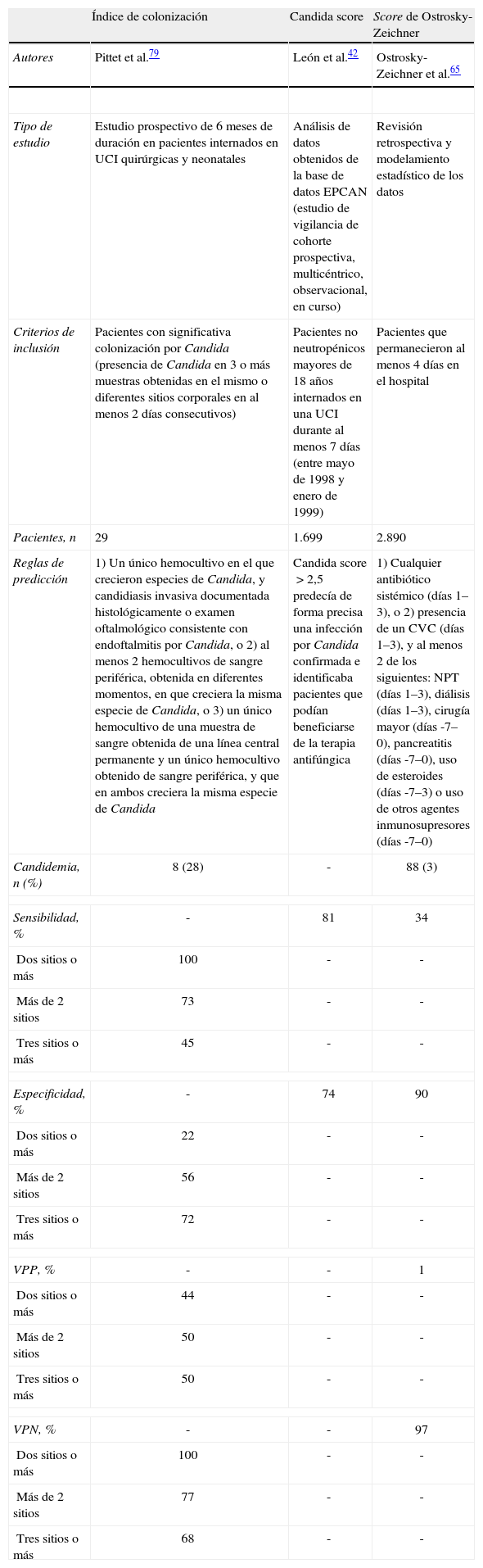
Puntajes clínicos para identificar pacientes con riesgo de candidemiaSe han realizado esfuerzos para identificar mejor a los pacientes con riesgo de candidemia utilizando puntajes clínicos y reglas de predicción. Alguno de estos han sido validados, pero ninguno es aceptado universalmente, dado que cada uno presenta sus propias limitaciones (tabla 1). Uno de estos sistemas de calificación se basa en la colonización de Candida como un factor de riesgo independiente para candidemia y puede ayudar a predecir la subsiguiente infección en pacientes críticos79. Este score es determinado por el cálculo de un índice de colonización (IC), definido como la razón del número de sitios corporales diferentes colonizados con cepas idénticas entre el número total de sitios corporales examinados, o un IC corregido, definido como la relación de sitios colonizados profusamente entre todos los sitios colonizados, multiplicado por el valor del IC. Un valor de IC≥0,5 tiene una especificidad del 69%, un valor predictivo positivo del 66% y un valor predictivo negativo del 100% para predecir la presencia de candidemia o candidiasis invasiva. Ambos valores predictivos fueron del 100% cuando se utilizó un IC corregido≥0,479. Aunque el IC corregido tiene un alto valor predictivo para la candidiasis invasiva, su uso presenta dificultades relacionadas con la práctica, ya que su logística y costes representan un obstáculo para su aplicación universal64.
Puntajes clínicos para identificar pacientes con riesgo de candidemia
| Índice de colonización | Candida score | Score de Ostrosky-Zeichner | |
| Autores | Pittet et al.79 | León et al.42 | Ostrosky-Zeichner et al.65 |
| Tipo de estudio | Estudio prospectivo de 6 meses de duración en pacientes internados en UCI quirúrgicas y neonatales | Análisis de datos obtenidos de la base de datos EPCAN (estudio de vigilancia de cohorte prospectiva, multicéntrico, observacional, en curso) | Revisión retrospectiva y modelamiento estadístico de los datos |
| Criterios de inclusión | Pacientes con significativa colonización por Candida (presencia de Candida en 3 o más muestras obtenidas en el mismo o diferentes sitios corporales en al menos 2 días consecutivos) | Pacientes no neutropénicos mayores de 18 años internados en una UCI durante al menos 7 días (entre mayo de 1998 y enero de 1999) | Pacientes que permanecieron al menos 4 días en el hospital |
| Pacientes, n | 29 | 1.699 | 2.890 |
| Reglas de predicción | 1) Un único hemocultivo en el que crecieron especies de Candida, y candidiasis invasiva documentada histológicamente o examen oftalmológico consistente con endoftalmitis por Candida, o 2) al menos 2 hemocultivos de sangre periférica, obtenida en diferentes momentos, en que creciera la misma especie de Candida, o 3) un único hemocultivo de una muestra de sangre obtenida de una línea central permanente y un único hemocultivo obtenido de sangre periférica, y que en ambos creciera la misma especie de Candida | Candida score>2,5 predecía de forma precisa una infección por Candida confirmada e identificaba pacientes que podían beneficiarse de la terapia antifúngica | 1) Cualquier antibiótico sistémico (días 1–3), o 2) presencia de un CVC (días 1–3), y al menos 2 de los siguientes: NPT (días 1–3), diálisis (días 1–3), cirugía mayor (días -7–0), pancreatitis (días -7–0), uso de esteroides (días -7–3) o uso de otros agentes inmunosupresores (días -7–0) |
| Candidemia, n (%) | 8 (28) | - | 88 (3) |
| Sensibilidad, % | - | 81 | 34 |
| Dos sitios o más | 100 | - | - |
| Más de 2 sitios | 73 | - | - |
| Tres sitios o más | 45 | - | - |
| Especificidad, % | - | 74 | 90 |
| Dos sitios o más | 22 | - | - |
| Más de 2 sitios | 56 | - | - |
| Tres sitios o más | 72 | - | - |
| VPP, % | - | - | 1 |
| Dos sitios o más | 44 | - | - |
| Más de 2 sitios | 50 | - | - |
| Tres sitios o más | 50 | - | - |
| VPN, % | - | - | 97 |
| Dos sitios o más | 100 | - | - |
| Más de 2 sitios | 77 | - | - |
| Tres sitios o más | 68 | - | - |
CVC: catéter venoso central; NPT: nutrición parenteral total; UCI: unidad de cuidados intensivos; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Candida score (CS) es un sistema de calificación diseñado con el propósito de seleccionar qué pacientes debían iniciar terapia antifúngica en UCI43. CS asigna un punto por ítem para cirugía, colonización multifocal y nutrición parenteral total, y 2 puntos para sepsis severa. Se ha descrito una incidencia de candidemia o candidiasis invasiva en pacientes críticos no neutropénicos y colonizados del 13,8% con un CS≥3, y del 2,3% con un CS<3, respectivamente64. Los pacientes con un CS>3 tuvieron un riesgo de candidemia y candidiasis invasiva del 11,5%. Además, este riesgo se incrementó al 30,3% en los pacientes con un CS>3 que también tenían cirugía abdominal. Se encontró que un CS≥3 era un predictor significativamente mejor de candidiasis invasiva que un IC≥0,5. Recientemente un estudio comparó diferentes sistemas de calificación e incorporó en la comparación la medición del nivel sérico de 1,3-β-D-glucano (BDG), un componente de la pared celular de los hongos. Este estudio mostró que el mejor predictor de candidemia fue el nivel de BDG (sensibilidad 93%, especificidad 86%), seguido por el CS y el IC82. Son necesarias nuevas investigaciones que permitan evaluar el beneficio de la terapia antifúngica temprana basada en los valores de CS y BDG64,105.
ProfilaxisLa profilaxis antimicótica se emplea para prevenir la infección fúngica en pacientes que no presentan evidencia clínica de infección, pero tienen riesgo de desarrollarla.
Pacientes no neutropénicosVarios grupos han realizado metaanálisis de ensayos controlados y aleatorizados (ECA) que investigaron la profilaxis antifúngica en pacientes de UCI no neutropénicos19,34,81,90,97. Los resultados mostraron que el uso de profilaxis redujo el riesgo de candidiasis invasiva (50-80%). Sin embargo, no se ha demostrado bien el efecto sobre la mortalidad, y solamente 3 metaanálisis mostraron una tendencia hacia una reducción de la mortalidad: uno en pacientes adultos en UCI por cirugía o trauma19, otro en pacientes quirúrgicos inmunocompetentes de alto riesgo34, y otro en pacientes quirúrgicos y críticamente enfermos no neutropénicos81. La gran heterogeneidad de los pacientes en los diferentes estudios probablemente influyó sobre los resultados.
Al comparar los criterios de inclusión en estudios individuales para la profilaxis de la candidemia se evidencia que es necesaria una cuidadosa selección de los pacientes para maximizar el beneficio de la profilaxis en los pacientes no neutropénicos22,29,72,85. Los estudios en pacientes con alto riesgo de infección han evidenciado el potencial beneficio de la profilaxis para reducir la tasa de incidencia de candidiasis invasiva confirmada microbiológicamente cuando dicha profilaxis es administrada a pacientes seleccionados apropiadamente (es decir, pacientes críticos que no tienen neutropenia)72,85. Por lo tanto, se recomienda un abordaje selectivo a fin de identificar pacientes no neutropénicos de alto riesgo para la terapia profiláctica.
No hay una recomendación universal para la profilaxis antifúngica en pacientes no neutropénicos. Sin embargo, se dispone y se han utilizado con diferente grado de éxito diversos sistemas de puntajes y estrategias de estratificación de riesgo a fin de definir los candidatos apropiados para la profilaxis. Se debe considerar la profilaxis en los lugares con elevada incidencia (>2%) de candidiasis invasiva. El fármaco de elección es fluconazol a una dosis diaria de 400mg (6mg/kg). No existen recomendaciones respecto a la duración estándar de la profilaxis, pero conceptualmente debería continuar mientras persista la exposición a los factores de riesgo.
Pacientes neutropénicosLos pacientes con leucemia mieloide aguda o síndrome mielodisplásico sometidos a quimioterapia intensiva para inducción o remisión y quienes recibieron un trasplante de células progenitoras hematopoyéticas tienen una elevada incidencia de infección fúngica invasiva8,89. El riesgo de dicha infección en estos pacientes se relaciona con la intensidad del régimen citotóxico, que produce severas mucositis orales y gastrointestinales, y con la duración de la neutropenia11,32. En un estudio que investigó las relaciones entre el régimen citotóxico, el daño de la mucosa intestinal y la colonización micótica y su relación con la patogenia de la enfermedad fúngica invasiva, los pacientes con leucemia mieloide aguda que recibían altas dosis de quimioterapia tuvieron una mayor incidencia de enfermedad fúngica invasiva11. Además, el daño de la terapia citotóxica sobre la integridad funcional del epitelio intestinal es predictivo de infecciones invasivas12. Por lo tanto, se debe considerar firmemente la profilaxis antifúngica en pacientes neutropénicos con mucositis severa.
El Grupo de Trabajo recomienda la profilaxis para pacientes neutropénicos de alto riesgo (es decir, pacientes que reciben quimioterapia intensiva con fuerte potencial de inducir neutropenia severa y mucositis). Para pacientes con trasplante de células progenitoras hematopoyéticas se ha utilizado fluconazol a dosis de 200-400mg (3-6mg/kg) diarios, voriconazol (200mg [3mg/kg] 2 veces al día), itraconazol en solución oral (2,5mg/kg 3 veces al día) o micafungina (50mg diarios). Diferentes estudios muestran que estos protocolos tienen una eficacia equivalente para prevenir la candidiasis invasiva31,47,92,96,105,108. El fluconazol es el fármaco de elección a menos que se necesite cobertura contra mohos.
Para pacientes con leucemia se recomienda fluconazol (400mg [6mg/kg diarios]) o posaconazol (200mg, 3 veces al día)17,55,107. En estos casos el fluconazol también es el fármaco de elección para la profilaxis contra Candida, a menos que se necesite una cobertura adicional contra mohos.
Sumario de recomendaciones para la profilaxis deCandidaen adultos no neutropénicos:
- 1.
Los pacientes no neutropénicos deben ser cuidadosamente seleccionados para la profilaxis. Aunque no hay recomendaciones universales respecto a la selección de los pacientes, los sistemas de puntajes y las reglas predictivas pueden ayudar a tomar decisiones clínicas caso por caso.
- 2.
Si se decide administrar profilaxis se recomienda el uso del fluconazol (400mg [6mg/kg/día]). No hay recomendaciones para la duración de la profilaxis, aunque se considera que los pacientes deberían continuar bajo profilaxis mientras dure la exposición a los factores de riesgo.
Sumario de recomendaciones para la profilaxis deCandidaen adultos neutropénicos:
- 1.
Se debe considerar firmemente la profilaxis en pacientes neutropénicos con posibilidad de desarrollar una mucositis severa.
- 2.
Los pacientes con leucemia mieloide aguda deben recibir profilaxis durante la terapia de inducción.
- 3.
En los pacientes que reciben trasplante de células progenitoras hematopoyéticas el fármaco de elección es el fluconazol a una dosis de 400mg (6mg/kg/día). Si se requiere cobertura antibiótica contra mohos se recomienda el uso de voriconazol (200mg [3mg/kg] 2 veces al día).
- 4.
Para pacientes con leucemia el fármaco de elección es el fluconazol (400mg [6mg/kg/día]), y si se requiere cobertura contra mohos se recomienda el posaconazol (200mg, 3 veces al día).
El Grupo de Trabajo recomienda que no se realice un tratamiento empírico en pacientes no neutropénicos que no hayan estado expuestos a factores de riesgo durante un largo período de tiempo, no tengan colonización y tengan valores BDG negativos. Se puede considerar el tratamiento empírico en pacientes no neutropénicos con sospecha de candidiasis. Las reglas de predicción que aparecen resumidas en la tabla 1 son herramientas importantes para la selección de pacientes apropiados para la terapia empírica. El fármaco de elección para la terapia empírica debe ser el mismo que para la candidemia documentada (ver apartado «Terapia para candidiasis hematógena confirmada»).
Pacientes neutropénicosLa terapia antifúngica empírica es considerada el tratamiento estándar en los pacientes neutropénicos con fiebre persistente a pesar de una terapia antibiótica apropiada, y habitualmente se intenta que sea eficaz contra Candida y mohos. Su aplicación exclusivamente para candidiasis invasiva es ocasional, y se considera su uso únicamente en pacientes que no hayan recibido profilaxis, tengan fiebre persistente, además de mucositis severa, pero que no tengan riesgo de infección invasiva por mohos. Para estos casos se recomienda la terapia antifúngica empírica con fluconazol, a una dosis de carga inicial de 800mg (12mg/kg), para continuar con una dosis de 400mg diarios (6mg/kg).
Recientemente se han realizado intentos de cambiar el tratamiento empírico por uno anticipado (pre-emptive) guiado por el diagnóstico45. Esto se debe a que en el tratamiento empírico clásico el desencadenante del inicio de la terapia antifúngica (la fiebre persistente) es demasiado sensible, lo que conduce a que un gran número de pacientes reciban agentes antimicóticos de manera innecesaria. Sin embargo, a pesar de los atractivos argumentos del tratamiento guiado por el diagnóstico, no se pueden efectuar recomendaciones formales sobre este punto.
La decisión de efectuar el tratamiento empírico se basa usualmente en la sospecha de que el paciente tiene riesgo de estar infectado tanto por Candida como por algún moho (fundamentalmente Aspergillus), situación que va más allá del alcance de las recomendaciones de este documento. De todas maneras, existen opciones aceptables que incluyen el tratamiento con equinocandinas, como la caspofungina (dosis de carga de 70mg, posteriormente 50mg diarios)102 o la micafungina (100mg diarios)70, o una formulación lipídica de anfotericina B (anfotericina B liposomal [L-AmB; 3mg/kg diarios]100 o anfotericina B complejo lipídico [ABLC; 5mg/kg diarios]106), o voriconazol con una dosis de carga de 6mg/kg 2 veces al día y después 3mg/kg 2 veces al día101.
La anidulafungina no ha sido investigada como terapia empírica en pacientes neutropénicos. De todas maneras, no hay evidencias que sugieran que la anidulafungina pudiera comportarse de forma diferente a las otras 2 equinocandinas en este marco. En ese sentido, el Grupo de Trabajo asume que la anidulafungina tendría un efecto similar al de caspofungina y micafungina en el tratamiento empírico de pacientes neutropénicos.
Sumario de recomendaciones para el tratamiento empírico de la candidemia en adultos no neutropénicos:
- 1.
Se debe considerar el tratamiento empírico para los pacientes no neutropénicos con factores de riesgo para candidemia.
- 2.
Las reglas de predicción se pueden emplear en la clínica para ayudar a seleccionar los candidatos para terapia empírica.
- 3.
No se pueden efectuar recomendaciones formales respecto al uso de biomarcadores séricos (como BDG).
- 4.
Las recomendaciones de agentes antimicóticos y de sus posologías para el tratamiento empírico son las mismas que para el tratamiento de la infección.
- 5.
No se pueden efectuar recomendaciones respecto a la duración de la terapia empírica.
Sumario de recomendaciones para el tratamiento empírico de la candidemia en adultos neutropénicos:
- 1.
La terapia antifúngica empírica es considerada el estándar de atención para los pacientes neutropénicos con fiebre persistente.
- 2.
Aunque el abordaje guiado por el diagnóstico parece razonable, no se pueden efectuar recomendaciones formales debido a la falta de estudios que avalen esta estrategia.
- 3.
Una formulación lipídica de anfotericina B, una equinocandina o voriconazol son opciones para el tratamiento empírico inicial de pacientes neutropénicos febriles.
- a.
L-AmB: 3mg/kg/día.
- b.
ABLC: 5mg/kg/día.
- c.
Caspofungina: dosis de carga de 70mg; posteriormente, 50mg diarios.
- d.
Micafungina: 100mg diarios.
- e.
Voriconazol: dosis de carga de 6mg/kg 2 veces al día; posteriormente 3mg/kg 2 veces al día.
- a.
- 4.
Se recomienda la terapia antifúngica empírica con fluconazol, utilizando una dosis de carga de 800mg (12mg/kg) y después 400mg (6mg/kg) diarios, si el paciente no ha recibido profilaxis contra Candida, tiene fiebre persistente, mucositis severa, y no tiene riesgo de infección invasiva por mohos.
El Grupo de Trabajo recomienda el uso de una equinocandina para el tratamiento inicial de la candidemia en adultos no neutropénicos. Las equinocandinas son inhibidores no competitivos de la síntesis de BDG, un componente de la pared celular de Candida. Su esquema de administración es cómodo (una vez al día) y su actividad es fungicida contra todas las especies de Candida10. Entre las equinocandinas se incluyen la anidulafungina, la caspofungina y la micafungina; las 3 están indicadas para el tratamiento de la candidemia6,50,78. Actualmente no hay evidencias que aconsejen el uso de una equinocandina más que otra en pacientes no neutropénicos.
Varios factores avalan el uso de las equinocandinas (agentes fungicidas) frente a los azoles (agentes fungistáticos) en el tratamiento inicial de la candidemia. En primer lugar, los cambios en la sensibilidad antifúngica, como la creciente prevalencia de C. glabrata y su relación con el uso de fluconazol, así como la progresiva disminución de la sensibilidad de C. krusei a los azoles, lo que sugiere que el uso de las equinocandinas debe tener preferencia sobre estos para el tratamiento inicial27,71,75. En segundo lugar está la eficacia clínica, sustentada en ECA, en los que se han observado tasas más elevadas de candidemia persistente en las diferentes opciones de tratamiento con fluconazol (15-17%) en comparación con otros agentes antimicóticos (8-9%)56. La mayor diferencia en las tasas de candidemia persistente se observó en un ensayo que comparó fluconazol con anidulafungina (16 frente a 6%, p=0,01)83. En tercer lugar, las evidencias de los estudios de metaanálisis de ECA también han mostrado que son preferibles las equinocandinas antes que los azoles. Un metaanálisis que comparó tratamientos antimicóticos para la candidiasis invasiva encontró que la anidulafungina se asociaba con tasas significativamente mayores de éxito clínico (riesgo relativo [RR]: 0,61; intervalo de confianza del 95% [IC 95%]: 0,42 a 0,89) y microbiológico (RR: 0,50; IC 95%: 0,29 a 0,86) comparada con el fluconazol28. En el mismo metaanálisis se encontró que las equinocandinas comparadas con otros agentes antimicóticos se asociaban a una menor frecuencia de eventos adversos que requirieron la interrupción del tratamiento28. Un metaanálisis de 7 ECA mostró que el uso de una equinocandina estaba asociado a una mayor disminución de la mortalidad en comparación con cualquier otro tipo de tratamiento antimicótico3. En cuarto lugar, en un reciente estudio que utilizó un modelo de análisis de toma de decisión, se encontró que la anidulafungina parecía ser una opción coste-efecto mejor comparada con el fluconazol en el tratamiento de la candidiasis invasiva53.
Por último, hay que mencionar que el fluconazol es el agente antifúngico más utilizado como terapia primaria para la candidemia en América Latina, pero con un alto reporte de mortalidad en todos los niveles57.
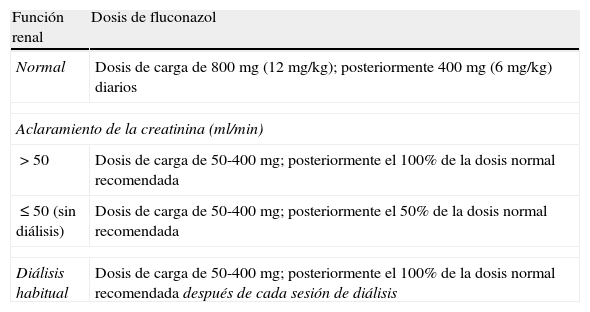
AzolesSi se inicia el tratamiento con una equinocandina y durante el seguimiento se conoce que en los cultivos iniciales se aisló un microorganismo sensible a fluconazol, si la evolución del paciente es favorable es posible bajar un nivel o desescalar el tratamiento (step-down therapy), cambiando el tratamiento a fluconazol; sin embargo, se recomienda considerar cuidadosamente la posología según la función renal (tabla 2). No se conoce la duración óptima de la terapia con una equinocandina antes de bajar un escalón terapéutico. En un estudio de 159 pacientes con candidemia o candidiasis invasiva se cambió el tratamiento con anidulafungina (duración promedio de tratamiento de 8,6 días) por fluconazol o voriconazol (duración promedio de la terapia antifúngica total: 14,1 días). Se obtuvo una respuesta terapéutica global efectiva del 80,1% (IC 95%: 84,0 a 96,2) en los pacientes cambiados a fluconazol y del 93,6% (IC 95%: 86,6 a 100) en los pacientes cambiados a voriconazol98. En un estudio similar, pero más pequeño, llevado a cabo en América Latina, un tratamiento breve con anidulafungina (mínimo 5 días) seguido por terapia oral con voriconazol también pareció ser una estrategia efectiva para la candidemia o la candidiasis invasiva61. Para el tratamiento de las infecciones fúngicas oculares se recomiendan los triazoles (fluconazol o voriconazol) antes que las equinocandinas46. Para las infecciones fúngicas cerebrales y oculares se recomienda el voriconazol más que una equinocandina.
Dosis recomendadas de fluconazol en pacientes con función renal normal o deteriorada
| Función renal | Dosis de fluconazol |
| Normal | Dosis de carga de 800mg (12mg/kg); posteriormente 400mg (6mg/kg) diarios |
| Aclaramiento de la creatinina (ml/min) | |
| >50 | Dosis de carga de 50-400mg; posteriormente el 100% de la dosis normal recomendada |
| ≤50 (sin diálisis) | Dosis de carga de 50-400mg; posteriormente el 50% de la dosis normal recomendada |
| Diálisis habitual | Dosis de carga de 50-400mg; posteriormente el 100% de la dosis normal recomendada después de cada sesión de diálisis |
El Grupo de Trabajo recomienda que se evite el uso de anfotericina B desoxicolato en pacientes de UCI debido a su alta toxicidad (especialmente renal). Las formulaciones lipídicas de anfotericina B incluyen ABLC, dispersión coloidal de anfotericina B y L-AmB. Estas 3 formulaciones lipídicas tienen diferentes propiedades farmacológicas y distintas tasas de efectos adversos, y son intercambiables solamente después de una cuidadosa consideración. El Grupo de Trabajo recomienda el uso de L-AmB más que el de ABLC para el tratamiento de la candidemia en adultos no neutropénicos. La dosis de L-AmB (3mg/kg por día) fue estandarizada en un estudio aleatorizado que comparó L-AmB con micafungina39. Por otro lado, no hay dosis estandarizada ni se han realizado estudios aleatorizados con ABLC.
Pacientes neutropénicosNo más del 10% de la población de estudio del total de ECA sobre tratamiento de la candidemia eran pacientes neutropénicos. Por lo tanto, el grado de evidencia en pacientes neutropénicos es menor que en pacientes no neutropénicos.
Considerando los riesgos de toxicidad renal asociados al uso de anfotericina B desoxicolato, el Grupo de Trabajo recomienda con énfasis que se evite el uso de este agente para el tratamiento de la candidemia. Al igual que en los pacientes no neutropénicos, se puede considerar una equinocandina como fármaco de elección para el tratamiento inicial de la candidemia en pacientes neutropénicos. Dado que el ECA de la anidulafungina en el tratamiento de la candidemia no incluyó pacientes neutropénicos, y por ende hay un vacío de información en relación con su utilidad, se debe mencionar que no hay evidencias preclínicas que demuestren que la anidulafungina no sería efectiva en pacientes neutropénicos con candidemia. Las alternativas al uso de una equinocandina incluyen el uso de una formulación lipídica de anfotericina B, voriconazol o fluconazol. Sin embargo, el uso de estos azoles puede estar limitado por: a) la mayoría de los pacientes neutropénicos han recibido previamente fluconazol como profilaxis, y b) la candidemia por C. glabrata es más frecuente en este grupo de pacientes. El esquema step-down para pasar a un agente oral como el fluconazol o el voriconazol puede ser adelantado cuando se dispone de información sobre la identidad de las especies y la sensibilidad antifúngica, siempre que el paciente esté mejorando.
Sumario de recomendaciones para el tratamiento de la candidemia en adultos no neutropénicos:
- 1.
Se recomiendan las equinocandinas como primera elección de tratamiento para la candidemia en adultos no neutropénicos.
- 2.
Se puede aplicar el esquema step-down y pasar a fluconazol cuando un paciente está evolucionando bien y el agente etiológico es sensible a fluconazol.
- 3.
En el tratamiento de las infecciones fúngicas cerebrales y oculares se recomienda el uso de triazoles más que el de equinocandinas.
- 4.
No se recomienda el uso de anfotericina B desoxicolato en pacientes de UCI.
- a.
Se recomienda el uso de L-AmB más que el de ABLC.
- a.
Sumario de recomendaciones para el tratamiento de la candidemia en adultos neutropénicos:
- 1.
Se recomiendan las equinocandinas como terapia primaria.
- 2.
Se puede aplicar el esquema step-down para pasar a fluconazol si el paciente está mejorando y la candidemia está causada por un aislamiento de Candida sensible al mismo.
Después de confirmar el diagnóstico de candidiasis hematógena, además de comenzar la terapia (ver el apartado «Terapia para candidiasis hematógena confirmada»), se deben realizar una serie de exámenes. Sin embargo, las guías actuales para el tratamiento de la candidemia brindan información limitada sobre recomendaciones para evaluar al paciente después del diagnóstico67.
Pacientes neutropénicos y no neutropénicosPara la evaluación del paciente después del diagnóstico de candidemia el Grupo de Trabajo recomienda la repetición de los hemocultivos iniciales (día 1 del tratamiento) el día 3 y el día 5, o hasta que los hemocultivos no muestren crecimiento.
HemocultivoLos estudios sobre los parámetros de evaluación de los hemocultivos han mostrado que el número de patógenos recuperados de una muestra se relaciona con el volumen del hemocultivo13. En adultos se recomienda generalmente el uso de 20 a 30ml de sangre por set de hemocultivo86. Las muestras de sangre deben ser divididas en 2 frascos de cultivo86. No se debe utilizar una única toma de hemocultivo para evaluar a un paciente con sospecha de candidemia dado que la detección óptima de microorganismos se alcanza con 3 o más sets de hemocultivo40. En estas preparaciones, un resultado positivo en un único test debería ser interpretado como candidemia y no como contaminación (aunque los resultados de las otras pruebas sean negativos). No se debe extraer sangre para más de 2 sets de hemocultivos en un período de 24h95, y las muestras de sangre deben ser tomadas de diferentes sitios de punción104.
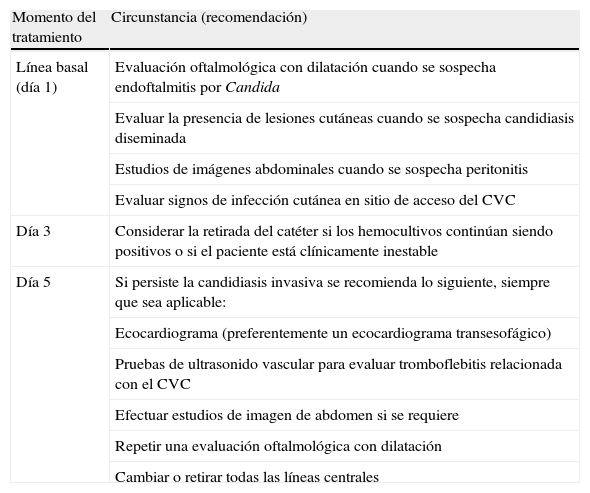
Evaluaciones adicionalesSe recomiendan estudios complementarios al hemocultivo en circunstancias específicas. Estas se muestran en la tabla 3.
Estudios adicionales para el seguimiento de los pacientes adultos después del diagnóstico
| Momento del tratamiento | Circunstancia (recomendación) |
| Línea basal (día 1) | Evaluación oftalmológica con dilatación cuando se sospecha endoftalmitis por Candida |
| Evaluar la presencia de lesiones cutáneas cuando se sospecha candidiasis diseminada | |
| Estudios de imágenes abdominales cuando se sospecha peritonitis | |
| Evaluar signos de infección cutánea en sitio de acceso del CVC | |
| Día 3 | Considerar la retirada del catéter si los hemocultivos continúan siendo positivos o si el paciente está clínicamente inestable |
| Día 5 | Si persiste la candidiasis invasiva se recomienda lo siguiente, siempre que sea aplicable: |
| Ecocardiograma (preferentemente un ecocardiograma transesofágico) | |
| Pruebas de ultrasonido vascular para evaluar tromboflebitis relacionada con el CVC | |
| Efectuar estudios de imagen de abdomen si se requiere | |
| Repetir una evaluación oftalmológica con dilatación | |
| Cambiar o retirar todas las líneas centrales |
CVC: catéter venoso central.
Se recomienda una evaluación oftalmológica con dilatación pupilar para descartar endoftalmitis por Candida. En un estudio de candidemia con pacientes hospitalizados se encontró una incidencia significativamente mayor de candidiasis ocular37. Una demora en el diagnóstico de la infección ocular por Candida puede llevar a una pérdida de la visión69.
La endocarditis de válvulas nativas es una complicación rara de la candidemia en pacientes no neutropénicos (1%). Por lo tanto, no se recomienda la realización de un ecocardiograma como examen de rutina para todos los pacientes con candidemia26, pero debería ser considerado en pacientes con candidemia que persiste durante más de 72h. Además, dado que los pacientes con válvulas cardíacas protésicas que desarrollan candidemia tienen un mayor riesgo de desarrollar endocarditis en la propia válvula, en este grupo de pacientes se recomienda la realización de un ecocardiograma al inicio del diagnóstico52. Otros factores de riesgo que predisponen a la endocarditis fúngica en pacientes no neutropénicos son la cirugía previa, las vías de acceso vascular, el uso de antibióticos y las cardiopatías subyacentes9,23,24.
Pacientes neutropénicosEn pacientes neutropénicos, si la fiebre persiste después de 7 días se recomienda realizar un examen ocular, repetir los hemocultivos y efectuar estudios de imagen. En pacientes que han tenido episodios previos de candidemia o que se han recuperado de una neutropenia o fiebre persistente se recomienda la realización de ecografía o tomografía computarizada para descartar una candidiasis diseminada crónica (CDC).
Sumario de recomendaciones para la evaluación de pacientes después del diagnóstico de candidemia:
Adultos no neutropénicos y neutropénicos
- 1.
El Grupo de Trabajo recomienda repetir los hemocultivos el día 1 de tratamiento, el día 3 y el día 5.
- 2.
Se recomiendan otros exámenes en circunstancias específicas.
- a.
Día 1: evaluación oftalmológica con dilatación pupilar, examen visual de la piel para detectar lesiones cutáneas o infección en el sitio de acceso del CVC, y estudios de imagen abdominales.
- b.
Día 3: considerar la retirada del catéter si el hemocultivo continúa siendo positivo o si el paciente está clínicamente inestable. Si la candidemia persiste hasta el día 5, retirar o cambiar todas las vías centrales.
- c.
Día 5: si la candidemia persiste, repetir la evaluación oftalmológica y los estudios de imagen (ecocardiograma y ultrasonido vascular).
- a.
Adultos neutropénicos
- 1.
Si un paciente continúa febril después de 7 días, se recomienda efectuar un examen ocular, repetir los hemocultivos y efectuar estudios de imagen.
- 2.
Se recomienda realizar ecografía o tomografía computarizada abdominales para descartar la CDC en pacientes que han tenido episodios previos de candidemia o se han recuperado de la neutropenia, pero tienen fiebre persistente.
No se ha estudiado la duración apropiada de la terapia para la candidemia. De acuerdo con los ECA de tratamiento de candidemia, la duración recomendada de la terapia antifúngica en adultos no neutropénicos es de 14 días a partir del primer hemocultivo negativo (que indica la eliminación de Candida del torrente sanguíneo), y la resolución de signos y síntomas de infección. Se puede requerir una terapia más prolongada en los pacientes con focos metastásicos de infección o endocarditis59. Se ha administrado terapia antimicótica prolongada a pacientes con endocarditis que no eran candidatos apropiados para cirugía de reemplazo de la válvula cardíaca, con la intención de curar la candidemia54.
Pacientes neutropénicosEl tratamiento de la candidemia en adultos neutropénicos debe continuar durante 14 días después del primer hemocultivo negativo, siempre que se haya producido la resolución clínica de la infección. Se recomienda un tratamiento más prolongado para los pacientes que desarrollan una CDC49. No se ha establecido la duración del tratamiento para las CDC, pero debería ser superior a 14 días y podría continuar durante semanas o meses hasta que se calcifiquen o resuelvan las lesiones67. Se ha demostrado que el uso de corticoides acelera la recuperación de la CDC41.
Sumario de recomendaciones para la duración del tratamiento de la candidemia en adultos no neutropénicos:
- 1.
Se recomiendan 14 días de tratamiento después del primer hemocultivo negativo y de la resolución de signos y síntomas de infección.
- 2.
Se puede requerir una terapia más prolongada en los pacientes con focos metastásicos de infección o endocarditis.
Sumario de recomendaciones para la duración del tratamiento de la candidemia en adultos neutropénicos:
- 1.
Se recomiendan 14 días de tratamiento después del primer hemocultivo negativo, siempre que se haya producido la resolución clínica de la infección.
- 2.
Se puede requerir una terapia más prolongada en los pacientes con CDC.
En pacientes con candidemia se ha encontrado que la retirada del catéter se correlaciona con una desaparición más rápida de Candida del torrente sanguíneo o un mejor pronóstico2,25,84. Sin embargo, las evidencias descritas son contradictorias respecto a retirar el CVC en este marco, como reflejan las guías más recientes de la Infectious Diseases Society of America. En las guías de 2009 de dicha sociedad para el manejo de la candidemia se recomienda la retirada temprana del CVC para todos los pacientes no neutropénicos con candidemia67. La correspondiente guía de la Infectious Disease Society of America para el manejo de la infección relacionada con catéter intravascular presenta una recomendación más conservadora, limitando la retirada del CVC solamente a los pacientes con candidemia relacionada con dicho catéter51.
Es poco probable que en el futuro se efectúe algún gran ECA prospectivo en el que la variable principal sea la retirada del CVC frente a su permanencia58. Las recomendaciones que promueven la retirada precoz del CVC en pacientes no neutropénicos se basan en estudios con un número pequeño de pacientes, son retrospectivos, no definen la retirada «temprana» del CVC e incluyen pacientes que fallecieron antes del diagnóstico de candidemia y, por lo tanto, no pudieron recibir una terapia antimicótica óptima1,2,44,60,63,103. Un análisis de subgrupo de 2 ECA en fase iii, multicéntricos y a doble ciego, estudió los efectos de la retirada temprana del CVC (dentro de las 24-48h del inicio del tratamiento) en una gran cohorte de pacientes (842 adultos)58. El análisis multivariante no pudo demostrar beneficio por la retirada temprana del CVC en el tiempo de erradicación micológica, las tasas de candidemia persistente o recurrente, el éxito terapéutico o la mortalidad a los 28 y 42 días. Todos los pacientes de estos estudios fueron tratados con una equinocandina o L-AmB, fármacos que tienen una buena penetración en los biofilms38.
Recomendación para el manejo del catéter venoso central. Pacientes no neutropénicosDe acuerdo con las evidencias publicadas, el Grupo de Trabajo considera que no se requiere efectuar la retirada rápida de todos los CVC en los adultos no neutropénicos con candidemia que están recibiendo tratamiento con una equinocandina o L-AmB, siempre que se necesite el CVC. Sin embargo, se justifica la evaluación después de 3-5 días de tratamiento (incluyendo repetición de los hemocultivos), y los clínicos deben considerar la retirada del CVC si el paciente no responde adecuadamente al tratamiento. La retirada temprana del CVC está indicada si hay signos claros de infección en el sitio de acceso o el trayecto del CVC. No se pueden efectuar recomendaciones basadas en la evidencia respecto al manejo del CVC en pacientes que reciben tratamiento con fármacos que no sean equinocandinas o L-AmB.
Se pueden aplicar recomendaciones similares para el manejo del CVC en pacientes neutropénicos con candidemia. Sin embargo, estas recomendaciones no han alcanzado el consenso de todos los miembros del Grupo de Trabajo, aunque un número reducido de expertos sugieren que se debería recomendar una rápida retirada de todos los CVC en los pacientes con candidemia que presentan shock séptico. Esta situación clínica representa un pequeño porcentaje entre los pacientes con candidemia.
Sumario de recomendaciones para el manejo del catéter en adultos no neutropénicos y neutropénicos:
- 1.
El CVC puede dejarse en los pacientes adultos no neutropénicos que están recibiendo tratamiento con una equinocandina o L-AmB, siempre que se necesite dicho CVC.
- 2.
Si el paciente no responde al tratamiento (3 a 5 días de terapia) se debe considerar la retirada del CVC.
- 3.
Si hay evidencia de infección en el sitio de acceso o en el trayecto del catéter se recomienda la retirada temprana (en el momento del diagnóstico) del CVC.
A.L. Colombo ha recibido ayudas para la investigación de Pfizer, MSD, United Medical y Luminex, y ayudas para la formación médica de Pfizer, MSD, United Medical y Astellas. Además, ha ejercido como consultor para MSD, Pfizer y Gilead. J.A. Cortes ha recibido de Pfizer y MSD ayudas para la investigación y para la asistencia a charlas de formación médica. M. Nucci ha recibido ayudas para la investigación de Pfizer y MSD, y ha sido consultor y conferenciante para Pfizer, Merck, Astellas y Gilead. F. de Queiroz Telles ha participado en cursos de Formación Continuada en laboratorios de Astellas, MSD, Pfizer y United Medical, y en programas de investigación en laboratorios de Astellas, MSD y Pfizer. I.N. Tiraboschi ha sido conferenciante para Pfizer y Gilead. J. Zurita ha sido miembro del consejo asesor y consultor de Pfizer, y ha recibido ayudas para la investigación de Wyeth y MSD por su participación en el estudio SMART.
Brigitte Teissedre, PhD, de Choice Healthcare Solutions, brindó asistencia editorial para la redacción del primer manuscrito, los comentarios de los revisores y sugerencias editoriales para las versiones en borrador del manuscrito; los fondos fueron provistos por Pfizer. Los autores son responsables de las opiniones, conclusiones y recomendaciones.
Cómo citar este artículo: Nucci M, et al. Recommendations for the management of candidemia in adults in Latin America. Rev Iberoam Micol. 2013;30:179–188.