Los lípidos obtenidos de microorganismos oleaginosos a partir de hidrolizados de residuos lignocelulósicos son una alternativa para la fabricación de biodiesel.
ObjetivosAislar una levadura oleaginosa capaz de producir lípidos a partir de nejayote centrifugado (NC), hidrolizado de sólidos de nejayote (HSN) e hidrolizado de bagazo de caña de azúcar (HBC).
MétodosPara identificar los aislamientos recuperados se secuenció el ADN ribosómico 26S. La capacidad metabólica se evaluó mediante tiras API20C AUX. La caracterización nutricional del NC, HSN y HBC se realizó cuantificando azúcares reductores, carbohidratos totales, almidón, proteína y nitrógeno total. La capacidad de producción de biomasa y lípidos de la cepa Clavispora lusitaniae Hi2 se evaluó mediante cinéticas de crecimiento en medios de cultivo formulados a partir de NC, HSN y HBC.
ResultadosSe aislaron e identificaron seis cepas de levaduras oleaginosas, siendo C. lusitaniae Hi2 seleccionada para producir lípidos mediante el uso de nejayote. Dicha cepa puede utilizar glucosa, xilosa, arabinosa, galactosa y celobiosa como fuentes de carbono. Los cultivos de C. lusitaniae Hi2 en medio con NC y HSN (en relación 25:75) presentaron la mayor producción de biomasa, 5,6 ± 0,28 g/L; la mayor producción de lípidos, 0,99±0,09 g/L, se obtuvo con una relación 50:50 de estos residuos a las 20 h de incubación.
ConclusionesLa utilización de NC, HSN y HBC para el crecimiento de C. lusitaniae Hi2 es una opción para el aprovechamiento de estos residuos y la generación de compuestos de interés biotecnológico.
Single-cell oils obtained from oleaginous microorganisms by using lignocellulosic waste hydrolysates are an alternative for producing biodiesel.
AimsTo isolate a yeast strain able to produce lipids from centrifuged nejayote (CN), hydrolyzed nejayote solids (HNS) and hydrolyzed sugarcane bagasse (HSB).
MethodsIn order to identify the yeasts recovered, 26S ribosomal DNA was sequenced. The metabolic profile was assessed by using API20C AUX strips. The nutritional characterization of CN, HNS and HSB was performed by quantifying reducing sugars, total carbohydrates, starch, protein and total nitrogen. The biomass and lipid production ability were evaluated by performing growth kinetics of Clavispora lusitaniae Hi2 in combined culture media.
ResultsSix oleaginous yeast strains were isolated and identified, selecting C. lusitaniae Hi2 to study its lipids production by using nejayote. The C. lusitaniae Hi2 strain can use glucose, xylose, arabinose, galactose and cellobiose as carbon sources. Cultures of C. lusitaniae Hi2 presented the best biomass (5.6±0.28 g/L) and lipid production (0.99±0.09 g/L) at 20 h of incubation with the CN:HNS media in the 25:75 and 50:50 ratios, respectively.
ConclusionsThe use of CN, HNS and HSB for the growth of C. lusitaniae Hi2 is an option to take advantage of these agro-industrial residues and generate compounds of biotechnological interest.
Los lípidos son altamente demandados en la producción de alimentos, suplementos nutricionales, detergentes, lubricantes y biocombustibles. Los lípidos se obtienen por extracción de semillas oleaginosas de diferentes plantas, pero aquellos producidos por microorganismos pueden ser una alternativa sostenible a los lípidos derivados de plantas. Varios microorganismos como algas, bacterias, levaduras y hongos poseen la capacidad de acumular lípidos en sus células. Los lípidos microbianos tienen muchas ventajas en comparación con los lípidos derivados de plantas, como un ciclo de vida más corto de los organismos que los producen, se requiere menos mano de obra, su producción es independiente de aspectos geográficos y estacionales, no se necesitan tierras cultivables y su obtención puede ser fácilmente escalable. Otra ventaja de obtener lípidos a partir de microorganismos es que estos se pueden cultivar en condiciones específicas, utilizando residuos agroindustriales como fuente de carbono, y evitar así los problemas de contaminación causados por la mala disposición de estos residuos. Lo anterior permitiría que la producción de lípidos microbianos fuera competitiva económicamente con respecto a la producción actual. Como productoras de lípidos, las levaduras oleaginosas (levaduras capaces de acumular más del 20% de su peso seco celular como lípidos) tienen varias ventajas sobre otros microorganismos: sus tiempos de duplicación son menores a 1 h, pueden alcanzar una masa celular superior a 20 g/L en cultivo líquido, acumulan un contenido de lípidos por encima del 50% de su peso seco celular, utilizan una amplia gama de sustratos, su cultivo en biorreactores es fácilmente escalable y su modificación genética es sencilla1,13,38. Las principales clases de lípidos producidas por las levaduras oleaginosas son triacilgliceroles y ésteres de esteroles que se acumulan en las células como partículas lipídicas49. Las levaduras oleaginosas que se han aislado y caracterizado hasta ahora incluyen levaduras del filo Ascomycota y de los géneros Lipomyces, Yarrowia, Aureobasidium, Trichosporon, Pichia, Apiotrichum, Candida, Sporidiobolus y Sporobolomyces, así como del filo Basidiomycota y los géneros Rhodosporidium, Rhodotorula y Cryptococcus33,38,42,47.
Para la producción de lípidos a partir del cultivo de levaduras oleaginosas se han empleado como medios de cultivo diversos residuos agrícolas e industriales con el fin de establecer así una economía circular que favorezca tanto a la industria como al medio ambiente3,5,11. Uno de estos residuos es el nejayote, agua residual que se obtiene del proceso de nixtamalización del maíz. La nixtamalización es la cocción del maíz en una solución de cal durante dos a ocho horas30. Este proceso permite una mayor biodisponibilidad de los nutrientes del maíz y facilita su conversión en una masa que se utiliza en la fabricación de varios productos alimenticios a nivel mundial. La nixtamalización es la base de una industria alimenticia muy importante en México, Centroamérica y en algunos países de Europa14,27. Solo en México se utilizan 2.437.552 toneladas de maíz al año para producir harina de maíz nixtamalizada24. La nixtamalización requiere alrededor de 1,5 L de agua para procesar 1 kg de maíz, lo que genera grandes cantidades de nejayote10,24. Debido a que el nejayote presenta un pH alcalino (9,8 o superior), una alta demanda química de oxígeno (9.153,30 mg/L) y alto contenido de sólidos suspendidos (9,06 g/L) es considerado un residuo contaminante24.
Por otro lado, el bagazo de caña de azúcar, un residuo fibroso que queda después de la extracción del jugo de caña, es también considerado un residuo agroindustrial contaminante. Este subproducto alcanza hasta un 25% del peso de la caña de azúcar procesada en los ingenios azucareros2,7. Es un material lignocelulósico que en ambientes tropicales presenta un alto contenido de carbohidratos y bajo contenido de lignina; sin embargo, de forma natural, es difícil de degradar45.
Para utilizar estos materiales lignocelulósicos como medio de cultivo debe realizarse una hidrólisis que permita liberar azúcares fermentables tales como glucosa, xilosa y arabinosa. Durante la hidrólisis también se generan otros compuestos solubles provenientes de la degradación (a altas temperaturas y presiones) de xilosa y glucosa, como el furfural y el hidroximetilfurfural, o de la lignina, como el alcohol p-cumarílico y el alcohol coniferílico. Estos compuestos pueden inhibir el crecimiento y consumo de azúcares de los microrganismos durante la fermentación. Los azúcares obtenidos mediante hidrólisis del material lignocelulósico pueden ser una excelente fuente de carbono para el crecimiento de microorganismos oleaginosos productores de lípidos45. El hidrolizado de bagazo de caña de azúcar ha sido aprovechado previamente para la obtención de azúcares fermentables por hidrólisis ácida, alcalina o enzimática de la celulosa y hemicelulosa de este residuo, así como para lo producción de lípidos a partir del cultivo de levaduras oleaginosas7,17,45. Por otro lado, el nejayote y sus sólidos suspendidos no han sido estudiados hasta el momento como medios de cultivo para el crecimiento de levaduras oleaginosas y la producción de lípidos.
En el presente trabajo se llevó a cabo el aislamiento, selección e identificación de levaduras oleaginosas de muestras ambientales, así como la caracterización del crecimiento y producción de lípidos por Clavispora lusitaniae Hi2 al cultivarla en medios formulados a partir de diferentes combinaciones de nejayote centrifugado, hidrolizado de sólidos de nejayote e hidrolizado de bagazo de caña de azúcar.
Materiales y métodosAislamiento de levaduras de suelos y frutos silvestresEn mayo de 2018 se tomaron muestras de suelos y frutos silvestres de ciruela mexicana (Spondias purpurea L.) en el municipio de Yautepec de Zaragoza, en el estado de Morelos, México (coordenadas geográficas 18°53′09″N y 99°03′38″O, y altitud de 1210 msnm). Una masa de 0,5 g de cada muestra se añadió a 25 mL de medio liquido YPD (peptona bacteriológica 20 g/L, extracto de levadura 10 g/L y glucosa 20 g/L) en un matraz Erlenmeyer de 250 mL, que se incubó a 28°C durante 24 h con agitación a 180 rpm. Un mililitro del cultivo anterior se añadió a 9 mL de agua destilada estéril y se procedió a realizar diluciones seriadas en el rango de 10-1 a 10-5. Volúmenes de 0,1 mL de cada dilución se extendieron en placas Petri con agar YPD. Las placas se incubaron a 28°C durante 2-4 días, y las colonias aisladas que mostraron la morfología colonial típica de levadura se subcultivaron para obtener cultivos puros. Para confirmar que las cepas aisladas eran levaduras se realizó una tinción simple con cristal violeta. Los aislamientos de levaduras, confirmados por su morfología celular, se utilizaron para estudios posteriores.
Selección de cepas de levaduras oleaginosasLos aislamientos de levaduras se examinaron para determinar su capacidad de crecimiento y producción de lípidos en nejayote como medio de cultivo mediante análisis semicuantitativo con la técnica de tinción con Negro Sudan B (NSB), desarrollada por Thakur et al. en 1989. Este método determina el valor de absorbancia a 580 nm de un cultivo teñido con NSB, al que se resta la absorbancia de un cultivo sin teñir. El NSB es un colorante lipofílico, por lo que a mayor producción de lípidos mayor será la acumulación de este colorante en la masa celular44. Las cepas de levaduras potencialmente oleaginosas, que mostraban una mayor absorción del pigmento lipofílico NSB, se mantuvieron en placas de agar YPD a 4°C y se subcultivaron una vez cada dos meses.
Identificación de levaduras oleaginosasEl ADN genómico de cada uno de los aislamientos seleccionados como cepas oleaginosas mediante la prueba de NSB se extrajo mediante un mini kit de extracción de ADN genómico de plantas (QIAGEN GmbH, Hilden, Alemania). Los cebadores utilizados para la amplificación por reacción en cadena de la polimerasa (PCR) de la región D1/D2 del gen de ADNr 26S fueron 5′-GCATATCAAAAGCGGAGGAAAAG-3′ y 5′-GGTCCGTGTTTCAAGACGG-3′. La amplificación se realizó con un paso de desnaturalización inicial de 94°C durante 4 min, seguido de 30 ciclos de desnaturalización a 94°C durante 1 min, alineamiento a 55°C durante 1 min y extensión a 72°C durante 1 min; el último ciclo fue una extensión final a 72°C durante 7 min. Posteriormente se secuenció el amplicón de aproximadamente 570 pb de cada cepa y se analizaron las secuencias de ADN mediante la herramienta BLASTn del NCBI. Adicionalmente, para establecer la capacidad de utilizar diferentes fuentes de carbono, el aislamiento que presentó el mejor crecimiento en nejayote, se transfirió a medio de cultivo YPD y se incubó a 30°C durante 72 h. Posteriormente se preparó una suspensión de la levadura en NaCl al 0,85% (p/v) hasta una turbidez aproximada de 2 en la escala de McFarland, se transfirió a tiras API20C AUX (bioMérieux, Marcyl’Etoile, Francia) y se incubó a 30°C durante 48–72 h. La interpretación de los resultados se realizó de acuerdo con las instrucciones del fabricante.
Preparación de hidrolizadosEl nejayote se obtuvo de la nixtamalización de maíz blanco comercial en la relación de 1 g maíz: 3 mL de agua: 0,02 g de cal, se realizó la cocción de la mezcla durante 45 min a 80°C y se dejó reposar durante 18 h. El líquido resultante (nejayote) fue drenado y el maíz lavado con 4,5 L de agua destilada, que fue también drenada. El volumen total de nejayote obtenido se dejó sedimentar, formando así dos fases; la fase líquida se centrifugó a 6.000 g durante 20 min, se ajustó el pH a 6,5±0,02 y se almacenó en refrigeración. Por otro lado, la fase semisólida se secó en horno a 70°C durante dos días y se guardó a temperatura ambiente.
Los hidrolizados de bagazo de caña de azúcar y sólidos de nejayote se obtuvieron mediante hidrólisis ácida (30 min en autoclave, 121°C y 15 psi) utilizando la relación 1 g de sustrato: 5 mL de ácido clorhídrico (HCl) al 2,5%. Los hidrolizados obtenidos se filtraron, se ajustó el pH a 6,5±0,02, se centrifugaron a 6.000 g durante 20 min, se decantó el sobrenadante y se guardó en refrigeración.
Caracterización de los hidrolizadosLos sustratos nejayote centrifugado (NC), hidrolizado de sólidos de nejayote (HSN) e hidrolizado de bagazo de caña de azúcar (HBC) se caracterizaron mediante la cuantificación de azúcares reductores por la técnica DNS (ácido 3,5-dinitrosalicílico)26, carbohidratos totales por el método de ácido sulfúrico: fenol8, almidón por la técnica de yodo50, y proteína y nitrógeno total por el método Kjeldahl25. La relación carbono/nitrógeno se calculó con la fórmula Cglucose/CNitrógenoTotal, o en g/L: (azúcares reductores como glucosa)x 0,4/(nitrógeno total)6. El cálculo de los rendimientos lípidos/biomasa, lípidos/sustrato y biomasa/sustrato, así como las productividades de biomasa (g/L/h) y lípidos (g/L/h) se realizó a través de fórmulas establecidas previamente36.
Preparación de medios de cultivo a partir de residuos agroindustrialesLos medios de cultivo generados a partir de los residuos agroindustriales hidrolizados y sus mezclas binarias fueron esterilizados en autoclave durante 15 min a 121°C, y posteriormente se centrifugaron en condiciones estériles a 6.000 g durante 20 min para clarificar los medios.
Cultivos de C. lusitaniae Hi2 en los medios formuladosLas cinéticas de crecimiento se realizaron en minirreactores RTS-1C (BioSan) durante 20 h con un volumen de operación de 25 mL a 2000 rpm y 30°C. La medición de la densidad óptica se realizó a 850 nm. Para esto se preparó un pre-cultivo de C. lusitaniae Hi2 en medio líquido YPD durante 12 h, posteriormente se ajustó el cultivo al valor 0,1 de densidad óptica a 600 nm y se inoculó en minirreactores para el sistema RTS-1C en los medios a evaluar en relación 1:10. Se evaluaron los medios de cultivo NC, HSN e HBC de manera independiente, así como las mezclas NC:HSN, HBC:HSN e HBC:NC en relaciones 25:75, 50:50 y 75:25. Se utilizó YPD como control positivo para el crecimiento de la levadura.
Cuantificación de biomasa y lípidosLa biomasa se determinó gravimétricamente mediante tubos tipo Falcon de 50 mL llevados a peso constante en un horno a 60°C. Para esto se vertieron en los tubos los medios de cultivo de las cinéticas de crecimiento de 20 h, se centrifugaron a 6.000 g durante 25 min y los tubos con los pellets celulares fueron llevados nuevamente a peso constante en horno a 60°C. Finalmente, se restó el peso del tubo vacío al peso del mismo tubo con el pellet celular seco, obteniendo así el valor de la biomasa en el medio de cultivo evaluado. Posteriormente, se extrajeron los lípidos de la biomasa seca mediante la técnica modificada de Bligh et al.4, y se estableció la cantidad producida de lípidos en g/L y el porcentaje de lípidos con respecto a la biomasa seca. Los sobrenadantes de los cultivos previamente centrifugados se almacenaron para la determinación de las características nutricionales.
Análisis estadísticoTodos los experimentos se realizaron por triplicado. Los resultados se sometieron a un análisis de varianza (ANOVA) y se realizó la comparación de medias por medio de la prueba Tukey con nivel de significancia de 0,05 mediante el programa Minitab 18. Los gráficos ternarios se realizaron con el programa OriginPro2018.
ResultadosAislamiento e identificación de levaduras oleaginosasSe aislaron a partir de muestras de suelo y frutos silvestres recogidos en el estado de Morelos, México, un total de 24 cepas con morfología macroscópica y microscópica características de levaduras. Mediante la tinción con NSB se identificaron seis cepas capaces de producir biomasa lipídica al cultivarlas en nejayote como medio de cultivo. La identificación de dichas cepas se realizó por comparación de la secuencia de la región D1/D2 del gen ADNr 26S con las secuencias depositadas en la base de datos del NCBI GenBank mediante el programa BLASTn; todas las cepas tuvieron un porcentaje de identidad superior al 98%. Las cepas seleccionadas fueron identificadas como Clavispora. lusitaniae Hi2, Clavispora lusitaniae Fachp, Kluyveromyces marxianus C0, Issatchenkia orientalis M2, Candida glabrata MR1 y Pichia kudriavzevii M1. Debido a que la cepa clasificada como C. lusitaniae Hi2 presentó la mayor acumulación de lípidos (37% con respecto al peso seco de la biomasa) y la mayor velocidad de crecimiento (0,12 h-1) al cultivarla en nejayote (dato no mostrado), fue seleccionada para continuar con su caracterización metabólica y para los estudios de crecimiento y producción de lípidos en los medios de cultivo formulados a partir de los residuos agroindustriales nejayote, hidrolizado de sólidos de nejayote e hidrolizado de bagazo de caña de azúcar. La secuencia parcial del gen ADNr 26S de C. lusitaniae Hi2 fue depositada en la base de datos GenBank con el número de acceso MW585075.
Para realizar una caracterización de las capacidades metabólicas de C. lusitaniae Hi2 se analizó el uso de fuentes de carbono mediante tiras reactivas API20C AUX. Esta cepa puede utilizar como fuentes de carbono D-glucosa, L-arabinosa, D-maltosa, glicerol, 2-ceto-gluconato, D-xilosa, adonitol, D-galactosa, D-sorbitol, N-acetil-glucosamina, D-celobiosa, D-sacarosa, D-trehalosa y D-melecitosa. Las fuentes de carbono que no puede utilizar esta cepa son xilitol, inositol, metil-αD-glicopiranosido, D-lactosa y D-rafinosa. La capacidad de C. lusitaniae Hi2 de utilizar como fuentes de carbono glucosa, xilosa, arabinosa, galactosa y celobiosa demuestran el potencial de esta cepa para la bioconversión de residuos lignocelulósicos, ya que estos azúcares están presentes de manera preponderante en los hidrolizados de estos materiales.
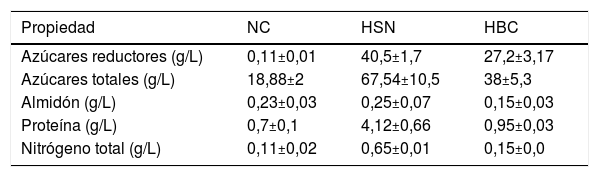
Caracterización de los residuos agroindustrialesEl nejayote y el bagazo de caña de azúcar fueron seleccionados para evaluar su potencial como medios de cultivo para el crecimiento y producción de lípidos por C. lusitaniae Hi2. Para aumentar la disponibilidad de azúcares reductores y nitrógeno se realizó una hidrólisis ácida de ambos residuos agroindustriales. En la tabla 1 se muestra la caracterización de los residuos NC, HSN y HBC. Como puede apreciarse en la tabla 1, el HSN presenta las concentraciones más altas en todos los parámetros evaluados. La cantidad de azúcares reductores del HSN es 1,5 y 368 veces superior a las de HBC y NC, respectivamente. Igualmente, la concentración de azúcares totales en el HNS es 1,8 y 3,6 veces más alta que en HBC y NC. La cantidad de almidón es similar en NC y HSN, mientras que la cantidad de nitrógeno total es de 4 a 6 veces mayor en el HSN que en NC y HBC. Puede concluirse que al hidrolizar los sólidos de nejayote se puede obtener una mayor cantidad de azúcares reductores que en el NC, lo que hace que el hidrolizado de este residuo sea más atractivo como medio de cultivo para el desarrollo de bioprocesos de interés comercial.
Propiedades nutricionales del nejayote centrifugado (NC), del hidrolizado del sólido de nejayote (HSN) y del hidrolizado de bagazo de caña de azúcar (HBC)
| Propiedad | NC | HSN | HBC |
|---|---|---|---|
| Azúcares reductores (g/L) | 0,11±0,01 | 40,5±1,7 | 27,2±3,17 |
| Azúcares totales (g/L) | 18,88±2 | 67,54±10,5 | 38±5,3 |
| Almidón (g/L) | 0,23±0,03 | 0,25±0,07 | 0,15±0,03 |
| Proteína (g/L) | 0,7±0,1 | 4,12±0,66 | 0,95±0,03 |
| Nitrógeno total (g/L) | 0,11±0,02 | 0,65±0,01 | 0,15±0,0 |
Con el fin de encontrar la combinación adecuada de residuos agroindustriales para el crecimiento de C. lusitaniae Hi2, se evaluaron 12 medios de cultivo empleando por separado NC, HSN y HBC, así como las mezclas NC:HSN, HBC:HSN y HBC:NC en relaciones 25:75, 50:50 y 75:25. Se utilizó el medio YPD como control positivo para el crecimiento de la levadura.
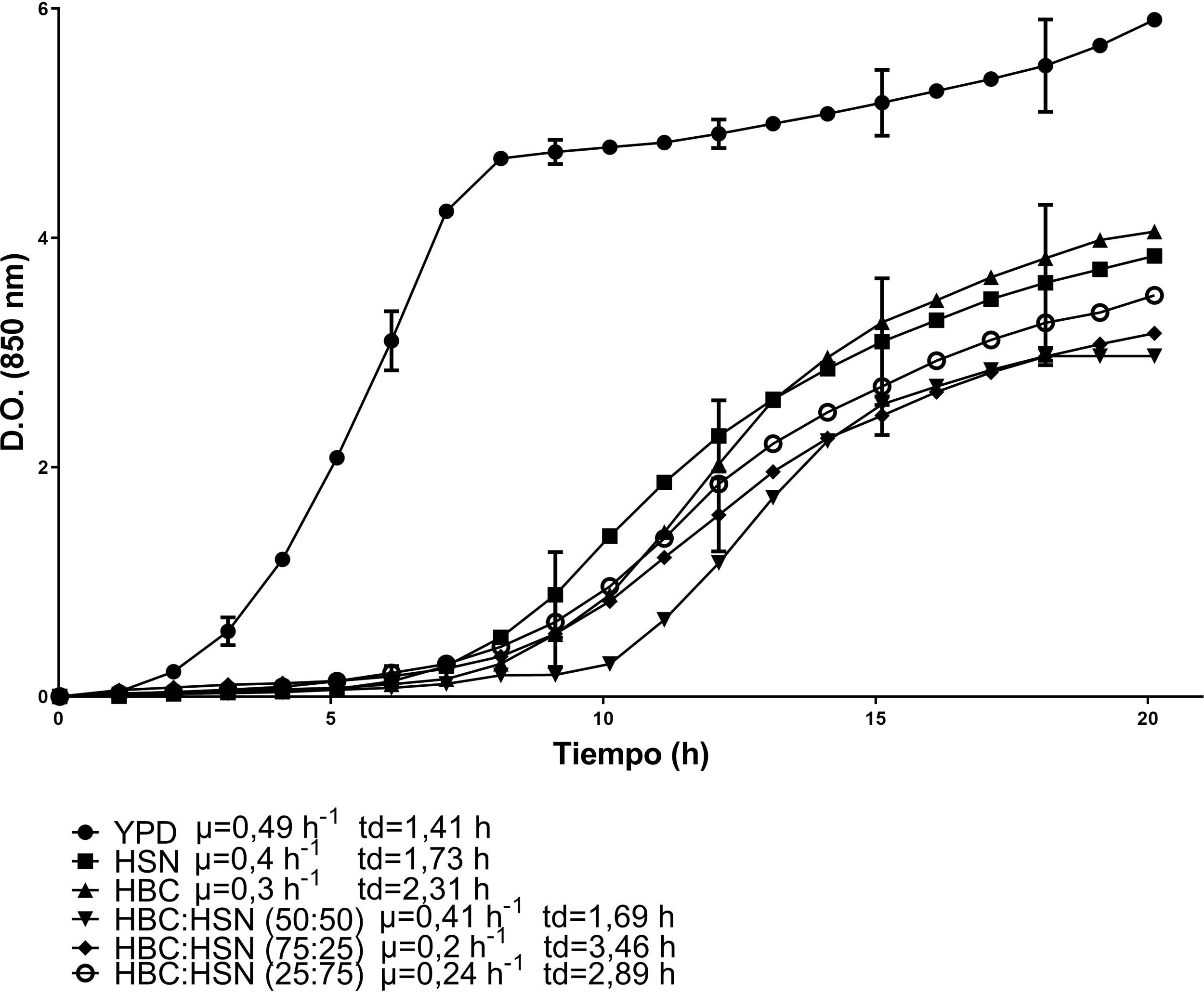
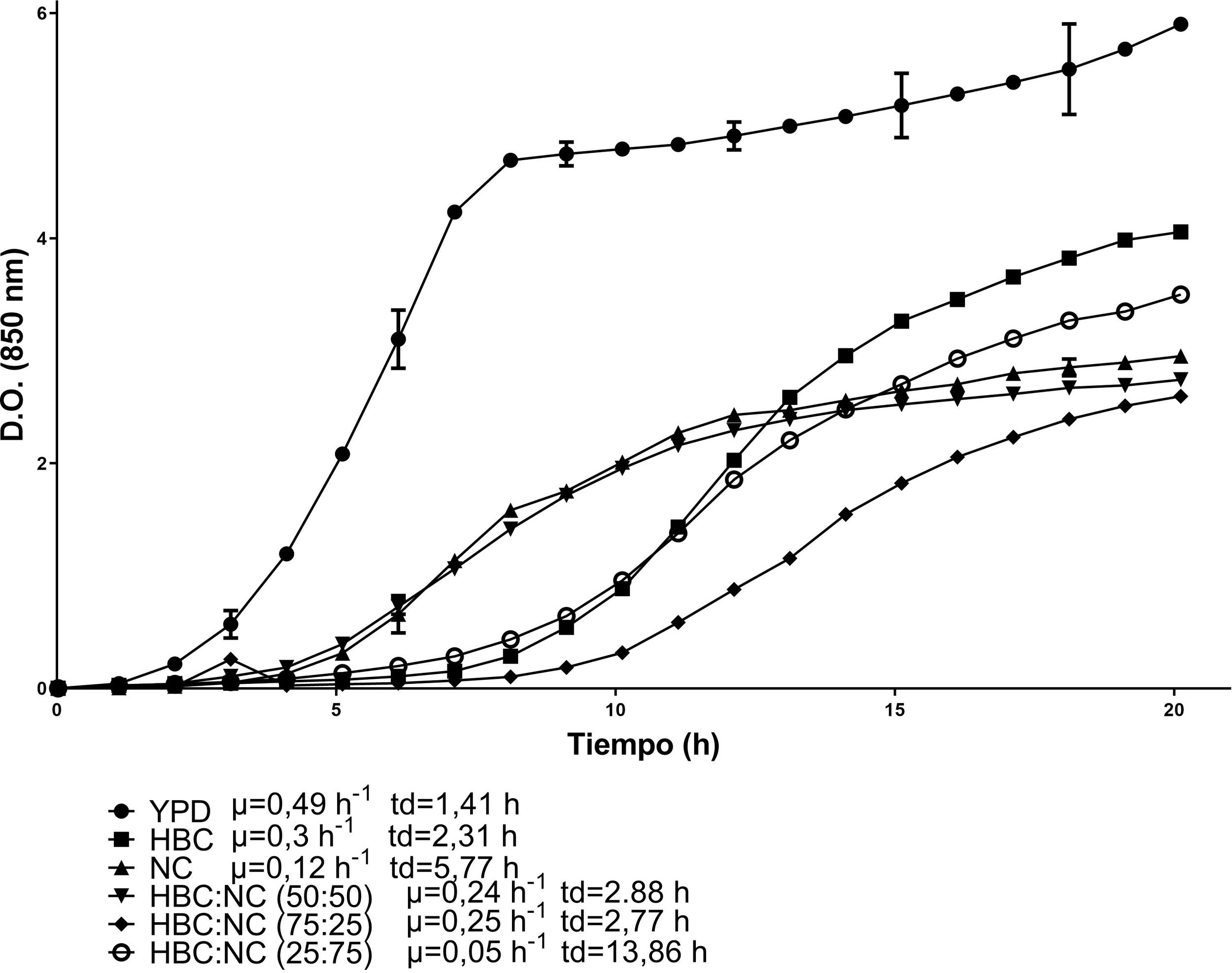
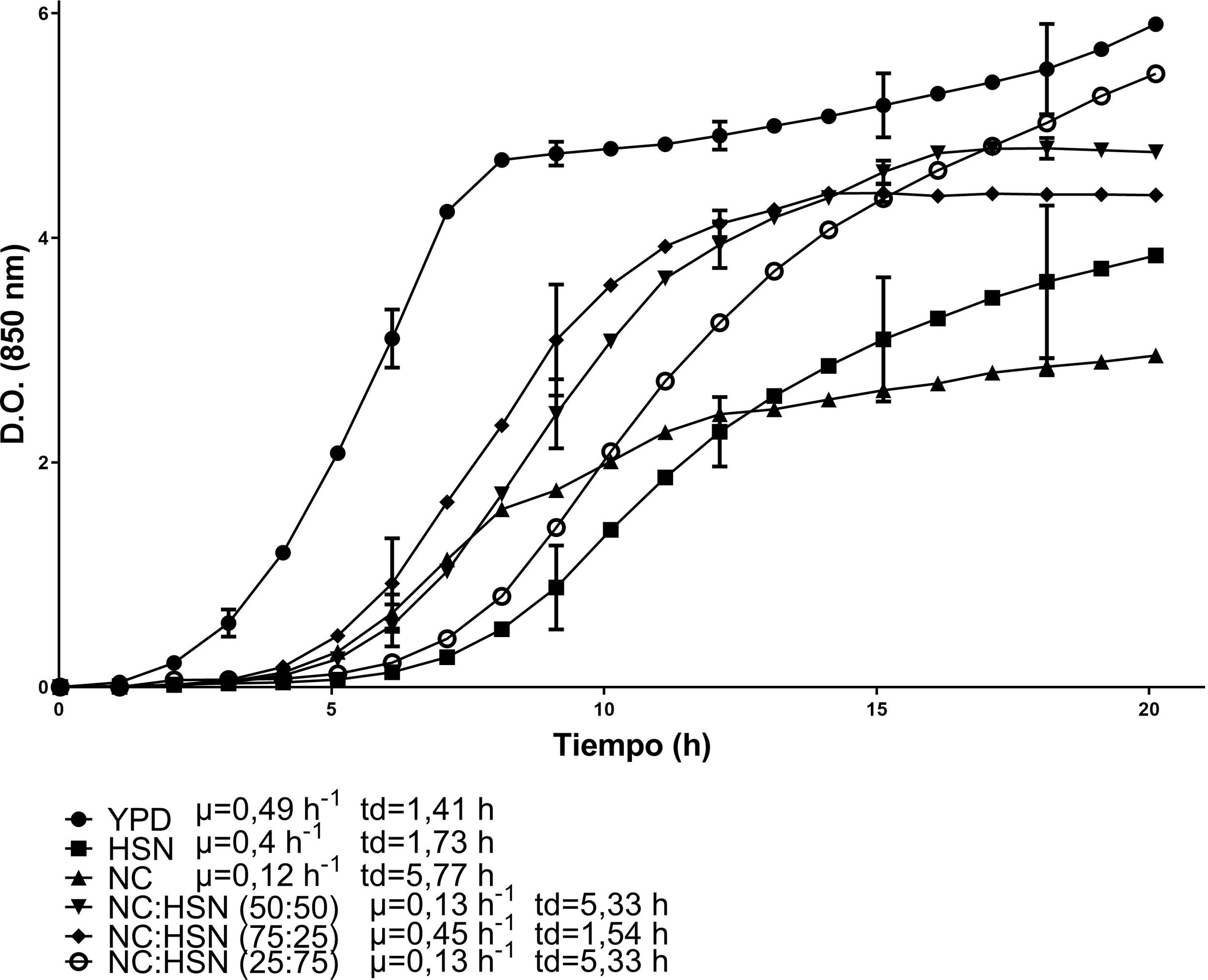
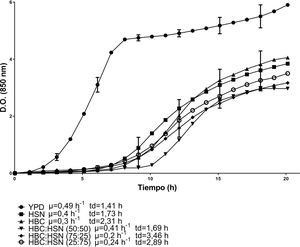
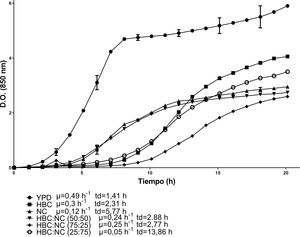
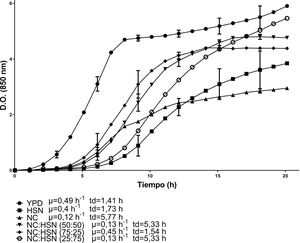
Las cinéticas de crecimiento de C. lusitaniae Hi2 en los medios de cultivo formulados a partir de la combinación de HBC con HSN se presentan en la figura 1. La combinación con la mayor velocidad de crecimiento fue HBC:HSN (50:50) con 0,41 h-1 y un tiempo de duplicación de 1,69 h, en contraste con el medio HBC:HSN (25:75), que presentó la menor velocidad de crecimiento (0,2 h-1), aumentando así el tiempo de duplicación a 3,46 h. En la figura 2 se presentan las cinéticas de crecimiento de C. lusitaniae Hi2 en los medios de cultivo formulados a partir de la combinación de HBC con NC, observándose que las mezclas de estos hidrolizados no favorecieron el crecimiento de la levadura ya que la velocidad de crecimiento fue inferior a las obtenidas con los hidrolizados por separado. Las cinéticas de crecimiento de C. lusitaniae Hi2 en los medios de cultivo formulados a partir de la combinación de NC y HSN se muestran en la figura 3. El medio donde se presentó la mayor velocidad de crecimiento (0,45 h-1) fue NC:HSN 75:25, con un tiempo de duplicación de 1,54 h. Las combinaciones de estos hidrolizados favorecieron el crecimiento de la levadura ya que la densidad óptica alcanzada por estos cultivos fue superior a las obtenidas con los hidrolizados por separado.
Cinéticas de crecimiento de la levadura C. lusitaniae Hi2 en los medios de cultivo formulados a partir de hidrolizado del sólido de nejayote (HSN) e hidrolizado de bagazo de caña de azúcar (HBC) en diferentes proporciones porcentuales, evaluadas en minirreactor RTS BioSan durante 20 h a 30°C. Se incluye la velocidad de crecimiento (μ) y el tiempo de duplicación (td) de cada cinética.
Cinéticas de crecimiento de la levadura C. lusitaniae Hi2 en los medios de cultivo formulados a partir de hidrolizado de bagazo de caña de azúcar (HBC) y nejayote centrifugado (NC) en diferentes proporciones porcentuales, evaluadas en minirreactor RTS BioSan durante 20 h a 30°C. Se incluye la velocidad de crecimiento (μ) y el tiempo de duplicación (td) de cada cinética.
Cinéticas de crecimiento de la levadura C. lusitaniae Hi2 en los medios de cultivo formulados a partir de nejayote centrifugado (NC) e hidrolizado del sólido de nejayote (HSN) en diferentes proporciones porcentuales, evaluadas en minirreactor RTS BioSan durante 20 h a 30°C. Se incluye la velocidad de crecimiento (μ) y el tiempo de duplicación (td) de cada cinética.
En cuanto al consumo de azúcares reductores por la levadura C. lusitaniae Hi2 se observa que en la mayoría de las combinaciones se presentó un consumo superior al 69,8%, con respecto al observado en los hidrolizados por separado, con un máximo de 59% (tabla 2). A partir del análisis de las cinéticas de crecimiento y del consumo de azúcares reductores en los medios evaluados, se puede concluir que algunas de las combinaciones de NC, HSN y HBC permiten un mejor crecimiento de C. lusitaniae Hi2 que en los sustratos por separado.
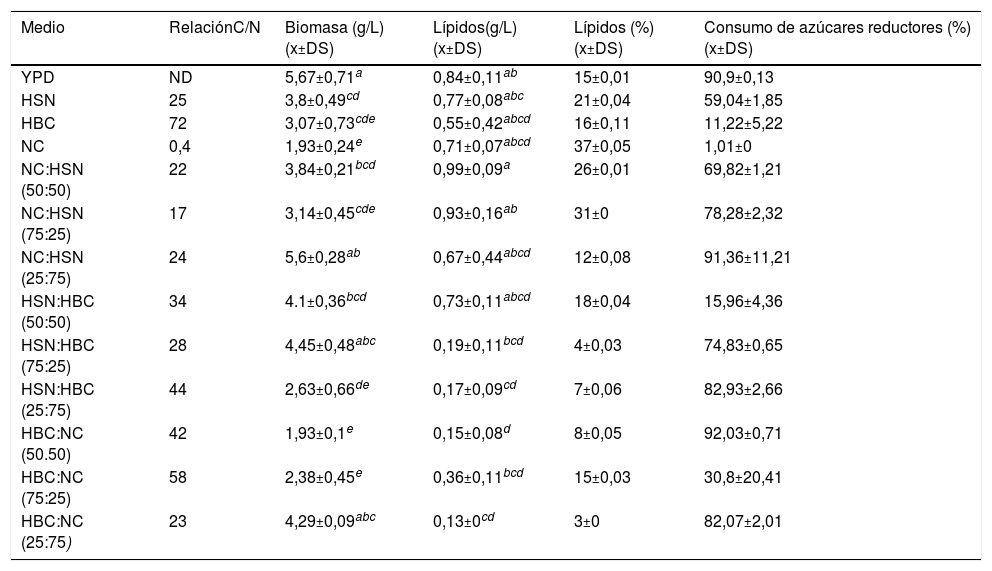
Producción de biomasa, lípidos y consumo de azúcares reductores a las 20 h de incubación de cultivos de C. lusitaniae Hi2 en los medios formulados. Se incluye la relación C/N de los medios y el análisis estadístico de los resultados
| Medio | RelaciónC/N | Biomasa (g/L) (x±DS) | Lípidos(g/L) (x±DS) | Lípidos (%) (x±DS) | Consumo de azúcares reductores (%) (x±DS) |
|---|---|---|---|---|---|
| YPD | ND | 5,67±0,71a | 0,84±0,11ab | 15±0,01 | 90,9±0,13 |
| HSN | 25 | 3,8±0,49cd | 0,77±0,08abc | 21±0,04 | 59,04±1,85 |
| HBC | 72 | 3,07±0,73cde | 0,55±0,42abcd | 16±0,11 | 11,22±5,22 |
| NC | 0,4 | 1,93±0,24e | 0,71±0,07abcd | 37±0,05 | 1,01±0 |
| NC:HSN (50:50) | 22 | 3,84±0,21bcd | 0,99±0,09a | 26±0,01 | 69,82±1,21 |
| NC:HSN (75:25) | 17 | 3,14±0,45cde | 0,93±0,16ab | 31±0 | 78,28±2,32 |
| NC:HSN (25:75) | 24 | 5,6±0,28ab | 0,67±0,44abcd | 12±0,08 | 91,36±11,21 |
| HSN:HBC (50:50) | 34 | 4.1±0,36bcd | 0,73±0,11abcd | 18±0,04 | 15,96±4,36 |
| HSN:HBC (75:25) | 28 | 4,45±0,48abc | 0,19±0,11bcd | 4±0,03 | 74,83±0,65 |
| HSN:HBC (25:75) | 44 | 2,63±0,66de | 0,17±0,09cd | 7±0,06 | 82,93±2,66 |
| HBC:NC (50.50) | 42 | 1,93±0,1e | 0,15±0,08d | 8±0,05 | 92,03±0,71 |
| HBC:NC (75:25) | 58 | 2,38±0,45e | 0,36±0,11bcd | 15±0,03 | 30,8±20,41 |
| HBC:NC (25:75) | 23 | 4,29±0,09abc | 0,13±0cd | 3±0 | 82,07±2,01 |
Los valores de biomasa y lípidos con letras superíndices iguales, dentro de la misma columna, no presentan medias estadísticamente diferentes (Tukey, 0,05)
Para determinar cuál era la mejor combinación de residuos para el crecimiento y producción de lípidos por parte de C. lusitaniae Hi2 se evaluó la producción de biomasa y lípidos, así como el contenido porcentual de lípidos celulares con relación a la biomasa seca al alcanzar los cultivos la fase estacionaria a las 20 h de incubación (tabla 2). La mayor producción de biomasa (5,67±0,71 g/L) se obtuvo en el medio YPD, seguido de los medios de NC:HSN (25:75) y HSN:HBC (75:25), con 5,6±0,28 y 4,45±0,48 g/L, y una relación C/N de 24 y 28, respectivamente. En los medios NC:HSN y HSN:HBC se observó que a mayor proporción de HSN mayor era la biomasa que se obtenía, lo que puede deberse al alto contenido de azúcares reductores de este hidrolizado. Sin embargo, los valores de biomasa obtenidos no parecen tener relación con el contenido C/N de los medios evaluados. Por otro lado, los cultivos de C. lusitaniae Hi2 en los medios compuestos NC:HSN (50:50) y NC:HSN (75:25) presentaron la mayor producción de lípidos, con 0,99±0,09 y 0,93±0,16 g/L, y una relación C/N de 22 y 17, respectivamente. Finalmente, en cuanto al rendimiento porcentual lípidos/biomasa, la levadura oleaginosa C. lusitaniae Hi2, crecida en el medio constituido solo por NC, con una relación C/N de 0,4, presentó el mayor porcentaje (37%) seguido de los medios NC:HSN (75:25) y NC:HSN (50:50), con una relación C/N de 17 y 22, y valores del 31% y 26%, respectivamente. Lo anterior confirma el carácter oleaginoso de C. lusitaniae Hi2, ya que su contenido en lípidos es superior al 20% de la biomasa celular seca.
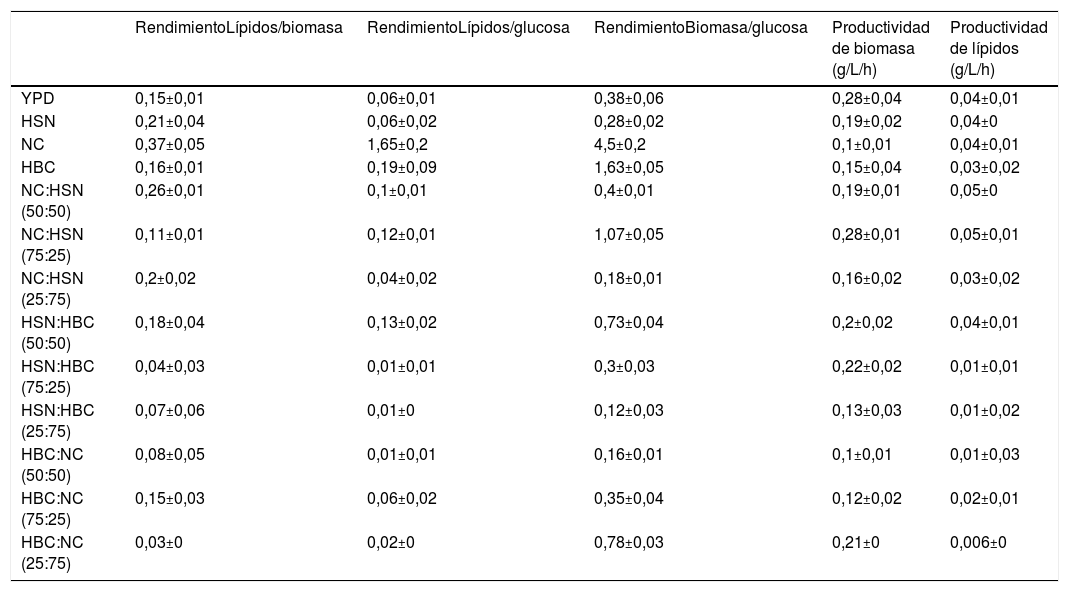
Con el fin de realizar una evaluación más precisa de los rendimientos y productividad de biomasa y lípidos obtenidos a partir de los cultivos de C. lusitaniae Hi2 en los medios formulados se realizó el cálculo de los rendimientos lípidos/biomasa, lípidos/sustrato y biomasa/sustrato, así como las productividades de biomasa (g/L/h) y lípidos (g/L/h) a las 20 h de incubación (tabla 3). En cuanto a los primeros tres parámetros destaca el cultivo en NC con 0,37 g de lípidos/g de biomasa, 1,65 g de lípidos/g de glucosa y 4,5 g de biomasa/g de glucosa. Los resultados anteriores permiten establecer que C. lusitaniae Hi2 está empleando otras fuentes de carbono presentes en el NC, que no fueron cuantificadas, ya que los rendimientos de lípidos y biomasa seca son superiores a los de azúcares reductores presentes en este medio. En cuanto a la productividad de biomasa, los medios YPD y NC:HSN (75:25) presentaron 0,28 g/L/h, seguido por todos los medios de NC:HSN y HBC:HSN, con una productividad de biomasa entre 0,19 y 0,22 g/L/h. Finalmente, la mayor productividad de lípidos se presentó en los medios NC:HSN (50:50) y NC:HSN (75:25) con 0,05 g/L/h.
Rendimientos lípidos/biomasa, lípidos/sustrato, biomasa/sustrato, productividad de biomasa (g/L/h) y lípidos (g/L/h) a las 20 h de incubación de los cultivos de C. lusitaniae Hi2 en los medios formulados a partir de NC, HSN y HBC
| RendimientoLípidos/biomasa | RendimientoLípidos/glucosa | RendimientoBiomasa/glucosa | Productividad de biomasa (g/L/h) | Productividad de lípidos (g/L/h) | |
|---|---|---|---|---|---|
| YPD | 0,15±0,01 | 0,06±0,01 | 0,38±0,06 | 0,28±0,04 | 0,04±0,01 |
| HSN | 0,21±0,04 | 0,06±0,02 | 0,28±0,02 | 0,19±0,02 | 0,04±0 |
| NC | 0,37±0,05 | 1,65±0,2 | 4,5±0,2 | 0,1±0,01 | 0,04±0,01 |
| HBC | 0,16±0,01 | 0,19±0,09 | 1,63±0,05 | 0,15±0,04 | 0,03±0,02 |
| NC:HSN (50:50) | 0,26±0,01 | 0,1±0,01 | 0,4±0,01 | 0,19±0,01 | 0,05±0 |
| NC:HSN (75:25) | 0,11±0,01 | 0,12±0,01 | 1,07±0,05 | 0,28±0,01 | 0,05±0,01 |
| NC:HSN (25:75) | 0,2±0,02 | 0,04±0,02 | 0,18±0,01 | 0,16±0,02 | 0,03±0,02 |
| HSN:HBC (50:50) | 0,18±0,04 | 0,13±0,02 | 0,73±0,04 | 0,2±0,02 | 0,04±0,01 |
| HSN:HBC (75:25) | 0,04±0,03 | 0,01±0,01 | 0,3±0,03 | 0,22±0,02 | 0,01±0,01 |
| HSN:HBC (25:75) | 0,07±0,06 | 0,01±0 | 0,12±0,03 | 0,13±0,03 | 0,01±0,02 |
| HBC:NC (50:50) | 0,08±0,05 | 0,01±0,01 | 0,16±0,01 | 0,1±0,01 | 0,01±0,03 |
| HBC:NC (75:25) | 0,15±0,03 | 0,06±0,02 | 0,35±0,04 | 0,12±0,02 | 0,02±0,01 |
| HBC:NC (25:75) | 0,03±0 | 0,02±0 | 0,78±0,03 | 0,21±0 | 0,006±0 |
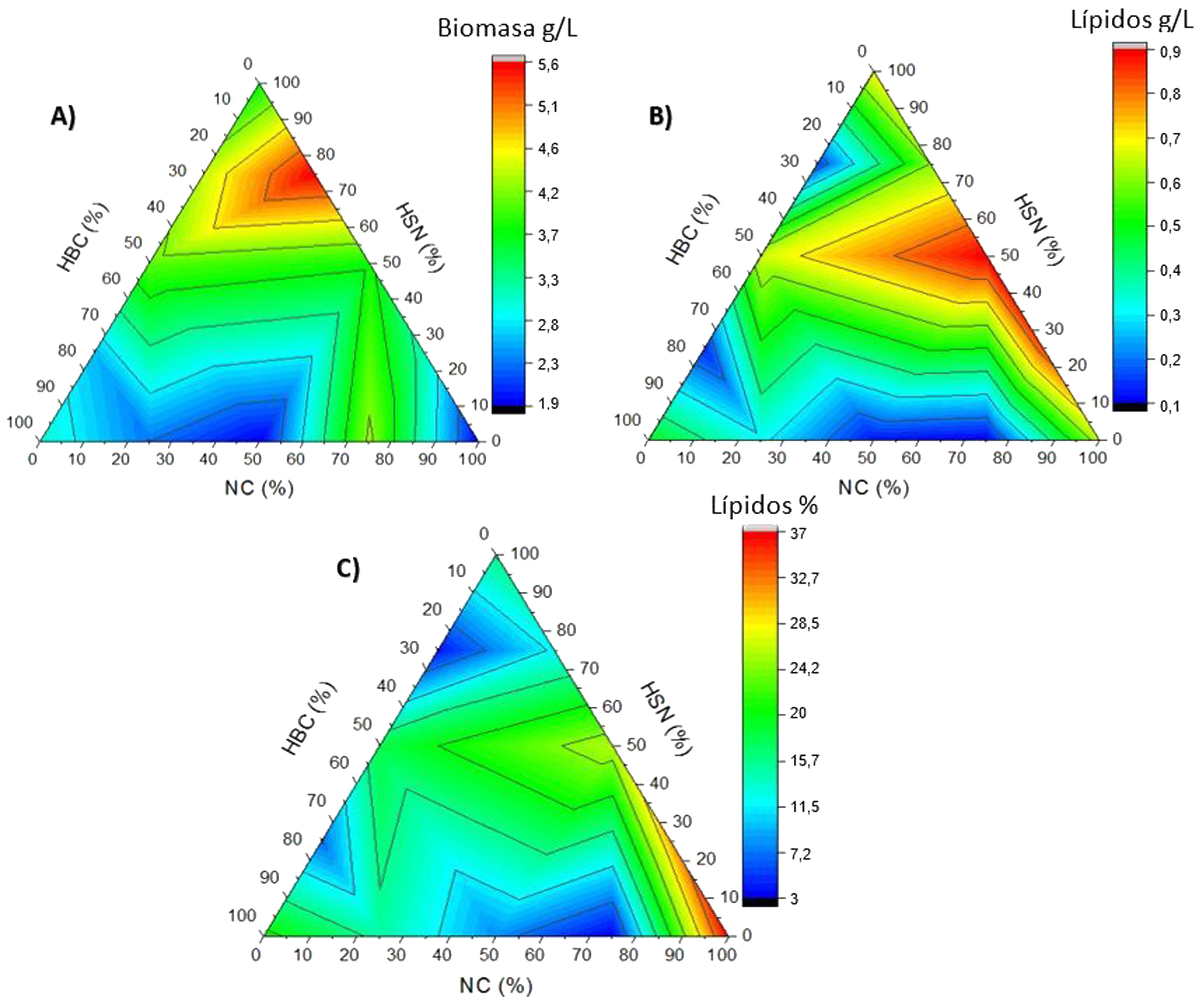
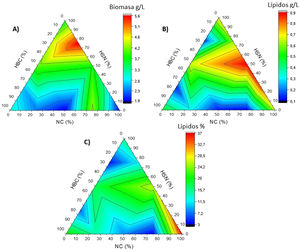
Mediante la elaboración de gráficos ternarios (fig. 4) se evaluó el comportamiento de C. lusitaniae Hi2 en las variables de producción de biomasa, producción de lípidos y rendimiento lípidos/biomasa (%) en los medios NC, HSN y HBC de manera individual y al combinarse, en donde el área roja nos indica la mejor respuesta posible de la variable evaluada en el experimento. La figura 4A muestra la producción de biomasa, con la mejor respuesta en concentraciones del 56,5% al 78% para HSN, del 8-31,5% con NC e inferior al 24% para el HBC. En la figura 4B se observa la producción de lípidos; la mayor producción con HSN fue a concentraciones situadas entre el 24% y el 77%, con NC para concentraciones del 33-77% y concentraciones inferiores al 13% para el HBC. La figura 4C muestra el rendimiento porcentual lípidos/biomasa. Con HSN la mejor respuesta se obtuvo con concentraciones inferiores al 17%, con NC con concentraciones superiores al 84% e inferiores al 6% con HBC. De esta forma puede predecirse cuáles son las mejores combinaciones de NC, HSN y HBC para la óptima producción de biomasa y lípidos por parte de C. lusitaniae Hi2.
Gráficos ternarios del comportamiento de las variables de (A) biomasa (g/L), (B) lípidos (g/L) y (C) rendimiento lípidos/biomasa (%), elaborados a partir de los valores obtenidos de los cultivos de C. lusitaniae Hi2 en los medios formulados de manera individual o en mezclas de los siguientes residuos: hidrolizado de bagazo de caña de azúcar (HBC), hidrolizado del sólido de nejayote (HSN) y nejayote centrifugado (NC). El área roja en los gráficos ternarios representa la mejor respuesta posible de las variables evaluadas.
En este trabajo se aislaron 24 cepas de levadura y se seleccionaron seis de ellas, mediante un método rápido semicuantitativo con NSB, como posibles cepas oleaginosas44. Técnicas basadas en el uso del NSB se han empleado previamente para descubrir microorganismos oleaginosos en colecciones de cepas silvestres o de mutantes (mediante procesos de mutagénesis al azar) con una capacidad de producción de lípidos mejorada. Por ejemplo, 129 aislamientos de levaduras de diferentes regiones de Brasil fueron analizados para establecer su potencial oleaginoso, de los que 42 aislamientos fueron seleccionados8. En otro estudio, las cepas Cryptococcus podzolicus CPOH4, Trichosporon porosum TPST6 y Pichia segobiensis SSOH12 fueron seleccionadas como productoras potenciales de lípidos utilizando la misma técnica40. Lindquist et al.23 mostraron, mediante un método densitométrico con NSB, que una mutagénesis por radiación UV de Yarrowia lipolytica NRRL YB-567 generó mutantes con un incremento del 48% en la producción de lípidos con respecto a la cepa silvestre. Katre et al.19 llevaron a cabo una mutagénesis química con el agente alquilante N-metil-N′-nitro-N-nitrosoguanidina y generaron 761 mutantes de Yarrowia lipolytica NCIM 3589, de los que 27 fueron seleccionados a través de una técnica en placas Petri con NSB; la mejor mutante seleccionada presentaba un incremento del 49% en la producción de lípidos con respecto a la cepa silvestre.
La levadura oleaginosa caracterizada y utilizada en este trabajo fue identificada como C. lusitaniae, un teleomorfo de Candida lusitaniae del filum Ascomycota. Se trata de una levadura ambientalmente ubicua, sin nicho ecológico específico conocido. Puede aislarse de diferentes sustratos, como suelos, aguas, plantas y extractos gastrointestinales de muchos animales, incluidas aves, mamíferos y el ser humano; también ha sido aislada de bebidas fermentadas tradicionales43. En hospedadores inmunodeprimidos, C. lusitaniae puede ser patógena oportunista y es responsable de alrededor del 1% de las candidiasis invasivas, particularmente en pacientes pediátricos y oncohematológicos12,20.
En cuanto a la caracterización de los sustratos, el nejayote centrifugado presentó bajo contenido de azúcares reductores (0,11±0,01 g/L), hecho también descrito por García-Depraect et al.14 y Ramírez-Romero et al.35, que describieron concentraciones de azúcares reductores de 0,148 y 0,166-0,818 g/L, respectivamente. Esto puede deberse a que por las condiciones del proceso de nixtamalización (hidrólisis alcalina) al que es sometido el maíz, la celulosa y la hemicelulosa del pericarpio no se hidrolizan; en la centrifugación del nejayote se obtiene un sobrenadante y un precipitado sólido. En nuestro trabajo se obtuvieron 10,35±0,25 g/L de sólidos de nejayote, cantidad que está dentro del rango descrito en la literatura existente, que va de 10 a 50 g/L15,46. Las características del nejayote en el proceso de nixtamalización como pérdida de materia seca, generación de sólidos suspendidos y concentración de nutrientes, están influenciadas por los parámetros de procesamiento, que pueden incluir utilizar un maíz híbrido, la dureza del endospermo, la calidad del grano, el tipo de cal y su concentración, los tiempos y temperaturas de cocción y remojo, la fricción producida durante el lavado y transporte, y los equipos de procesamiento y prácticas utilizadas37. Por tanto, los resultados generados en los estudios realizados con nejayote dependen en gran medida del proceso de nixtamalización utilizado. Al realizar la hidrólisis ácida de los sólidos del nejayote se obtuvo una mayor concentración de azúcares reductores (40,5±1,7 g/L) y carbohidratos totales (67,54±10,5 g/L), debido a la posible rotura de la celulosa y hemicelulosa del pericarpio del maíz. Estos resultados son novedosos ya que no se ha reportado previamente el uso de hidrolizado de sólidos de nejayote como medio de cultivo. En cuanto al nitrógeno total obtenido del nejayote centrifugado, este residuo presentó concentraciones bajas (0,11±0,02 g/L) en comparación con los resultados de España-Gamboa et al.9 y García-Depraect et al.14, que obtuvieron concentraciones de 0,209 y 0,359 g/L, respectivamente. López-Pacheco et al.24 describen resultados similares a los obtenidos en este trabajo, con una concentración de 0,12 g/L de nitrógeno. A diferencia de los trabajos citados previamente, en los que se emplearon muestras de nejayote obtenidas de empresas, nuestras muestras de nejayote provienen de maíz nixtamalizado de manera casera, por lo que las diferencias observadas pueden atribuirse al proceso de nixtamalización del maíz.
Por otro lado, el HBC presentó una mayor concentración de azúcares (27,2±3,17 g/L), superior a la descrita por Domínguez-Domínguez et al.7, de 0,98 g/L, y similar a la obtenida por Tsigie et al.45 y Hernández-Salas et al.17, de 21,38 y 29,9 g/L, respectivamente. Las diferencias observadas pueden deberse a las condiciones (tiempo de hidrólisis, tipo y concentración del ácido, relación ácido:bagazo) que se emplearon en cada uno de los trabajos mencionados para obtener los hidrolizados.
Con respecto a las curvas de crecimiento de C. lusitaniae Hi2 en los residuos agroindustriales, estas fueron similares en los medios compuestos por la mezcla de HBC y HSN, es decir, no se favoreció el crecimiento al combinar estos hidrolizados. En los medios formulados a partir de HBC:HSN 75:25 y 25:75 se presentó una menor velocidad de crecimiento en comparación con los hidrolizados evaluados por separado, lo que puede deberse a que ambos medios de cultivo, provenientes de una hidrólisis ácida, presentan compuestos tóxicos para la levadura, tales como el furfural y el 5-hidroximetilfurfural, que afectan su crecimiento, como reporta Tsigie et al.45 (fig. 1). De la misma manera, al evaluar los medios formulados a partir de la mezcla de HBC y NC no se mejoró el crecimiento de C. lusitaniae Hi2, aunque en la relación 50:50 la fase de adaptación fue menor, similar a la obtenida en el medio NC (fig. 2). Al combinar NC y HSN se obtuvo un mayor crecimiento de la levadura en comparación con el observado al utilizar los residuos por separado, aproximándose al crecimiento observado en el medio YPD. La tendencia que se presenta al combinar estos hidrolizados es que, a mayor cantidad de HSN, mayor es el crecimiento de C. lusitaniae Hi2, si bien la fase de adaptación es más larga; en cambio, a mayor contenido de NC la fase de adaptación es menor, así como su crecimiento (fig. 3).
Los cultivos de la levadura oleaginosa C. lusitaniae Hi2, crecida en los medios compuestos por NC y HSN, presentaron la mayor concentración de biomasa y lípidos. El cultivo de C. lusitaniae Hi2 en el medio NC:HSN (50:50) presentó la mayor producción de lípidos con 0,99±0,09 g/L y 26% de lípidos por biomasa seca, seguido del cultivo en el medio NC:HSN (75:25, con 0,97±0,16 g/L y 31% de lípidos por biomasa seca). Se han descrito levaduras oleaginosas del género Candida, como Candida lipolytica, Candida tropicalis, Candida lambica, Candida membranaefaciens, y dos especies sin determinar, que presentaron porcentajes de lípidos por biomasa seca de 13,8±1,5; 23,1±2,6; 34,8±3,4; 29,6±3,3; 36±3,2; 21±1,4, respectivamente, a los dos días de incubación en un medio de melaza18. Asimismo, Pan et al.28 reportaron que las cepas Candida pulcherrima J2-4, Candida tropicalis J3-1,Candida utilis J3-2 y Candida utilis J3-3 presentaron una producción de 6,5; 20,5; 20,9 y 10,4 g/L de biomasa, 1,95; 5,1; 4,9 y 2,54 g/L de lípidos y 30; 24,88; 23,44 y 24,5% de lípidos por biomasa seca, respectivamente, en un medio limitado de nitrógeno a los cinco días de incubación. Es importante mencionar que la relación C/N de los medios elaborados (tabla 1) va desde 0,4 en el NC hasta 72 en el HBC. Según otras publicaciones, la acumulación de lípidos tiene lugar cuando los microorganismos oleaginosos son cultivados en medios con un exceso de carbono donde otros nutrientes, particularmente el nitrógeno, limitan su crecimiento29. Por lo tanto, la relación C/N juega un papel importante en la acumulación de lípidos. De acuerdo con varias publicaciones desarrolladas en este campo, la acumulación de lípidos es estimulada con una relación molar de C/N mayor a 20 y menor a 7029, por lo que las relaciones C/N de la mayoría de los medios elaborados en este trabajo están dentro de este intervalo. Resulta contradictorio que con el medio NC, que tenía la menor relación C/N de los medios evaluados, se obtuviera el mayor rendimiento porcentual lípidos/biomasa; esto podría explicarse por el cálculo de la relación C/N a partir del contenido de azúcares reductores, sin considerar el carbono proporcionado por otros compuestos presentes en este residuo, así como la complejidad nutricional del mismo.
En cuanto a los rendimientos obtenidos de lípidos/biomasa, lípidos/sustrato y biomasa/sustrato destaca el cultivo en NC con 0,37 g/g, 1,65 g/g y 4,5 g/g, respectivamente. En cuanto a la productividad de biomasa los medios YPD y NC:HSN (75:25) presentaron 0,28 g/L/h, seguidos por todos los medios de NC:HSN y HBC:HSN con una producción de biomasa de 0,19 a 0,22 g/L/h. La mayor productividad de lípidos se presentó en los medios NC:HSN (50:50) y NC:HSN (75:25), con 0,05 g/L/h. Estos resultados están dentro del rango descrito para la producción de lípidos por levaduras oleaginosas a partir de diferentes residuos agrícolas y subproductos industriales, datos recopilados en un trabajo de revisión por Probst et al. en 201634. Sin embargo, la concentración de biomasa obtenida en nuestro estudio es inferior a la generada en la mayoría de los estudios previos34. Por ejemplo, Liang et al.22 en 2014, reportaron que un cultivo de Cryptococcus curvatus ATCC 20509 en hidrolizado con cal de fibra de maíz complementado con minerales presentó un rendimiento lípidos/sustrato de 0,27 g/g y una productividad de lípidos de 0,035 g/L/h, con una concentración de biomasa de 6,7 g/L. Por su parte, Sitepu et al.39, en una publicación de 2014, describen un rendimiento de lípidos/sustrato de 0,21 g/g y una productividad de lípidos de 0,042 g/L/h con una concentración de biomasa de 17,2 g/L en un cultivo de Lipomyces starkeyi UCDFST 78-23 con un hidrolizado enzimático de raquis de maíz como sustrato. Es importante mencionar que los resultados de nuestro estudio se obtuvieron a las 20 h de incubación.
El uso de mezclas de residuos agroindustriales como medio de cultivo para C. lusitaniae Hi2 es una alternativa atractiva para el aprovechamiento de los mismos, proporcionándoles un valor agregado por la producción de biomasa y lípidos. Anteriormente se ha mencionado que los lípidos microbianos son similares a los aceites vegetales y podrían ser utilizados de manera comercial como materia prima para la producción de biodiesel u otros productos de interés comercial21. Al igual que la cepa C. lusitaniae Hi2 aislada en este trabajo, la cepa C. lusitaniae ATCC 42720, empleada para la producción de bioetanol, presenta la capacidad de asimilar varios monosacáridos presentes en los hidrolizados de residuos lignocelulósicos, como glucosa, xilosa, arabinosa y galactosa32,41, así como la de asimilar la celobiosa, un dímero β-1,4 de glucosa, la mayor celodextrina de la hidrólisis enzimática (vía endoglucanasas y exoglucanasas) de la celulosa31,48. Por todo ello esta cepa de levadura resulta interesante para ser empleada en procesos biotecnológicos para el aprovechamiento de residuos agroindustriales lignocelulósicos16,32,41.
ConclusionesLa hidrólisis de los sólidos del nejayote permitió obtener una mayor concentración de azúcares reductores en comparación con el nejayote centrifugado. La combinación de los diferentes hidrolizados empleados en este reporte favoreció el crecimiento y producción de lípidos por la levadura C. lusitaniae Hi2 (con excepción de la combinación de HBC y HSN) al comparar los resultados obtenidos de las mezclas con los de los hidrolizados por separado, siendo las combinaciones de NC y HSN las que presentaron los mejores resultados para la producción de biomasa y lípidos por parte de esta levadura.
FinanciaciónEste estudio ha recibido financiación del Consejo Nacional de Ciencia y Tecnología de México a través de la subvención CB_2012_183795, y del Programa para el Desarrollo Profesional Docente de la Secretaría de Educación Pública de México a través de la subvención PROMEP/103.5/11/132.
Conflicto de interesesLos autores de este artículo declaran no tener conflicto de intereses.