La división Ascomycota comprende alrededor del 75% de las especies fúngicas descritas e incluye especies de enorme importancia médica, fitosanitaria, agrícola y biotecnológica. La capacidad para propagarse, explorar y colonizar nuevos sustratos es una característica de vital importancia para este grupo de organismos. En ese sentido, procesos como la germinación conidial, la extensión de las hifas y la esporulación constituyen el eje central del desarrollo en la mayoría de los hongos filamentosos. Estos procesos requieren de una maquinaria morfogénica especializada, coordinada y regulada por mecanismos que aún están siendo dilucidados. En los últimos años se ha avanzado sustancialmente en la comprensión del papel que desempeña la ruta de señalización mediada por proteínasG heterotriméricas en los procesos biológicos básicos de diversos hongos filamentosos. Por lo anterior, esta revisión se enfoca en el papel que desempeñan las subunidades alfa de dichas proteínas en los procesos morfogénicos de los hongos filamentosos de la división Ascomycota.
The phylum Ascomycota comprises about 75% of all the fungal species described, and includes species of medical, phytosanitary, agricultural, and biotechnological importance. The ability to spread, explore, and colonise new substrates is a feature of critical importance for this group of organisms. In this regard, basic processes such as conidial germination, the extension of hyphae and sporulation, make up the backbone of development in most filamentous fungi. These processes require specialised morphogenic machinery, coordinated and regulated by mechanisms that are still being elucidated. In recent years, substantial progress has been made in understanding the role of the signalling pathway mediated by heterotrimericG proteins in basic biological processes of many filamentous fungi. This review focuses on the role of the alpha subunits of heterotrimericG proteins in the morphogenic processes of filamentous Ascomycota.
Los hongos filamentosos conforman uno de los grupos biológicos de mayor abundancia en la biosfera y tienen un importante impacto para el hombre, ya sea como patógenos de plantas y/o animales, o en aplicaciones en diferentes ámbitos: farmacéutico, industrial, alimentario, agrícola, entre otros. En los hongos filamentosos de la división Ascomycota la unidad central de crecimiento es la hifa68. A pesar de su aparente simplicidad, las hifas son estructuras extraordinarias que permiten que estos organismos colonicen una gran variedad de hábitats. Cada hifa consiste en una serie lineal de células haploides vegetativas, mono o multinucleadas, separadas por septos que permiten la migración de orgánulos y nutrientes entre células, y propician la compartimentalización de funciones, procesos ambos en los que resulta crucial la participación de las proteínas septinas4,70. Por una parte, el extremo apical es el que direcciona el crecimiento y, en condiciones nutricionales adecuadas, se elonga constantemente; por otra parte, las células subapicales pueden generar nuevas hifas mediante ramificaciones laterales que incrementan la superficie del entorno a ser explorada34. Esta dinámica de crecimiento en la superficie de medios de cultivo sólidos genera una colonia simétricamente radial que se expande a una velocidad constante66.
Con el fin de afianzar su supervivencia, los hongos filamentosos necesitan asegurar la dispersión de sus propágulos, razón por la cual desarrollan hifas aéreas que les permiten iniciar la elaboración de estructuras multicelulares de reproducción asexual que son conocidas como «conidióforos». La estructura del conidióforo es diversa; pueden ser simples o ramificados, y en ocasiones pueden estar agrupados en una estructura denominada conidioma. Estos conidióforos producen esporas asexuales, mono y/o multinucleadas, denominadas conidias. La regulación molecular de la conidiación es compleja y está sujeta a diversos factores del entorno circundante28,64. Una vez liberada, y después de un periodo de dormancia en el que alcanza su madurez fisiológica, la conidia germina. Para que este proceso ocurra es necesaria una señal medioambiental que indique la existencia de un ambiente favorable en el entorno y modifique la tasa metabólica de la conidia35,79. Esta señal externa desencadena un crecimiento isotrópico que rehidrata e incrementa el volumen de la conidia, al tiempo que ocurren cambios metabólicos característicos tales como la disminución intraconidial de manitol y/o trehalosa16,94. En un momento dado, el crecimiento deja de ser isotrópico para convertirse en polarizado, lo que conlleva finalmente la aparición del tubo germinal. En este proceso es fundamental la coordinación entre la actina y los microtúbulos para el establecimiento del citoesqueleto y el redireccionamiento de la maquinaria morfogénica al sitio de polarización3,84. Una vez la conidia ha germinado da comienzo el crecimiento vegetativo, con el mantenimiento permanente del crecimiento polarizado de la nueva hifa, hecho que los diferencia de las levaduras68. Posteriormente la organización funcional alcanzará su madurez cuando el sistema de vesículas secretoras direccionadas al extremo de la hifa se acumule temporalmente de manera estratificada en una estructura apical denominada Spitzenkörper, que organiza el crecimiento hifal69.
Como podemos ver, la conidiación, la germinación conidial y el crecimiento apical de las hifas son eventos que conforman el eje central del desarrollo en los hongos filamentosos. Se trata de procesos que requieren de coordinados y complejos sistemas de regulación en los que están implicadas algunas rutas de transducción de señales que son reguladas por mecanismos que aún no se conocen o que están siendo dilucidados. Una comprensión profunda de las bases moleculares de estos mecanismos es de gran importancia y tiene implicaciones prácticas. Por un lado, en el caso de los hongos patógenos, bloquear cualquier estadio de su desarrollo sería una forma efectiva de combatirlos, y conocer las vías de transducción de señal y los efectores que controlan el desarrollo permite buscar dianas terapéuticas sobre las que actuar. Por otro lado, en el caso de hongos de uso industrial, el conocimiento de estos mecanismos regulatorios puede permitir mejoras en aspectos como la eficiencia en la germinación y la tasa de crecimiento. En los últimos años, se ha avanzado en la comprensión de la importancia y del rol de la ruta de señalización mediada por proteínasG heterotriméricas en los procesos biológicos básicos de hongos filamentosos. Tomando en consideración lo anterior, el presente trabajo presenta de manera sucinta las características generales de las proteínasG heterotriméricas y profundiza en el papel que desempeñan las subunidades alfa de dichas proteínas en los procesos morfogénicos de los hongos filamentosos de la división Ascomycota.
Proteínas G heterotriméricasEste grupo de proteínas conforman una subfamilia denominada GTPasas heterotriméricas, incluida en la clase translation factor-related (TRAFAC) de GTPasas que contienen el motivo P-loop47. Esencialmente, estas proteínasG acoplan los receptores integrados en la membrana citoplasmática con una amplia variedad de efectores intracelulares, como canales iónicos o enzimas, lo cual hace fluctuar la concentración de segundos mensajeros en el citosol (por ejemplo, AMP cíclico) y desencadena una respuesta celular al estímulo proveniente del entorno55.
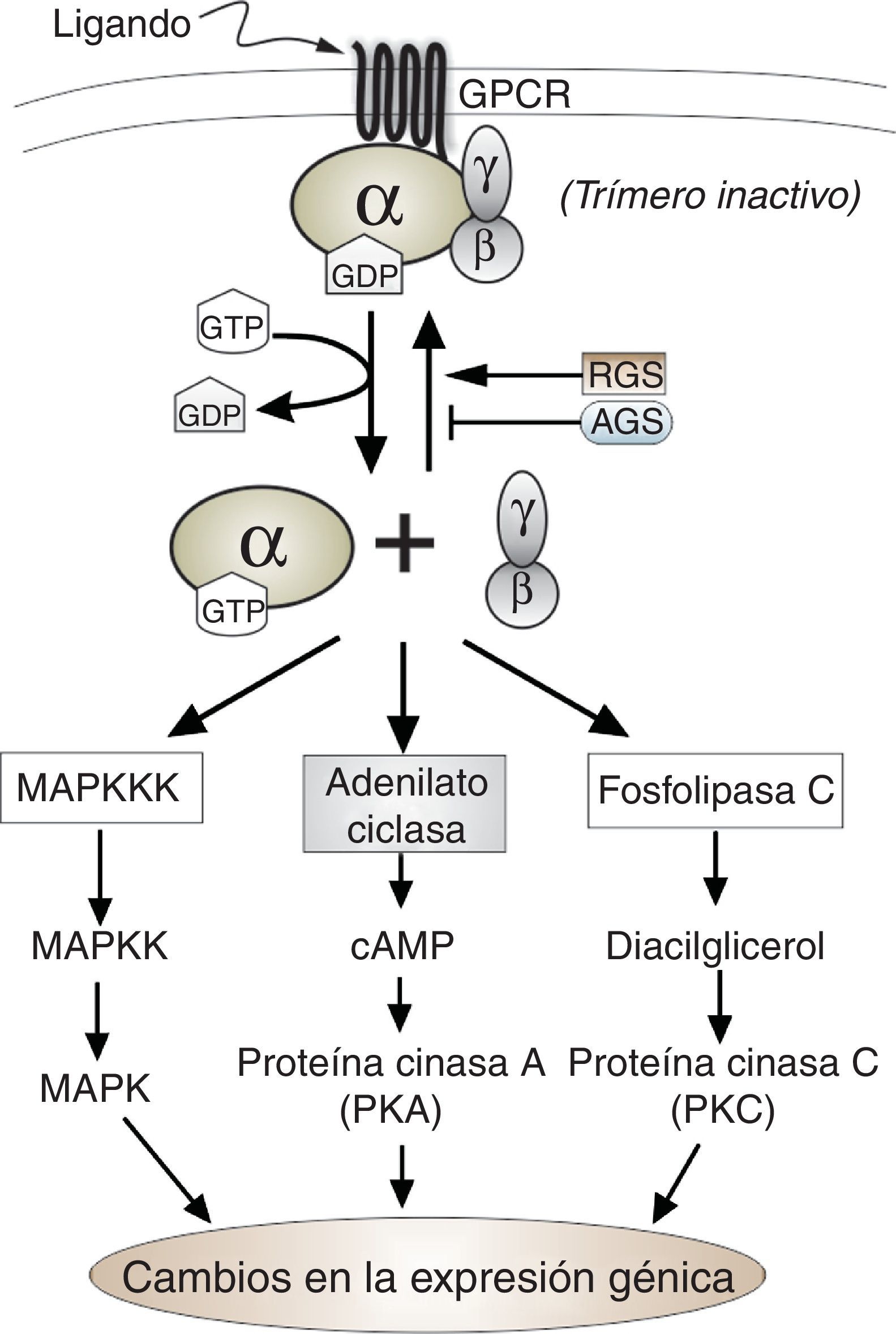
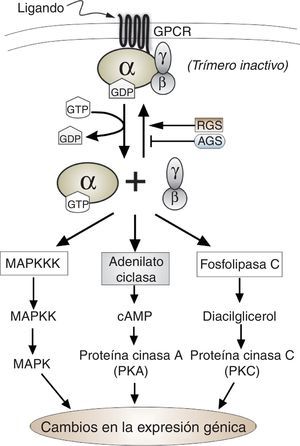
Componentes funcionales y ciclo de activación e inactivaciónLas proteínas G heterotriméricas están compuestas por tres subunidades: alfa (Gα), beta (Gβ) y gamma (Gγ), que en su estado inactivo se hallan asociadas formando un trímero en el lado interno de la membrana celular. Este trímero (α-β-γ) se encuentra además asociado a una proteína receptora ubicada en la membrana celular, que pertenece a la familia G protein-coupled receptor (GPCR), que responde a una amplia variedad de ligandos90. La subunidad alfa es una GTPasa que se encuentra anclada a la membrana mediante un grupo miristoilo o palmitoilo93, y tiene una molécula de guanosina-difosfato (GDP) unida a ella. La estimulación de la proteínaG por un receptor activado conlleva el intercambio de GDP por GTP en la subunidad alfa, proceso que ocasiona la separación del complejo heterotrimérico en dos componentes: la subunidad alfa unida a una molécula de GTP y, por otra parte, las subunidades beta y gamma, que debido a su estructura permanecen fuertemente asociadas en forma de dímero y ancladas a la membrana a través de la prenilación de la subunidad Gγ17,61,93. Ambas subunidades, el monómero alfa y el dímero Gβ-γ, son entonces capaces de interactuar con moléculas efectoras (fig. 1). Todas las subunidades alfa son GTPasas, y cuando el GTP es hidrolizado a GDP, la subunidad alfa se reagrupa con el dímero Gβ-γ, retornando así la proteínaG a su estado inactivo inicial (α-β-γ) asociado al receptor de membrana17,61.
Debido a que la actividad GTPasa intrínseca de la subunidad alfa determina el tiempo que la señal permanece activa, su modificación regulará el ciclo de activación de la señal. En este sentido, se ha caracterizado un grupo de proteínas que cumple una función aceleradora de la actividad GTPasa de tal subunidad, al actuar como GTPase activating protein (GAP) y disminuir drásticamente el tiempo de activación de la señal, por lo que su efecto es inhibitorio. Esta familia de proteínas ha sido denominada regulator of G-protein signaling (RGS)92. Por otra parte, se ha descrito la existencia de un grupo de proteínas que pueden regular positivamente la señal mediada por proteínasG de una manera totalmente independiente de los receptores GPCR, grupo que ha sido denominado activators of G-protein signaling (AGS) (fig. 1)72. De este grupo de proteínas hay un subgrupo de particular interés, ya que tales proteínas presentan uno o varios motivos reguladores, también conocidos como motivos GoLoco, con los que interaccionan con la subunidad Gα unida a GDP para formar en algunas ocasiones complejos proteicos y evitando la reagrupación del heterotrímero62.
Proteínas G heterotriméricas en Ascomycetes filamentososLas GTPasas triméricas en hongos, al igual que en animales, se clasifican dependiendo de la similitud estructural y funcional de su respectiva subunidad alfa6. Al analizar varios genomas fúngicos depositados en las bases de datos se encontró que, a diferencia de las levaduras que poseen dos subunidades Gα, la gran mayoría de los Ascomycetes filamentosos poseen tres subunidades Gα, junto con una única subunidad Gβ y otra Gγ, lo que les permite formar tres diferentes proteínasG heterotriméricas50,82,95. Actualmente, siguiendo el criterio definido por Bölker6, se consideran tres grupos de proteínasG heterotriméricas fúngicas (gruposi, ii yiii). El grupoi (GαI) contiene las subunidades Gα con el mayor grado de conservación filogenética, y parece ser el grupo con mayores efectos pleiotrópicos en los hongos, y el único grupo que afecta significativamente el metabolismo secundario50. Estas subunidades, debido a la presencia de los motivos de miristoilación en el extremo N-terminal y de ADPribosilación por la toxina pertussis en el extremo C-terminal, se encuentran relacionadas con el grupo Gαi de mamíferos. Esto hizo pensar que este subgrupo provocaría una disminución del AMP cíclico intracelular tal como ocurre en eucariotas superiores, pero en muchos hongos filamentosos el efecto parece ser el opuesto22,31,82,85. Por su parte, el grupoii (GαII) incluye las subunidades con mayor heterogeneidad filogenética y sin un equivalente claro en mamíferos. Finalmente, el grupoiii (GαIII) abarca las subunidades que se consideran análogas al grupo Gαs de mamíferos debido al efecto positivo sobre los niveles de AMP cíclico intracelular en levaduras6; sin embargo, esta relación parece ser más funcional que estructural, puesto que en casos como el de Neurospora crassa, la subunidad GNA3 tiene mayor similitud con el subgrupo Gαi2 del ser humano que con el grupo Gαs50. Con la secuenciación de genomas completos se ha reportado de manera reciente en algunos hongos filamentosos la presencia de una cuarta subunidad Gα, que no tiene una identidad filogenética propia como los tres grupos ya mencionados, y cuya función es aún desconocida. Este es el caso de Metarhizium anisopliae, Stagonospora nodorum, Penicillium roqueforti, Aspergillus oryzae y Thielavia terrestres5,19,32,105.
Debido al hecho de que la activación o inactivación de la señal de transducción depende de la actividad GTPasa de las subunidades Gα, para el estudio funcional de las mismas ha sido de gran ayuda el desarrollo de alelos modificados, que se comportan de manera dominante y que provocan una activación constitutiva de la señal puesto que producen una subunidad Gα cuya actividad GTPasa está disminuida o afectada completamente. Tal es el caso de las modificaciones G42R, R178L, G183S, R205H y Q204L para las GαI, o G45L, R182L, G187S y Q208L para las pertenecientes al grupoiii51,54,95,101,106. De manera similar también se han generado alelos que afectan la unión de la subunidad Gα con el dímero Gβ-γ y evitan la separación del trímero, lo que inactiva la señal. La modificación más ampliamente usada es la G203R para el grupoi y su análoga la G207R para las GαIII23,101,107. La incorporación de estos alelos conlleva, en la mayoría de los casos, alteraciones fenotípicas importantes, además de afectar a aspectos como la patogenicidad o la producción de metabolitos secundarios8,23,50,51. Por ejemplo, en Aspergillus nidulans la incorporación del alelo con la modificación G42R (GαI) generó un fenotipo en el que prolifera el micelio aéreo sin la producción de conidióforos, al que se denominó «fluffy» y que perdió su capacidad productora de esterigmatocistina8,36,103. En casos como el de Magnaporthe grisea, los alelos G187 y Q208L (GαIII) inducen un incremento del cAMP intracelular y la generación de apresorios en condiciones no inductoras, lo que promueve su fitopatogenicidad51. Estos efectos fenotípicos suceden como consecuencia de la afectación de algunos procesos morfogénicos en los que se profundizará a continuación.
Finalmente cabe señalar que hasta el momento, en los hongos, se ha demostrado que la señalización mediada por proteínasG heterotriméricas es transmitida a través de una de las siguientes rutas: a)vía adenilato ciclasa con modificación de la concentración de AMP cíclico intracelular14,44,82,85 y, en consecuencia con la regulación de la actividad de la proteína cinasa dependiende de AMP cíclico (PKA)8,44; b)a través de la ruta de las proteínas cinasas activadas por mitógenos (MAPK)13,73, y c)por afectación de la fosfolipasa C74 (fig. 1).
Participación de las subunidades Gα en los procesos morfogénicosGerminación conidialEl estudio de las señales de transducción que afectan la germinación conidial es un tema relativamente poco abordado; a pesar de ello, algunas rutas de señalización han sido vinculadas a la germinación conidial. Es el caso de la señalización mediada por proteínasG monoméricas tipo Ras, que se han asociado principalmente al crecimiento isotrópico y su transición al crecimiento polarizado18,33,97. Sin embargo, la evidencia experimental indica que otros aspectos del proceso son regulados en los hongos filamentosos por proteínasG heterotriméricas13,14,107. En este sentido, la cascada mediada por AMP cíclico/PKA es el mecanismo más ampliamente estudiado, y se ha comprobado que tanto en A.nidulans como en N.crassa ejerce un control primordial en pasos críticos que suceden en etapas tempranas del proceso germinativo, tales como la hidrólisis de la trehalosa y la acumulación de glicerol10,11,16,88. Respalda lo anterior el hallazgo de que en A.nidulans la GTPasa trimérica conformada por la subunidad GαIII y el dímero β-γ (GαIII-β-γ) juega un papel estimulador del proceso, ya que participa en la detección de la fuente de carbono (glucosa), y en respuesta a ello se incrementan los niveles de AMP cíclico dentro de la conidia, lo cual desencadena la germinación9,45. Trabajos posteriores realizados en la búsqueda de la participación de esta subunidad (GαIII) en Talaromyces marneffei, Trichoderma atroviride y Botrytis cinerea han corroborado lo hallado en A.nidulans, ya que en todos los casos la ausencia de la subunidad GαIII afectó negativamente la cinética de germinación conidial13,104,107. Por lo tanto, el papel positivo de GαIII en la germinación parece ser algo generalizado en los hongos filamentosos (tabla 1).
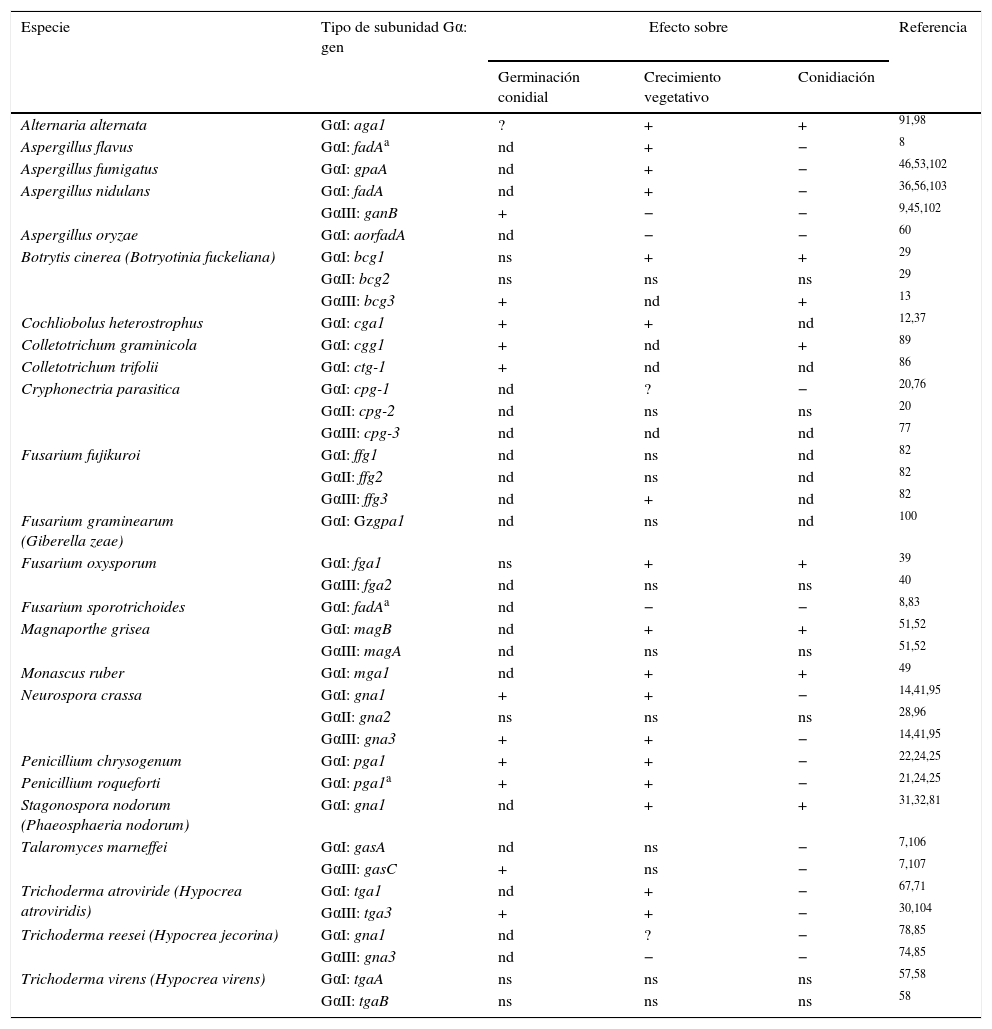
Efectos descritos de las subunidades Gα de los gruposi, ii yiii sobre los procesos de germinación, crecimiento y conidiación en especies de hongos ascomicetos filamentosos
| Especie | Tipo de subunidad Gα: gen | Efecto sobre | Referencia | ||
|---|---|---|---|---|---|
| Germinación conidial | Crecimiento vegetativo | Conidiación | |||
| Alternaria alternata | GαI: aga1 | ? | + | + | 91,98 |
| Aspergillus flavus | GαI: fadAa | nd | + | − | 8 |
| Aspergillus fumigatus | GαI: gpaA | nd | + | − | 46,53,102 |
| Aspergillus nidulans | GαI: fadA | nd | + | − | 36,56,103 |
| GαIII: ganB | + | − | − | 9,45,102 | |
| Aspergillus oryzae | GαI: aorfadA | nd | − | − | 60 |
| Botrytis cinerea (Botryotinia fuckeliana) | GαI: bcg1 | ns | + | + | 29 |
| GαII: bcg2 | ns | ns | ns | 29 | |
| GαIII: bcg3 | + | nd | + | 13 | |
| Cochliobolus heterostrophus | GαI: cga1 | + | + | nd | 12,37 |
| Colletotrichum graminicola | GαI: cgg1 | + | nd | + | 89 |
| Colletotrichum trifolii | GαI: ctg-1 | + | nd | nd | 86 |
| Cryphonectria parasitica | GαI: cpg-1 | nd | ? | − | 20,76 |
| GαII: cpg-2 | nd | ns | ns | 20 | |
| GαIII: cpg-3 | nd | nd | nd | 77 | |
| Fusarium fujikuroi | GαI: ffg1 | nd | ns | nd | 82 |
| GαII: ffg2 | nd | ns | nd | 82 | |
| GαIII: ffg3 | nd | + | nd | 82 | |
| Fusarium graminearum (Giberella zeae) | GαI: Gzgpa1 | nd | ns | nd | 100 |
| Fusarium oxysporum | GαI: fga1 | ns | + | + | 39 |
| GαIII: fga2 | nd | ns | ns | 40 | |
| Fusarium sporotrichoides | GαI: fadAa | nd | − | − | 8,83 |
| Magnaporthe grisea | GαI: magB | nd | + | + | 51,52 |
| GαIII: magA | nd | ns | ns | 51,52 | |
| Monascus ruber | GαI: mga1 | nd | + | + | 49 |
| Neurospora crassa | GαI: gna1 | + | + | − | 14,41,95 |
| GαII: gna2 | ns | ns | ns | 28,96 | |
| GαIII: gna3 | + | + | − | 14,41,95 | |
| Penicillium chrysogenum | GαI: pga1 | + | + | − | 22,24,25 |
| Penicillium roqueforti | GαI: pga1a | + | + | − | 21,24,25 |
| Stagonospora nodorum (Phaeosphaeria nodorum) | GαI: gna1 | nd | + | + | 31,32,81 |
| Talaromyces marneffei | GαI: gasA | nd | ns | − | 7,106 |
| GαIII: gasC | + | ns | − | 7,107 | |
| Trichoderma atroviride (Hypocrea atroviridis) | GαI: tga1 | nd | + | − | 67,71 |
| GαIII: tga3 | + | + | − | 30,104 | |
| Trichoderma reesei (Hypocrea jecorina) | GαI: gna1 | nd | ? | − | 78,85 |
| GαIII: gna3 | nd | − | − | 74,85 | |
| Trichoderma virens (Hypocrea virens) | GαI: tgaA | ns | ns | ns | 57,58 |
| GαII: tgaB | ns | ns | ns | 58 | |
nd: el efecto no fue determinado; ns: Gα no produce un efecto significativo en la característica analizada; +: el efecto es positivo; −: el efecto es negativo; ?: los resultados son contradictorios o poco claros.
Por otra parte, los resultados sobre la participación de la subunidad GαI en la germinación no son tan consistentes. En primer lugar se debe considerar que en algunos Ascomycota filamentosos se ha abordado el efecto morfogénico de la ruta mediada por proteínasG heterotriméricas pero sin ningún experimento orientado específicamente a establecer la relación de GαI con la germinación conidial. Por ejemplo, en A.nidulans, Cryphonectria parasitica, Fusarium fujikuroi, Gibberella zeae y T.marneffei no se ha abordado este aspecto77,80,82,100,106. El uso en ensayos de germinación conidial de una cepa de M.grisea con la deleción del gen codificante de GαI no fue posible al no haber producción de conidias51. Por su parte, en los fitopatógenos Fusarium oxysporum y B.cinerea la eliminación de GαI no generó ningún efecto observable en la cinética germinativa29,39; de hecho, en B.cinerea la responsabilidad en la activación de la germinación parece recaer únicamente en GαIII13.
En segundo lugar, tenemos un grupo de hongos filamentosos en el que la subunidad GαI es, de alguna manera, necesaria para la germinación. Los primeros reportes proceden de dos hongos fitopatógenos, Cochliobolus heterostrophus y Colletotrichum trifolii, en los que la eliminación o la disrupción del gen que codifica esta subunidad afectó notoriamente la tasa de germinación conidial12,37,86. En particular, en C.trifolii la germinación estuvo acompañada de un incremento del ARN mensajero del gen ctg-1 (GαI) en las conidias germinantes86. En estas dos especies, los resultados indican que GαI desempeña un papel relevante en las etapas tempranas de la germinación. Posteriormente, nuestro grupo de trabajo describió que la activación constitutiva de la señal mediada por la subunidad GαI de P.roqueforti desencadena la germinación aun en un entorno sin fuentes de carbono, lo que sugiere además que dicho efecto está relacionado con el incremento en los niveles de AMP cíclico intracelular21. Al examinar con mayor profundidad el proceso en Penicillium chrysogenum se observó que la deleción de esta subunidad ralentizó la cinética de germinación y disminuyó la tasa de conidias germinadas, un efecto no tan drástico como el documentado en C.trifolii, mientras que la activación constitutiva de la señal produjo resultados similares a los observados en P.roqueforti21,24. Los resultados también sugieren la participación del AMP cíclico en la inducción de la germinación en P.chrysogenum24. En cepas de Alternaria alternata defectivas en GαI se produjo una ralentización en la cinética de germinación similar a la observada en P.chrysogenum98. Recientemente se ha observado que en P.roqueforti GαI promueve la germinación conidial reprimiendo la expresión de un factor transcripcional del tipo Zn(II)2Cys6 que además regula de manera negativa los genes brlA, abaA y wetA de la ruta central reguladora de la conidiación27. Se han publicado también evidencias indirectas que respaldarían la participación de las subunidades Gα en la germinación conidial en G.zeae y Trichoderma virens57,63.
En un reciente estudio transcriptómico de la germinación conidial en Aspergillus niger se encontró que el gen que codifica la subunidad GαIII se expresa a niveles muy bajos, al menos durante las 8h posteriores al inicio del proceso germinativo, por lo que no se considera que posea un rol importante en el proceso. Por el contrario, los datos sugieren una temprana y fuerte participación de GαI aun desde la fase de dormancia de la conidia, por lo que puede observarse un pico de expresión 2h después de iniciado el proceso87. Al realizar un estudio similar en Aspergillus fumigatus se encontró que gpaA (que codifica la subunidad GαI) es uno de los genes que se transcriben casi de manera constitutiva en la fase de dormancia de la conidia, y su expresión se incrementa alrededor de 7veces después de 30min de inducida la germinación46. Estos resultados demuestran la participación de GαI en las fases tempranas de la germinación en A.niger y A.fumigatus, y son consistentes con lo observado en P.chrysogenum, P.roqueforti, C.heterostrophus y C.trifolii21,24,37,86. Esta participación preponderante de GαI en la germinación conidial en A.niger y A.fumigatus contradice lo observado en A.nidulans, donde el rol central es desempeñado por la subunidad GαIII45. Resulta llamativo, por tanto, que entre especies del mismo género se observen diferencias en cuanto a la participación de las subunidades Gα en la germinación.
Con esta diversidad de resultados en diferentes Ascomycota filamentosos en lo referente a la participación de GαI en la germinación, merece la pena destacar el caso del hongo modelo N.crassa. Teniendo en cuenta que algunos trabajos previos habían abordado el análisis de las subunidades Gα de manera separada, se generó un triple mutante (se delecionaron los genes de los tres tipos de Gα), pero no se realizó ningún análisis experimental para evaluar la incidencia en la germinación conidial41. Sin embargo, al estudiar recientemente una proteína no-GPCR que induce el intercambio de GDP por GTP, que activa la señal, se dilucidó el papel de las Gα en la germinación14. Los resultados indican que tanto GαI como GαIII son necesarias en la regulación del proceso germinativo en N.crassa, con una diferencia en la magnitud de su participación, con GαIII con un papel más importante ya que su función resultaría fundamental en los eventos tempranos de la germinación (activación y crecimiento isotrópico), mientras que GαI tiene un rol secundario ya que actuaría en las etapas posteriores (crecimiento polarizado), en la emisión y crecimiento del tubo germinal14. Este rol secundario de GαI también se observa en el micoparásito T.virens, en el que los mutantes defectivos en GαI mostraron un proceso germinativo con tubos germinales anormales, por lo que su papel no parece muy relevante en etapas tempranas sino más bien en el establecimiento del crecimiento polarizado58. En N.crassa queda por dilucidar la implicación de GPR-4, un receptor GPCR que responde a fuentes de carbono y que se demostró se acopla a GαI en una ruta de señalización mediada por AMP cíclico48. Como en muchos otros casos, la subunidad GαII mostró no estar implicada en la germinación51,52,58. De esta manera, N.crassa se constituye en un ejemplo que nos invita a considerar hasta qué punto en otros hongos filamentosos se habrá pasado por alto el evaluar con cierta profundidad el rol y la cooperación de las subunidades Gα en la germinación conidial.
Crecimiento vegetativoLa elongación de las hifas en los hongos filamentosos es un proceso coordinado en el que la participación de la señalización mediada por las proteínasG heterotriméricas resulta importante, en la mayoría de los casos, para un normal crecimiento y desarrollo de la colonia en medio de un cultivo sólido, y en el caso de los fitopatógenos para un adecuado funcionamiento de los mecanismos de patogenicidad. Sin embargo, la señalización mediada por proteínasG no es indispensable para el desarrollo micelial, por lo que puede inferirse la participación de otras rutas50,82. Por ejemplo, en T.virens y T.marneffei la señalización mediada por las subunidades Gα no participa en la regulación del crecimiento vegetativo7,58, mientras que en el resto de Ascomycota filamentosos en los que se ha estudiado este proceso la participación recae en las subunidades GαI y GαIII, especialmente cuando dichas subunidades afectan la actividad de la adenilato ciclasa. No obstante, la magnitud de su función y el tipo de regulación (positiva o negativa) depende del organismo en estudio (tabla 1).
En el hongo modelo A.nidulans la activación de la señal mediada por la subunidad GαI generó, como ya se ha comentado, un fenotipo fluffy en el que se observó un proceso acelerado de autolisis8. La participación de GαI en el crecimiento se postuló al demostrar que la inactivación constitutiva de la señal (alelo G203R) disminuyó considerablemente la tasa de extensión apical en medio sólido101,103. Por ello se asume que la actividad de GαI es necesaria para mantener y promover una tasa de crecimiento normal102. Esta función es llevada a cabo mediante la regulación de los niveles de AMP cíclico intracelular, que al estimular la acción de una proteína cinasa dependiente de AMP cíclico (PkaA) promueve el crecimiento vegetativo en medio sólido80. Por su parte, la subunidad GαIII tiene una función complementaria y diferente a GαI, ya que su activación constitutiva tuvo un efecto negativo sobre la extensión radial de la colonia del hongo, mientras que ni su inactivación ni su deleción tuvieron consecuencias en el crecimiento apical9. Lo anterior sugiere que el balance en la expresión de las subunidades GαI y GαIII regula la extensión de las hifas en medio sólido. En A.fumigatus el mecanismo de acción de la subunidad GαI es similar al descrito en A.nidulans102. Por su parte, un estudio reciente demostró que, a diferencia de lo que sucede en A.nidulans, la activación constitutiva de la subunidad GαI reprime el crecimiento vegetativo en A.oryzae60.
En Monascus ruber, M.grisea, B.cinerea, C.heterostrophus y Colletotrichum graminicola GαI desempeña un papel promotor del crecimiento vegetativo29,37,49,51,52,89. En el caso de N.crassa la inactivación de la subunidad GαI redujo en un 50% la tasa de extensión apical, en tanto que al delecionar GαIII la extensión apical se redujo en un 20%. Lo anterior sugiere que ambas subunidades participan de manera cooperativa en la regulación del crecimiento, resultado que se confirmó al observar que el crecimiento vegetativo se afectó drásticamente en la cepa en la que se suprimieron ambas subunidades41. En N.crassa la subunidad GαII no desempeña una función evidente en el crecimiento96.
En algunos casos, los resultados ponen en evidencia la diferencia de funciones y de subunidades participantes en el crecimiento, incluso en organismos filogenéticamente muy próximos, tal como se presenta en el género Trichoderma. En T.atroviride la señalización mediada por proteínasG tiene un efecto positivo sobre el crecimiento. En este organismo participan tanto GαI como GαIII pero, a diferencia de N.crassa, es la subunidad GαIII la que posee un papel preponderante sobre la extensión apical30,71,104. En Trichoderma reesei (Hypocrea jecorina) también participan ambas subunidades, pero la regulación tiene un sentido negativo y es dependiente de la luz78. En condiciones de cultivo sumergido el mecanismo opera de manera diferente, siendo GαI la subunidad protagonista con un efecto positivo sobre el crecimiento en condiciones de oscuridad78. Por su parte, en T.virens, ni GαI ni GαII parecen afectar el crecimiento vegetativo58. Esta diversidad de efectos también se observa en el género Fusarium. Mientras que en Fusarium sporotrichoides la subunidad GαI afectó negativamente la tasa de crecimiento apical8,83, en F.oxysporum GαI es requerida para una adecuada morfología de la colonia en medio sólido, fenómeno en el que no interviene la subunidad GαIII39, en tanto que en Fusarium graminearum (G.zeae) no son las subunidades alfa sino la subunidad beta la que asume la regulación del proceso, y lo hace estimulando el crecimiento vegetativo100. Además, en F.fujikuroi la señal mediada por proteínasG tiene un efecto positivo sobre el crecimiento, pero tal efecto solo es llevado a cabo por la subunidad GαIII; ni GαI ni GαII parecen participar en dicha regulación82.
En el género Penicillium no se ha observado, hasta el momento, esa disparidad de resultados descrita en otros géneros. Nuestro grupo de trabajo encontró que en P.chrysogenum y P.roqueforti la activación de GαI genera una reducción en la tasa de extensión apical en medio sólido, lo que sugiere una regulación negativa de este proceso25. La participación prioritaria de esta subunidad con un efecto represor del crecimiento también fue descrita en M.anisopliae, T.reesei y F.sporotrichoides8,15,83,85. Por su parte, C.parasitica podría considerarse un caso particular, puesto que la activación de la subunidad GαI ocasionó, al igual que su eliminación, una considerable reducción de la tasa de crecimiento y una completa ausencia de micelio aéreo20,76.
Reproducción asexual: conidiogénesisLa conidiogénesis necesita de una compleja regulación génica, una especialización celular y una coordinada comunicación intracelular2,64. En A.nidulans se ha propuesto una ruta reguladora central esencial donde confluyen todas las rutas reguladoras, que está conformada por el producto de los genes brlA, abaA y wetA1. Esta ruta actúa en conjunto con otros genes para controlar la expresión de los genes específicos de la conidiación y determinar el orden de la activación génica durante el desarrollo del conidióforo y la maduración de los conidios2,64. La señalización mediada por las proteínasG heterotriméricas desempeña un papel muy importante en la regulación de este proceso. En muchos hongos filamentosos la señalización por proteínas G heterotriméricas parece actuar analizando el entorno para controlar la germinación y posteriormente el crecimiento vegetativo, mientras que se mantiene reprimida la conidiación9,22,24,45,63,82,96,102. Lo anterior permitiría inferir que cuando las condiciones nutricionales del medio cambian, el mecanismo permite la conidiación al tiempo que se controla el crecimiento vegetativo2,22,28,42,53,106.
Tal como sucede en la germinación conidial, son las subunidades GαI y GαIII las que participan en este proceso (tabla 1), siendo la subunidad GαI la que posee mayor relevancia en buena parte de las especies fúngicas estudiadas. En este sentido se observa que al sobreexpresar o activar constitutivamente GαI se produce un efecto represor de la conidiación, generando en algunas ocasiones un fenotipo aconidial8. En el caso de A.nidulans, Aspergillus flavus, Cryphonectria parasitica y T.marneffei, el efecto es tan drástico que la activación de esta subunidad suprime la formación de conidióforos56,76,77,103,106, y en C.parasitica se demostró además que reprime la expresión de proteínas hidrofobinas76. Por su parte, en organismos como N.crassa, P.chrysogenum, P.roqueforti, A.fumigatus, F.sporotrichoides y T.atroviride se observa una reducción sustancial en la producción conidial22,28,41,53,67,83. Esta función represora de GαI se ve ratificada en especies como A.nidulans, A.fumigatus, P.chrysogenum, N.crassa, T.atroviride y T.marneffei, en las que al usar alelos de inactivación constitutiva de la subunidad GαI, o bien mediante atenuación de la expresión o la deleción del gen, se observa un inusual incremento en la expresión de los genes de la ruta reguladora central de la conidiogénesis, especialmente brlA. Esta desrregulación altera de tal manera el mecanismo conidiogénico que se forman conidióforos y cadenas de conidios en cultivos sumergidos, condiciones en las cuales la conidiación normalmente está reprimida en estas especies22,41,53,56,71,103,106.
La contraparte a este patrón de regulación negativa por parte de GαI la constituyen M.ruber y los hongos fitopatógenos F.oxysporum, B.cinerea, A.alternata, M.grisea, C.graminicola y S.nodorum, en los cuales la ausencia de esta subunidad genera un efecto negativo en la conidiogénesis29,39,49,51,75,81,89. Particularmente, en B.cinerea el efecto positivo se ejerce a través de ambas subunidades, GαI y GαIII, siendo al parecer la subunidad GαIII la que posee una función reguladora más fuerte a través de la ruta dependiente de AMP cíclico13,29,75. En los hongos filamentosos recientemente mencionados no se han descrito los efectos de la sobreexpresión o de la activación constitutiva de estas subunidades alfa, salvo en M.grisea. En este patógeno del arroz, el papel de la subunidad alfa es opuesto al descrito en A.nidulans, ya que la deleción de GαI suprime totalmente la conidiación, mientras que la activación constitutiva de la misma genera un fenotipo hiperconidiante. Al parecer, la participación de GαIII en el proceso es secundaria51.
En A.nidulans, T.atroviride, T.reesei y T.marneffei la subunidad GαIII también participa en la regulación de la reproducción asexual, con una función represora que genera efectos similares a los reportados para la activación constitutiva de GαI7,9,78,85,104,107. El grado de participación de cada subunidad, o la manera coordinada en que tiene lugar esta regulación, es aún tema de investigación; hasta el momento se ha demostrado que el mecanismo se produce mediante la interacción de estas subunidades con al menos dos proteínas cinasas dependientes de AMP cíclico, las cuales a su vez reprimen la expresión de brlA, el primer gen de la ruta reguladora central de la conidiación59,64. Se ha descrito recientemente en N.crassa que la ausencia de GαIII y la subunidadβ generan, cada una, fenotipos con un mayor grado de hiperconidiación que los observados al suprimir GαI, tanto en medios de cultivo aéreos como sumergidos; por tanto en N.crassa se ha propuesto que GαIII, junto con la subunidadβ, ejercen una regulación negativa preponderante en el control de la conidiación95.
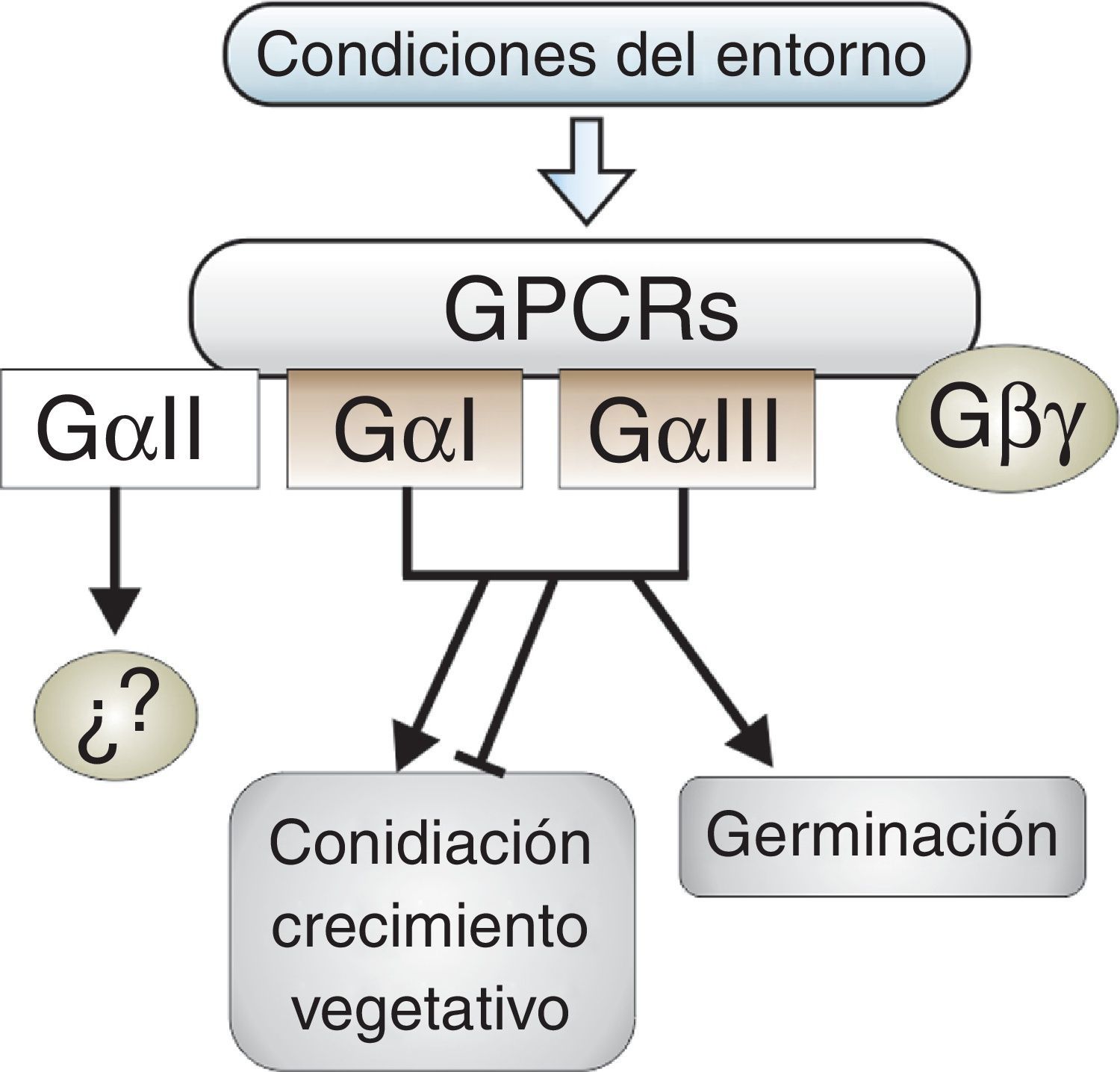
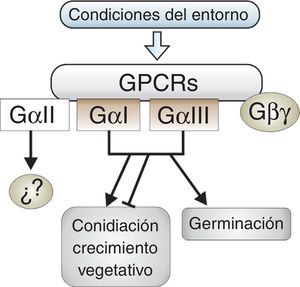
Conclusiones y perspectivasDe las tres subunidades alfa que poseen la mayoría de los hongos filamentosos, son las subunidades del tipo GαI y GαIII las que participan en la regulación de la germinación conidial, el crecimiento vegetativo y la reproducción asexual (fig. 2). La ausencia de reportes que involucren las subunidades GαII en alguno de los procesos mencionados y el hecho de que en hongos como B.cinerea, C.parasitica, F.fujikuroi, N.crassa y T.virens la subunidad GαII no tenga efecto fenotípico alguno, indica que este tipo de subunidad no juega un papel relevante en los procesos morfogénicos de los hongos filamentosos.
Participación de las subunidades alfa de proteínasG heterotriméricas en los procesos morfogénicos de hongos filamentosos de la división Ascomycota. Las subunidades GαI y GαIII están implicadas en los tres procesos. Su efecto en la germinación es siempre positivo, ya sea si actúan en conjunto o por separado, mientras que en la conidiación y el crecimiento su rol es variable y su efecto resulta de un balance entre ambas subunidades. No se ha demostrado la participación de GαII en estos procesos, por lo que no se sabe con precisión cuál pueda ser su función. Las líneas terminadas en flechas representan un efecto positivo y las terminadas en barra indican un efecto represor.
De los estudios llevados a cabo hasta el momento se puede concluir que no existe un patrón único de acción de las subunidades GαI y GαIII sobre los procesos morfogénicos. Se aprecian diferencias no solo en el grado de implicación de una determinada subunidad en un proceso, sino incluso en el sentido de su regulación sobre el mismo, siendo positivo en algunos casos y negativo en otros, y estos contrastes no se dan necesariamente entre taxones alejados filogenéticamente sino que en algunos casos ocurren también entre especies de un mismo género (tabla 1). Es decir, a lo largo de la evolución se ha conservado la función básica de señalización de la vía de las proteínasG heterotriméricas en los hongos, y en el caso particular de la subunidad GαI el muy elevado grado de conservación de la misma sugiere además un papel básico e insustituible en el control del programa de desarrollo de los hongos. Pero esta función básica de señalización se ha adaptado en cada especie a una función particular de regulación, positiva o negativa, y con distintos grados de control sobre cada uno de los procesos que conforman el programa general de desarrollo de los hongos. Esta particularidad puede enmarcarse dentro de un rasgo general que concierne a la evolución de los sistemas regulatorios de los organismos al que se ha dado el nombre de «weak linkage»26,43, y que básicamente consiste en la capacidad de las moléculas o complejos proteicos de cambiar a lo largo de la evolución aquellas moléculas con las que interactúan, a la vez que conservan sus funciones básicas. Así, las proteínasG heterotriméricas conservan en todos los hongos su función general al ejercer un papel central en la regulación del programa de desarrollo morfológico, pero mediante cambios en la interacción con otros efectores, o en la función de estos, se han producido modificaciones adaptativas de su función específica en cada especie, lo que hace que frecuentemente el tipo de regulación que se ejerce sobre un determinado proceso sea diferente, y hasta de sentido opuesto, entre especies. Este fenómeno llega a darse incluso entre especies de un mismo género, como es el caso de Aspergillus, Fusarium o Trichoderma. Las diferencias son probablemente una respuesta adaptativa a los diferentes hábitats naturales de cada especie. Por tanto, es de esperar que especies con hábitats diferentes presenten patrones de regulación diferentes por parte de la vía de las proteínasG heterotriméricas, y esto puede ser especialmente evidente en géneros que comprenden especies fitopatógenas.
Otro rasgo destacable en el control del desarrollo morfológico de los hongos filamentosos es la redundancia de funciones entre varias vías regulatorias, que se infiere de muchos de los resultados obtenidos en diferentes estudios, donde la inactivación de la función de una determinada subunidad Gα, o incluso de las tres, no tiene como consecuencia un fenotipo letal, ni tampoco la completa supresión de un determinado proceso. Por ejemplo, la eliminación de las subunidades GαIII o sus mutaciones no ocasionaron, en ningún caso, la pérdida total de la capacidad germinativa de los conidios, aunque sí afectó la cinética del proceso9,12-14,21,24,86,98,104,107. Esto mismo sucede al estudiar las proteínasG monoméricas tipo Ras (Ras1 y Ras2), que también regulan la germinación16,18,33,97. En cuanto al crecimiento vegetativo se observan situaciones similares, de las que podemos resaltar que el fenotipo resultante nunca es tan extremo como el generado por las mutaciones en efectores corriente abajo; tal es el caso de las proteínas cinasas dependientes de AMP cíclico en F.graminearum y F.fujikuroi38,82. Lo anterior sugiere que varias rutas de transducción pueden llegar a confluir en los mismos efectores18,73,85. Recientemente se ha reportado la participación de la vía de transducción de señales target of rapamycin (TOR) en la regulación del crecimiento vegetativo en hongos filamentosos, sin descifrar aún los mecanismos moleculares por los cuales esto sucede99; sin embargo, es evidente la interacción entre los componentes de esta vía con la ruta mediada por las proteínasG heterotriméricas54,99. Por otra parte, es en la conidiación donde se observan los fenotipos más drásticos, lo que apunta a que la vía de las proteínasG heterotriméricas tiene un papel especialmente relevante en este proceso. Cabe recordar que la activación de la señal mediada por GαI llega a suprimir por completo la conidiación en especies de Aspergillus, Cryphonectria y Talaromyces, y que su inactivación genera fenotipos hiperconidiantes.
La importancia de la vía de las proteínasG heterotriméricas en el proceso de desarrollo morfológico de los hongos filamentosos hace que sea necesario profundizar en el estudio de la misma, para lo cual pueden utilizarse diferentes abordajes que permitirán una caracterización más exhaustiva del funcionamiento de dicha vía. Es importante, por ejemplo, estudiar el tipo de participación y el grado de cooperación entre diferentes subunidades Gα en la regulación de los diferentes procesos, ya que estudios recientes apuntan en esta dirección. Por otro lado, es de gran importancia identificar y caracterizar los efectores que participan en la regulación de los procesos controlados por la vía de las proteínasG. Algunos de ellos han sido ya claramente establecidos, como la adenilil ciclasa o la proteína cinasa A50,65,80,82, y recientemente se ha identificado un posible efector final, un hipotético factor de transcripción codificado por el gen pcz1, implicado en la regulación de la germinación, crecimiento y conidiación en P.roqueforti27. Entre las metodologías aplicables a la identificación de efectores que medien la regulación ejercida por las subunidades Gα están los estudios de proteómica y fosfoproteómica comparativa en los que se utilizan cepas con subunidades Gα constitutivamente activas o inactivas, y los estudios de interactoma.
FinanciaciónEste artículo contó con el apoyo del Consejo Nacional de Ciencia y Tecnología de México (CONACYT) a través de los Proyectos CB-2008-01-105527 y CB-2013-01-222207.
A la Universidad de Pamplona y al grupo GIMBIO por el apoyo financiero y de recursos físicos.