Saccharomyces cerevisiae es una levadura ubicua muy utilizada en la industria y también presente en la microbiota humana. Sin embargo, en las últimas décadas ha habido un aumento significativo de infecciones fúngicas invasivas causadas por este hongo.
ObjetivosHacer un estudio retrospectivo de las infecciones por S. cerevisiae en un período de 10 años (2000-2010) en un hospital del sur de Brasil.
MétodosRevisión de las historias clínicas de los pacientes infectados por este hongo.
ResultadosEn este período, se encontraron 6 pacientes infectados por S. cerevisiae. El rango de edad de los pacientes oscilaba entre los 10 y los 84 años. Las muestras analizadas procedían de orina, sangre, líquido ascítico, fluido de diálisis peritoneal y biopsia de esófago. Las infecciones por S. cerevisiae estaban relacionadas con neoplasias, trasplantes, procedimientos quirúrgicos, insuficiencia renal, uso de catéter venoso central, ventilación mecánica, internación en la Unidad de Cuidados Intensivos, diabetes mellitus, quimioterapia, corticosteroides y nutrición parenteral. El fluconazol y la anfotericina B fueron los antifúngicos más utilizados en el tratamiento. Tres de los 6 pacientes presentaron mejoría clínica y fueron dados de alta, y los otros 3 fallecieron.
ConclusionesHay que poner especial atención en las infecciones emergentes, especialmente cuando existan factores predisponentes, tales como inmunosupresión o enfermedades graves. El diagnóstico rápido y específico de la infección por S. cerevisiae es importante para la decisión terapéutica. Son necesarios estudios epidemiológicos y de eficacia de los agentes antifúngicos con el fin de obtener un mejor enfoque terapéutico.
Saccharomyces cerevisiae is an ubiquitous yeast widely used in industry and it is also a common colonizer of the human mucosae. However, the incidence of invasive infection by these fungi has significantly increased in the last decades.
AimsTo evaluate the infection by S. cerevisiae in a hospital in southern Brazil during a period of 10 years (2000-2010).
MethodsReview of medical records of patients infected by this fungus.
ResultsIn this period, 6 patients were found to be infected by S. cerevisiae. The age range of the patients was from 10 years to 84. Urine, blood, ascitic fluid, peritoneal dialysis fluid, and esophageal biopsy samples were analyzed. The predisposing factors were cancer, transplant, surgical procedures, renal failure, use of venous catheters, mechanical ventilation, hospitalization in Intensive Care Unit, diabetes mellitus, chemotherapy, corticosteroid use, and parenteral nutrition. Amphotericin B and fluconazole were the treatments of choice. Three of the patients died and the other 3 were discharged from hospital.
ConclusionsWe must take special precautions in emerging infections, especially when there are predisposing conditions such as immunosuppression or patients with serious illnesses. The rapid and specific diagnosis of S. cerevisiae infections is important for therapeutic decision. Furthermore, epidemiological and efficacy studies of antifungal agents are necessary for a better therapeutic approach.
Saccharomyces cerevisiae es un ascomiceto ubicuo que se encuentra en las plantas, frutas y suelos7, y también se usa ampliamente en la industria para la producción de alimentos y bebidas28, como pan, cerveza y vino6,15.
En los seres humanos esta levadura forma parte de la microbiota habitual de la mucosa del tracto gastrointestinal y respiratorio17,26. No obstante, en las últimas décadas, la incidencia de infecciones por esta levadura aumentó sobre todo en individuos inmunodeprimidos22,29. Al mismo tiempo, el uso de antibióticos de amplio espectro, los catéteres intravasculares y los probióticos son algunos de los factores predisponentes más frecuentemente asociados15,16,22.
En este trabajo presentamos 6 casos de infección nosocomial por S. cerevisiae y comentamos las presentaciones clínicas, las condiciones predisponentes, la terapia utilizada y la evolución de la enfermedad.
Pacientes y métodosFueron revisados retrospectivamente desde enero de 2000 a diciembre de 2010, 6 casos de infecciones por S. cerevisiae existentes en los archivos del Laboratório de Micologia, Irmandade Santa Casa de Misericórdia de Porto Alegre (ISCMPA), Rio Grande do Sul, Brasil. La historia clínica de cada paciente fue analizada, y los aspectos como el género, la edad, las condiciones predisponentes, la enfermedad, las muestras clínicas, el tratamiento y la evolución de la enfermedad fueron descritos.
El diagnóstico micológico se efectuó mediante examen microscópico directo y cultivo de las muestras clínicas. Para la realización del diagnóstico se utilizó el sedimento obtenido de la centrifugación de las muestras de orina (un caso), sangre (2 casos), líquido de ascitis (un caso), líquido de diálisis peritoneal (un caso) y un fragmento de esófago procedente de biopsia (un caso). Para la centrifugación de las muestras de sangre fue utilizado el sistema de lisis-centrifugación (Isolator System, Wampole Labs., Cranbury, NJ, EE. UU.), que es considerado el método de referencia para el aislamiento de hongos a partir de muestras de sangre1. El sedimento de orina se sembró en agar glucosado de Sabouraud (SGA, Difco Laboratories, Detroit, MI, EE. UU.) con cloranfenicol (Unión Química, Brasil), y se incubó a 25°C. Las otras muestras clínicas se sembraron en SGA y agar infusión cerebro y corazón (BHI, Biobrás, Brasil), y se incubaron a 25 y 35°C, respectivamente.
Las colonias desarrolladas en los cultivos positivos fueron analizadas macroscópica y microscópicamente. El agente fúngico fue identificado por el método automatizado ID 32C-ATB Expression (bioMérieux, Francia) a partir de suspensiones estandarizadas (MacFarland 2) en un densitómetro (ATB 1550, bioMérieux, Francia) procedentes de cultivos de 24h de incubación. Esta suspensión se transfirió a un medio semisólido sintético (MedioC, bioMérieux, Francia) para la inoculación posterior en las galerías de 32 cúpulas con diferentes sustratos deshidratados (ID 32C, bioMérieux, Francia). El crecimiento fue interpretado en el equipo ATB después de la incubación de 24, 48 y 72h a 30°C.
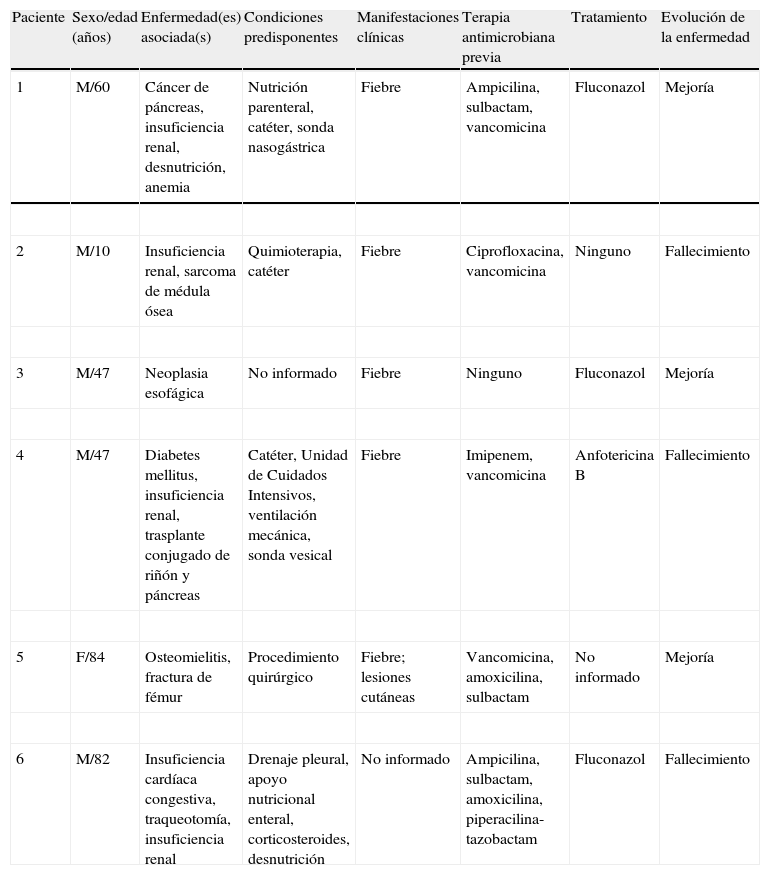
ResultadosEl rango de edad de los pacientes oscilaba entre los 10 y los 84 años, con una mediana de 53,5 y un predominio del sexo masculino (5 de los 6 pacientes). Las enfermedades asociadas o condiciones predisponentes relacionadas con la infección por S. cerevisiae destacadas fueron la diabetes mellitus, la insuficiencia renal, el cáncer, la malnutrición, el trasplante de órganos sólidos y la quimioterapia. Entre los factores predisponentes destacaron la utilización de catéter, la ventilación mecánica, la nutrición parenteral o sonda nasogástrica y los procedimientos quirúrgicos (tabla 1). La mayoría de los pacientes presentaron fiebre como manifestación clínica.
Características de los pacientes con infección nosocomial por Saccharomyces cerevisiae
| Paciente | Sexo/edad (años) | Enfermedad(es) asociada(s) | Condiciones predisponentes | Manifestaciones clínicas | Terapia antimicrobiana previa | Tratamiento | Evolución de la enfermedad |
| 1 | M/60 | Cáncer de páncreas, insuficiencia renal, desnutrición, anemia | Nutrición parenteral, catéter, sonda nasogástrica | Fiebre | Ampicilina, sulbactam, vancomicina | Fluconazol | Mejoría |
| 2 | M/10 | Insuficiencia renal, sarcoma de médula ósea | Quimioterapia, catéter | Fiebre | Ciprofloxacina, vancomicina | Ninguno | Fallecimiento |
| 3 | M/47 | Neoplasia esofágica | No informado | Fiebre | Ninguno | Fluconazol | Mejoría |
| 4 | M/47 | Diabetes mellitus, insuficiencia renal, trasplante conjugado de riñón y páncreas | Catéter, Unidad de Cuidados Intensivos, ventilación mecánica, sonda vesical | Fiebre | Imipenem, vancomicina | Anfotericina B | Fallecimiento |
| 5 | F/84 | Osteomielitis, fractura de fémur | Procedimiento quirúrgico | Fiebre; lesiones cutáneas | Vancomicina, amoxicilina, sulbactam | No informado | Mejoría |
| 6 | M/82 | Insuficiencia cardíaca congestiva, traqueotomía, insuficiencia renal | Drenaje pleural, apoyo nutricional enteral, corticosteroides, desnutrición | No informado | Ampicilina, sulbactam, amoxicilina, piperacilina-tazobactam | Fluconazol | Fallecimiento |
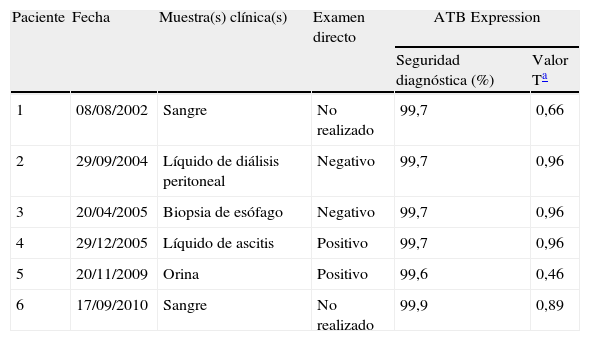
En el diagnóstico micológico, las colonias aisladas en cultivos de orina, sangre, líquido de ascitis, líquido de diálisis peritoneal y biopsia de esófago, después de 3-5 días de incubación, tenían textura cremosa de color blanco a crema, y la microscopía evidenció la presencia de blastoconidios. Las pruebas bioquímicas realizadas por el método automatizado ATB Expression identificaron S. cerevisiae en todos los casos con una seguridad diagnóstica superior al 90% y un valor T superior a 0,3 (tabla 2). Para la terapia, el fluconazol y la anfotericina B fueron los agentes antifúngicos escogidos para el tratamiento y, por otro lado, de acuerdo con la evolución clínica, 3 pacientes presentaron mejoría clínica y los otros 3 fallecieron (tabla 1).
Diagnóstico micológico: examen microscópico directo y método automatizado de identificación de especies
| Paciente | Fecha | Muestra(s) clínica(s) | Examen directo | ATB Expression | |
| Seguridad diagnóstica (%) | Valor Ta | ||||
| 1 | 08/08/2002 | Sangre | No realizado | 99,7 | 0,66 |
| 2 | 29/09/2004 | Líquido de diálisis peritoneal | Negativo | 99,7 | 0,96 |
| 3 | 20/04/2005 | Biopsia de esófago | Negativo | 99,7 | 0,96 |
| 4 | 29/12/2005 | Líquido de ascitis | Positivo | 99,7 | 0,96 |
| 5 | 20/11/2009 | Orina | Positivo | 99,6 | 0,46 |
| 6 | 17/09/2010 | Sangre | No realizado | 99,9 | 0,89 |
Los avances médicos en los últimos años han mejorado la prevención, el diagnóstico y los procedimientos terapéuticos para una gran variedad de enfermedades. Con todo, algunos tratamientos, como los que implican el uso de procedimientos quirúrgicos, materiales protésicos o agentes quimioterápicos, pueden inducir la inmunosupresión grave –por ejemplo, durante el tratamiento del cáncer y el trasplante de órganos– y permitir el acceso a los patógenos oportunistas21. Además, el grupo de pacientes con riesgo de nuevas infecciones oportunistas se ha incrementado dramáticamente desde los años 80 a causa de la epidemia mundial de infección por el virus de la inmunodeficiencia humana (VIH)10, con lo que hongos colonizadores y ubicuos pueden convertirse en patógenos, contribuyendo a una mayor morbimortalidad8,31.
S. cerevisiae es una levadura ubicua ampliamente utilizada en la industria, principalmente en la fabricación de bebidas alcohólicas como vino, cerveza o champán15. Esta levadura se encuentra también en la microbiota habitual: en el tracto gastrointestinal, el tracto respiratorio y las membranas mucosas17,26. Sin embargo, en las últimas décadas, especialmente desde 1990, aumentaron significativamente las infecciones fúngicas invasivas causadas por este hongo7,22.
El primer caso de infección por S. cerevisiae fue descrito en 1970 en un paciente con una válvula protésica mitral30. Tras un periodo de diez años, se observó un aumento gradual en el número de casos notificados en las décadas siguientes. Muñoz et al. realizaron una revisión de la literatura publicada entre 1966 y 2004 de los casos de fungemia y documentaron el aumento de la incidencia de la infección por S. cerevisiae: 4 casos durante 1970-1980, 10 casos durante 1981-1991 y 46 casos durante 1992-200417.
El síndrome clínico más importante causado por S. cerevisiae es la fungemia; no obstante, esta levadura también puede causar una variedad de síndromes clínicos, tales como vaginitis19, esofagitis13, neumonía, absceso hepático, infecciones genitourinarias, peritonitis, celulitis, fiebre y shock séptico17,27.
La conversión de este microorganismo de comensal a patógeno y el desarrollo de fungemia pueden producirse debido a una traslocación endógena gastrointestinal, al uso de un catéter5 o a la administración de probiótico5,16,22. Estos son agentes bioterápicos liofilizados20, preparados con una variedad de S. cerevisiae (S. cerevisiae var. boulardii) y administrados por vía oral23 para equilibrar la microbiota intestinal en el tratamiento de la diarrea crónica asociada con Clostridium difficile o con el uso de antibióticos9,11,24, enfermedad de Crohn u otras afecciones inflamatorias intestinales4, lo que sugiere que S. cerevisiae var. boulardii podría ir desde el tracto gastrointestinal hacia la corriente sanguínea y causar una fungemia28. Henry et al. presentaron el caso de un hombre de 65 años, que desarrolló fungemia por S. cerevisiae después de haberse sometido a quimioterapia y tratamiento de la diarrea con probióticos orales de S. cerevisiae var. boulardii12. El beneficio potencial de la utilización de este probiótico debe ser evaluado para cada paciente, ya que muchos casos de fungemia asociada con S. cerevisiae var. boulardii se han reportado en la literatura4,11,14,18,32. Debemos prestar particular atención a pacientes inmunocomprometidos o expuestos a factores predisponentes7. Sin embargo, no debemos descuidar a los pacientes inmunocompetentes pero con problemas cardiacos sometidos a implantes de injertos17.
La literatura también informa de las infecciones causadas por S. cerevisiae asociadas a pacientes inmunodeficientes, procedimientos dentales, cáncer de páncreas, quemaduras, insuficiencia renal, endocarditis29, enfermedades hematológicas, trasplantes, sida y terapia con corticosteroides33. Al mismo tiempo, el riesgo de fungemia también se ha asociado a pacientes en unidades de cuidados intensivos y al uso del catéter venoso central16. Ruiz-Esquide et al. describieron el caso de un recién nacido en la Unidad de Cuidados Intensivos, en quien se utilizó ventilación mecánica y catéter percutáneo, suma esta de factores que llevó a una endocarditis25. Belet et al. también informaron de un caso de un recién nacido que desarrolló fungemia, pero relacionada con el uso de catéter venoso central3.
En este trabajo se hizo una revisión de las infecciones causadas por S. cerevisiae en los últimos 10 años (2000-2010) en la ISCMPA, que resultó en 6 pacientes, a quienes se les asociaron condiciones similares a las descritas en la literatura como neoplasias (un paciente con cáncer de páncreas, otro con cáncer de esófago y un tercero con sarcoma de la médula ósea), trasplante (un trasplante conjugado de riñón y páncreas), procedimientos quirúrgicos (un paciente con cirugía ósea por fractura de prótesis), insuficiencia renal (3 pacientes), uso de catéter (3 pacientes), ventilación mecánica asociada a la Unidad de Cuidados Intensivos (un paciente), diabetes mellitus (un paciente) y nutrición parenteral (un paciente). En relación con las manifestaciones clínicas, la mayoría de los pacientes presentaron fiebre. Un paciente presentó lesiones en la piel por falta de movimiento, debido a la cirugía por fractura. En referencia a la asociación con el uso de antibióticos, 4 de los 5 pacientes habían empezado terapia previa. El antibiótico más utilizado fue la vancomicina (4 pacientes), seguida de sulbactam (2 pacientes), ampicilina (2 pacientes), amoxicilina (2 pacientes), ciprofloxacina (un paciente), piperacilina-tazobactam (un paciente) e imipenem (un paciente).
Después de la identificación del agente fúngico, el tratamiento más utilizado fue fluconazol (3 pacientes) y anfotericina B (un paciente). La anfotericina B es el tratamiento de elección para las infecciones graves causadas por este organismo2. Smith et al.29 y Ancott et al.2 han empleado anfotericina B o ketoconazol en el tratamiento de las fungemias por S. cerevisiae. Además de la anfotericina B, también hay informes de que el voriconazol parece ser activo in vitro contra S. cerevisiae, mientras que el fluconazol puede tener actividad variable16. Muñoz et al. informan que las cepas de S. cerevisiae son sensibles a anfotericina B (CIM90 0,5-1μg/ml) y fluorocitocina (CIM90 0,25mg/ml), mientras que para el fluconazol y el itraconazol se describen diferentes grados de sensibilidad17. Sin embargo, pocos datos están relacionados con la eficacia de los antifúngicos. Por lo tanto, hasta que haya más datos disponibles en la literatura, la anfotericina B parece ser el fármaco de elección, y el voriconazol o el posaconazol parecen tener buena actividad antifúngica in vitro contra este hongo16,17.
Además de la terapia antifúngica, otras medidas son también importantes, como la retirada del catéter y la suspensión de probióticos con S. cerevisiae27. En relación con la evolución clínica, 3 pacientes tuvieron una respuesta favorable y 3 fallecieron. En este trabajo no se pudo establecer si el óbito fue consecuencia de la infección; lo más probable es que el fallecimiento ocurriera debido a la evolución de sus respectivas enfermedades de base.
En conclusión, S. cerevisiae es una levadura de la microbiota habitual, pero no podemos descartarla como un importante agente de infecciones debido a su creciente incidencia. Debemos poner especial atención cuando existan condiciones predisponentes como la inmunosupresión o enfermedades graves, así como investigar el uso de preparaciones de probióticos con S. cerevisiae var. boulardii. La identificación rápida de esta levadura es importante para las decisiones terapéuticas y los estudios epidemiológicos, así como los estudios sobre la eficacia de los antifúngicos son necesarios para un mejor abordaje terapéutico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos al consultor lingüístico, Sr. Freddy Cuzco la revisión de este manuscrito.