La onicomicosis afecta a entre el 2 y el 30% de la población mundial; la biopsia ungueal facilita el diagnóstico y diferencia invasión de colonización.
ObjetivosEvaluar la utilidad diagnóstica de la biopsia ungueal con coloración de PAS en las onicomicosis frente al examen directo con KOH, el cultivo y su combinación en un laboratorio de referencia de Colombia.
MétodosSe incluyó a 66 pacientes, a quienes se les realizó lectura ciega e independiente de las tres pruebas; la utilidad se definió a partir de los resultados de validez (sensibilidad, especificidad, índice de Youden, cocientes de probabilidad), desempeño (valores predictores), eficiencia (proporción de pacientes correctamente diagnosticados) y reproducibilidad (índice kappa).
ResultadosLa edad media de los pacientes fue 55±16 años, el 76% fueron mujeres y el 66,7% (n=44) de los exámenes directos con KOH resultaron positivos; para el cultivo, el 62,1% (n=41) de las muestras fueron positivas y con la biopsia lo fueron el 56,1% (n=37). Los principales agentes causales fueron mohos no dermatofitos en un 36,4% (n=24) y las especies con la mayor frecuencia fueron Neoscytalidium dimidiatum (n=11), Trichophyton rubrum (n=11) y Candida parapsilosis (n=13). La sensibilidad de la biopsia ungueal frente al KOH o el cultivo fue del 71%, la especificidad del 83%, el índice de Youden 0,54, el cociente de probabilidad positivo de 4,25, el cociente de probabilidad negativo de 0,35, el valor predictivo positivo el 92%, el valor predictivo negativo el 52%, la eficiencia el 74% y el coeficiente kappa 0,45. Al evaluar la biopsia solo en pacientes con onicólisis de la lámina ungueal superior al 50%, aumentaron todos los parámetros de utilidad diagnóstica.
ConclusionesLa utilidad global de la biopsia fue moderada para pacientes con mayor sintomatología, por lo que se recomienda su uso en presencia de onicólisis extensa y en los casos en los que se requiera discriminar colonización de invasión.
Onychomycosis affects between 2% to 30% of the world population. Nail biopsy may help in making a diagnosis and can distinguish between invasion and colonisation.
AimsTo evaluate the diagnostic usefulness of nail biopsy with Periodic acid–Schiff (PAS) staining for onychomycosis, compared to direct KOH examination, culture and its combination in a reference laboratory in Colombia.
MethodsThe study included 66 patients in whom a blind and independent reading of the three tests was performed. The usefulness was defined based on the validity (sensitivity, specificity, Youden's index, likelihood ratios), performance (predictive values) efficiency (proportion of correctly diagnosed patients), and reproducibility (kappa coefficient).
ResultsThe mean age of the patients was 55±16 years, and included 76% women. The direct tests with KOH were positive in 66.7% (n=44), 62.1% (n=41) were positive with culture, and 56.1% (n=37) with the biopsy. The main causal agents were non-dermatophytes moulds in 36.4% (n=24). The most frequent species were Neoscytalidium dimidiatum (n=11), Trichophyton rubrum (n=11), and Candida parapsilosis (n=13). The sensitivity of nail biopsy, when compared to the standard (KOH and/or culture), was 71%, specificity 83%, Youden's index 0.54, positive likelihood ratio 4.25, negative likelihood ratio 0.35, positive predictive value 92%, negative predictive value 52%, efficiency 74% and kappa coefficient 0.45. When biopsy was evaluated only in patients with onycholysis of the nail plate greater than 50%, all the parameters of diagnostic usefulness increased.
ConclusionsThe overall usefulness of the biopsy was moderate for patients with more severe symptomatology, which makes its use advisable in cases of extensive onycholysis, and when discriminating colonisation from invasion is required.
La onicomicosis es una infección causada por la invasión de estructuras micóticas en la lámina ungueal; corresponde aproximadamente al 50% de los desórdenes ungueales25,29,33,38. En el ámbito mundial, se han publicado prevalencias entre el 2 y el 30%13,15,25, lo que muestra una amplia variabilidad que se ve influida por factores como el sexo, la edad, la ocupación, la actividad física y las enfermedades de base del hospedero2,4,5,13,15,33.
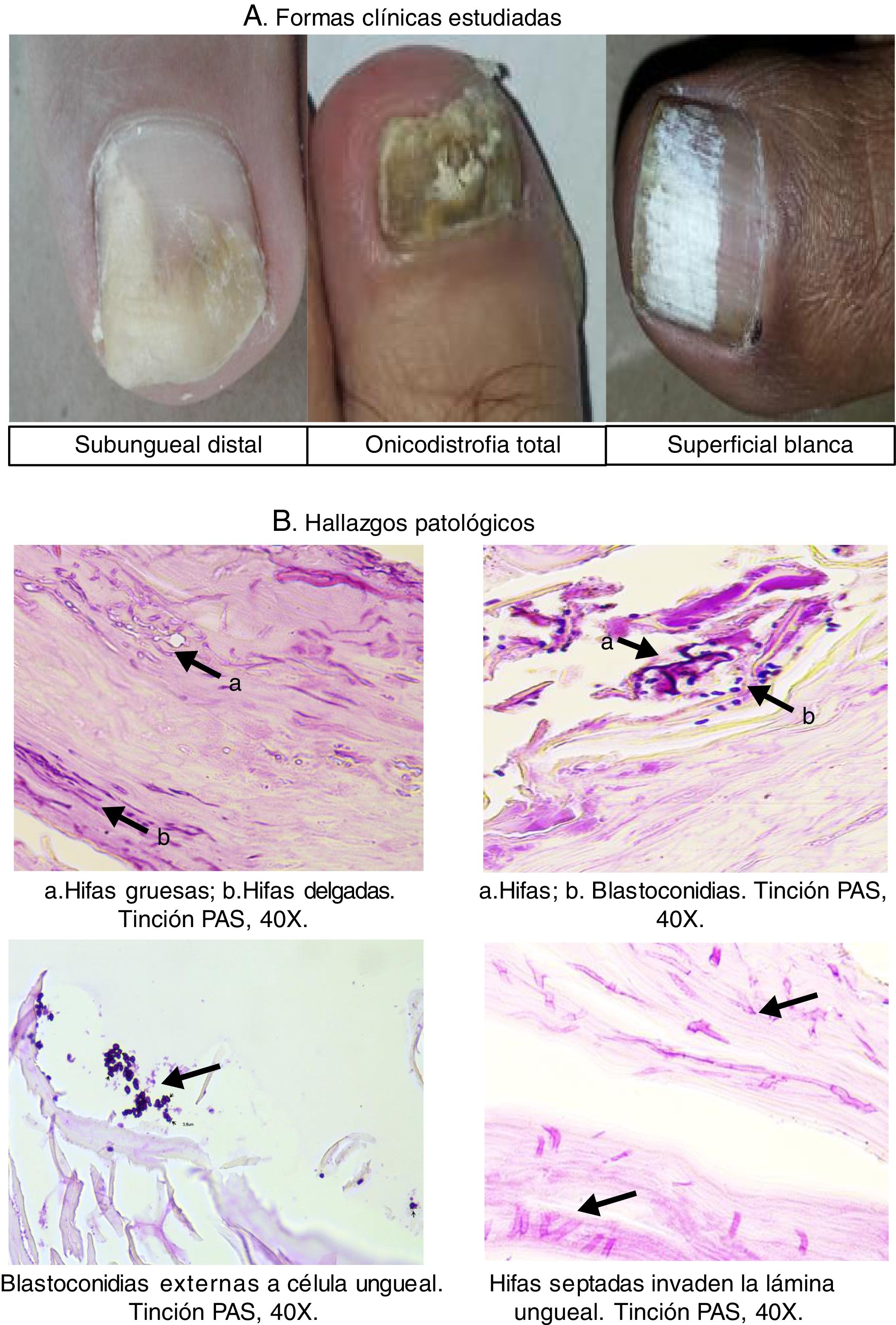
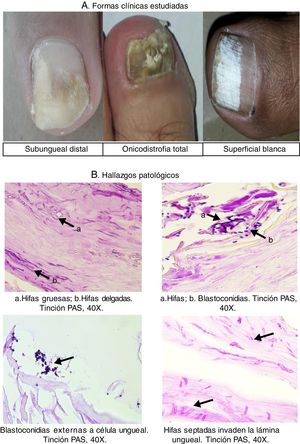
La presentación clínica de la onicomicosis es variada y se clasifica según el sitio anatómico en la lámina ungueal. La onicomicosis subungueal distal es la forma clínica más frecuente y se caracteriza por la presencia de onicólisis, cambio de color que va desde blanco hasta café o negro, hiperqueratosis y, en casos crónicos, engrosamiento de la lámina ungueal. La onicomicosis subungueal proximal presenta onicomadesis en la zona proximal, generalmente con perionixis, y se asocia fuertemente a la infección por VIH. En la forma endonix aparece una mancha blanca difusa sin hiperqueratosis ni onicólisis; en la onicomicosis superficial blanca el hongo se ubica en la superficie de la lámina, con manchas blancas bien delimitadas. Finalmente, la onicodistrofia total es la fase final con un compromiso total de la lámina ungueal, generalmente con engrosamiento y pigmentación, masas queratósicas y destrucción de la uña6,25,29,33.
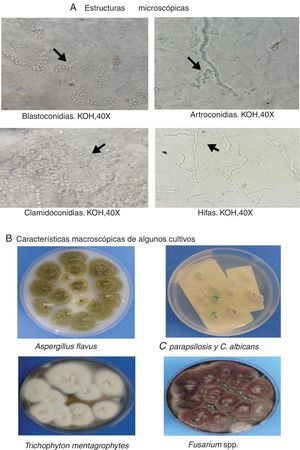
Los agentes causales incluyen hongos dermatofitos, levaduras, mohos no dermatofitos y hongos ambientales. Las especies más frecuentemente aisladas son Trichophyton rubrum, Trichophyton mentagrophytes, especies de Candida, Fusarium, Aspergillus, Scytalidium o Neoscytalidium dimidiatum, entre otras25,29,33,38.
La presencia de levaduras y de mohos no dermatofitos en los cultivos dificulta el diagnóstico dado que pueden tratarse de microorganismos colonizadores transitorios o de contaminantes del cultivo. En su mayoría, no poseen actividad queratinolítica como los dermatofitos y generalmente no se comportan como patógenos primarios, por lo que es difícil darles un valor diagnóstico2,8,12. Para el caso de los mohos ambientales, es importante cumplir algunos criterios, como aislar el agente en dos cultivos diferentes, que el hongo esté presente en más de cinco puntos de siembra, que se aísle en medios de cultivo diferentes, y que no haya otros aislamientos de un patógeno primario8,12. Con relación a las levaduras es importante determinar el grado de presencia para darle un adecuado valor diagnóstico8,11.
La biopsia ungueal es una herramienta que permite observar la presencia de estructuras fúngicas, así como el grado de invasión de las mismas30; también es de ayuda en el tipo de organismo involucrado (dermatofitos, levaduras o mohos no dermatofitos)3,9. Es por esto que ha sido considerada un apoyo importante en el diagnóstico de las onicomicosis, pues permite discriminar entre una colonización y una invasión. Otra característica de la biopsia ungueal es el incremento en la sensibilidad que aporta al diagnóstico tradicional de las onicomicosis, como se indica en estudios que mencionan un incremento en la sensibilidad de hasta un 97% cuando se combinan la biopsia ungueal, el examen directo con hidróxido de potasio (KOH) y el cultivo7. A esto se suma la relevancia de disponer de pruebas diagnósticas válidas como eje de la orientación terapéutica y el seguimiento de los pacientes con onicomicosis crónicas.
A pesar de las ventajas que ofrece la biopsia, en la literatura científica persisten limitaciones relacionadas con la evaluación de su validez, desempeño y eficiencia diagnósticas, dado que algunas publicaciones disponibles solo presentan datos de sensibilidad, especificidad o valores predictivos14,22,28,37, obviando parámetros de evaluación más robustos, como los cocientes de probabilidad, el índice J de Youden y la eficiencia global de la prueba; a esto se suman sesgos en estudios que al evaluar la biopsia la incluyen en el estándar o referencia1 y el hecho de disponer de un bajo número de estudios de validación de la prueba en el ámbito mundial.
Por lo anterior, el objetivo de este estudio fue evaluar la utilidad de la biopsia ungueal en el diagnóstico de la onicomicosis en un laboratorio de referencia de Medellín, Colombia, a partir de los criterios de validez, desempeño, eficiencia y reproducibilidad.
Material y métodosPoblación del estudioSe incluyó en el estudio a 66 pacientes con sospecha clínica de onicomicosis que asistieron al servicio diagnóstico especializado de Micología Médica y Experimental de la IPS CIB-Salud de la Corporación para Investigaciones Biológicas (CIB), entre los meses de julio y septiembre del 2016; todos diligenciaron un consentimiento informado y se les aplicó un protocolo válido de la CIB para la toma y el procesamiento de muestras para el examen directo con KOH, cultivo de hongos y biopsia de uña con tinción con ácido peryódico de Schiff (PAS).
MétodosExamen directo con KOH: se realizó un raspado con bisturí estéril para la recogida de los detritus de la zona subungueal; este material fue depositado en una lámina y se añadió KOH al 10% con tinta negra y azul Parker©(casa comercial MDM científica), se observó al microscopio y se registró la presencia o ausencia de estructuras micóticas.
Cultivo de hongos: las muestras se sembraron en cuatro medios de cultivo diferentes, agar Mycosel, agar Sabouraud, agar patata y CHROMagar Candida®, con el fin de incrementar la posibilidad de aislar los agentes infecciosos. Además, el CHROMagar en particular permite detectar infecciones mixtas producidas por más de una especie de Candida. Una vez sembrados, los cultivos fueron incubados a 25°C, y fueron revisados macroscópicamente cada semana, durante 4 semanas, en busca de potenciales colonias de hongos causantes de onicomicosis. En los cultivos que presentaron crecimiento se identificaron el género y la especie.
Biopsia de uña: se realizó un corte de la uña en su porción más afectada. Para el estudio patológico se siguió el protocolo del servicio de Dermatopatología del Centro Hospitalario Universitario (CHU) de Lieja, Bélgica. Se incluyó la uña en agar granulado a una concentración de 1,5g/100ml, marca Difco® (casa comercial MDM científica), después se depositó en una solución de formol al 10%. El proceso de inclusión en parafina, corte, fijación y coloración con PAS se realizó en un laboratorio de la ciudad de Medellín, Colombia.
Las variables que se tuvieron en consideración fueron sexo y edad, signos que denotaran traumatismo, presencia de estructuras fúngicas (blastoconidias o hifas), presencia de bacterias y sección de la lámina ungueal afectada (interna, media, externa, compromiso total o ausencia de afectación) con el fin de determinar la presencia de colonización o invasión por el agente infeccioso.
Control de sesgos y análisis estadísticoLa lectura de las placas de los cortes histopatológicos se llevó a cabo de manera independiente por dos observadores diferentes (análisis de reproducibilidad intra e interobservador) para evitar errores de clasificación atribuibles al lector; de igual forma, se desconocían los resultados de las otras dos pruebas para reducir el sesgo de enmascaramiento en la interpretación de las pruebas. Además, la prueba evaluada no se incluyó dentro del estándar, lo que evita sesgos de verificación parcial1. Se aplicaron también las recomendaciones de la guía STARD10.
En SPSS y Epidat 3.1 se describieron las variables sociodemográficas y microbiológicas, se determinó el coeficiente kappa y el valor Phi para la concordancia entre las pruebas individuales y su combinación: 1) KOH vs. biopsia; 2) cultivo vs. biopsia; 3) KOH vs. cultivo, y 4) biopsia vs. KOH+cultivo. Para calcular la validez de la biopsia se determinaron la sensibilidad, la especificidad, los cocientes de probabilidad y el índice de J Youden; para el cálculo del desempeño se usaron los valores predictivos y para la eficiencia, la proporción de pacientes correctamente diagnosticados.
ResultadosEl 76% (n=50) de los pacientes fueron mujeres, la edad promedio fue de 55±16 años, con edades entre 19 y 87 años. La distribución según el tipo de onicomicosis fue del 50% (n=33) para la subungueal distal, seguida de la distal lateral con un 27% (n=18), la onicomicosis con distrofia total en el 9% (n=6), la superficial blanca con el 2% (n=1) y lesiones de tipo indefinido en el 12% (n=8) restante.
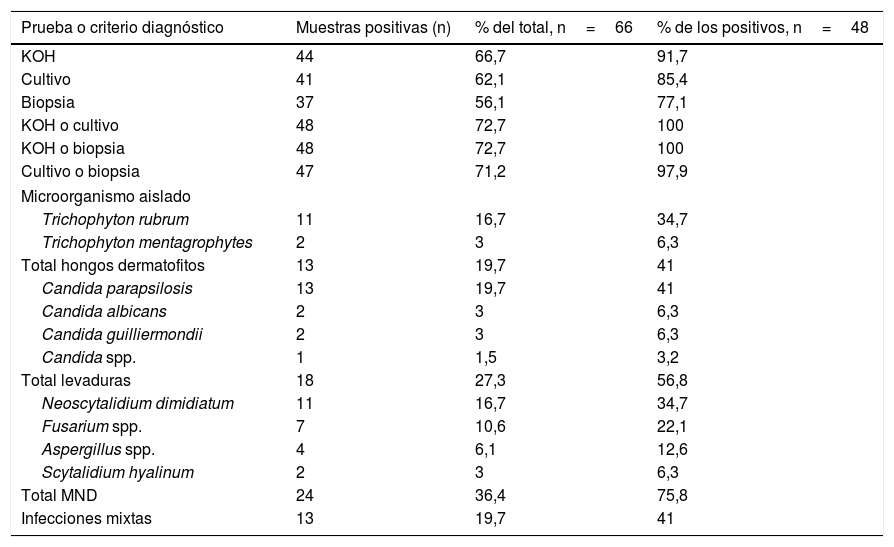
De los 66 pacientes evaluados, el 72,7% (n=48) presentó cultivo o KOH positivo, siendo mayor la frecuencia de resultados positivos en las preparaciones con KOH y menor en la biopsia ungueal (tabla 1). En cuanto a las variables evaluadas en la lectura de la biopsia ungueal, en el 91,9% de los pacientes con muestra positiva había traumatismo (34/37), el 89,2% (33/37) presentaba una infección bacteriana concomitante según la biopsia, en el 5,4% (2/37) de las muestras se observó colonización y en el 94,6% (35/37) se constató invasión fúngica.
Pruebas diagnósticas y microorganismos aislados
| Prueba o criterio diagnóstico | Muestras positivas (n) | % del total, n=66 | % de los positivos, n=48 |
|---|---|---|---|
| KOH | 44 | 66,7 | 91,7 |
| Cultivo | 41 | 62,1 | 85,4 |
| Biopsia | 37 | 56,1 | 77,1 |
| KOH o cultivo | 48 | 72,7 | 100 |
| KOH o biopsia | 48 | 72,7 | 100 |
| Cultivo o biopsia | 47 | 71,2 | 97,9 |
| Microorganismo aislado | |||
| Trichophyton rubrum | 11 | 16,7 | 34,7 |
| Trichophyton mentagrophytes | 2 | 3 | 6,3 |
| Total hongos dermatofitos | 13 | 19,7 | 41 |
| Candida parapsilosis | 13 | 19,7 | 41 |
| Candida albicans | 2 | 3 | 6,3 |
| Candida guilliermondii | 2 | 3 | 6,3 |
| Candida spp. | 1 | 1,5 | 3,2 |
| Total levaduras | 18 | 27,3 | 56,8 |
| Neoscytalidium dimidiatum | 11 | 16,7 | 34,7 |
| Fusarium spp. | 7 | 10,6 | 22,1 |
| Aspergillus spp. | 4 | 6,1 | 12,6 |
| Scytalidium hyalinum | 2 | 3 | 6,3 |
| Total MND | 24 | 36,4 | 75,8 |
| Infecciones mixtas | 13 | 19,7 | 41 |
MND: mohos no dermatofitos.
La frecuencia de dermatofitos fue del 19,7%, que corresponden al 41% del total de los resultados positivos, en el 27,3% se hallaron levaduras y en el 36,4% mohos no dermatofitos; las especies presentes con mayor frecuencia fueron Candida parapsilosis, T. rubrum, N. dimidiatum y especies del género Fusarium (tabla 1).
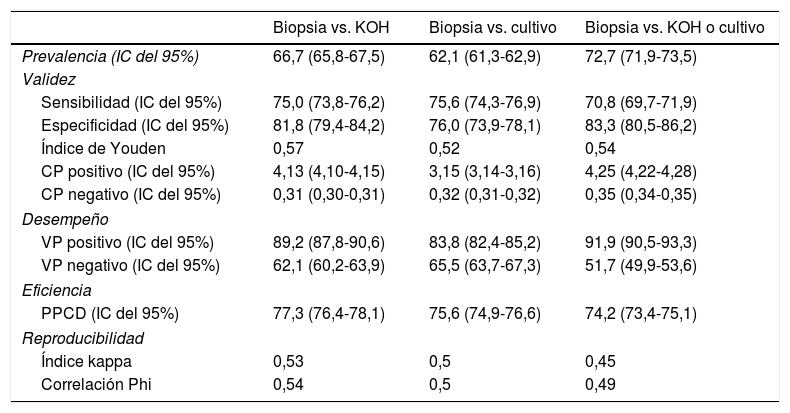
En la tabla 2 se presentan los resultados de la utilidad diagnóstica de la biopsia en comparación con el examen directo, el cultivo y su combinación: los valores de sensibilidad fueron superiores al 70%, la especificidad fue superior al 75%, el cociente de probabilidad positivo fue de aproximadamente 4 y el negativo de 0,3; el valor predictivo positivo fue cercano al 80% y el negativo estuvo entre el 52 y el 65%, con una proporción de pacientes correctamente diagnosticados cercana al 75%.
Utilidad diagnóstica de la biopsia ungueal en comparación con la técnica de KOH, el cultivo y su combinación
| Biopsia vs. KOH | Biopsia vs. cultivo | Biopsia vs. KOH o cultivo | |
|---|---|---|---|
| Prevalencia (IC del 95%) | 66,7 (65,8-67,5) | 62,1 (61,3-62,9) | 72,7 (71,9-73,5) |
| Validez | |||
| Sensibilidad (IC del 95%) | 75,0 (73,8-76,2) | 75,6 (74,3-76,9) | 70,8 (69,7-71,9) |
| Especificidad (IC del 95%) | 81,8 (79,4-84,2) | 76,0 (73,9-78,1) | 83,3 (80,5-86,2) |
| Índice de Youden | 0,57 | 0,52 | 0,54 |
| CP positivo (IC del 95%) | 4,13 (4,10-4,15) | 3,15 (3,14-3,16) | 4,25 (4,22-4,28) |
| CP negativo (IC del 95%) | 0,31 (0,30-0,31) | 0,32 (0,31-0,32) | 0,35 (0,34-0,35) |
| Desempeño | |||
| VP positivo (IC del 95%) | 89,2 (87,8-90,6) | 83,8 (82,4-85,2) | 91,9 (90,5-93,3) |
| VP negativo (IC del 95%) | 62,1 (60,2-63,9) | 65,5 (63,7-67,3) | 51,7 (49,9-53,6) |
| Eficiencia | |||
| PPCD (IC del 95%) | 77,3 (76,4-78,1) | 75,6 (74,9-76,6) | 74,2 (73,4-75,1) |
| Reproducibilidad | |||
| Índice kappa | 0,53 | 0,5 | 0,45 |
| Correlación Phi | 0,54 | 0,5 | 0,49 |
CP: cociente de probabilidad; VP: valor predictivo; PPCD: proporción de pacientes correctamente diagnosticados.
Al incluir la prueba en el estándar, la prevalencia fue del 77,3% (intervalo de confianza [IC] del 95%=76,4-78,1), la sensibilidad del 72,5% (71,5-73,6), la especificidad del 100% (96,7-100), el índice Youden fue 0,72, el valor predictivo positivo fue del 100% (98,6-100), el valor predictivo negativo del 51,7% (49,9-53,6) y el cociente de probabilidad negativo de 0,27. Además, al realizar los análisis solo con los pacientes con lesiones graves (onicólisis superior al 50%), todos los parámetros de evaluación diagnóstica mejoraron, aunque con IC muy amplios, debido al poder estadístico de las estimaciones en este subgrupo.
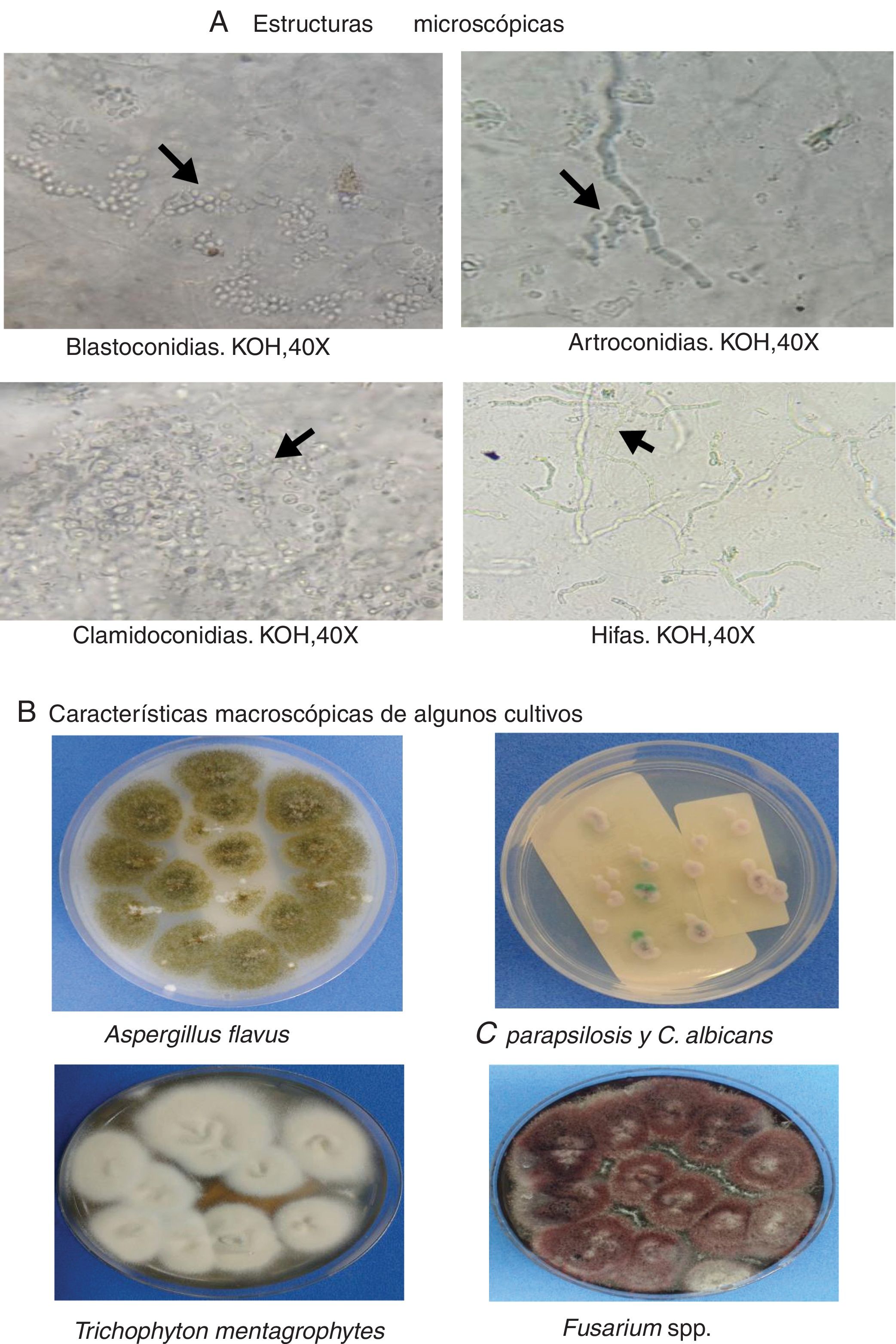
Finalmente, en la figura 1 se presentan tres formas clínicas en algunos de los pacientes del estudio, así como algunos hallazgos patológicos relevantes, como la presencia de hifas delgadas que siguen el mismo orden de las células ungueales e hifas gruesas que atraviesan el curso longitudinal de las células, lo que pone en evidencia una infección mixta por mohos; también se expone la fotografía de una infección mixta con blastoconidias e hifas, un cúmulo de blastoconidias que no comprometen las células ungueales (colonización) y la imagen de la biopsia de una paciente que muestra hifas septadas que invaden la lámina ungueal (infección). En la figura 2 se muestran varias imágenes correspondientes a algunos de los cultivos con el crecimiento de los géneros Aspergillus, Candida, Trichophyton y Fusarium, así como las estructuras microscópicas de levaduras y mohos observadas en el examen directo (fig. 2).
DiscusiónEste estudio es la primera publicación en Colombia que evalúa la utilidad diagnóstica de la biopsia ungueal para el diagnóstico de onicomicosis en función de los parámetros de validez, desempeño y eficiencia; los resultados han sido satisfactorios frente a otros métodos diagnósticos de rutina, con la ventaja de permitir discriminar entre colonización e invasión y confirmar el agente etiológico, lo que redunda en ventajas comparativas para la orientación terapéutica.
Con respecto al sexo, la incidencia de onicomicosis es superior en las mujeres, con una relación aproximada de 3 a 1; esto coincide con otros estudios que han atribuido este comportamiento a un mayor interés de las mujeres para acudir a la consulta médica y obtener un diagnóstico29,38, así como al uso de zapatos abiertos que favorecen los traumatismos26. Sin embargo, otros estudios han publicado una mayor prevalencia en hombres, lo que implica la necesidad de otros estudios epidemiológicos para evaluar la consistencia de este hallazgo2,16,27,28,36.
El promedio de edad obtenido (55 años) y las presentaciones clínicas más frecuentes (onicomicosis subungueal distal) son acordes con varias publicaciones de la literatura6,25,28,29,32. En relación con la edad, algunos estudios concluyen que la prevalencia de onicomicosis es mayor en los adultos y que su incidencia se incrementa con la edad debido al deterioro natural de la lámina ungueal, al incremento del riesgo de presentar enfermedades del sistema circulatorio y a traumatismos repetidos en las uñas6,25.
Los resultados positivos de las pruebas evaluadas son diferentes a las halladas en el estudio de Hsiao et al.18, donde fueron positivas el 87,2% (68/78) con el KOH, el 66,7% (52/78) con el cultivo y el 80,8% (63/78) con la biopsia. De igual manera, el estudio de Zanardi et al.37 obtuvo un resultado positivo del 72,5% (29/40) con el KOH, el 55% (22/40) con el cultivo y el 35% (14/40) con la biopsia. Es de destacar que todos los estudios coinciden en una mayor frecuencia de resultados positivos con el KOH, lo que se puede explicar por el hecho de que en el raspado para la toma de la muestra se obtienen detritus que pueden contener estructuras fúngicas no necesariamente asociadas a la infección de la uña6,12.
En cuanto a los aislamientos fúngicos, el grupo con mayor número fue el de mohos no dermatofitos, el género más frecuente fue Candida y las especies con mayor presencia fueron C. parapsilosis, N. dimidiatum y T. rubrum. En este sentido, Ameen et al.2 y Balleste et al.6 subrayan el comportamiento como patógeno primario de N. dimidiatum por la producción de queratinasas; en el estudio de Morales et al.26, N. dimidiatum fue también la especie más frecuente, lo que sugiere una incidencia de mohos no dermatofitos de hasta un 68%; esto demuestra la importancia de detectar este grupo de microorganismos como agentes etiológicos de las onicomicosis.
De igual forma, Cavallera y Asbati8 exponen en su estudio que la incidencia de onicomicosis producidas por levaduras y mohos no dermatofitos va en aumento, y Mendoza et al.25 afirman que la etiología varía con las condiciones geográficas y climáticas. En la mayoría de los estudios, los hongos dermatofitos siguen siendo los agentes causales de onicomicosis más frecuentes14,17,19-21.
La especie más frecuentemente aislada en nuestro estudio fue C. parapsilosis, lo que coincide con otros estudios23,34; asimismo, en el estudio de Manzano et al.24 los autores indican que el incremento de C. parapsilosis en las últimas dos décadas se ha hecho notorio y proponen como explicación de este fenómeno una capacidad adquirida de esta levadura para aprovechar los nutrientes disponibles en la lámina ungueal, nutrientes que puedan favorecer la colonización y posterior infección. Sin embargo, otros trabajos describen que es Candida albicans la especie más comúnmente aislada como agente causal de onicomicosis6,25.
En los parámetros de utilidad diagnóstica, particularmente en el criterio de reproducibilidad, se halló una baja concordancia entre la biopsia y el estándar, lo que podría sustentarse en lo enunciado previamente sobre la diferenciación entre colonización e invasión, a lo que se podrían sumar las diferencias atribuibles a que el examen directo y el cultivo pueden resultar positivos desde estadios iniciales de la infección o del contacto con el hongo, mientras que la biopsia resulta de mayor utilidad para estadios avanzados.
En relación con los criterios de validez y eficiencia, los resultados muestran una utilidad satisfactoria de la biopsia al discriminar esta adecuadamente entre infección y colonización, con valores de sensibilidad y especificidad superiores al 70%, cocientes de probabilidad positivo superior a 4 y negativo inferior a 0,35, y una proporción de pacientes correctamente diagnosticados superior al 70%. La sensibilidad y la especificidad resultan más bajas que las de algunos estudios previos, lo que podría atribuirse a sesgos de verificación parcial de algunas investigaciones que incluyen la prueba evaluada como parte del estándar1,16,18,32,35, con lo que se incrementaría de forma errada su especificad, así como el valor predictivo positivo. En el estudio de Zanardi et al.37 se relaciona el valor de sensibilidad inferior al esperado con el modo de obtención de la muestra. Finalmente, según el criterio de desempeño, la utilidad de la biopsia fue mayor para las muestras positivas en comparación con las negativas. Un resultado positivo permitirá confirmar la infección con mayor seguridad (valor predictivo positivo mayor); por el contrario, un resultado negativo no permitirá descartar el diagnóstico, resultando en un bajo valor predictivo negativo31.
Entre las principales limitaciones del estudio está el bajo tamaño de muestra y su selección no probabilística, lo que afecta a su validez externa. Sin embargo, debe destacarse la elevada validez interna, al controlar los sesgos de verificación parcial y de enmascaramiento de las pruebas1. La utilidad global de la biopsia fue buena para pacientes con mayor sintomatología y su uso podría resultar más costo-efectiva en pacientes con onicólisis distal subungueal, onicodistrofia total, afectación de la lámina ungueal superior al 50% y en aquellos casos en los que el cultivo y la prueba con KOH son positivos por la presencia de hongos colonizadores o contaminantes.
FinanciaciónEste estudio fue parcialmente financiado por el Programa de Sostenibilidad de Grupos de Investigación de la Universidad de Antioquia, año 2015.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.