La esporotricosis causada por el hongo dimorfo Sporothrix schenckii puede presentar una gran diversidad de formas clínicas. El diagnóstico de laboratorio se lleva a cabo por estudio micológico y serológico. Muy pocos estudios se han enfocado a la evaluación de su diagnóstico molecular.
ObjetivoEnsayar la técnica de reacción en cadena de la polimerasa (PCR) anidada en el diagnóstico de la esporotricosis experimental en órganos de ratones y compararla con los estudios micológico y serológico.
MétodosRatones BALB/c fueron inoculados con concentraciones crecientes de las 2 fases morfológicas del hongo. Los animales fueron sacrificados un mes después de la inoculación, evaluándose muestras de hígado, bazo, pulmón y testículo para el estudio micológico (examen directo y cultivo) y molecular por PCR anidada, y muestras de sangre para la captación de anticuerpos específicos contra S. schenckii por inmunodifusión doble.
ResultadosLos resultados de patogenicidad con las diferentes concentraciones del hongo, y el aislamiento del mismo por cultivo mostraron pocas diferencias en el estudio de las muestras de los órganos infectados con las 2 fases morfológicas de S. schenckii. En las muestras de ratones inoculados con la fase micelial los porcentajes de positividad del cultivo y examen directo fueron mayores (100 y 37,5%), en comparación con los encontrados con los de levadura (73 y 2%). Sin embargo, en el diagnóstico molecular por PCR anidada, en estas últimas muestras, los porcentajes de positividad fueron mayores (75%), encontrándose con el micelio un 43% de resultados positivos. La detección de anticuerpos específicos fue positiva en el 100% de todos los grupos de ratones infectados.
ConclusionesEn el estudio de la esporotricosis experimental en ratones, el cultivo demostró ser una herramienta de gran eficacia, así como también la detección de anticuerpos específicos, mientras que la prueba de PCR anidada y el estudio microscópico resultaron ser de de inferior valor diagnóstico.
Sporotrichosis caused by the dimorphic fungus Sporothrix schenckii can presents in a variety of clinical forms. Routine diagnosis is made by mycology and serology studies. Few investigations have been focused on the evaluation of the molecular diagnosis.
AimTo determine the value of the nested PCR technique for the diagnosis of experimental sporotrichosis in organs of mice, and to compare the results with the established laboratory diagnostic procedures.
MethodsBALB/c mice were inoculated with growing concentrations of the 2 morphological phases of the fungus. The infected animals were sacrificed one month later and specimens from liver, spleen, lung and testicle were obtained to perform wet mount, culture and molecular diagnosis by the nested PCR technique. Blood samples were obtained for determination of specific antibodies against S. schenckii by the double immunodiffusion procedure.
ResultsThe pathogenicity observed with the different concentrations of the fungus inoculated and its isolation by culture, showed scarce differences in the study of specimens from organs infected with the 2 morphological phases of S. schenckii. Specimens from organs of mice inoculated with the mycelial phase when studied by wet mount and culture, showed a higher positivity (100 and 37.5%) than those from mice inoculated with the yeast phase (73 and 2%). However, diagnosis by the nested PCR molecular technique applied to the latter specimens showed a higher percentage of positivity (75%) and 43% of positive results coming from animals infected with the mycelial phase. Specific antibody detection was positive in 100% all groups of infected mice.
ConclusionsIn the study of experimental sporotrichosis in mice, the culture, as well as the antibody detection, was an effective diagnostic procedure, while the nested PCR and microscopic studies had a lower diagnostic value.
La esporotricosis es una micosis cosmopolita causada por el hongo dimorfo Sporothrix schenckii, el cual se encuentra ampliamente distribuido en la naturaleza como saprófito de plantas y suelos, afectando al hombre y a otros mamíferos. Esta especie era considerada como la única responsable de producir la patología. Sin embargo, estudios moleculares recientes han demostrado que esta constituye un complejo de especies filogenéticas12. La infección se produce la mayoría de las veces como consecuencia de la inoculación traumática del hongo, ocasionando lesiones cutáneas y subcutáneas muy polimorfas1,5; la esporotricosis sistémica puede desarrollarse a partir de una lesión inicial cutánea o también con la inhalación por conidios. Las formas clínicas más severas afectan a pacientes inmunocomprometidos14,15. En América Central, tiene una mayor incidencia en México. En Sudamérica la prevalencia es mayor en Brasil5.
En Venezuela la esporotricosis constituye la micosis subcutánea de mayor incidencia en el área urbana. Las zonas más afectadas son los Estados Centrales, Mérida, Táchira y Bolívar1. Su diagnóstico se realiza regularmente mediante examen micológico e inmunológico. Sin embargo, el estudio micológico puede presentar una serie de limitaciones para el diagnóstico, ya que en el examen microscópico es difícil la visualización del microorganismo a partir de la muestra clínica, y el estudio por cultivo requiere un lapso de tiempo de 8 a 20 días para el crecimiento del hongo y su identificación. Por otra parte, el diagnóstico serológico presenta por lo general baja sensibilidad en las formas cutáneas fijas3. Estos métodos son tardíos en cuanto a la necesidad de un diagnóstico rápido y específico de la patología. Por ello, el ensayo de otras técnicas que permitan la detección del hongo en un lapso corto de tiempo podría contribuir a la obtención de un diagnóstico temprano de la micosis. Como la mayoría de los hongos dimorfos, S. schenckii se encuentra en el tejido en forma de levadura, mientras que su fase saprofítica es la que comúnmente infecta al huésped. Siendo esta fase micelial poco estudiada en los trabajos de infección experimental en ratones, en esta investigación se evaluó el diagnóstico molecular por la técnica de reacción anidada en cadena de la polimerasa (PCR), empleando para la infección las 2 fases morfológicas del hongo a diferentes concentraciones de inóculos, y comparando estos resultados con los métodos de estudio micológico y serológico.
Materiales y métodosMicroorganismoSe empleó una cepa de S. schenckii (4526), obtenida a partir de una lesión linfocutánea en el antebrazo izquierdo de un paciente proveniente de Barcelona, Estado Anzoátegui, en el año 1977. La cepa ha sido mantenida por cultivos trimestrales en medio Sabouraud-dextrosa agar a temperatura ambiente. La fase filamentosa de la cepa para el estudio se obtuvo por cultivos en medio Sabouraud-tiamina-asparagina tras 12 a 15 días de incubación a temperatura entre 26 a 28°C. Para la fase de levadura se llevaron a cabo cultivos en agar infusión de cerebro y corazón a 37°C, con 5-8 días de incubación.
Animales de experimentaciónPrevia revisión y aprobación del Comité de Bioética del Instituto de Biomedicina del Hospital Vargas de Caracas, en este estudio se utilizaron 42 ratones adultos jóvenes de 6 a 10 semanas de edad cepa BALB/c obtenidos del Bioterio del Instituto de Biomedicina. Los ratones fueron distribuidos en 4 grupos experimentales: 15 ratones para inoculación con la fase micelial del hongo (grupo i), 15 para inoculación con la fase de levadura (grupo ii), 2 ratones como controles negativos, y adicionalmente otros 10 ratones para inoculación con la fase de micelio para la posterior obtención de sangre completa.
Preparación de inóculosFase micelialBajo condiciones de esterilidad y bioseguridad, se tomaron pequeños fragmentos del cultivo de 13 días de crecimiento, que se suspendieron en un homogeneizador de células conteniendo 20mL de solución salina estéril; luego se procedió a homogeneizar hasta lograr la completa disgregación de los fragmentos. La suspensión resultante fue diluida con solución salina, hasta ir obteniendo una turbidez que se ajustó por comparación a los patrones McFarland de referencia: 2, 4, 6, 8 y 10, equivalentes a una concentración aproximada de 6×102, 1,2×103, 1,8×103, 2,4×103, 3×103 partículas/mL, respectivamente.
Fase de levaduraColonias del cultivo de 7 días a 37°C fueron disgregadas con ayuda de un homogeneizador en 20mL de solución salina estéril; luego se llevó a cabo el contaje de las levaduras en cámara de Neubauer y posteriormente se realizaron las diluciones hasta obtener las concentraciones de: 1×102, 1×104, 1×106, 1×108 y 1×109 células/mL.
Inoculación en animales de experimentaciónSe inocularon 3 ratones vía intraperitoneal con 0,5mL de cada inóculo preparado con ambas fases morfológicas del hongo (grupo i y grupo ii). El grupo control fue inoculado con 0,5mL de solución salina estéril. Al mes de la inoculación los ratones de cada grupo experimental fueron sacrificados.
Por cada ratón se obtuvo sangre por punción cardiaca (para la obtención de suero y posterior diagnóstico serológico), y los siguientes órganos para examen directo y cultivo: hígado, bazo, pulmón y testículo. Una fracción de cada órgano fue suspendida en solución salina estéril y guardada a -20°C para la extracción de ADN y posterior diagnóstico molecular por PCR anidada.
Los 10 ratones adicionales fueron inoculados con la fase de micelio, tomando como referencia los patrones de McFarland 2, 4, 6, 8 y 10 partículas/mL (2 ratones por cada concentración); estos fueron sacrificados al mes para la obtención de sangre completa para ser empleada en el diagnóstico molecular.
Se incluyeron en el estudio muestras de biopsias de pacientes con diagnóstico comprobado de esporotricosis cutánea fija (3 congeladas y 6 embebidas en parafina), con el fin de evaluar la eficacia del método molecular estandarizado en este estudio en la detección del hongo en este tipo de material.
Diagnóstico micológicoExamen directoSe llevó a cabo por dilaceración de una pequeña porción de cada órgano, con formol al 10% y con Clorazol Black E.
CultivoLa muestra fue seccionada en pequeños trozos y sembrada en 4 tubos conteniendo agar Sabouraud dextrosa con cloranfenicol. Los tubos se incubaron a temperatura ambiente con lecturas cada 8 días hasta el mes de cultivo.
Diagnóstico inmunológicoSe llevó a cabo la detección de anticuerpos contra S. schenckii en los sueros de ratones por ensayo de inmunodifusión doble (IDD) con el antígeno metabólico del hongo obtenido en el Laboratorio de Micología del Instituto de Biomedicina13.
Diagnóstico por PCR anidadaLa extracción del ADN del hongo a partir de sus 2 fases, micelio y levadura, se llevó a cabo a través del kit comercial Wizard Genomic DNA Purification. Para la extracción del ADN de los órganos extraídos (hígado, bazo, pulmón y testículo) de los ratones inoculados, se procedió a pesar entre 20-40mg de tejido, añadiéndose 600μL de EDTA (50mM) pH 8. Se homogeneizó y posteriormente se añadieron 5μL de liticasa (20mg/mL). Se continuó el procedimiento según el protocolo del kit antes mencionado. El ADN obtenido fue almacenado a −8°C. Se evaluó su calidad mediante electroforesis en gel de agarosa al 1%, tinción con bromuro de etidio y visualización bajo luz UV. El desarrollo de la reacción tipo PCR anidada se llevó a cabo según los trabajos de Hu et al.8 con algunas modificaciones. Los cebadores utilizados son específicos de la secuencia del gen 18S ARNr de S. schenckii (Gen Bank M85053) y no del ADN humano u otros patógenos humanos comunes. Las secuencias de los cebadores externos para la primera reacción eran SS1 5′- CTC GTT CGG CAC CTT CACA CG -3′; SS2 5′- CGC TGC CAA AGC AAC GCG GG -3′, cebadores complementarios a las posiciones 1007 a 1026 y 1311 a 1292 respectivamente, de la secuencia del GenBank que definen un amplicón de 305 nucleótidos. Las secuencias de los cebadores internos de la segunda reacción eran SS3 5′- ACT CAC CAG GTC CAG ACA CGA TG -3′; SS4 5′- CGC GGG CTA TTT AGC AGG TTA AG -3′, cebadores complementarios a las posiciones 1146 a 1168 y 1297 a 1275 respectivamente, delimitando una secuencia de 152 nucleótidos. En nuestro estudio se empleó como control positivo ADN de S. schenckii cepa 4526 en su fase de micelio, a una concentración total de 2,7534μg/mL, y como control negativo ADN de tejido humano (DNA K562, PROMEGA) a una concentración de 655μg/mL. La mezcla de la primera reacción se llevó a cabo con MgCl2 4,2mM, dNTPs 2mM, cebador SS1 y SS2 100pmol/μL de cada uno, Tag DNA 0,38U, buffer de Tag 1x, ADN entre 10-0,05ng/μL. Para la segunda reacción se emplearon las mismas condiciones, cambiando solo los cebadores por SS3 y SS4. En ambas reacciones se ensayó con un volumen final de 15μL. La amplificación se llevó a cabo en un termociclador PTC-100 (MJ Research, Inc.) bajo las siguientes condiciones de amplificación (con las mismas condiciones para la primera y segunda reacción): un ciclo de 95 ¿C durante 5 minutos, 40 ciclos de 95°C durante un minuto, 63°C durante un minuto y 72°C durante un minuto. Extensión final de 72°C durante 10 minutos. Se realizó la electroforesis de los productos de amplificación en gel de agarosa al 2% a 80V, que se tiñó con bromuro de etidio. La visualización y el registro se llevaron a cabo con un transiluminador de luz UV.
Los resultados del diagnóstico de las muestras por órganos fueron analizados en valores porcentuales.
ResultadosLos resultados del diagnóstico micológico obtenidos a partir de las muestras de ratones inoculados con las 2 fases morfológicas del hongo a diferentes concentraciones no mostraron mayores diferencias.
De los ratones inoculados con la fase de micelio, de un total de 60 órganos se procesaron 40 (5 ratones murieron antes de la fecha de sacrificio); con la fase de levadura se evaluaron 48 muestras (3 ratones murieron antes de la fecha de sacrificio).
La determinación de la presencia del hongo en los órganos (hígado, bazo, pulmón y testículo) de los ratones inoculados con la fase de micelio mostró al examen directo un 37,5% (15/40) de positividad; 25 muestras fueron negativas (62,5%) (tabla 1). Las estructuras observadas en el examen directo fueron levaduras ovales. Los cultivos de todas estas muestras fueron positivos (100%), obteniéndose a temperatura ambiente colonias filamentosas de color beige a marrón. Su evaluación microscópica con azul de lactofenol mostró hifas delgadas hialinas, abundantes conidios sésiles dispuestos lateralmente a lo largo de las hifas, y en rosetas en el ápice de las células conidiógenas, características compatibles con el género del complejo Sporothrix. Estudios bioquímicos y moleculares son necesarios para corroborar la especie12.
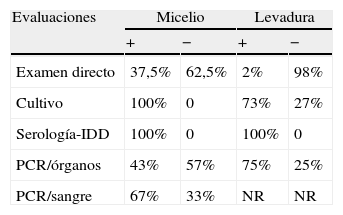
Porcentaje de positividad en el diagnóstico de la esporotricosis experimental en ratones por estudio micológico, serológico y molecular
| Evaluaciones | Micelio | Levadura | ||
| + | − | + | − | |
| Examen directo | 37,5% | 62,5% | 2% | 98% |
| Cultivo | 100% | 0 | 73% | 27% |
| Serología-IDD | 100% | 0 | 100% | 0 |
| PCR/órganos | 43% | 57% | 75% | 25% |
| PCR/sangre | 67% | 33% | NR | NR |
IDD: inmunodifusión doble; NR: no realizado; PCR: reacción en cadena de la polimerasa.
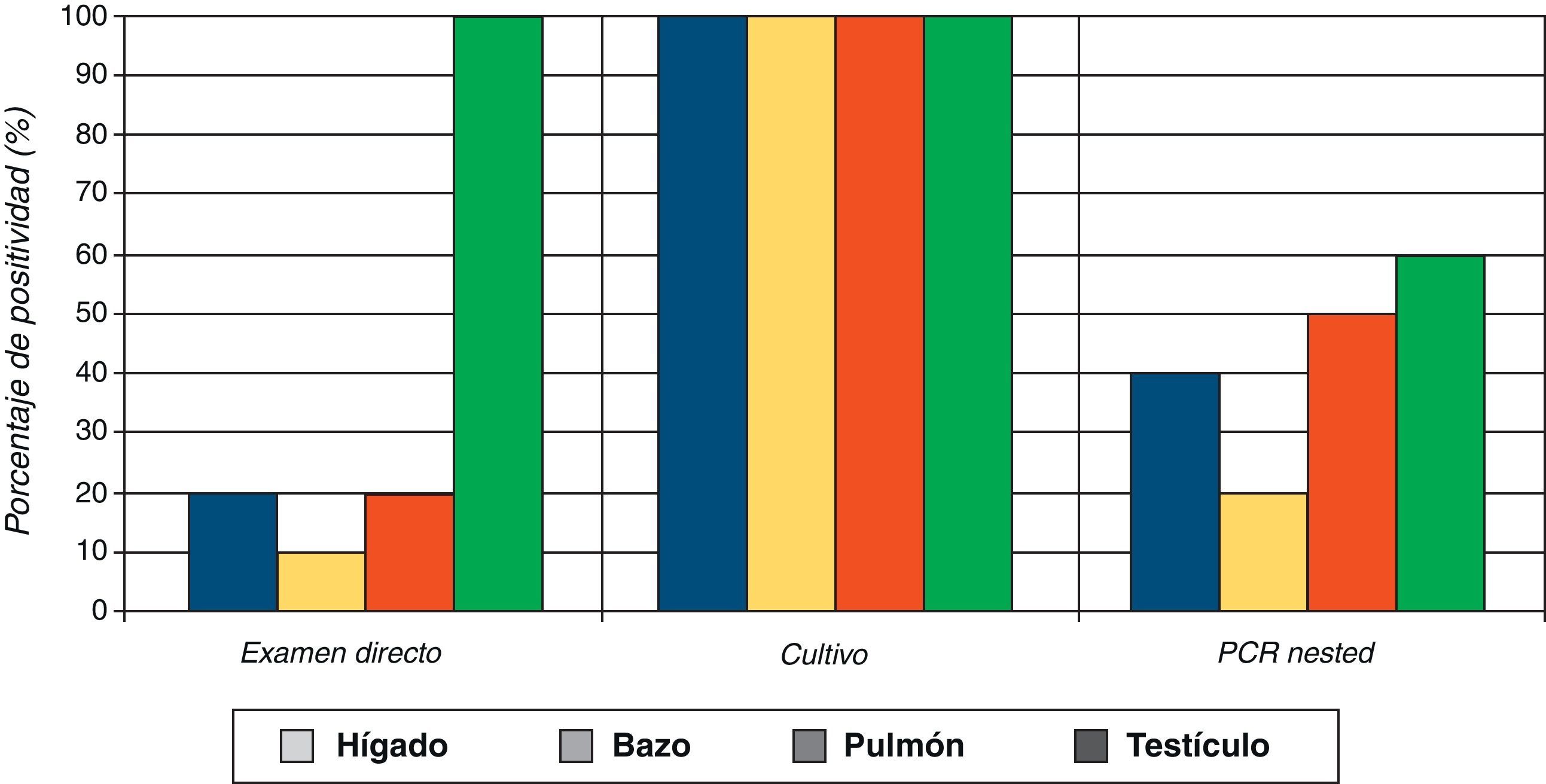
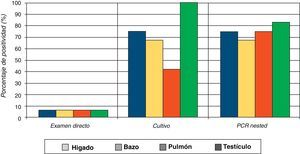
Los resultados obtenidos por cada órgano a partir de las diferentes muestras de los ratones inoculados con la fase de micelio del hongo mostraron en el examen directo del testículo un 100% de resultados positivos, seguido por hígado, pulmón y bazo (fig. 1). Contrariamente, con la fase de levadura se obtuvo en el examen directo solo un 2% de positividad (un resultado positivo de testículo) (tabla 1).
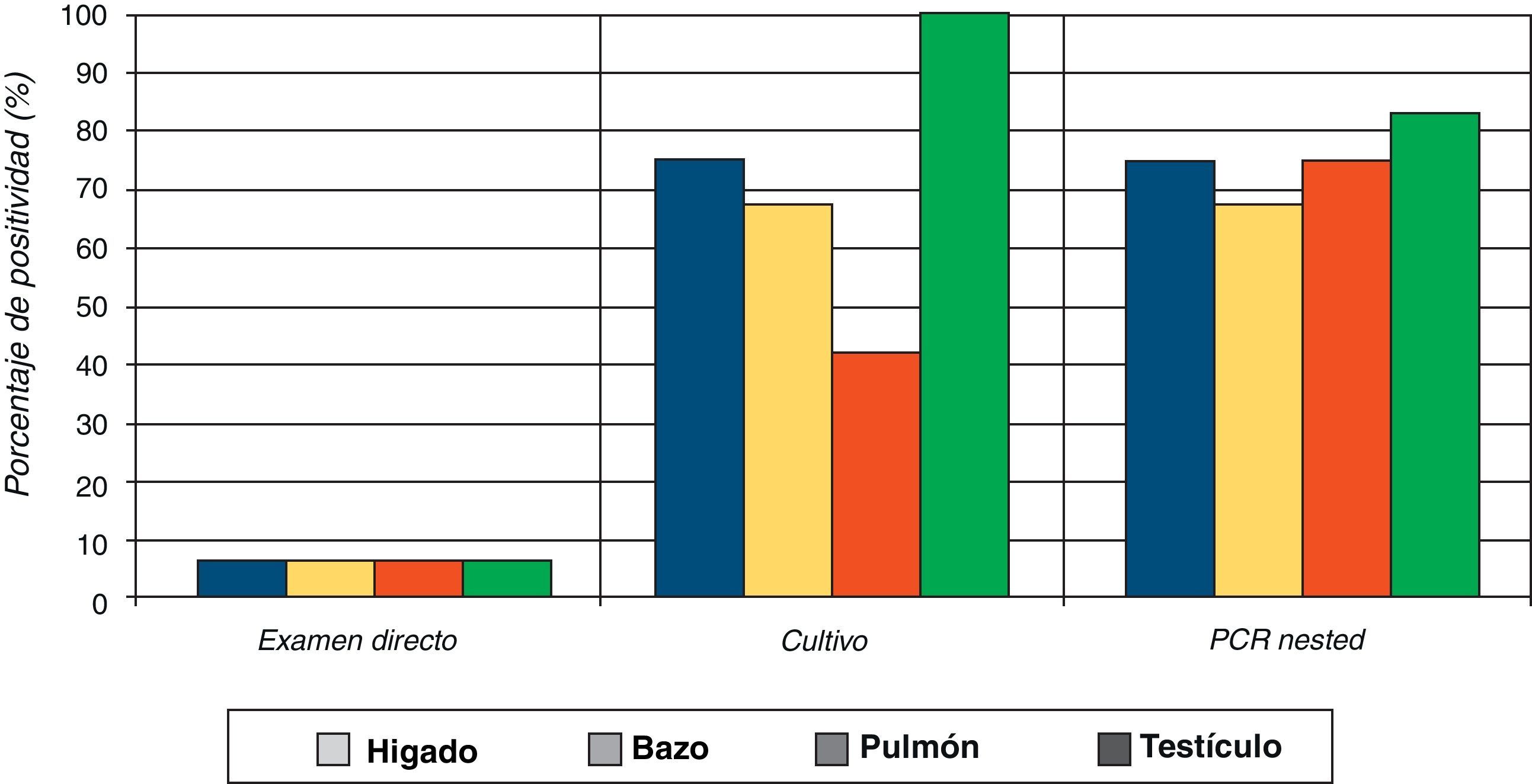
Los resultados del aislamiento del hongo por cultivo a partir de las muestras de los diferentes órganos de los ratones inoculados con levadura mostraron un 73% (35/48) de resultados positivos; 13 fueron negativos (27%). Similarmente a los resultados obtenidos para la fase de micelio con el cultivo, el órgano de donde se aisló con mayor frecuencia el hongo fue el testículo, seguido por hígado, bazo y pulmón (fig. 2). Se corroboró la morfología macro y microscópica de todas las colonias, las cuales fueron compatibles con el género del complejo Sporothrix.
En el estudio molecular por PCR anidada de los diferentes órganos de ratones inoculados con micelio, se encontró que la menor concentración de ADN con la cual se obtuvo reacción positiva fue de 0,0861ng/μL, y de 0,0622ng/μL para la fase de levadura. De las 40 muestras de los diferentes órganos de ratones inoculados con la fase de micelio, se detectó el ADN del hongo por la técnica PCR anidada en 17 casos (43%), obteniéndose 23 (57%) con resultados negativos.
De las muestras de órganos de ratones inoculados con la fase de levadura, se obtuvieron 36 resultados positivos y 12 negativos, lo cual representó el 75 y 25% respectivamente. En las pruebas moleculares, las muestras de testículo continuaron presentando el mayor número de resultados positivos, seguido por pulmón, hígado y bazo (figs. 1 y 2).
La evaluación molecular por PCR anidada de las muestras de sangre completa de los ratones inoculados con la fase de micelio mostró 6/9 resultados positivos (67%) (tabla 1).
La evaluación serológica por la técnica IDD de los sueros de los ratones inoculados con micelio y levadura mostraron bandas de precipitinas frente al antígeno de S. schenckii, obteniéndose un 100% de positividad (tabla 1).
De 9 biopsias de pacientes con diagnóstico micológico previo de esporotricosis incluidas en este estudio para el diagnóstico molecular, 3 de las mantenidas por congelación resultaron negativas por PCR anidada, mientras que 5/6 de las biopsias embebidas en bloques de parafina fueron positivas, lo cual representó el 83% de positividad.
DiscusiónEn la actualidad es aún un reto en la mayoría de los laboratorios de Micología la estandarización, implementación y validación de las pruebas moleculares para el diagnóstico de las micosis endémicas y oportunistas. La estandarización y comparación de estas técnicas con los métodos diagnósticos convencionales nos podrían permitir evaluar el alcance e impacto que estas nuevas metodologías tienen en el estudio de las micosis que más afectan a la población. En nuestro trabajo se realizó la inducción de la esporotricosis experimental en ratones, con las 2 fases morfológicas del hongo (micelio y levadura), con el objeto de llevar a cabo posteriormente el diagnóstico micológico (examen directo y cultivo), molecular por PCR anidada y la evaluación serológica, resultados que fueron posteriormente analizados y comparados.
Las 2 fases morfológicas del hongo inoculadas en los ratones a concentraciones crecientes para la inducción de la esporotricosis experimental no mostraron diferencias en cuanto al grado de afectación y diseminación de la enfermedad. La levadura es la fase parasitaria del hongo en el tejido y ha sido empleada con frecuencia para el desarrollo de la esporotricosis experimental1,5,7,11,14. Por otra parte, la fase de micelio, una vez que ha penetrado en el tejido del huésped, requiere de un periodo para su conversión de hifa a levadura, sin embargo, pese a estas diferencias, los 2 grupos de ratones infectados mostraron un desarrollo bastante similar de las lesiones, observándose nódulos internos, hepatoesplenomegalia y orquitis, pero los ratones inoculados con el micelio mostraron un mayor número de nódulos a lo largo de la cola, y en algunos casos estos estaban ulcerados. Esto podría estar relacionado con el mayor grado de respuesta inmune del tejido del ratón ante la fase saprofítica del hongo, o a una mayor capacidad del micelio para la invasión y degradación del tejido.
Por otra parte, los resultados de la detección del hongo por examen directo en las muestras de los órganos de ratones inoculados con la fase de micelio presentaron un mayor porcentaje de resultados positivos (37,5%), en comparación a los resultados obtenidos con la fase de levadura (2%). En el diagnóstico por cultivo, fueron también las muestras provenientes de ratones inoculados con el micelio las que mostraron un 100% de resultados positivos. Estos mayores porcentajes de positividad obtenidos en el examen directo y cultivo se correlacionan con la severidad de las lesiones que presentaron los ratones inoculados con el micelio. También se observó que el mayor porcentaje de resultados positivos, tanto en el examen directo como en el cultivo, fue obtenido con las muestras de testículos, independientemente de la fase del hongo que se empleara para la inoculación, demostrándose, una vez más, el tropismo de S. schenckii por este órgano en la infección experimental10.
Los resultados obtenidos por el estudio de PCR anidada, contrariamente a lo conseguido con el diagnóstico micológico, mostraron que las muestras de órganos de ratones inoculados con la fase de levadura dieron un mayor porcentaje de positividad (75%) que los encontrados en la fase de micelio (43%), resultados estos de difícil interpretación, y aunque se valoró la cantidad y calidad del ADN total extraído de las muestras, hay que tomar en cuenta que la mayor cantidad de este ADN obtenido proviene de las células del ratón y no del ADN del hongo.
Sin embargo, el mayor porcentaje de resultados positivos obtenido en el estudio molecular en las muestras con el inóculo de levadura se correlaciona con los resultados de otros investigadores donde se emplea la fase parasitaria del hongo en el modelo experimental para evaluar el diagnóstico por PCR anidada, y señalan la alta sensibilidad y especificidad de esta técnica en el diagnóstico de la esporotricosis9, así como en otras micosis6.
Por otra parte, los resultados que se obtuvieron del estudio molecular a partir de las muestras de sangre completa de los ratones inoculados con las concentraciones crecientes del micelio mostraron un mayor porcentaje de positividad (67%) que el obtenido con las muestras de órganos (43%), demostrándose que con la inoculación con la fase de micelio, la captación del hongo por estudio molecular fue más eficaz en la sangre completa que en los órganos evaluados. Estos resultados podrían aportar cierta confianza en la técnica molecular en el diagnóstico de casos de septicemia por el hongo.
La evaluación molecular de las muestras adicionales incluidas de biopsias embebidas en parafina dio buenos resultados (83%). Una buena sensibilidad también fue obtenida por esta técnica en la detección de Histoplasma capsulatum en muestras de bazo de ratones embebidas en parafina4. En las biopsias que fueron mantenidas por congelación, el estudio molecular fue negativo. Sin embargo, otros trabajos señalan una gran eficacia en la detección del hongo en este tipo de muestras16. Posiblemente, la fracción de la biopsia congelada y procesada en nuestro estudio no fue suficiente para la captación del ADN del hongo.
La determinación de anticuerpos específicos contra el antígeno de S. schenckii por IDD mostró 100% de positividad con los sueros de ratones inoculados con ambas fases morfológicas del hongo, demostrando una vez más la eficacia de esta prueba en la detección de anticuerpos y su gran utilidad en la orientación diagnóstica de la enfermedad. Su empleo ha sido sugerido en la orientación diagnóstica de los casos de esporotricosis cutánea por los buenos resultados obtenidos con respecto a la especificidad y sensibilidad2. Sin embargo, se debe tener presente que en este tipo de técnica inmunológica, el resultado depende del estado inmunológico del huésped y de la forma clínica que presente la enfermedad2,8.
En base a los resultados obtenidos en este estudio, se demostró la alta eficacia que sigue teniendo el cultivo en el estudio de la esporotricosis experimental y la captación de anticuerpos específicos, en comparación con la evaluación microscópica y la técnica de PCR anidada. El estudio molecular resultó ser más eficaz en el diagnóstico de las muestras de órganos infectados con la fase de levadura, y las muestras de órganos infectados con la fase de micelio dieron un mayor porcentaje de positividad en el diagnóstico micológico (examen directo y cultivo).
Podemos concluir que el estudio micológico por cultivo y examen directo fue más eficaz para el diagnóstico de la esporotricosis experimental diseminada en ratón que el estudio molecular por PCR anidada. Y de acuerdo con los resultados obtenidos con la fase morfológica de levadura, la técnica molecular también podría ser considerada para la detección del hongo en las muestras de órganos, así como en sangre completa y biopsias embebidas en parafina.
Por otra parte, la prueba de IDD (en la que se obtuvieron líneas de precipitinas en todos los casos), independientemente de la fase morfológica del hongo empleada para la inoculación, sigue siendo una herramienta altamente eficaz en la captación de anticuerpos específicos contra el hongo, y para la orientación diagnóstica de la enfermedad.
En este trabajo se demuestra una mayor eficacia del cultivo, el examen directo, así como de la captación de anticuerpos específicos contra el hongo, en comparación con la prueba de PCR anidada en el estudio de la esporotricosis experimental diseminada en ratón. Futuros estudios son necesarios para continuar la evaluación de los métodos moleculares en el diagnóstico de esta y otras micosis.
FinanciaciónTrabajo financiado por el Proyecto N.° PI-09-6588-2006 del Consejo Desarrollo Científico y Humanístico-Universidad Central de Venezuela (CDCH-UCV), Caracas, Venezuela.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A las Doctoras Isabel Tapia, María Antonia de la Parte y Nieves González, Profesoras Insignes de la Escuela de Medicina de la Universidad Central de Venezuela, por su disposición y valioso apoyo brindado.