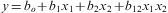El uso de basidiomicetes para la remoción de metales es una alternativa con respecto a los métodos tradicionales, básicamente porque la biomasa actúa como un intercambiador natural al remover metales en solución.
ObjetivoDesarrollar un bioadsorbente laminar empleando el hongo basidiomicete con mayor resistencia al cadmio (Cd), al níquel (Ni) y al plomo (Pb).
MétodosSe valoró la tolerancia de Trametes versicolor, Pleurotus ostreatus y Phanerochaete chrysosporium frente a concentraciones ascendentes de sulfato de sulfato de cadmio, acetato de plomo y cloruro de níquel. Se desarrolló un bioadsorbente a base de láminas de polietileno con biomasa fúngica, que se evaluó en columnas de burbujeo empleando agua residual sintética con los 3 metales con una concentración final de 300mg/l. Finalmente, con un experimento complementario en matraces Erlenmeyer, se valoró el efecto de mayor cantidad de biomasa sobre la eficiencia de remoción.
ResultadosEl hongo P. chrysosporium fue la cepa más tolerante a C4H6O4Pb (10.000mg/l), a Cl2Ni (300mg/l) y CdSO4·8H2O (1.500mg/l). En el reactor y bajo condiciones no ligninolíticas, el hongo removió el 69% de la demanda química de oxígeno, produjo enzimas como lignino peroxidasa (0,01U/l) y manganeso peroxidasa (0,6U/l) y se observó la acumulación de los metales en la pared. Al incrementar la biomasa a 1,6 (p/v) se favoreció la bioadsorción de los metales en la mezcla (el 57% para el Pb, el 74% para el Cd y el 98% para el Ni) y por separado (el 95% para el Pb, el 60% para el Cd y el 56% para el Ni). Se observó una competencia entre el Ni y el Pb por los ligandos de la pared.
ConclusiónSe desarrolló un novedoso sistema laminar a base de biomasa viable de P. chrysosporium que posee gran área superficial y tolera elevadas concentraciones de Cd, Ni y Pb, como alternativa para la remoción de metales en aguas.
The use of basidiomycetes for metal removal is an alternative to traditional methods. In this, the biomass acts as a natural ionic exchanger removing metals from solution.
ObjectiveTo develop a laminar biosorbent using a basidiomycete fungus resistant to high Cd, Ni and Pb concentrations.
MethodsThe tolerance of Trametes versicolor, Pleurotus ostreatus and Phanerochaete chrysosporium was evaluated using increasing concentrations of the heavy metal salts, cadmium sulphate, lead acetate and nickel chloride. A biosorbent system was developed based on polyethylene sheets with a fungal biomass. It was evaluated in bubble columns using synthetic wastewater with the 3 metal salts at a rate of 300mg/l. Finally, in a complementary experiment using shake flasks, the effect of a higher amount of biomass related to the metal removal efficiency was evaluated.
ResultsP. chrysosporium strain was more tolerant to C4H6O4Pb (10,000mg/l), Cl2Ni (300mg/l) and CdSO4·8H2O (1,500mg/l). In a reactor, under non-ligninolytic conditions, the fungus removed 69% of the chemical oxygen demand and produced enzymes such as LiP (0.01U/l) and MnP (0.6U/l.). An accumulation of metals in the wall was observed. By increasing the biomass to 1.6 (w/v), the metal biosorption was favored in the mixture (57% Pb, 74% Cd, and 98% Ni) and separately (95% Pb, 60% Cd, and 56% Ni). Competition between Ni and Pb by ligands of the wall was observed.
ConclusionA novel laminar system based on P. chrysosporium viable biomass was developed. It has a large surface area and tolerance to high concentrations of Cd, Ni and Pb. It seems to be an alternative for the removal of metals from water.
A partir de actividades industriales, como electroplateado, pinturas, galvanoplastia, baterías, curtidos, textiles, entre otras, se generan aguas residuales con elevada concentración de metales pesados, sustancias persistentes con tendencia a la acumulación y a la magnificación en diferentes niveles tróficos8. Para su remoción se han utilizado diversos adsorbentes naturales a base de subproductos agroindustriales y microorganismos como bacterias, algas y hongos30, y han sido de especial interés los hongos de la podredumbre blanca por tener mayor capacidad de remoción, de acuerdo con sus características fisiológicas: a) su pared celular contiene subunidades del aminoazúcar N-acetilglucosamina unidas por enlaces glucosídicos β 1–4, que pueden remover los metales al formar uniones con ciertos grupos funcionales, como carboxilo y amino13,23; b) su crecimiento in vitro se puede controlar para favorecer la producción de biomasa en forma de una extensa red miceliar con elevada área superficial, y actúa como un intercambiador natural12; c) toleran y transforman una amplia variedad de compuestos recalcitrantes, por la producción de enzimas ligninolíticas como lacasa (E.C. 1.10.3.2), manganeso peroxidasa (MnP) (E.C. 1.11.1.13), lignino peroxidasa (LiP) (E.C. 1.11.1.14) y versátil peroxidasa (E.C. 1.11.1.16). Estas enzimas pueden oxidar la lignina y los anillos aromáticos con similitud estructural, y se inducen por parte de concentraciones variables de metales21,22. Por esta razón, también podrían estar implicadas en la tolerancia a metales, ya que participan en la producción de sustancias orgánicas, como melaninas que se han relacionado con la remoción de éstos6.
Diferentes autores han reportado el uso de la biomasa fúngica libre, inmovilizada, viable e inactiva para la adsorción y la detoxificación de metales. El hongo Trametes versicolor se inmovilizó en perlas de carboximetilcelulosa para la adsorción de cadmio (Cd), y se observó que después de 1h se removieron 153mg/l a 25°C31. El efecto de la mezcla de metales sobre la capacidad adsortiva y la competencia por los grupos funcionales también se estudió empleando la biomasa viva y muerta de Phanerochaete chrysosporium inmovilizada en alginato de sodio. Se demostró que tiene diferente afinidad por el Cd y el mercurio (Hg), ya que al emplear la biomasa viable se removieron 70mg/l de Cd y 75mg/l de Hg, mientras que la biomasa inactiva perdió sitios de unión al adsorber solamente 40mg/l y 50mg/l para el Cd y el Hg, respectivamente14. Un fenómeno similar se describió para el mismo hongo, pero empleando pellets de biomasa para la bioadsorción de Cd y plomo (Pb) en mezcla: se presentó una competencia entre los iones por los sitios de adsorción26. La remoción combinada entre biomasa y soporte también se demostró en un estudio con T. versicolor inmovilizado en perlas de carboximetilcelulosa para la remoción de cobre (Cu), Pb y zinc. De acuerdo con los resultados, el soporte y la biomasa actuaron de forma complementaria, y permitieron mayores niveles de remoción con células muertas inmovilizadas (1,84mg/l de Cu, 1,11mg/l de Pb y 1,67mg/l de zinc)4.
En Colombia, la legislación que regula la calidad de las aguas residuales exige como límites de vertimiento en aguas residuales industriales concentraciones de 0,2mg/l, 0,003mg/l y 0,1mg/l para el níquel (Ni), el Cd y el Pb, respectivamente, pero en muchos casos, los estándares no se cumplen y se realiza el vertido al alcantarillado o a cuerpos receptores con concentraciones elevadas, lo que se convierte en un grave problema ambiental y se asocia con la magnificación a través de las cadenas tróficas. Por esto, es interesante evaluar microorganismos con características fisiológicas especiales para el tratamiento de este tipo de residuos7. En estudios previos, se ha demostrado que la biomasa viable de P. chrysosporium inmovilizada en espuma de poliuretano removió 1.537mg/l del cromo total presente en el agua residual de curtido de pieles, y se la catalogó como una cepa tolerante al sulfato de cromo, ya que soportó concentraciones de 85.000mg/l12.
Por esta razón, en el presente estudio se utilizó P. chrysosporium, Pleurotus ostreatus y T. versicolor, y se los enfrentó a diferentes concentraciones de Cd, Pb y Ni con el fin de seleccionar la cepa más tolerante y desarrollar un sistema híbrido laminar como alternativa no convencional para el tratamiento de aguas residuales industriales con elevadas concentraciones de los 3 metales.
Materiales y métodosMicroorganismosLos hongos P. ostreatus, T. versicolor (Laboratorio de Biotecnología Aplicada de la Pontificia Universidad Javeriana, Bogotá, Colombia) y P. chrysosporium (Laboratorio de Compuestos Xenobióticos, Centro de Investigaciones y de Estudios Avanzados del Instituto Politécnico Nacional, D. F., México) se reactivaron en cultivos de 8días a 30°C en agar extracto de salvado con la siguiente composición (en g/l): glucosa, 10; peptona, 5; extracto de levadura, 2; KH2PO4, 0,1; MgSO4·7H2O, 0,05; MnSO4·H2O, 0,076; agar, 15; extracto líquido de salvado de trigo, 17525.
Concentración máxima tolerada para C4H6O4Pb, Cl2Ni y CdSO4·8H2OLa tolerancia de las 3 cepas a diferentes concentraciones de Cd, Ni y Pb se realizó por medio de 2 experimentos identificados como prueba de tolerancia a bajas concentraciones (PTBC) y prueba de tolerancia a elevadas concentraciones (PTEC). En las PTBC se evaluó un rango de concentraciones entre 0,02 y 1,5mg/l midiendo el crecimiento en mm a los 10 días de incubación a 30°C. Por el contrario, en las PTEC se cuantificó diariamente el crecimiento radial durante el mismo tiempo y las concentraciones evaluadas oscilaron entre 15 y 11.000mg/l. El montaje se realizó empleando cajas de Petri de 50mm de diámetro que contenían 10ml de agar Radha, cuya composición fue glucosa de 2,5g/l, KH2PO4 de 2,0g/l, NH4Cl de 0,050g/l, MgSO4·7H2O de 0,5g/l, CaCl2·2H2 de 0,01g/l, tiamina de 100μg/l y agar de 15g/l. A este medio se añadieron 10ml de una solución de elementos traza y el pH final fue de 6,827. Al finalizar el proceso de esterilización, se añadieron en concentraciones ascendentes las sales de cloruro de Ni (NiCl3), sulfato de Cd (CdSO4·8H2O) y acetato de Pb (CH3COOPb). La inoculación se realizó al colocar un disco de agar, con los hongos previamente reactivados, en cada una de las cajas y al incubarlas a 30°C durante 10 días. Como control negativo se utilizó el medio Radha libre de metales. La concentración máxima tolerada (CMT) se definió como el valor más alto de cada metal con el que se observó el crecimiento de los hongos; la concentración mínima inhibitoria se definió como la concentración más baja que inhibía el crecimiento fúngico.
Producción de biomasa para la inmovilización del soporteSe tomaron 10 discos de agar colonizados con micelio, se inocularon en matraces Erlenmeyer de 250ml, que contenían 50ml de caldo de extracto de salvado de trigo, y se incubaron durante 8 días a 30°C y a 120rpm. Al finalizar la propagación en el líquido, la biomasa se recuperó por filtración y se disgregó en un molino eléctrico durante 5min a 1.000rpm. El homogeneizado se resuspendió en agua destilada estéril hasta completar un volumen de 50ml y se almacenó refrigerado a 4°C para emplearlo como inóculo en la elaboración de los bioadsorbentes laminares.
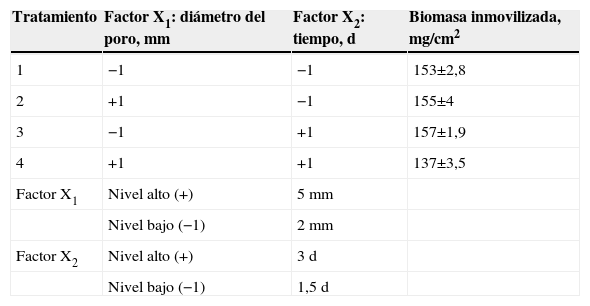
Efecto del tamaño del poro del soporte y el tiempo de colonización sobre la cantidad de biomasa inmovilizadaPara evaluar el efecto del tiempo de colonización y el diámetro del poro de las mallas sobre la cantidad de biomasa fúngica inmovilizada, se realizó un diseño experimental 22 (tabla 1)19. Como variable de respuesta, se evaluaron los mg/cm2 de biomasa inmovilizada sobre las láminas. El análisis de datos se realizó usando los programas SAS 9.0® y Desing Expert 6.0®, y los resultados se trataron con un modelo empírico que relaciona las respuestas cuantificadas con los factores evaluados y sus respectivos niveles. Para un diseño de 2 factores, el modelo de primer orden fue el siguiente:
Efecto del diámetro del poro y el tiempo de colonización sobre la cantidad de biomasa inmovilizada por medio de un diseño factorial 22
| Tratamiento | Factor X1: diámetro del poro, mm | Factor X2: tiempo, d | Biomasa inmovilizada, mg/cm2 |
| 1 | −1 | −1 | 153±2,8 |
| 2 | +1 | −1 | 155±4 |
| 3 | −1 | +1 | 157±1,9 |
| 4 | +1 | +1 | 137±3,5 |
| Factor X1 | Nivel alto (+) | 5mm | |
| Nivel bajo (−1) | 2mm | ||
| Factor X2 | Nivel alto (+) | 3 d | |
| Nivel bajo (−1) | 1,5 d |
Donde y correspondió a la variable dependiente, bo fue el intercepto, b1 y b2 fueron los coeficientes lineales, y x1 y x2 fueron los factores o variables independientes.
Elaboración del bioadsorbente laminar para el diseño factorial y los reactores de 750mlEn el diseño experimental se utilizaron mallas de 5×5cm colocadas sobre cajas de Petri de 9cm que contenían 15ml de agar extracto de salvado de trigo. Se inocularon con 1,5ml de la suspensión de biomasa fúngica y se incubaron a 30°C durante 36 y 72h.
La producción del bioadsorbente para los reactores se realizó de manera similar que la de las mallas pequeñas. Sin embargo, se realizó una modificación que consistió en utilizar mallas de 20×30cm colocadas sobre bandejas de aluminio de 35×25cm que contenían 150ml del mismo agar. Posteriormente, se inocularon con 50ml de la suspensión de biomasa y se incubaron a 30°C durante 72h. El peso seco de la biomasa final en cada bioadsorbente se realizó por medio del secado de las mallas con la biomasa a 80°C durante 12h y por medio del cálculo de los mg/cm2 según la diferencia de pesos, teniendo en cuenta el peso inicial de las mallas.
Curvas de remoción para C4H6O4Pb, Cl2Ni y CdSO4·8H2O a 300mg/l en la columna de burbujeoSe utilizaron columnas de vidrio de 50cm de largo y 5cm de diámetro interno. Cada columna se inoculó con 2 mallas de 20×30cm colonizadas con biomasa fúngica y 525ml de medio Radha suplementado con la mezcla de metales a 300mg/l (agua residual sintética). La temperatura y la aireación se mantuvieron constantes a 30°C y a 1 l/min. Los muestreos se realizaron cada 24h para determinar el pH, los azúcares reductores18, la actividad enzimática tipo MnP17 y LiP29, la demanda química de oxígeno (DQO)10 y el recuento de bacterias heterótrofas totales9. Las mallas colonizadas se secaron para calcular el peso seco final y realizar su estudio en el microscopio electrónico de barrido; se empleó un equipo JEOL JSM-6.300® adaptado a un detector de rayos X por dispersión de energía Noral Voyager II software 1100/1110® para llevar a cabo el microanálisis de los metales en porcentaje atómico por la técnica de espectrometría de dispersión de energía de rayos X (EDX).
Además, para demostrar si la biomasa fúngica libre tenía mayor afinidad por alguno de los metales, se realizó un experimento complementario empleando matraces Erlenmeyer de 500ml, que contenían 170ml de agua residual sintética, y metales por separado y en mezcla a una concentración final de 300mg/l. Cada uno de éstos se inoculó con 1,6 (p/v) de biomasa y se incubaron durante 2 días a 30°C y a 120rpm. Se evaluaron los niveles de los metales pesados por absorción atómica10, pH, azúcares y microscopia electrónica acoplada a EDX.
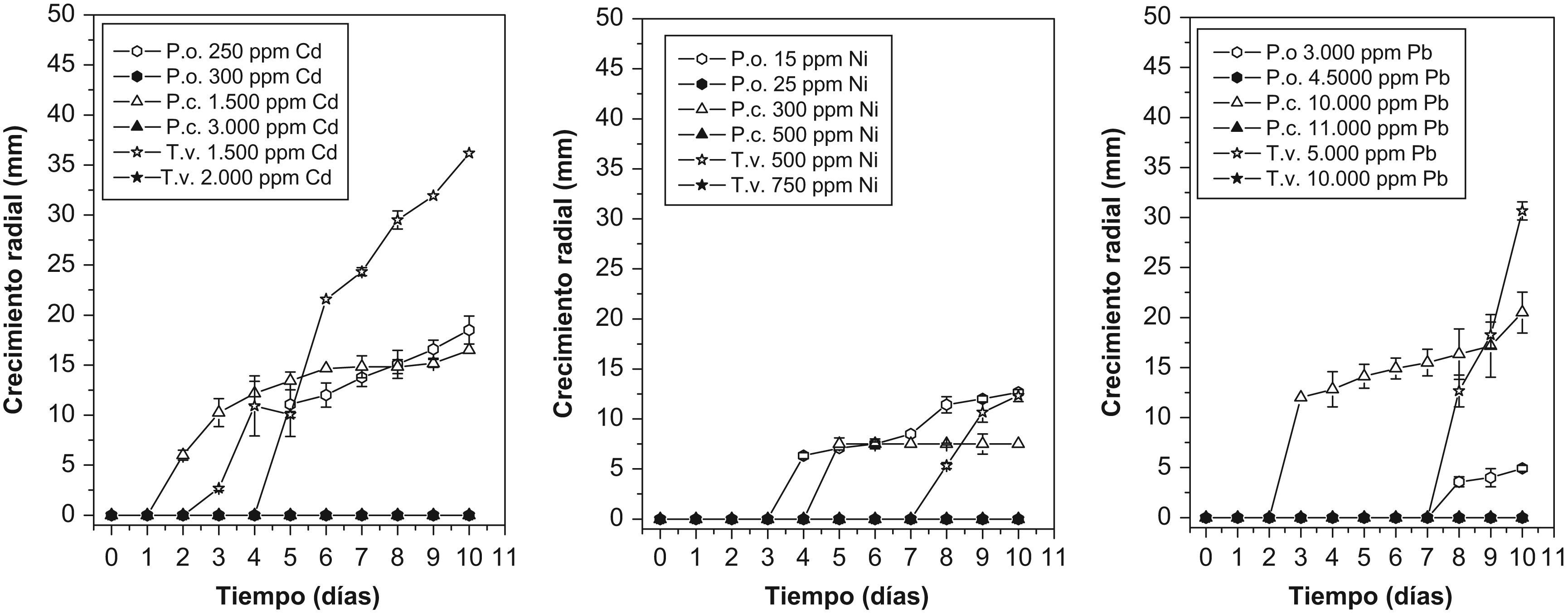
ResultadosEn las PTBC, los 3 hongos soportaron todas las concentraciones de CdSO4·8H2O, NiCl3 y CH3COOPb; asimismo, se observó un crecimiento radial de 50mm a los 10 días de incubación, sin alteración ni en la morfología macroscópica, ni en la microscópica, ni en la presencia de melaninas difusibles en agar Radha. Los resultados de las PTEC mostraron que la tolerancia variaba de acuerdo con el tipo de metal y la concentración; el NiCl3 fue el más tóxico para los 3 microorganismos con una CMT de 30, 300 y 500mg/l para P. ostreatus, P. chrysosporium y T. versicolor, respectivamente. Con respecto al CdSO4·8H2O, las concentraciones fueron de 250, 1.500 y 1.500mg/l para P. ostreatus, P. chrysosporium y T. versicolor, respectivamente (fig. 1). El metal más tolerado fue el CH3COOPb, con valores de 2.000, 10.000 y 5.000mg/l para el mismo orden de microorganismos. De acuerdo con el análisis estadístico, los hongos P. chrysosporium y T. versicolor fueron significativamente más tolerantes a los 3 metales (p<0,0001). Sin embargo, al comparar el tiempo de crecimiento en presencia del metal, se determinó que P. chrysosporium presentó el mejor crecimiento, en un menor tiempo que T. versicolor (p<0,0001), y alcanzó valores de 10, 9 y 12mm a los 5 y 2 días de incubación para el Ni, el Cd y el Pb, respectivamente. Por el contrario, el crecimiento máximo de T. versicolor fue de 5, 6 y 7mm a los 8, 4 y 10 días, respectivamente.
Determinación de la concentración máxima tolerada para CdSO4, Cl2Ni y C4H6O4Pb sobre agar Radha para los hongos de podredumbre blanca. Las viñetas oscuras corresponden a las concentraciones máximas toleradas y las claras a los valores de las concentraciones mínimas inhibitorias. Incubación durante 10 días a 30°C. Cd: sulfato de cadmio; Ni: cloruro de níquel; Pb: acetato de plomo; P.o.: Pleurotus ostreatus; P.c: Phanerochaete chrysosporium; T.v.: Trametes versicolor.
Los resultados del análisis de la variancia demostraron que el diámetro del poro de las mallas (X1) y el tiempo de colonización (X2) no tuvieron efecto significativo alguno ni por separado ni en conjunto sobre la cantidad de biomasa inmovilizada (p>0,0001), lo que determinó que el bioadsobente laminar se podía elaborar tanto en las mallas de 5mm como en las de 2mm, en 36 o 72h. No obstante, se seleccionó el tratamiento 3 por ser en el que retuvo la mayor cantidad de biomasa (157mg/cm2, tabla 1).
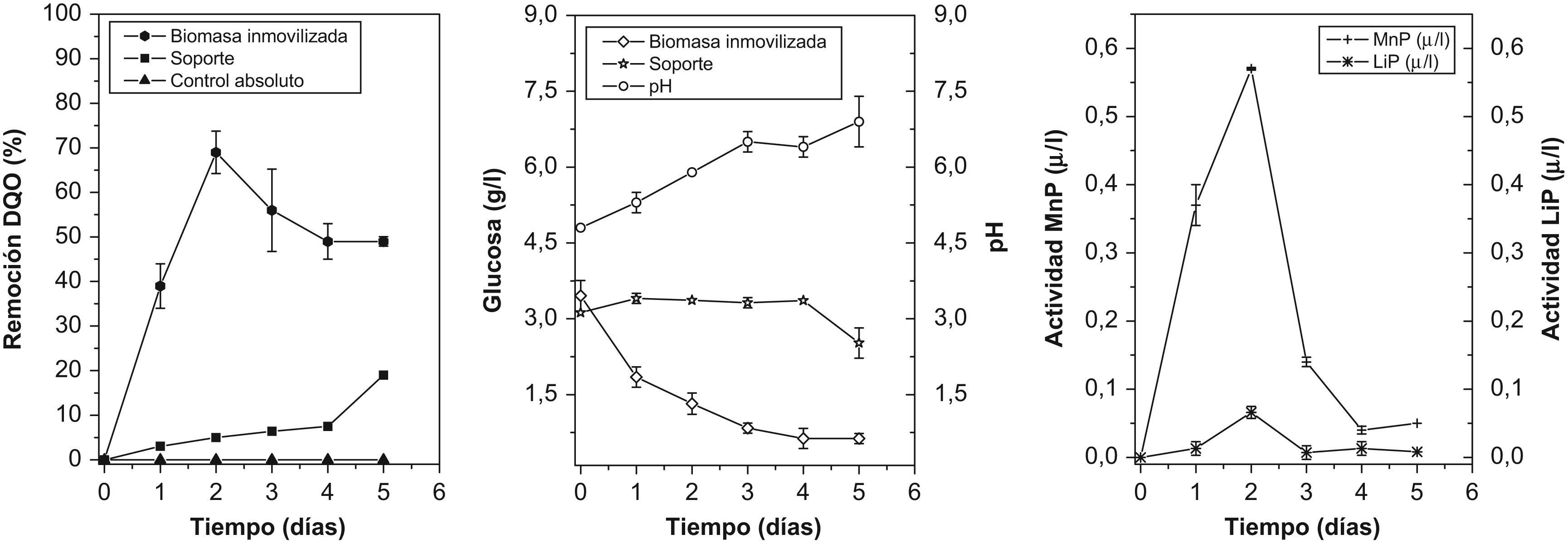
Curvas de remoción de cadmio, níquel y plomo en la columna de burbujeoCon respecto a la remoción de la DQO, el agua residual sintética tenía 1.700mg/l de DQO, y en su mayoría la aportó la fuente de carbono, nitrógeno y bacterias heterótrofas (25×102UFC/ml). Bajo estas condiciones, el bioadsorbente removió un 68% a las 48h; posteriormente, se presentó una disminución del porcentaje equivalente a un 15%, que pudo haberse asociado con el incremento de los heterótrofos (30×108UFC/ml) a medida que la biomasa fúngica absorbía los metales, lo que generó condiciones más favorables para las bacterias. Además, se presentó una correlación negativa significativa (p=0,0006) entre el porcentaje de remoción de la DQO y la glucosa residual hasta el segundo día, lo que demostró que la fuente de carbono se utilizó para mantener el metabolismo primario y favoreció la remoción de la materia orgánica representada en la disminución de la DQO. De la misma forma, la fuente de nitrógeno también se pudo asimilar e inmovilizar para la síntesis de compuestos como quitina, ADN, ARN y proteínas, entre otros. De acuerdo con estos resultados, el hongo inmovilizado fue más eficiente que el soporte solo, ya que en el control libre de biomasa la remoción no superó el 10% al quinto día. El consumo de glucosa se mantuvo constante hasta el cuarto día, en el que se presentó un descenso que pudo haber estado relacionado con el incremento de las bacterias heterótrofas (95×103UFC/ml). En el control absoluto (agua residual sin adición de microorganismos), no se presentó remoción de la DQO, la glucosa osciló entre 3,4 y 3,7g/l, y las poblaciones se mantuvieron durante todo el experimento en 10×102UFC/ml.
En la figura 2 se observa el comportamiento de las enzimas MnP y LiP en función del tiempo; las 2 se produjeron desde el comienzo del proceso, y alcanzaron la actividad más alta a los 2 días con 0,6 y 0,01U/l (MnP y LiP, respectivamente). Se observó una correlación positiva altamente significativa (p<0,0001) con la remoción de DQO, posiblemente porque la presencia de los metales generó una inducción al estimular la síntesis de melaninas, que pudieron participar de manera complementaria en la remoción y como mecanismo de protección para el hongo. Otro factor que afectó la actividad enzimática, especialmente en los últimos días, fue el cambio en el pH, ya que al iniciar la cinética se encontraba en 4,0 y gradualmente se fue incrementando hasta alcanzar un valor de 6,8.
Microscopia electrónica de barrido y microanálisis de energía de rayos XEn la figura 3A se observan las características microscópicas del soporte empleado para la inmovilización. Éste correspondía a un material delgado con densidad baja y elevada área superficial, estructuralmente formado por hilos plásticos entrecruzados para formar una malla con diámetro de 2mm. En la microfotografía del bioadsorbente laminar se observó una colonización total, y se destacaron la presencia de hifas delgadas y septadas, y la presencia de esporas sobre la superficie (fig. 3B). En el microanálisis de EDX se presentaron picos de carbono, oxígeno y nitrógeno que correspondieron a elementos constitutivos de la biomasa fúngica.
A) Malla de polietileno (40×) de 2mm de diámetro de poro sin colonizar. B) MEB de la malla de polietileno de 2mm a 2.000×. C) Malla colonizada (10×) con Phanerochaete chrysosporium tras 2 días de incubación a 30°C. D) Microscopía electrónica de barrido de las hifas y las esporas de P. chrysosporium que recubre la malla (1000x).
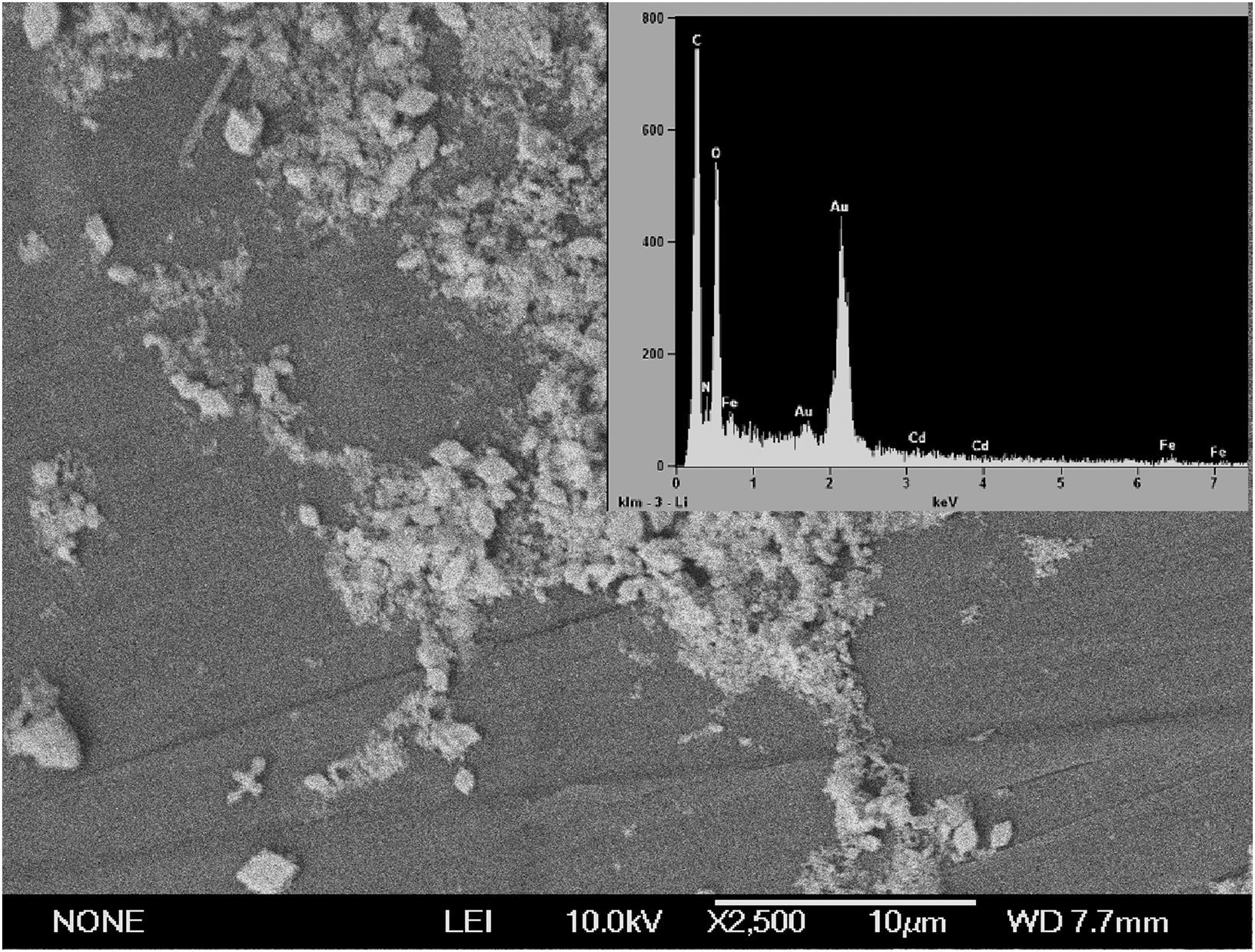
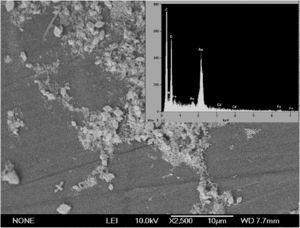
Respecto a la mezcla de los 3 metales, con la microscopía electrónica se observó que los 3 se adsorbieron sobre la pared formando agregados de diferente tamaño (fig. 4). Esta disposición pudo determinar una posible competición por los grupos funcionales con capacidad de unión para los metales, situación que se corroboró con el microanálisis de EDX, en el que los porcentajes atómicos para cada metal fueron de 0,19, 0,64 y 5,1% para el NiCl3, el CdSO4·8H2O y el CH3COOPb en el bioadsorbente, y de 0,09, 0,08 y 0,1% en la malla sin biomasa. La adsorción era 2, 8 y 50 veces más alta cuando la biomasa recubría la malla. La menor adsorción de NiCl3 se correlacionó con las pruebas de tolerancia, ya que fue el metal más tóxico con una CMT de 300mg/l.
Remoción de níquel, cadmio y plomo con biomasa viable sin inmovilizarPara verificar el efecto de una mayor cantidad de biomasa y la posible competición entre metales por los ligandos de la pared se realizó un ensayo complementario en matraces Erlenmeyer, y se colocó 4 veces más biomasa en forma de pellets que en las columnas de burbujeo. Con respecto al comportamiento de la mezcla, se obtuvieron remociones del 74, 57 y 98% para el CdSO4·8H2O, el CH3COOPb y el NiCl3, respectivamente, con una posible competencia por los sitios de unión por los metales, especialmente entre el Pb y el Ni, ya que al realizar los experimentos con las mismas concentraciones de metal, pero de manera independiente, la remoción de Pb aumentó a un 95% y la de Ni disminuyó al 56%. Asimismo, este resultado demuestra que la biomasa de P. chrysosporium tuvo mayor afinidad por el Pb seguido, del Cd (60%) y el Ni —valores que concuerdan con los resultados de EDX que se presentan más adelante— (figs. 5–7).
En las imágenes por microscopio electrónico en presencia de Ni se observaron algunas características de la pared, como la homogeneidad de la estructura asociada con la organización de las subunidades de N-acetilglucosamina unidas por enlaces glucosídicos β 1–4. En el microanálisis de EDX se confirmó nuevamente que el Ni fue el metal que más afectó a la biomasa, al acumular un porcentaje atómico del 0,13% (fig. 5). En lo referente al Cd, se pudieron evidenciar los agregados del metal, y con la EDX se estableció que fue el segundo con respecto a la afinidad (0,43%). Por último, en el ensayo con Pb se demostró que este fue el metal por el que la biomasa tuvo mayor afinidad, con un porcentaje del 8,1% (valor más alto que el obtenido en la mezcla). Los datos se correlacionan con la prueba de tolerancia, ya que la cepa soportó hasta 10.000mg/l de Pb (fig. 7).
Las actividades enzimáticas LiP y MnP se presentaron en todos los tratamientos, con valores de LiP de 0,028, 0,029, 0,024 y 0,02U/l en el Ni, el Cd, el Pb y la mezcla. Con respecto a la enzima MnP, las actividades fueron de 0,2, 0,17, 0,13 y 0,016U/l en la misma secuencia. Los valores bajos podrían relacionarse con la condición no ligninolítica del agua residual en asociación con la presencia de los metales, siendo inducidas para estimular la producción de melaninas como proteínas de protección contra los metales. A diferencia de las curvas de remoción en el reactor, en este ensayo en matraces Erlenmeyer y con mayor cantidad de biomasa se presentó una acidificación del medio en todos los tratamientos, con valores iniciales de pH de 5,2, y que finalizó con valores de 3,4, 4,1, 3,6 y 4,7 para el Ni, el Cd, el Pb y la mezcla. Este cambio en el pH se pudo deber a la mayor cantidad de biomasa. Esta biomasa utilizó eficientemente la glucosa como fuente de carbono, ya que en todos los tratamientos se presentó un consumo al finalizar el experimento.
DiscusiónLa elevada tolerancia de P. chrysosporium pudo haber aparecido como respuesta a la exposición prolongada y ascendente de los 3 metales, lo que determina que posiblemente se hayan activado mecanismos como el engrosamiento de la pared, la síntesis de melaninas y la producción de ácidos orgánicos2. Estos hongos producen una pared celular compuesta principalmente por polisacáridos (β 1–3 y β 1–6 glucanos), que atrapan los iones metálicos y ofrecen una barrera primaria contra el metal3. Otro tipo de ligandos son las melaninas, compuestos de alto peso molecular formados por la oxidación y la polimerización de compuestos fenólicos (dihidroxinaftaleno y tirosinasa). Estos compuestos pueden existir como radicales libres que actúan como receptores o donadores de protones, ya que contienen grupos carboxilo, amino, fenólico e hidroxilo, que se reducen por parte de iones metálicos y oxidados por peróxido6.
Es factible que los 2 primeros mecanismos se hayan presentado en este microorganismo, ya que al observar la parte anterior de las cajas era evidente una pigmentación en la gama del café y el amarillo, que se acentuó especialmente con el Cd. Por otro lado, cuando se realizaron las observaciones microscópicas con bajo aumento (40x), las hifas no tomaron uniformemente el colorante azul de lactofenol, lo que demuestra que a medida que se fue incrementando la concentración de metales, se generó un complejo entre éstos y los grupos oxidrilo o hidroxilo de los monómeros de N-acetilglucosamina, y se ocasionó la disminución en los sitios de unión para el colorante. Un fenómeno similar se reportó para Neurospora crassa expuesta a sulfito de cadmio; los autores evidenciaron la formación de un complejo metálico con ciertos grupos funcionales de la quitina5.
Con respecto a los resultados del diseño experimental, la colonización eficiente del soporte se atribuyó a 2 mecanismos: la capacidad invasiva de las hifas de P. chrysosporium y la producción de conidios. Cuando este microorganismo se cultiva in vitro empleando medios que simulan condiciones ligninolíticas (relación carbono/nitrógeno 150–300), crece formando abundante micelio. Por esta razón, la colonización fue eficiente, ya que para acceder a la fuente de carbono, nitrógeno y nutrientes, las hifas se fueron desarrollando apicalmente y fueron atravesando los poros de la malla, lo que originó que se formara una fina capa sobre los soportes de 3±1 mm de espesor. De manera complementaria, los conidios, al ser más pequeños que las hifas (30±2μm), pudieron atravesar con mayor facilidad los poros de 2mm y se convirtieron en unidades germinativas que colonizaron la parte posterior del material. El desarrollo de este novedoso bioadsorbente laminar tiene ventajas con respecto a otras geometrías presentadas en la literatura médica, ya que, al ser delgado, presenta una mayor área superficial con capacidad de adsorción por ambas caras y su flexibilidad facilita su uso14,15.
Además, al tener un espesor de 3mm, la transferencia de oxígeno se ve favorecida al no generarse zonas anaerobias o microaerófilas que afecten el metabolismo aerobio del hongo. Se ha observado que en soportes muy gruesos, la colonización en el interior es deficiente y puede estar relacionada con gradientes de oxígeno12,25.
En las curvas de remoción en la columna de burbujeo, la carga inicial de la DQO fue alta y se puede atribuir a la fuente de carbono y nitrógeno, y a las poblaciones acompañantes, ya que el experimento se realizó sin control de esterilidad. Bajo estas condiciones, la remoción de la DQO se atribuyó a la utilización de la glucosa a través de rutas como la glucólisis y el ciclo de los ácidos tricarboxílicos20, que no se vieron inhibidas por la presencia de los 3 metales (al final de las curvas el peso de la biomasa fue superior). Se confirmó la viabilidad del hongo al sembrar un fragmento de la malla en agar salvado, y se observó el crecimiento característico a los 8 días de incubación (datos no mostrados). Además, se pudieron formar ácidos orgánicos, como el ácido oxálico, que funcionaría como agente quelante para remover los iones metálicos en solución. El efecto sinérgico de la biomasa y el soporte quedó demostrado al comparar los resultados con la remoción de la DQO con el soporte solo. Los posibles mecanismos implicados en la producción de las enzimas se podrían explicar por 2 teorías. Según la primera, las enzimas se pueden inducir por la presencia de metales pesados, mecanismo que se lleva a cabo a nivel transcripcional y genera un incremento en los niveles de ARNm. Los estudios han documentado ampliamente para manganeso, Cu, Cd, Hg y cobalto11,16,24, aunque el mecanismo no está completamente dilucidado, ya que son muy pocas la investigaciones que se reportan en las que se realice la cuantificación de la actividad enzimática asociada con la remoción de metales pesados. La segunda teoría está relacionada con la producción de melaninas como mecanismo de protección contra los metales, ya que en la síntesis de estos compuestos intervienen peroxidasas y polifenol oxidasas. Por lo tanto, al sintetizarse las melaninas, las enzimas ligninolíticas incrementarían su actividad para participar en su producción sin sustraer electrones en el compuesto metálico6,12.
Con respecto a los resultados de la EDX y a la cuantificación de los metales por espectrofotometría de absorción atómica, los resultados indican que posiblemente la biomasa libre tenga sitios de unión, como los grupos sulfidrilo, amino, carboxilo, fosfato, entre otros, por medio de los que los iones metálicos se pudieron capturar y llevarse a cabo el proceso de adsorción. Además, se observó un comportamiento similar al colocar el hongo en cada tipo de metal y en la mezcla de éstos. No obstante, se presentó mayor afinidad por el Pb, y es evidente que en la mezcla se generó un proceso de competencia entre el Pb y el Ni por los ligandos de la pared. Este mismo resultado se reportó para P. chrysosporium al ser expuesto a Cd, a Pb y a Cu. De acuerdo con los resultados de acumulación, el orden de afinidad en la mezcla fue Cu (ii)>Pb (ii)>Cd (ii), secuencia que se mantuvo al evaluar de manera independiente cada uno de éstos28. La disminución de los porcentajes de remoción se ha asociado con el fenómeno de competencia de los cationes1. Otro factor que favoreció la remoción en el experimento en matraz fue la acidificación del medio, ya que se permitió la solubilización de los metales y una unión más eficaz a los ligandos aniónicos como grupos fosfóricos, carbonilos, sulfidrilos e hidróxidos, que se activan en presencia de los metales.
Finalmente, los resultados de este trabajo permitieron desarrollar un novedoso sistema laminar con capacidad de absorción a base de la biomasa viable de P. chrysosporium, con una gran área superficial y tolerancia a concentraciones elevadas de Cd, Ni y Pb. Además, actividades enzimáticas como la MnP y la LiP podrían estar relacionadas con ciertos mecanismos de tolerancia e inducción.
FinanciaciónEl presente estudio forma parte del proyecto N.o 00002769, financiado por la Oficina de Fomento a la Investigación de la Vicerrectoría Académica de la Pontificia Universidad Javeriana, Bogotá, Colombia.