La hernia inguinal abdominal sigue siendo hoy en día una de las patologías que más frecuentemente requiere tratamiento quirúrgico. Las técnicas para su reparación quirúrgica representan un 20 % de todos los procedimientos de cirugía general. Aunque su patogenia es compleja, parece haber muchos factores que contribuyen a su desarrollo, incluyendo la predisposición individual.
La etiología de la hernia inguinal implica cambios en la expresión de diferentes componentes de la matriz extracelular, que inciden especialmente a nivel de la fascia transversalis (FT), tales como el colágeno, el componente elástico y las metaloproteinasas (MMP).
En este trabajo se pretende hacer una revisión de todas las alteraciones que inciden sobre el tejido conectivo y la matriz extracelular que tienen lugar a nivel de la región inguinal. Nuestro grupo demostró, en estudios previos, una sobreexpresión de MMP-2 en la FT de pacientes jóvenes con hernia inguinal directa, correlacionada con un incremento de TGF-beta1 que muestra un intento de contrarrestar un proceso aumentado de degradación de la matriz extracelular en estos pacientes. A nivel del tejido elástico de la FT, los pacientes con hernia inguinal directa muestran unos niveles más bajos de tropoelastina (TE), monómeros que conforman la elastina, y lisil oxidasa like-1 (LOXL-1), enzima implicada en la reticulación de la elastina. Todo ello, además, va acompañado de una expresión significativamente mayor de elastasa, principal enzima implicada en el proceso de degradación de elastina. En cultivos celulares procedentes de FT los niveles de ARNm que codifica LOXL-1 también resultaron ser significativamente menores en pacientes portadores de hernia inguinal directa.
Todas estas alteraciones ponen de relieve un desorden a nivel de la matriz extracelular del tejido conectivo en los pacientes portadores de hernias inguinales, que unidos a otros factores exógenos (tabaquismo, esfuerzos mecánicos, envejecimiento de los tejidos, etc.) explicarían en parte la génesis de esta patología.
Inguinal hernia is still today one of the entities that most frequently requires surgical treatment. The techniques for surgical repair are around 20% of all general surgery procedures. Although its etiology remains unclear, there seem to be many contributing factors added to an individual predisposition.
The aetiology of inguinal hernia involves changes in the expression of different extracellular matrix constituents, affecting especially at the level of the transversalis fascia (TF), such as collagen, elastic component and Metalloproteinases (MMPs).
This work aims to make a review of all the alterations that affect connective tissue and the extracellular matrix, which take place at the level of the inguinal region.
In previous studies, we were able to demonstrate the overexpression of MMP-2 in the transversalis fascia of young patients with direct inguinal hernia correlated with the overexpression of TGF-beta1 showing an attempt to counterbalance the enhanced matrix degradative process observed in these patients. At the level of the elastic tissue of the TF, direct inguinal hernia patients show low levels of tropoelastin (TE), precursor to the elastin molecule and lysyl oxidase like-1 (LOXL-1), enzyme involved in cross-linking of elastin. In contrast, these patients showed significantly higher elastase expression, main enzyme involved in the process of degradation of elastin. Significantly lower LOXL-1 mRNA levels were also observed in cells obtained from the TF of patients with direct inguinal hernia.
All these alterations highlight a disorder at the level of the extracellular matrix of connective tissue in patients with inguinal hernias, which together with other exogenous factors (smoking, mechanical stress, aging of tissues...) would partly explain the genesis of this pathology.
Introducción
La hernia inguinal constituye todavía hoy en día uno de los procedimientos más frecuentemente realizado por los cirujanos generales. Su coste socio-sanitario y laboral es importante (en EE. UU. esta patología tiene un coste aproximado de 3 billones de dólares al año)1. Su etiología y patogenia es compleja, existiendo múltiples factores que contribuyen a su desarrollo, incluyendo la predisposición individual y algunas alteraciones congénitas como la persistencia del conducto peritoneo-vaginal.
Desde un punto de vista general, la integridad de la pared abdominal a nivel de la región inguinal depende de la orientación oblicua del canal inguinal, de una estructura tipo esfínter que forma parte del anillo inguinal profundo y de la fascia transversalis2 (FT). Esta última estructura que constituye la pared posterior del canal inguinal es la que impide, finalmente, la formación de hernias, y de una manera especial las hernias de tipo directo. Algunos autores3, después de la realización de estudios mecánicos, atribuyen a la integridad de la FT un mecanismo de contención que impediría la formación de hernias tanto de tipo directo como indirecto.
El desarrollo de hernias a nivel de la pared abdominal y su recurrencia se ha demostrado que ocurre más frecuentemente en pacientes con desórdenes del tejido conectivo, sin olvidar algunos otros factores importantes como el tabaquismo4.
En patologías en las que existen alteraciones del tejido conectivo la incidencia de hernia inguinal es mayor, como son los pacientes con aneurisma aórtico, síndromes de Marfan y Ehlers-Danlos, cutis laxa, osteogénesis imperfecta y luxación congénita de la cadera5,6.
Papel de la matriz extracelular en la patología herniaria
Los mecanismos generadores de hernia inguinal implican cambios en la expresión de diferentes componentes de la matriz extracelular detectables a nivel de la FT, tales como el recambio de colágeno (ratio colágeno I:III) y las metaloproteinasas (MMP). Asimismo, el componente elástico que forma parte de la matriz fibrilar extracelular puede contribuir al desarrollo de esta patología.
Los factores biológicos propuestos por el grupo de Read implicados en el desarrollo de hernia han ganado aceptación en los últimos años, atribuyendo un papel particularmente relevante a los factores metabólicos en el desarrollo de hernia inguinal7-9. Otros grupos, como el de Jansen et al.10, han situado las hernias inguinales en el contexto de una condición generada por una composición anormal de la matriz extra-celular.
Los pacientes con hernia inguinal muestran algunas alteraciones en el metabolismo del colágeno y relaciones de colágeno I/III significativamente alterados11,12, pero pocos datos se conocen acerca del componente elástico de la matriz extracelular y de los factores involucrados en la remodelación tisular que puedan afectar el metabolismo de la elastina.
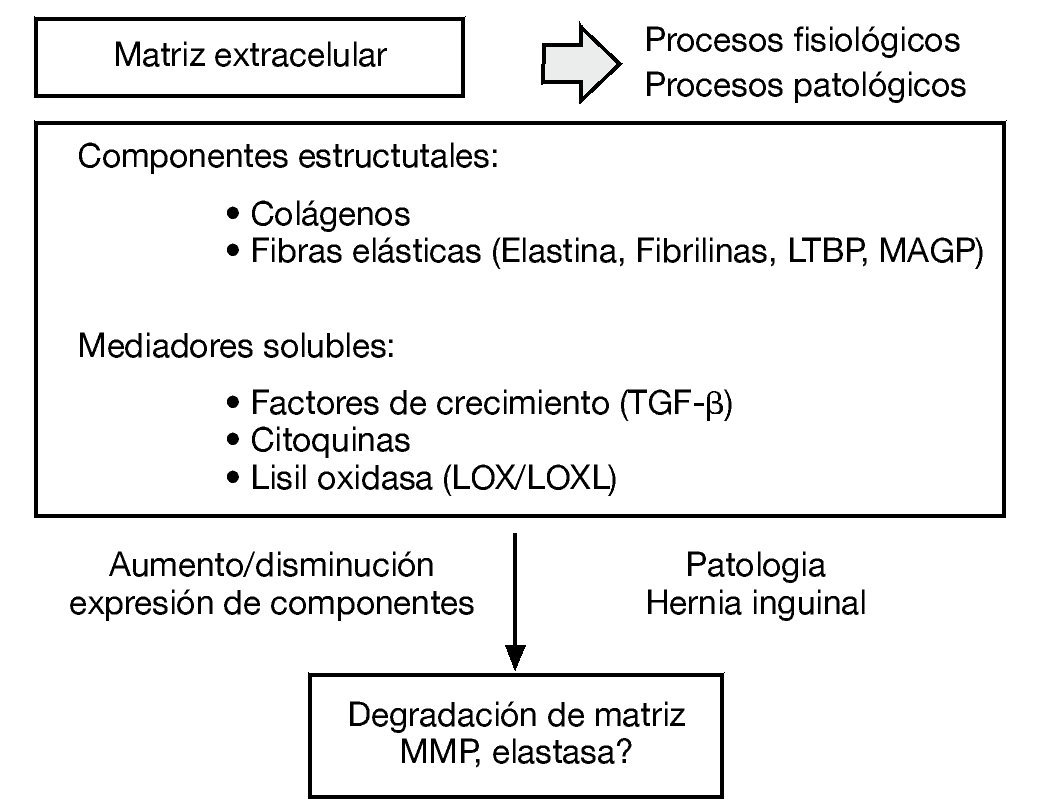
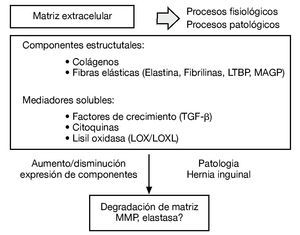
La matriz extracelular es un sistema integrado muy complejo, responsable de las propiedades mecánicas del tejido conectivo. Los diferentes constituyentes de la matriz interaccionan unos con otros y cualquier alteración de uno de ellos puede derivar en una desorganización de la matriz extracelular y en el desarrollo de diferentes patologías como la hernia inguinal (fig. 1).
Figura 1 - Esquema de los diferentes constituyentes de la matriz extracelular como sistema integrado complejo y su desorganización en el desarrollo de diferentes patologías como la hernia inguinal.
Entre los diferentes constituyentes de la matriz extracelular más estudiados en relación con la patología herniaria se encuentra el colágeno y las MMP. En los últimos años se ha demostrado que otros mediadores solubles, como determinados factores de crecimiento o enzimas relacionadas con la reticulación de proteínas fibrilares de matriz, pueden estar alterados en los pacientes portadores de hernias13,14.
A continuación vamos a revisar los constituyentes de matriz más estudiados en relación con la patología de la hernia inguinal, y haremos especial énfasis en los hallazgos obtenidos por nuestro grupo de investigación.
Colágenos
El colágeno es la proteína fibrilar principal y más abundante de la matriz extracelular. Esta proteína es principalmente sintetizada por los fibroblastos del tejido conectivo. En el proceso de formación del colágeno tienen lugar importantes reacciones de hidroxilación a nivel intracelular para formar hidroxilisina y hidroxiprolina, que son esenciales en el proceso de síntesis y confieren estabilidad a la molécula de colágeno. Esta molécula se conforma por tres cadenas polipeptídicas ensambladas a nivel intracelular en forma de triple hélice. Es secretada a la matriz extracelular en forma de procolágeno, que tras un proceso de escisión de sus extremos terminales se convertirá en tropocolágeno ensamblándose en forma de fibras de colágeno en el espacio extracelular, mediado por enzimas de la familia de las lisil oxidasas que promueven la formación de enlaces covalentes de gran resistencia entre los residuos de lisina e hidroxilisina. Este cruzamiento del colágeno proporciona fuerza y estabilidad a la fibra de colágeno. Algunos grupos15 han demostrado una disminución de la hidroxilacion de la prolina en la FT acompañado de una significativa disminución del contenido de prolina e hidroxiprolina en la vaina del músculo recto16 de pacientes con hernia inguinal directa, lo que indica una estabilidad comprometida del colágeno a nivel de la fascia.
Existen más de 20 tipos diferentes de colágeno en humanos. El colágeno de tipo I es el más resistente, distribuido ampliamente en el cuerpo humano, incluidas las fascias, el sistema tegumentario, los ligamentos y el tejido fibroso. El colágeno de tipo III se encuentra en pequeñas cantidades en los mismos tejidos y en mayor proporción en los estadios iniciales de la reparación tisular y cicatrización de heridas4. El tipo I confiere principalmente resistencia a la tracción, mientras que el de tipo III está relacionado con una matriz temporal durante el proceso de remodelado tisular. Por lo tanto, un cambio en la relación del colágeno a favor del inmaduro de tipo III se traduciría en una pérdida de resistencia de las estructuras implicadas.
Cuando se analiza el contenido de colágeno en muestras tisulares, el resultado frecuentemente se cuantifica por la relación entre colágeno tipo I:III. Esta relación de colágenos se encontraba significativamente disminuida en la fascia FT de pacientes con hernia inguinal indirecta comparado con los controles17. Por el contrario, otros trabajos han mostrado un incremento de colágeno tipo III, pero no reportan diferencias estadísticamente significativas en la relación colágeno I:III en la FT entre pacientes con hernia inguinal y controles15,18. Otros autores3 han demostrado que la FT de pacientes con hernia directa muestra mayores niveles de colágeno inmaduro tipo III, y que la cantidad total de colágeno es menor en la hernia directa que en la indirecta19.
Estudios ultraestructurales mediante microscopia electrónica de transmisión se han centrado en el estudio del colágeno y matriz interfibrilar del tejido conectivo de pacientes con esta patología, y muestran la inexistencia de alteraciones en el diámetro de las fibras de colágeno en la FT de pacientes con hernia inguinal20.
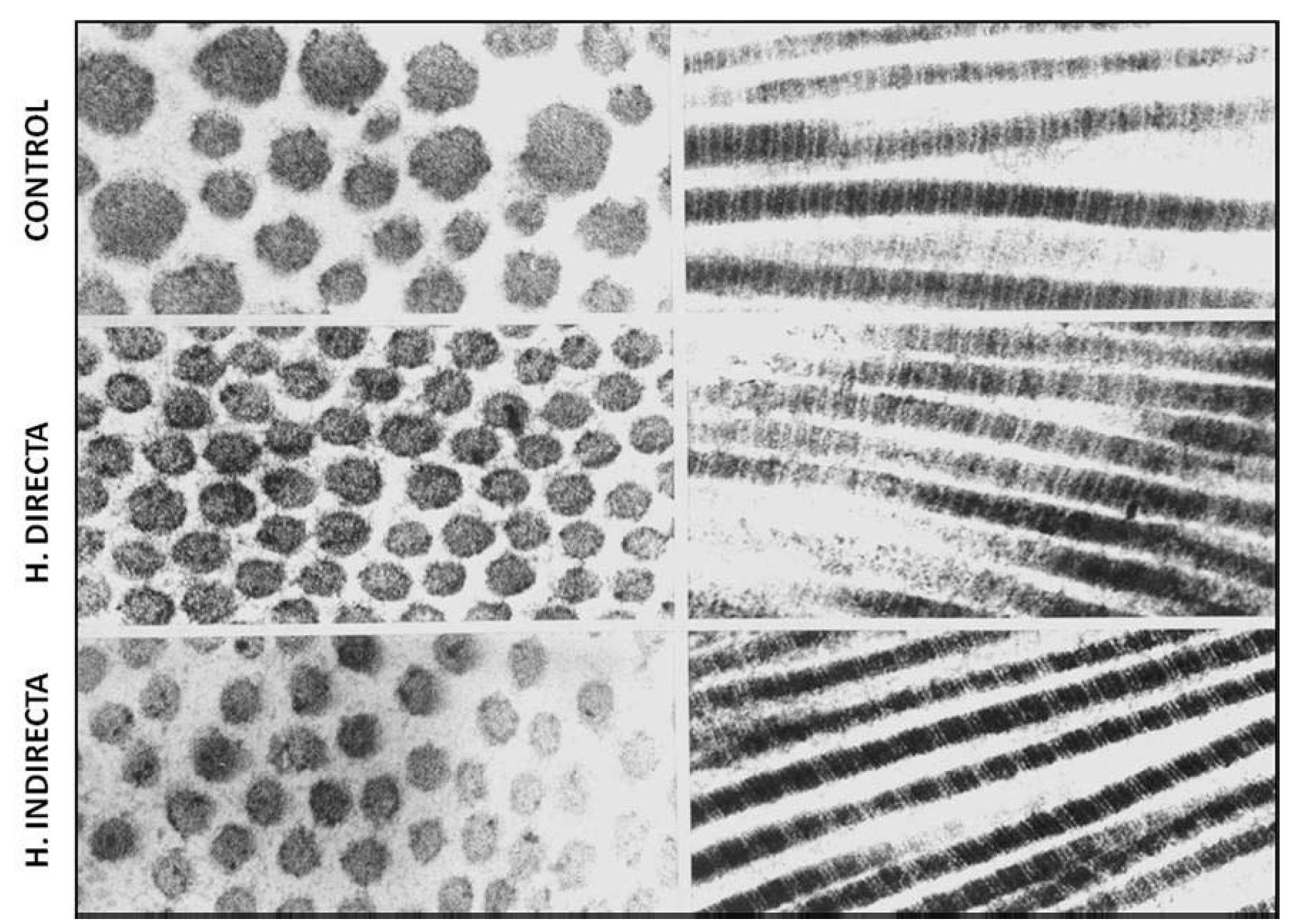
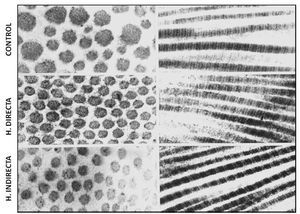
Nuestro grupo15, examinando la ultraestructura de la FT de pacientes con hernia directa e indirecta, observó que no existían diferencias en la uniformidad de las fibrillas de colágeno ni tampoco en su característico patrón de bandeado; sin embargo, la matriz de interfibrillar fue más abundante en las hernias directas, mostrando abundantes partículas de pequeño tamaño con gran electrodensidad (fig. 2).
Figura 2 - Imágenes de microscopia electrónica de transmisión del tejido conectivo de la fascia transversalis, que muestra ausencia de alteraciones ultraestructurales de las fibras de colágeno en los diferentes grupos de estudio. Tinción con citrato de plomo y acetato de uranilo. Aumento: 85 000.
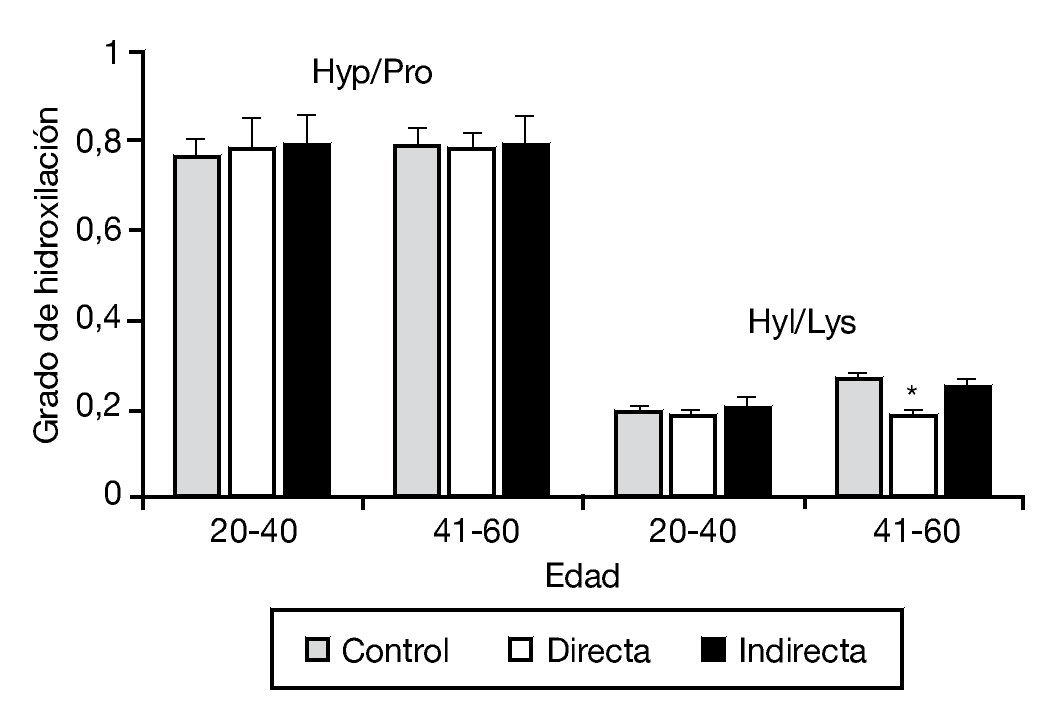
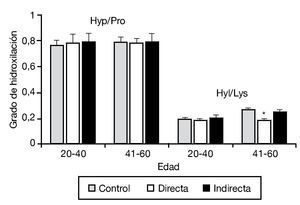
En este mismo trabajo, y mediante un estudio bioquímico, se analizó complementariamente el grado de hidroxilación de la lisina y prolina, esenciales en el proceso de síntesis y estabilidad a la molécula de colágeno. No se observaron diferencias en la hidroxilación de la prolina en los diferentes tipos de hernia, y únicamente se detectó una pequeña disminución en la hidroxilación de la lisina en pacientes con hernia directa de más de 40 años (fig. 3).
Figura 3 - Hidroxilación de la prolina y lisina en la fascia transversalis de los grupos control y portadores de hernias inguinales directas e indirectas, en función del factor edad de la población. Se observó una disminución significativa de la hidroxilación de la lisina en las hernias directas del grupo de mayor edad respecto al resto de los grupos de estudio (p < 0.05). Hyp/Pro: ratio hidroxiprolina/prolina; Hyl/Lys: ratio hidroxilisina/lisina.
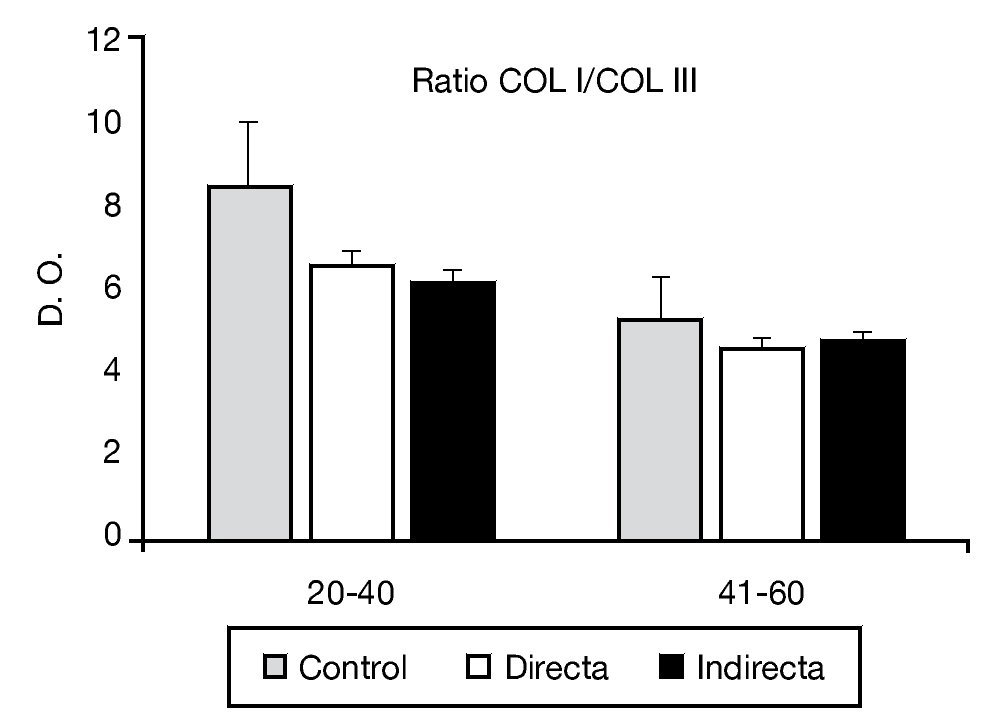
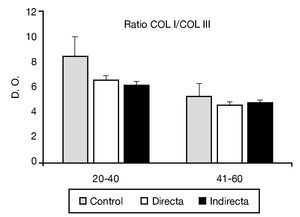
La relación de colágeno tipo I:III estudiado mediante análisis inmunoenzimático no mostró diferencias estadísticamente significativas entre los controles y los pacientes portadores de patología herniaria (fig. 4).
Figura 4 - Relación colágeno I:III observada en los diferentes grupos de estudio, teniendo en cuenta el factor edad de la población. Se observó ausencia de diferencias significativas entre los diferentes grupos de pacientes. COL I: colágeno I; COL III: colágeno III; D. O.: densidad óptica.
Metaloproteinasas de matriz
Las MMP, proteínas zinc dependientes, son importantes enzimas involucradas en el remodelado de la matriz extracelular. Esta se encuentra sometida a un constante equilibrio dinámico entre su síntesis y degradación por acción de las MMP. Estas enzimas son conocidas por regular la síntesis y degradación de colágeno, pero también de muchos otros componentes de la matriz extracelular como proteoglicanos, elastina, fibronectina, etc. Existen alrededor de 23 tipos diferentes de MMP humanas que están agrupadas en colagenasas, gelatinasas, estromelisinas, matrilisinas, MMP de membrana y otras MMP. Las clásicas colagenasas incluyen la MMP-1, 8 y 13, involucradas en la degradación de colágenos de tipo I, II y III, y las gelatinasas MMP-2 y 9, involucradas en la degradación de colágenos desnaturalizados tipo IV y proteoglicanos. Sin embargo, MMP-2 también es capaz de degradar colágenos nativos tipo I, II y III21,22. Las colagenasas y gelatinasas son probablemente las MMP más importantes en relación con la formación de hernia.
En general, las MMP se expresan a muy bajos niveles; sin embargo, su expresión puede ser inducida como consecuencia de diferentes mecanismos patológicos. Las citoquinas proinflamatorias, los factores de crecimiento y las hormonas son importantes reguladores de la expresión de las MMP. La actividad proteolítica de estas enzimas, secretadas en forma latente, está controlada principalmente por la activación de inhibidores tisulares de MMP conocidos como TIMP23.
Estudios experimentales realizados por diferentes grupos han demostrado que no existen diferencias significativas en los niveles de las enzimas MMP-1-9 y 13 en la FT de pacientes con hernia directa o indirecta respecto a controles24,25. Otros autores han encontrado niveles significativamente elevados de MMP-2 en pacientes con hernia inguinal directa respecto a pacientes con hernia indirecta o control, acompañados de una disminución significativa de su inhibidor TIMP-226,27.
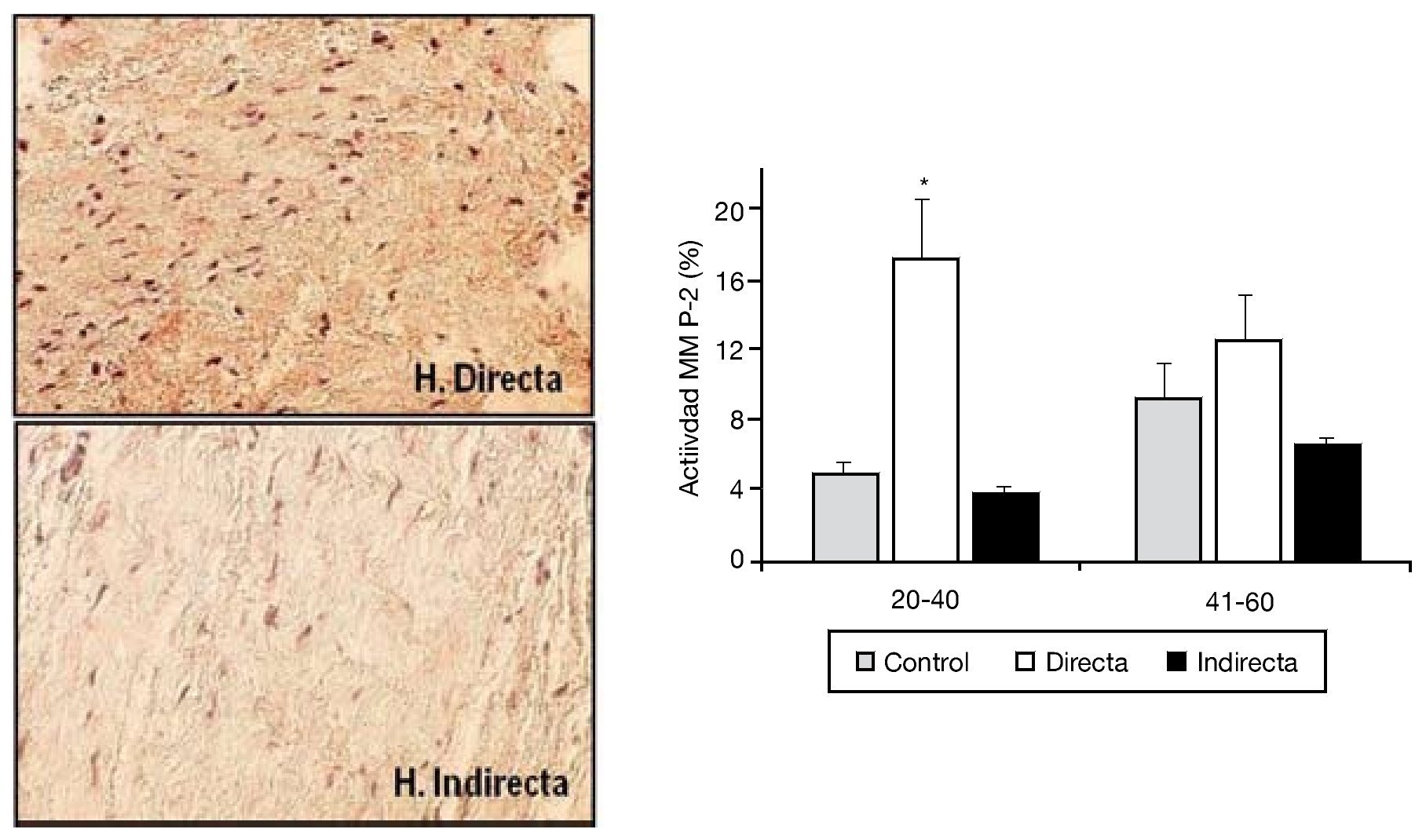
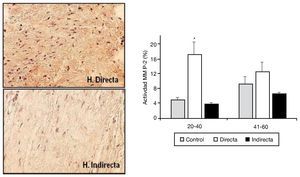
La degradación de la matriz extracelular por efecto de las MMP en la FT ha sido también objetivo de nuestras investigaciones. Cuatro tipos diferentes de MMP (MMP-1, 2, 3 y 9) fueron analizados por nuestro grupo en secciones tisulares, utilizando técnicas inmunohistoquímicas con anticuerpos monoclonales específicos. Sin embargo, solo encontramos diferencias significativas en la expresión proteica de MMP-215, donde se observó una sobreexpresión significativa de la enzima en las hernias directas del grupo de menor edad respecto al resto de los grupos (fig. 5).
Figura 5 - Imágenes de la tinción inmunohistoquímica para la detección de MMP-2 en las secciones tisulares de fascia transversalis. Se puede observar un incremento de la expresión en el grupo de hernia inguinal directa. (Aumento: 200). Cuantificación de la actividad MMP-2 en los diferentes grupos de estudio, en función de la edad de la población. Se observó un incremento significativo (p < 0.05) de la expresión en la hernias directas del grupo de pacientes menores de 40 años.
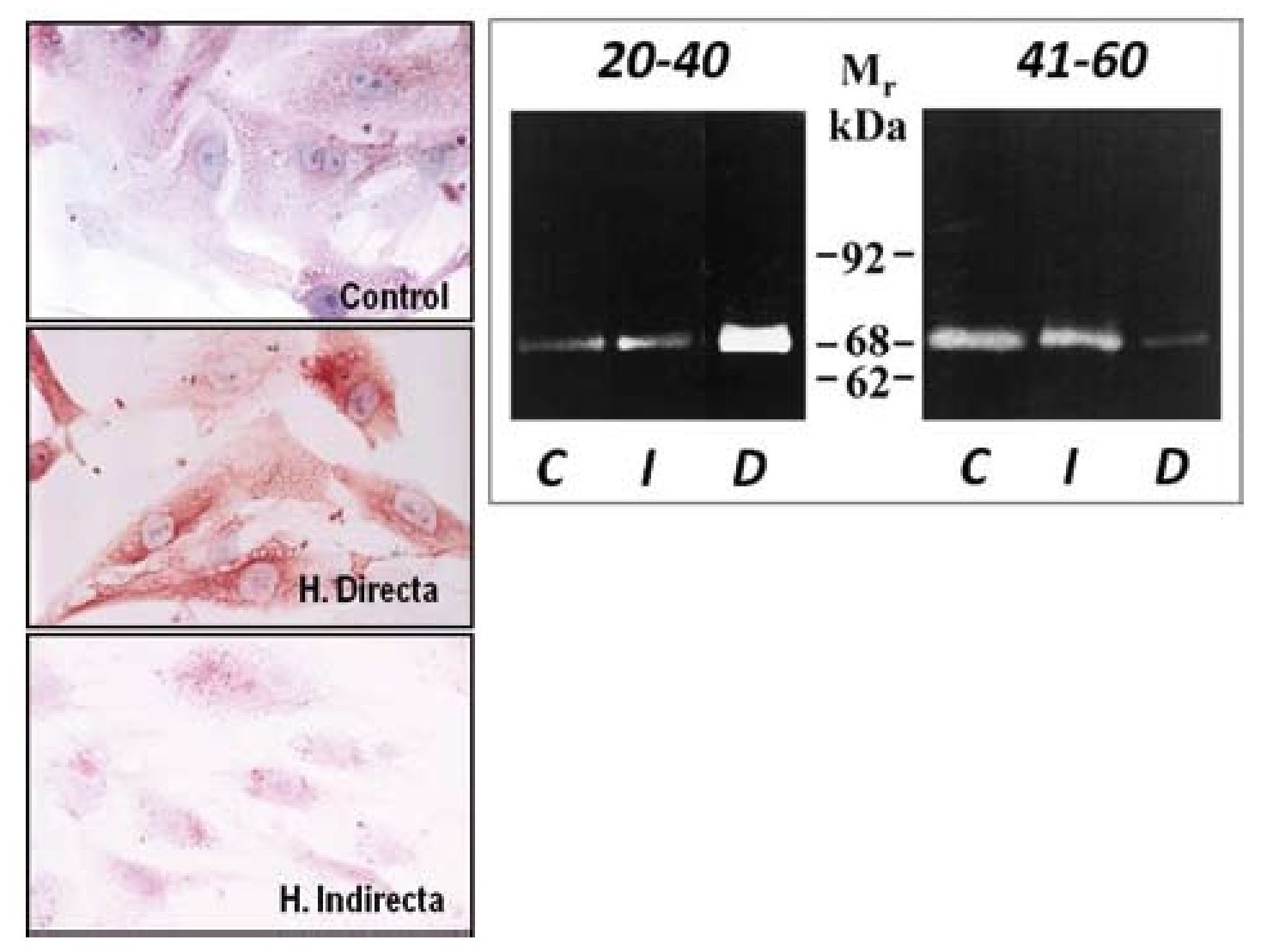
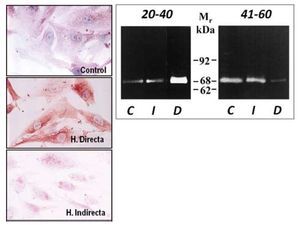
Tras este estudio, llevamos a cabo una segunda fase in vitro28 en la que utilizamos fibroblastos, con el objeto de comprobar si la sobreexpresión de MMP-2 observada en tejido se mantenía en las células en cultivo obtenidas de la FT. Los resultados obtenidos con técnicas inmunocitoquímicas, de inmunoblotting y de zimografía corroboraron que la MMP-2 estaría involucrada en el proceso de degradación de la matriz de la FT en pacientes con hernia directa. La persistencia de las alteraciones en los niveles de MMP-2 en cultivos celulares parece sugerir un defecto genético o cambio irreversible como el origen de esta patología en lugar de factores ambientales, que más tarde puedan participar en el desarrollo de la misma (fig. 6). Estos trabajos fueron los primeros en la literatura en implicar a la MMP-2 en la patogenia de un tipo de hernia, concretamente la hernia directa en pacientes menores de 40 años, en los que a menudo, esta hernia es bilateral.
Figura 6 - Imágenes de fibroblastos obtenidos de la fascia transversalis de los diferentes grupos de pacientes sometidos a técnicas inmunohistoquímicas para la detección de MMP-2. Se observaron mayores niveles de la enzima en el grupo de hernias directas. (Aumento: 1000×). Actividad gelatinolítica determinada por técnicas de zimografía en los diferentes grupos de estudio, que mostró una banda degradativa incrementada en el grupo de hernias directas del grupo de menor edad C: control; D: directa; I: indirecta; Mr: peso molecular.
Recientemente nuestro grupo ha publicado también otro trabajo29 relacionado con la MMP-2 y sus moduladores, utilizando como material biopsias humanas de piel obtenidas de pacientes sometidos a cirugía de reparación de hernia inguinal. En este estudio se han utilizado técnicas inmunocitoquímicas y de inmunoblotting en tejido intacto y cultivos celulares de fibroblastos, así como técnicas de zimografía para analizar la actividad degradativa de la MMP-2. Nuestros resultados indican una sobreexpresión de la forma activa de la MMP-2 en el grupo de hernias directas, que podría apuntar a un metabolismo sistémico anormal como factor de riesgo para el desarrollo de este tipo de hernia.
Factores de crecimiento
Las citoquinas o factores de crecimiento tipo TGF-ββ (factor de crecimiento transformante beta) están involucrados en los procesos de remodelación de diferentes tipos de tejidos. El TGF-β es una proteína de secreción multifuncional que regula muchos aspectos de la función celular, incluyendo la proliferación celular, diferenciación y el metabolismo de la matriz extracelular30 mediante su unión a receptores celulares específicos. Han sido descritas cinco isoformas diferentes, y tres de ellas se encuentran en todas las especies de mamíferos.El TGF-β1 es el más difundido, y se trata de una proteína homodimérica de peso molecular 25 000 Kd, compuesta de dos proteínas idénticas de 12.5 kd unidas por un puente disulfuro31,32. Una gran variedad de potenciales aplicaciones clínicas han sido sugeridas para este factor de crecimiento, incluyendo el aumento del tejido de cicatrización, control de inflamación crónica asociada a fibrosis y supresión de enfermedades autoinmunes31. El TGF-β es un factor pleiotrófico que puede estimular, inhibir o modular acontecimientos celulares de una forma tiempo y concentración dependiente. Es un péptido crucial en el control de la cicatrización, atrayendo células a la herida, pero sobre todo promoviendo el subsiguiente depósito de colágeno y matriz31. También ha sido identificado como un potente modulador de la expresión de las MMP30. Algunos autores han afirmado que este factor de crecimiento regula la expresión de MMP-2 en varios tipos celulares como fibroblastos y células endoteliales33,34.
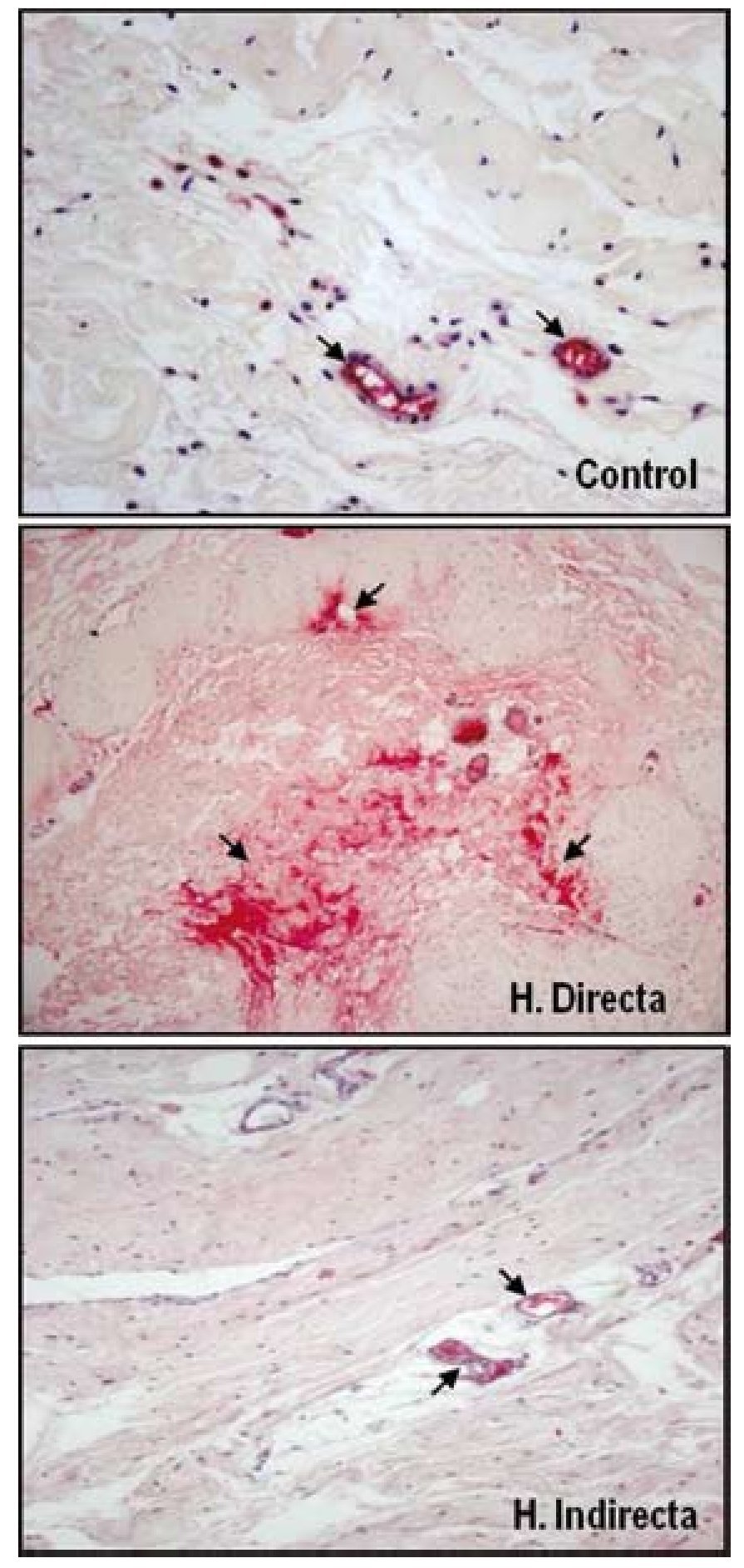
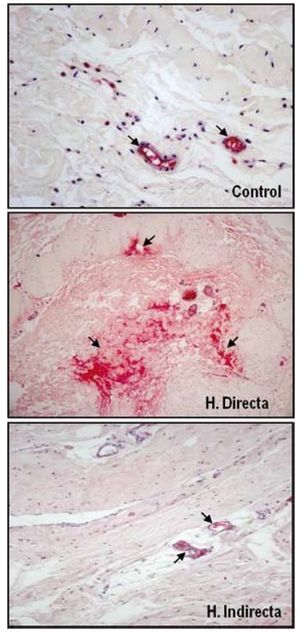
Nuestro grupo ha llevado a cabo diferentes estudios con el objeto de evaluar la expresión de diferentes factores de crecimiento en tejido afectado por hernia inguinal13 y sobre el tejido de integración tras el implante de diferentes tipos de materiales protésicos35. Para ello se realizó un análisis proteico, sobre la FT, de la distribución y niveles de la forma activa y latente del TGF-β1, mediante técnicas inmunohistoquímicas y de Western blot. No se encontraron diferencias significativas en la expresión de la forma latente del TGF-β1 (LAP-TGF-β1); sin embargo, los resultados de nuestro estudio indicaron una sobreexpresión de la forma activa del TGF-β1 en la FT de pacientes jóvenes portadores de hernia inguinal directa (fig. 7). Esta sobreexpresión de TGF-β1 se correlacionaba con la anteriormente descrita sobreexpresión de MMP-2 en el mismo grupo de pacientes, lo cual se podía interpretar como un intento de contrarrestar el proceso de degradación de la matriz extracelular observada en este tipo de hernia.
Figura 7 - Imágenes histológicas de la técnica inmunohistoquímica realizada sobre secciones tisulares de fascia transversalis de pacientes sanos y con hernias inguinales directas e indirectas para detectar la MMP-2 activa. Se puede observar sobreexpresión de los niveles de enzima activa sobre el tejido correspondiente a los pacientes portadores de hernia directa. (Aumento: 200×).
Elastina
La elastina es una proteína fibrilar del tejido conectivo, con funciones estructurales, que confiere elasticidad a muchos tejidos de nuestro organismo. Esta proteína es un polímero con un peso molecular de 70 kDa y con gran capacidad de expansión, que se forma a través de la reticulación de monómeros de tropoelastina (TE) sobre un soporte de microfibrillas ricas en fibrilina36. En este proceso de reticulación juegan un papel fundamental la enzima lisil oxidasa (LOX). Las LOX son una familia de enzimas dependientes de cobre que juegan un papel crítico en el entrecruzamiento de diferentes proteínas de matriz extracelular. Algunos autores37 han propuesto un papel selectivo para LOXL-1 (lisil oxidasa like-1) en el metabolismo de la elastina, mediante el cual se estabiliza la deposición de elastina de manera definida espacialmente como requisito previo para la formación de fibras elásticas funcionales38. Una de las enzimas degradativas más importantes del sistema elástico es la elastasa, que es capaz de degradar la elastina y las fibras elásticas, y que junto con el colágeno determina las propiedades mecánicas del tejido conectivo.
Han sido previamente descritas39 alteraciones estructurales en las fibras elásticas, relacionadas con la edad, que incluyen una reducción considerable en el número de microfibrillas y conducen a una pérdida de resistencia a la tracción y de elasticidad del tejido de la fascia transversalis. Este hecho podría explicar la alta incidencia de hernia inguinal observada a partir de los 50-60 años de edad.
Como ya hemos comentado, los pacientes con hernia inguinal muestran algunas anomalías en el metabolismo del colágeno y alteraciones del sistema de MMP11,12, pero se ha estudiado muy poco sobre el componente elástico de la matriz extracelular y los factores que intervienen en la remodelación tisular que podrían afectar el metabolismo de la elastina.
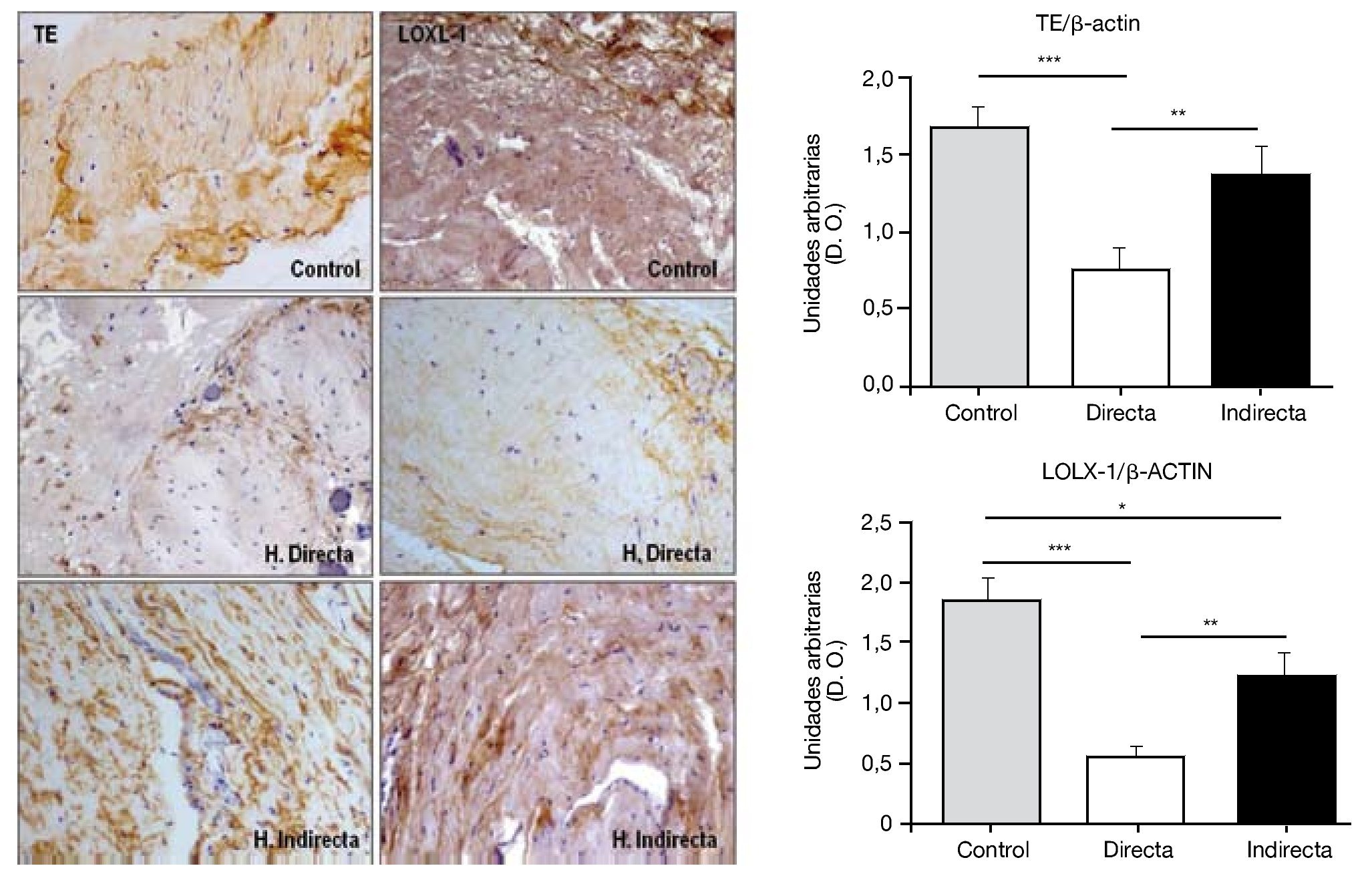
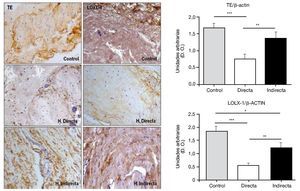
Por todo ello, realizamos un estudio que tuvo como objetivo examinar en la FT afectada por hernia inguinal, la expresión del precursor de elastina, tropoelastina (TE), LOXL-1, la enzima responsable de la reticulación del polímero de elastina y de la elastasa, principal enzima que causa la degradación de la elastina. Para ello se utilizaron técnicas de análisis proteico como inmunohistoquímica y western blot, así como técnicas de biología molecular, RT PCR, de análisis de la expresión génica. En el estudio realizado14 se demostró una deficiencia en el metabolismo de la elastina en pacientes con hernia inguinal que podría contribuir al fracaso de la FT. Esta deficiencia quedó reflejada por la insuficiente producción de LOXL-1 (fig. 8), que desempeña un papel selectivo en el entrecruzamiento de la elastina, así como por la sobreproducción de elastasa, una de las más importantes enzimas involucradas en la degradación del componente elástico.
Figura 8 - Detección inmunohistoquímica y cuantificación de tropoelastina (TE) y lisil oxidasa like-1 (LOXL-1) sobre el tejido de la fascia transversalis de los diferentes grupos de estudio. Se puede observar una disminución significativa de ambos constituyentes en los pacientes con hernia inguinal directa. (Aumento: 200×). D. O.: densidad óptica.
Nuestros hallazgos indicaron cantidades similares de ARNm que codificaba para TE en fibroblastos aislados de la FT de pacientes con hernia inguinal directa e indirecta, pero los niveles del mensajero para LOXL-1 mostraron una expresión significativamente disminuida en los cultivos celulares obtenidos de pacientes con hernia inguinal directa.
Comentarios
A lo largo de todo este trabajo de revisión hemos podido comprobar que los hallazgos de nuestro grupo muestran una FT conformada por un tejido conjuntivo portador de una matriz extracelular alterada, principalmente en aquellos pacientes con hernia inguinal directa. Los análisis ultraestructurales realizados en nuestro estudio no mostraron alteraciones de la densidad y diámetro de las fibras de colágeno que justifiquen la formación de hernias. Otros grupos, de acuerdo con nuestros resultados, han comunicado resultados similares40, pero alguno de ellos ha observado algunas alteraciones que han sido atribuidas al factor edad y no a la condición herniaria39. La hidroxilacion de los aminoácidos prolina y lisina de la molécula de colágeno es un proceso esencial en la formación y estabilización de la triple hélice de colágeno. Nuestros resultados no muestran diferencias de hidroxilación de prolina, al igual que otros autores16 en pacientes con hernia. Sin embargo, fue observada una disminución significativa de la hidroxilación de la lisina en hernia inguinal directa de pacientes del grupo de mayor edad. Esto podría indicar alteraciones en el entrecruzamiento del colágeno que podrían afectar a la interacción con otros componentes de la matriz13.
Algunos autores11,41 han descrito alteraciones en el ratio colágeno I:III (a diferencia de nuestro grupo, que no ha demostrado diferencias significativas en este ratio en la FT entre los diferentes tipos de hernias). Un estudio reciente de revisión bibliográfica42 sobre las alteraciones del colágeno en pacientes con hernia inguinal afirma que existen evidencias de un significativo incremento del colágeno inmaduro tipo III respecto al colágeno maduro de tipo I, con la correspondiente pérdida de resistencia biomecánica. Sugiere que estas alteraciones pueden ser debidas a variaciones en el proceso de síntesis, maduración o degradación de la matriz colágena por las MMP, en combinación con otros procesos o independientemente. Los autores de esta revisión concluyen que tanto el desarrollo de hernia primaria como su recurrencia están asociados con una disminución del ratio de colágeno I:III.
Tras el estudio del componente colágeno, nuestro interés se centró en el análisis de diferentes MMP. Solo encontramos diferencias significativas en la expresión de MMP-2, cuyos sustratos principales son diferentes tipos de colágenos y otros componentes de matriz extracelular como fibronectina, elastina y proteoglicanos43. Nuestros resultados con MMP-2 demostraron que esta enzima está sobreexpresada en hernias directas a nivel tisular y en cultivos celulares obtenidos de la FT de estos pacientes15,28. Estos resultados quedan corroborados por las investigaciones de otros grupos, que muestran un incremento de MMP-1, MMP-2 y MMP-9 en la hernia inguinal, y afirman que estas enzimas juegan un papel muy importante en el desarrollo de esta patología44.
Otros grupos45 han mostrado, posteriormente, una disregulación del proceso de degradación de la matriz extracelular en pacientes con hernia inguinal, y muestran un significativo aumento de MMP-2 y 9 acompañado de disminución de sus inhibidores endógenos (TIMP). Los resultados de este estudio sugieren problemas en el metabolismo del colágeno que podrían ser el mecanismo fisiopatológico subyacente de formación de la hernia inguinal.
No existe apenas bibliografía que analice la importancia de los factores de crecimiento en el desarrollo de hernia inguinal. El TGF-β1 ha sido descrito como un importante modulador de las MMP30. En nuestro estudio, la sobreexpresión de TGF-β1 estaba correlacionada con la sobreexpresión de MMP2 en los pacientes portadores de hernia directa. Otros autores han demostrado, en cultivos de fibroblastos, una regulación selectiva de MMP-2 por TGF-β1 a nivel transcripcional y postranscripcional46. Otros autores47, de acuerdo con esta regulación, mantienen la posibilidad de que bajo condiciones patofisiológicas la digestión de la matriz extracelular por las MMP podría inducir la reacción tisular mediada por TGF-β liberado por el tejido conectivo. Todos estos resultados están de acuerdo con nuestros hallazgos en la FT de pacientes con patología herniaria.
Algunos autores48, en un modelo de hernia experimental en rata, han demostrado que la aplicación local de este factor de crecimiento no incrementa la resistencia biomecánica de la pared abdominal. Sin embargo, otro grupo de investigación49, utilizando también un modelo experimental en rata, afirma que el tratamiento con TGF-β2 previene el desarrollo de hernias, estimulando no solo la movilización de macrófagos y fibroblastos sino también un incremento del depósito de colágeno en la zona de la herida.
Respecto al componente elástico, nuestros estudios han mostrado una desorganización y reducción del número de fibras elásticas en la FT de pacientes con hernia inguinal directa, que se correspondía con la mínima expresión de LOXL-1, lo que impediría la reticulación normal de TE, y con la mayor expresión de elastasa, que degrada los componentes elásticos. Estos resultados enfatizan la importancia de LOXL-1 para evitar la pérdida de elasticidad de los tejidos en los que las fibras elásticas son esenciales para su correcta funcionalidad.
De acuerdo con nuestros resultados, otros grupos50 también han observado tanto fragmentación de fibras elásticas como reducción de su número a expensas de un incremento de la matriz extracelular en pacientes con hernia. Otros estudios han relatado una disminución de la cantidad total de fibras elásticas en el tejido conectivo en localizaciones distantes al sitio de la hernia como la vaina del músculo recto, apoyando la teoría de un desorden global del tejido conectivo51. Otros autores19, por el contrario, han reportado un significativo aumento de fibras elásticas en la fascia de pacientes con hernia inguinal directa.
No existen estudios dedicados al análisis de las enzimas implicadas en la reticulación de elastina en el tejido de la hernia. El único estudio existente52 analiza los niveles de cobre en el plasma y saco herniario de pacientes herniados, observando una disminución de este cofactor esencial para la LOX. Los autores proponen que los pacientes con hernia directa pueden mostrar problemas de síntesis de colágeno y elastina debido a una deficiente actividad de lisil oxidasa. Algunos autores53, de acuerdo a nuestros resultados, también han reportado un significativo aumento de la actividad elastinolítica en suero de pacientes con hernia directa.
Por último, el grupo de Junqueira et al.54 ha descrito una mutación genética que implica al tejido elástico y su disfunción a nivel de la FT.
Teniendo en cuenta nuestros hallazgos y los de otros autores, en relación con los factores biológicos implicados en la herniogénesis, podríamos concluir afirmando que los distintos elementos de la matriz extracelular del tejido conectivo juegan un importante papel en la génesis de hernias inguinales, y especialmente en un tipo: la hernia de tipo directo.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
*Autor para correspondencia:
Dpto. Especialidades Médicas, Facultad de Medicina,
Universidad de Alcalá, Ctra. A2 km 33,600,
28871 Alcalá de Henares, Madrid, España.
Correo electrónico: gemma.pascual@uah.es (G. Pascual González).
INFORMACIÓN DE ARTÍCULO
Historia del artículo:
Recibido el 27 de noviembre de 2012
Aceptado el 3 de diciembre de 2012