Introducción
El ibuprofeno (ácido 2-[4-isobutil-fenil]-propiónico) posee una importante actividad antiinflamatoria, analgésica y antipirética. Sus efectos terapéuticos, así como el perfil de reacciones adversas (RAM) que ocasiona, se deben a su efecto inhibidor de la actividad de las ciclooxigenasas1, enzimas que transforman el ácido araquidónico en endoperóxidos cíclicos inestables, los cuales se transforman en prostaglandinas (PG) y tromboxanos.
Las PG de los tipos E e I desempeñan un papel decisivo en el proceso inflamatorio, pues favorecen la vasodilatación, aumentan el flujo sanguíneo en la microcirculación y, al mismo tiempo, potencian la acción de otros mediadores como la bradicinina y la serotonina, capaces de incrementar la permeabilidad vascular y activar las terminaciones nerviosas potenciando el estímulo doloroso2. Por otro lado, se ha podido demostrar que la IL (interleucina)-1* y el TNF (factor de necrosis tumoral)-*, considerados los factores principales en la patogenia de la artritis reumatoide3, estimulan la producción de PGE2 en los sinoviocitos humanos4. Esta evidencia sugiere que la sobreproducción de PGE2, inducida por la IL-1* y TNF-*, desempeña un papel importante en la inflamación sinovial que caracteriza a la artritis reumatoide. Es fácil, por tanto, entender el efecto antiinflamatorio del ibuprofeno, ya que, al inhibir la acción de la ciclooxigenasa, evita la sobreproducción de PGE2.
La eficacia del ibuprofeno en el tratamiento de estos procesos artríticos5-8 o dolorosos9-13, y su seguridad14-17, hacen de este fármaco uno de los antiin-flamatorios no esteroideos (AINE) más utilizados en la práctica clínica. Recientemente se encuentra disponible para su prescripción una nueva for-
mulación de ibuprofeno, Neobrufen® Retard, en comprimidos de liberación retardada, para su administración una vez al día. Los comprimidos contienen 800 mg de ibuprofeno, y la administración de 2 comprimidos en una sola toma mantiene concentraciones plasmáticas efectivas del fármaco durante 24 h18, lo que permite su administración una vez al día. Esto supone una gran ventaja para todos los pacientes, aunque en especial para aquellos que precisan tomar medicación a largo plazo, pacientes ancianos y, en general, para todos aquellos pacientes polimedicados. Por otro lado, se ha observado que las concentraciones plasmáticas del ibuprofeno administrado en comprimidos de liberación retardada no experimentan modificaciones significativas cuando se administran a pacientes ancianos o a individuos jóvenes19.
La eficacia y la seguridad del nuevo preparado de ibuprofeno de liberación retardada han sido comparadas con formulaciones retardadas de piroxicam20 y diclofenaco21,22 en el tratamiento de procesos osteoarticulares crónicos; se ha constatado que el nuevo preparado se presenta como una alternativa terapéutica aceptable. Si bien el perfil de RAM de la nueva formulación de ibuprofeno no ha mostrado diferencias con respecto a la formulación convencional en los ensayos clínicos realizados hasta ahora18-24, el número de pacientes en los que se ha ensayado es limitado, ya que no superan los 700. Por ello, consideramos de interés valorar la seguridad del ibuprofeno de liberación retardada en condiciones de uso habitual y con ese objetivo se realizó este estudio multicéntrico, observacional, abierto, longitudinal y prospectivo.
Pacientes y métodos
Población de estudio
En el estudio, patrocinado por Abbott Laborato-
ries S.A., se incluyeron 4.370 pacientes mayores de
18 años, diagnosticados de artritis reumatoide, espondilitis anquilopoyética, artrosis u otros procesos reumáticos agudos o crónicos, así como lesiones traumáticas de tejidos blandos (indicaciones aprobadas). Los pacientes incluidos en el estudio debían firmar el consentimiento informado. Se excluyeron los pacientes con úlcera péptica activa o con antecedentes de hipersensibilidad (asma, rinitis o urticaria) a ibuprofeno u otros AINE.
Diseño del estudio
Estudio multicéntrico, abierto, observacional, longitudinal y prospectivo, realizado en condiciones de utilización habitual del fármaco para las indicaciones aprobadas. La selección de los pacientes se llevó a cabo por reumatólogos, traumatólogos o médicos de atención primaria entre pacientes no hospitalizados. En el momento en que el investigador decidía que el paciente podía beneficiarse del tratamiento con ibuprofeno, se le hacía entrega de la medicación de estudio para 20 días de tratamiento.
En la primera visita (basal), se registraba el patrón (agudo o crónico) y el diagnóstico del proceso patológico por el que se decidió iniciar el tratamiento con ibuprofeno, así como la información sobre la medicación concomitante y la medicación tomada por el paciente en los 3 días previos a su inclusión. El paciente debía tomar 2 comprimidos de ibuprofeno de 800 mg una sola vez al día, por la noche, durante los 20 días siguientes, o en el caso de pacientes agudos, el tiempo que se considerase oportuno. Transcurrido dicho período, el paciente acudía a la consulta para una segunda visita (final) en la que se recogían todos los acontecimientos adversos (AA) que había presentado y se documentaba la descripción del suceso, la gravedad, cualquier acción terapéutica adoptada y la resolución del acontecimiento junto con la valoración del investigador sobre la posible relación con la medicación objeto de estudio.
En aquellos casos en los que el investigador consideraba que se debía prolongar el tratamiento otros 20 días más, éste se realizaba bajo prescripción médica habitual. En estos casos, existía una tercera visita en la que se recogían igualmente todos los AA que se hubieran producido.
El estudio se siguió in house por el promotor del estudio. Periódicamente se llevó a cabo un seguimiento para controlar la inclusión de pacientes y reunir los cuadernos de recogida de datos de los pacientes que hubiesen finalizado el estudio. El seguimiento tuvo como objetivo principal el control detallado de los AA.
Análisis estadístico
En este análisis, se incluyeron 4.307 pacientes, todos ellos cumplieron con los criterios de inclusión y firmaron el consentimiento informado. De éstos, 4.273 tomaron al menos una dosis del fármaco en estudio.
La variable principal del estudio fue la tasa de AA y su posible o probable relación con la medicación de estudio. También se valoró la intensidad de los AA. Ésta se catalogó como leve (el AA es transitorio o fácilmente tolerado por el paciente y no interfie-
re en sus actividades cotidianas), moderado (el AA causa un malestar en el paciente o interfiere en sus actividades cotidianas) o severo (el AA imposibilita las actividades cotidianas o incapacita o pone en peligro la vida del paciente).
A los parámetros medidos en el estudio se les aplicaron técnicas descriptivas para variables cuantitativas: media, desviación estándar, tamaño (número de sujetos incluidos, datos perdidos) y valores mínimo y máximo.
El nivel de rechazo de la hipótesis nula para las pruebas estadísticas se situó en * = 0,05. La eva-luación estadística se realizó mediante el paque-
te estadístico homologado SAS 8.0 en versión
Windows.
Resultados
Datos demográficos
De los 4.370 pacientes incluidos en el estudio, tras la verificación de los criterios de inclusión, sólo se consideraron evaluables 4.307, los cuales habían tomado como mínimo una dosis de la medicación de estudio. De éstos, se registraron los AA de 4.273 pacientes. Los 34 pacientes para los que no se disponen estos datos corresponden a aquellos que no acudieron a la segunda visita.
La edad media de los pacientes fue de 57,18 ± 14,77 años, de ellos el 61,4% eran mujeres. Del total de pacientes analizados, el 58,11% presentaba un patrón clínico crónico, frente al 40,98% que presentaba un patrón clínico agudo.
El diagnóstico más frecuente para la prescripción de la medicación de estudio fue la artrosis (46,69%), seguido de otros procesos reumáticos (26,18%) y lesiones traumáticas (23,10%).
La duración media del tratamiento fue de 20,2 ± 5,8 días para la totalidad de la muestra, con una media de 20,9 ± 7,6 días en el caso de pacientes crónicos con algún AA, frente a los 18,9 ± 6,1 días para los pacientes agudos con algún AA.
En la visita basal, un 53,36% de los pacientes tomaba medicación concomitante; este valor disminuyó significativamente (p < 0,0001) al final del estudio, de tal forma que sólo el 11% de la muestra tomaba medicación concomitante transcurridos 20 días de tratamiento. La medicación concomitante más frecuente fue el paracetamol (5,25%) seguido del omeprazol (4,62%).
Acontecimientos adversos
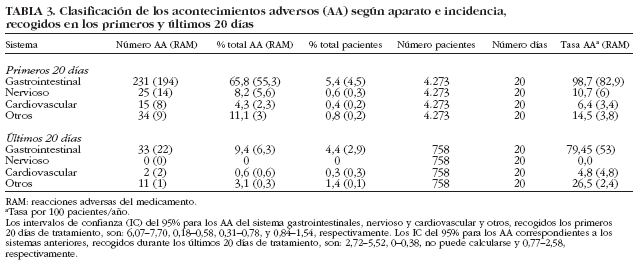
Hubo un total de 288 (6,7%) pacientes que presentaron 351 AA, de los que el 80% fueron de intensidad moderada y el 3% se consideraron de intensidad severa. La mayoría de los pacientes que indicaron tener algún tipo de AA (66,29%) presentaron un patrón inicial crónico, frente al 33,71% con patrón agudo. Un 86,9% de los AA tuvieron lugar durante los 20 primeros días del tratamiento, el resto durante los siguientes 20 días (tabla 1).
Al estudiar la relación de los AA con el fármaco de estudio (tabla 2), se encontró que los AA debidos probable o posiblemente al ibuprofeno correspondían al 49,84 y al 20,56%, respectivamente; para el 8,72% de los AA no se comunicó la relación con el fármaco del estudio.
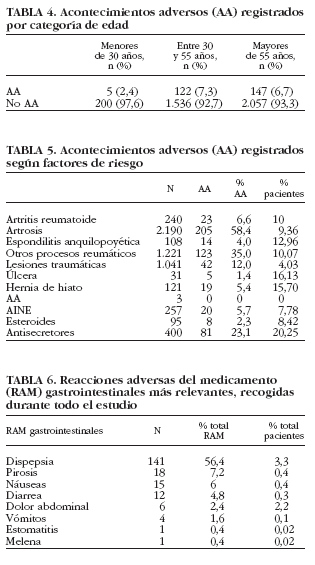
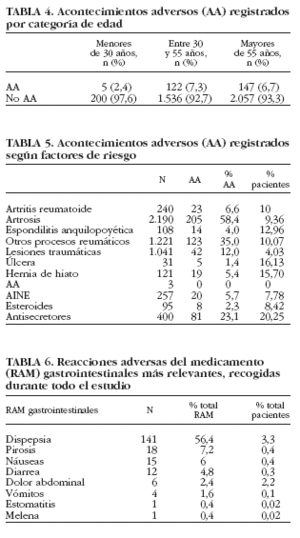
El 82% de los pacientes con AA únicamente presentaron un AA, el 15,3% 2 y sólo el 2,7% indicaron haber tenido más de 2 AA. Entre los AA y los RAM de mayor incidencia se encontraban los gastrointestinales, seguidos de los neurológicos y cardiovasculares (tabla 3). Al finalizar el estudio, el 68,6% de los pacientes que presentaron algún AA se consideraron recuperados, el 10,67% se encontraba en proceso de recuperación, el 0,61% se recuperó con secuelas, mientras que el 5,79% no se recuperó. Se consideró desconocido el resultado en el 14,02% de la población que presentó algún AA. Cuando se analizó la incidencia de los AA según la edad de los pacientes (tabla 4) se observó que los AA fueron más frecuentes en los sujetos de una edad comprendida entre 30 y 55 años (el 7,3% de ellos tuvo algún AA). La incidencia de RAM fue similar para el grupo de pacientes de 30-55 años y los mayores de 55 años (4,9%). Esta incidencia fue superior a la observada en los pacientes menores de 30 años (1,9%).
Se observó que pacientes que tenían factores de riesgo tales como úlcera péptica o hernia de hiato presentaron AA con mayor frecuencia que el resto de pacientes (tabla 5). También se observó una alta incidencia de AA en pacientes (20,25%) que tomaban medicación gastroprotectora como tratamiento concomitante. En cambio, no se observó que ninguna de las indicaciones, para las que se administró el tratamiento de estudio, estuviese asociada a una incidencia de AA más elevada.
Acontecimientos adversos gastrointestinales. Los AA gastrointestinales (264) fueron los más frecuentes, tanto durante los primeros 20 días del tratamiento como durante los últimos 20 días, 75,2% del total de AA ocurridos en el estudio. Ello supuso una incidencia respecto del total de la población del 6,1% (tabla 3). El 62,96% de los AA gastrointestinales se dieron en pacientes crónicos, frente al 37% en pacientes con patrón agudo.
El 57,2% respecto del total de AA gastrointestinales se consideró probablemente relacionado con el tratamiento del estudio, mientras que el 24% fue catalogado como posiblemente relacionado con el fármaco; no se comunicó la relación de causalidad en el 7,4%.
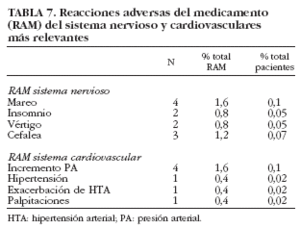
Al analizar globalmente el tipo de RAM gastrointestinales que se produjeron (tabla 6), se observó que la dispepsia, en la que se incluyen epigastralgias y gastralgias, fue la más frecuentemente registrada (56,4%).
En cuanto a la gravedad de los AA gastrointestinales, se observó que el 95% correspondía a una intensidad moderada. El 6,18% de los pacientes tuvo necesidad de tomar medicación gastroprotectora.
Al finalizar el estudio, el 72,94% de los pacientes que presentó algún AA gastrointestinal se consideró recuperado; el 10,66% se encontraba en proceso de recuperación; el 0,82% se recuperó con secuelas, y el 4,92% no se había recuperado en el momento de finalizar la recogida de datos del paciente. Se consideró desconocido el resultado en el 10,66% de la población que presentó algún AA gastrointestinal.
Acontecimientos adversos relacionados con el sistema nervioso. Hubo 25 AA relacionados con el sistema nervioso, lo que representó el 8,2% del total de AA ocurridos en el estudio y el 0,6% sobre el total de pacientes (tabla 3). El 83,3% de los AA de origen nervioso se dio en pacientes crónicos, frente al 16,6% en pacientes con patrón agudo.
Del conjunto de AA del sistema nervioso, el 44,4% se consideró probablemente relacionado con el tratamiento del estudio, mientras que el 16,6% fue catalogado como posiblemente relacionados con el fármaco y en el 5,5% no fue comunicado el grado de relación con el ibuprofeno de liberación retardada.
En cuanto a la gravedad de los AA del sistema nervioso, se observó que el 94,4%17 presentó una intensidad moderada. Al finalizar el estudio, el 72,2% de los pacientes que presentaron algún AA relacionado con el sistema nervioso se consideraron recuperados y el 11,1% se encontraba en proceso de recuperación. Se desconoció el resultado en el 16,66% de la población que presentó algún AA relacionado con el sistema nervioso.
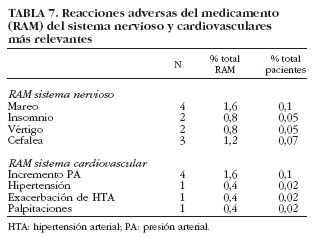
Al analizar globalmente los RAM más relevantes referidos al sistema nervioso (tabla 7), se observó que los mareos y las cefaleas fueron los más frecuentes.
Acontecimientos adversos relacionados con el aparato cardiovascular. Hubo 10 AA relacionados con el sistema cardiovascular, lo que representó un 2,8% del total de AA ocurridos en el estudio y del 0,23% sobre el total de pacientes (tabla 3). El 86,6% de los AA cardiovasculares se dio en pacientes crónicos, frente al 13,3% en pacientes con patrón agudo.
Respecto al total de AA cardiovasculares, el 26,6% se consideró probablemente relacionado con la nueva formulación de ibuprofeno de liberación retardada, mientras que el 13,3% fue catalogado como posiblemente relacionado con el fármaco y en el 26,6% no fue comunicado el grado de relación con el fármaco del estudio. Todos los AA cardiovasculares fueron de intensidad moderada.
Al finalizar el estudio, se consideró que 66,6% de los pacientes que presentó algún AA cardiovascular se había recuperado, mientras que el 13,3% se encontraba en proceso de recuperación. Asimismo, se consideró desconocido el resultado en el 20% de la población que presentó algún AA cardiovascular.
Al analizar qué tipo de RAM cardiovasculares se produjeron, se observó que los RAM relacionados con un aumento de la presión arterial fueron los más frecuentes (1,15%) (tabla 7).
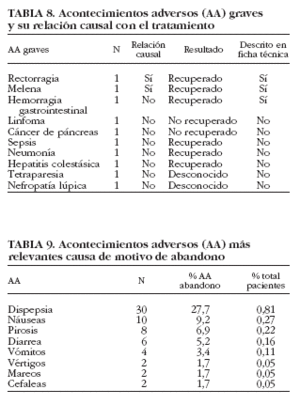
Acontecimientos adversos graves. Hubo 5 pacientes que presentaron un total de 10 AA graves, lo que supuso una incidencia respecto a la población de estudio del 0,12%. El 91% de los AA graves se produjo en pacientes que presentaban una sintomatología crónica, para la cual se prescribió la medicación del estudio.
En la tabla 8 se describen los 10 AA graves ocurridos durante el estudio. Se notificaron 2 AA graves (rectorragia y melenas) consideradas por los investigadores clínicamente significativas. A pesar de ello, no se realizó ninguna exploración diagnóstica adicional ni seguimiento posterior para confirmar o descartar la relación causal de estos 2 AA con la medicación del estudio. El 80% de los AA graves no estuvo relacionado con el tratamiento. En cuanto al resultado, únicamente aquellos AA correspondientes a procesos cancerosos o autoinmunes no indicaron recuperación.
Abandonos
El 12,7% de los pacientes indicó que abandonaba el estudio. De éstos, el 19,7% lo hizo tras presentar algún tipo de AA, lo cual representó que el 2,5% de la población total del estudio abandonó por AA. Al analizar estos abandonos, se observó que en el 86,79% tuvieron relación posible o probable con
el fármaco en estudio.
En la tabla 9 se resumen los AA más frecuentes de los pacientes que abandonaron por esa causa. De ellos, la dispepsia fue la causa más común (27,7%).
Entre el resto de los abandonos, el 37,59% se debió al deseo explícito del paciente, el 13,69% a falta de eficacia, el 4,2% fue por pérdida de seguimiento y el 23,36 a otros motivos no especificados.
Discusión
Una de las principales preocupaciones de la utilización de los AINE es la incidencia de efectos adversos gastrointestinales y sus complicaciones. La participación de dichos fármacos en la lesión de la mucosa gástrica se debe a 2 mecanismos diferentes, uno tópico y otro de naturaleza sistémica. El primero de ellos se basa en la naturaleza ácida de los AINE, que promueve la acumulación de moléculas ionizadas en el interior de las células que constituyen el epitelio gástrico, lesionándolo. El mecanismo sistémico es el más relevante, ya que, al inhibir la acción de la ciclooxigenasa, se promueve el descenso de las PG y de su acción gastroprotectora, ocasionando daños gastrointestinales25.
La incidencia de RAM gastrointestinales relacionados con la administración de AINE es variable, ya que no sólo depende del tipo de AINE empleado sino también del tipo de pacientes, la dosis y la duración del tratamiento26-30.
El ibuprofeno, empleado en dosis de 1.200 mg/día y en tratamientos de corta duración, es un AINE muy bien tolerado, con una tasa de RAM gastrointestinales similar a la del placebo28. De hecho, la tolerabilidad gastrointestinal del ibuprofeno en las condiciones mencionadas es tan buena como la del paracetamol y significativamente mejor que la de la aspirina29. Al analizar varios estudios30, se observó que, en pacientes tratados con AINE, la incidencia anual de RAM gastrointestinales estaba entre el 2,5-4,5% y que podían ser graves en un porcentaje entre el 1-1,5%31. Sin embargo, el uso de AINE en pacientes crónicos implica tratamientos prolongados y el empleo de dosis terapéuticas mayores, lo cual conduce a una peor tolerancia del fármaco y a un aumento de las complicaciones habituales. De hecho, los pacientes diagnosticados de problemas reumáticos son los consumidores más frecuentes de AINE, por lo que presentan un riesgo potencial mayor de presentar RAM31. Estudios clínicos realizados en grupos de pacientes artríticos, con tratamientos prolongados de varias semanas y dosis diarias de 1.600 mg de ibuprofeno, revelan una incidencia de RAM próxima al 10%, la mayoría de ellos de carácter gastrointestinal21.
Estos resultados se reflejan igualmente en el presente estudio, donde la incidencia de RAM, tanto gastrointestinales como de otro tipo, fue mayor en los pacientes crónicos que en los que presentaron un patrón agudo de la enfermedad, por el que se prescribió la nueva formulación de ibuprofeno de liberación retardada.
Es un hecho conocido que aunque los estudios observacionales tienen limitaciones, en ocasiones pueden ser metodológicamente criticables, pero no por ello dejan de ser útiles, ya que aportan información sobre la realidad del fármaco del estudio en la práctica clínica real, tal como se demuestra en recientes publicaciones32,33. Si bien en el presente estudio se observó una tasa de AA ligeramente inferior a la referida en estudios aleatorios21, resultó ser del mismo orden a la de otros estudios observacionales similares27. Cabe destacar que los resultados en relación con el tipo de AA ocurridos fueron muy parecidos a los observados en otros estudios21,28, sobre todo con AA de tipo gastrointestinal, clásicamente asociados a la administración de AINE.
La frecuencia de AA y de RAM registrada en este estudio es parecida a la observada en otros, al igual que la tasa por año registrada de RAM (130,26 y 110,75 en los primeros y últimos 20 días de tratamiento, respectivamente). Cuando la tasa de RAM se comparó con la publicada para estudios de corta duración (3 o 4 semanas) en los que se utilizó ibuprofeno para el tratamiento de procesos agudos (extracciones dentales y artrosis de rodilla, entre otros), se observaron valores similares34,35. En uno de estos estudios de corta duración, la tasa de RAM a las 3 semanas fue de 135,634, mientras que en un segundo de 4 semanas de duración fue de 13035.
Los datos de la bibliografía internacional36 muestran que la utilización de medicación gastroprotectora en grupos de población en tratamiento con AINE, alcanzó el 16% en pacientes sin factores de riesgo asociados. Dicha cifra se incrementó hasta el 30% en pacientes con factores de riesgo asociados, como una edad > 75 años o alteraciones gastrointestinales previas36. En nuestro estudio, el porcentaje de pacientes que tomó medicación gastroprotectora fue relativamente bajo. El uso de protectores gástricos es recomendable en aquellos pacientes que reciban AINE y que presenten algún factor de riesgo asociado (mayores de 60 años, úlcera péptica, hernia de hiato, etc.)37. En el presente estudio, se administró ibuprofeno siguiendo la práctica clínica habitual. Se desconoce si se prescribió gastroprotección concomitante sólo en aquellos pacientes con factores de riesgo.
Si bien el uso de protectores gástricos es recomendable durante la administración de AINE, ya que reducen la sintomatología de algunos de los efectos contraproducentes que el empleo prolongado de AINE ocasiona, en ocasiones pueden llegar a enmascarar problemas gastrointestinales graves al hacerlos asintomáticos. Así, algunos estudios internacionales revelan que pacientes que toman medicación gastroprotectora tienden a presentar el doble de complicaciones gastrointestinales graves que pacientes que no la toman31,36. Esta controversia podría ser la causa del reducido uso de protectores gástricos en los sujetos participantes en el presente estudio.
No se observó un incremento del riesgo de úlcera péptica, una de las complicaciones asociadas al uso de altas dosis de ibuprofeno38. La incidencia de úlcera péptica fue parecida a la observada para otros AINE.
Es conocida la influencia de los AINE sobre la regulación de la presión arterial. La tasa de incidencia de hipertensión y edemas periféricos durante el tratamiento con AINE es baja, aunque puede variar desde menos del 1% de los pacientes hasta, en algunos casos, más del 9%39. Los datos aportados por el presente estudio confirmarían dicha información, ya que, aunque las complicaciones cardiovasculares tuvieron una incidencia escasa, inferior al 1% relatado en la bibliografía40, éstas fueron principalmente aumentos de la presión arterial y edemas, ya descritos en la ficha técnica. Los RAM relacionados con el sistema nervioso tampoco fueron diferentes a los recogidos en la ficha técnica del producto, ya que se trató principalmente de mareos, insomnio y cefaleas.
Las complicaciones graves producidas por el tratamiento con AINE suelen ser gastrointestinales, en su mayoría hemorragias digestivas o úlceras28, con una incidencia del 1 al 2%26,30. El tipo de RAM graves ocurridos en el presente estudio, aunque de incidencia menor a la mencionada anteriormente, corresponde al tipo de complicaciones relatadas en la bibliografía, ya que todos los RAM graves ocurridos fueron de naturaleza gastrointestinal. Asimismo, al analizar los abandonos producidos por RAM, se observó, como era esperable, que eran mayoritariamente de naturaleza gastrointestinal.
Como conclusión, cabe señalar que los resultados de este estudio indican una favorable tolerabilidad del Neobrufen® Retard, tanto en pacientes crónicos como en agudos, y los RAM observados se correspondieron con los reflejados en la ficha técnica del producto.