Introducción
Se considera que la osteoporosis es una enfermedad propia de las mujeres posmenopáusicas. Sin embargo, en ocasiones este proceso puede presentarse en mujeres jóvenes. Aunque el cuadro clínico es similar, existen unas características peculiares que diferencian la osteoporosis de la mujer joven. En este sentido, las mujeres premenopáusicas tienen con mayor frecuencia una osteoporosis «secundaria» o asociada a otros procesos, entre los que destacan el tratamiento con glucocorticoides, el síndrome de Cushing, la osteogénesis imperfecta y la osteoporosis del embarazo, entre otros; mientras que alrededor del 50% de las pacientes presenta una osteoporosis idiopática, en estos casos la existencia de hipercalciuria y los antecedentes familiares de osteoporosis son frecuentes. Adicionalmente, la edad de las pacientes y la posibilidad de futuros embarazos completan el cuadro diferencial. Todo ello condiciona que el abordaje y la actitud terapéutica en estas pacientes sea distinto de los de la mujer posmenopáusica.
Incidencia
Los estudios que analizan la incidencia de osteoporosis en la población joven, y concretamente en la mujer premenopáusica, son escasos. Sin embargo, si asumimos una distribución de Gauss de la densidad mineral ósea (DMO) en la población general, alrededor de un 0,5% de los adultos jóvenes pueden tener una osteoporosis según los criterios de la Organización Mundial de la Salud (OMS)1. Así, se ha indicado que la prevalencia de osteoporosis densitométrica en la columna lumbar en mujeres jóvenes en nuestra población es del 0,34%; este dato se refiere a mujeres con edades comprendidas entre los 20 y 44 años. La prevalencia en el cuello del fémur en el mismo grupo de población es del 0,17%; la prevalencia aumenta al 4,3% cuando se incluye a mujeres con edad superior a los 45 años2. En otros grupos de población, como en la norteamericana, la prevalencia de osteoporosis en mujeres jóvenes es más baja3, con una incidencia estimada de 4,1 por 100.000 personas/año en individuos jóvenes4. Es interesante resaltar que si bien en adultos el desarrollo de osteoporosis es más frecuente en la mujer, en la población joven la incidencia de este proceso es similar en ambos sexos, con una relación mujer:varón de 1,2:14. Además, en este grupo de población el desarrollo de osteoporosis suele asociarse a causas secundarias, y el tratamiento con glucocorticoides es una de las causas más frecuentes4.
Aunque los estudios que analizan la incidencia de fracturas en este grupo de población son escasos, la incidencia estimada de fracturas vertebrales en individuos jóvenes (< 35 años) es de 3 * 100.000 personas/año, que asciende a 21 * 100.000 personas/año en la población de 35 a 44 años5. En estos individuos, especialmente en los más jóvenes, las fracturas vertebrales con frecuencia son de origen traumático5. A pesar de ello, es importante resaltar que la presencia de fracturas en este grupo de población, especialmente las de radio distal, se asocia a una disminución de la masa ósea6,7 y que, además, constituye un factor de riesgo para presentar futuras fracturas en la posmenopausia8.
Factores determinantes de la masa ósea
Existen varios factores que influyen en la adquisición del «pico» de masa ósea y en su evolución a lo largo de la vida. Así, factores genéticos junto a ambientales, como el ejercicio y la dieta, y factores hormonales son los principales determinantes en la adquisición del pico de masa ósea. Habitualmente, el valor máximo de DMO en la columna lumbar se alcanza entre los 25 y 35 años de edad, y es muy similar en ambos sexos hasta los 40 años9,10. A partir de esta edad, la evolución es diferente ya que el déficit estrogénico influye de forma importante en la pérdida ósea en las mujeres; este déficit se produce de forma gradual, de modo que unos años antes de la menopausia (alrededor de 3 años) en la mujer suele iniciarse un aumento de la pérdida de masa ósea que con frecuencia se asocia a un incremento de los valores de gonadotrofinas séricas, (FSH) y a una disminución del estradiol11-13.
Varios factores se han relacionado con una disminución de la masa ósea en la mujer premenopáusica adulta. Así, un índice de masa corporal bajo durante la menarquia se ha asociado a una disminución de la masa ósea en mujeres adultas de 40-45 años14, mientras que el bajo peso, una edad de menarquia superior a los 15 años y la inactividad física durante la adolescencia son factores que se han asociado a una disminución de la masa ósea en mujeres jóvenes de menos de 35 años15. Debe recordarse que la adolescencia es un período crítico en el crecimiento y la adquisición de la masa ósea, ya que aproximadamente el 86% del pico de masa ósea se alcanza antes de los 14 años o bien a los 2 años de la menarquia16. Por ello, la exposición a factores deletéreos o la presencia de enfermedades que puedan afectar al metabolismo óseo durante este período podrán influir en gran medida en la masa ósea en la edad adulta.
Causas de osteoporosis en la mujer premenopáusica
Osteoporosis secundaria
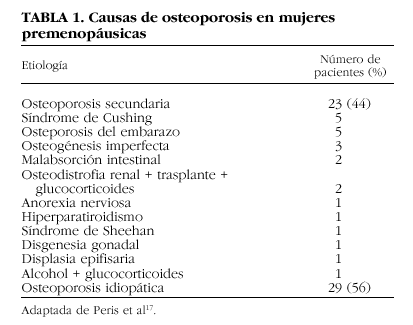
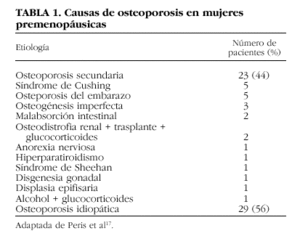
En la mujer joven, la presencia de uno o más factores asociados al desarrollo de osteoporosis es frecuente. Así, se ha descrito que alrededor del 50% de las pacientes presentan enfermedades o fármacos relacionados con el desarrollo de esta patología ósea17,18. Entre las causas más frecuentes de osteoporosis en individuos jóvenes destaca el tratamiento prolongado con glucocorticoides4. Un estudio reciente que analiza las causas más frecuentes de osteoporosis en mujeres premenopáusicas señala que el síndrome de Cushing, la osteoporosis asociada al embarazo y la osteogénesis imperfecta son algunas de las causas de osteoporosis secundaria más frecuentes en este grupo de población; además, indican que la osteoporosis idiopática es muy frecuente en este grupo de pacientes, en donde el antecedente de osteoporosis familiar o bien la presencia de hipercalciuria son hallazgos habituales (tabla 1)17. Existen otros procesos que también han sido implicados en el desarrollo de osteoporosis en estas pacientes, entre los que destacan: la malabsorción intestinal, enfermedades endocrinas (hipertiroidismo, hiperparatiroidismo, hipopituitarismo), la anorexia nerviosa, las enfermedades inflamatorias, como la artritis reumatoidea, la mastocitosis sistémica, y ciertos fármacos (anticonvulsionantes, heparina)17-21. En los últimos años también se ha incluido en este grupo la osteoporosis de los pacientes sometidos a un trasplante de órgano22. Asimismo, en la perimenopausia la presencia de osteoporosis también suele asociarse a una causa secundaria en el 50% de los casos; el déficit estrogénico, el tratamiento con glucocorticoides, el hipertiroidismo y el tratamiento anticonvulsionante son algunas de las causas más frecuentes de osteoporosis en este grupo de población18.
Como se ha comentado previamente, el tratamiento crónico con glucocorticoides es una de las causas más frecuentes de osteoporosis secundaria. La mayoría de los estudios que analizan el impacto de los glucocorticoides en el tejido óseo coinciden en demostrar que todos los pacientes, jóvenes y ancianos, varones y mujeres, son susceptibles al efecto de los glucocorticoides sobre la masa ósea23,24. Así, aunque las mujeres posmenopáusicas tienen un mayor riesgo para presentar fracturas, los individuos jóvenes también pueden perder masa ósea de forma acelerada. De hecho, entre un 18-22% de mujeres jóvenes premenopáusicas que siguen tratamiento prolongado con dosis altas de prednisona desarrollan una osteoporosis25,26. Se desconoce claramente la dosis a partir de la cual los glucocorticoides afectan al tejido óseo, pero parece que dosis de 5 mg/día de prednisona o superiores ya inducen, en la mayoría de los individuos, una pérdida de masa ósea, más intensa durante los primeros meses de tratamiento24. Los corticoides inhalados también han mostrado un efecto deletéreo sobre la masa ósea; aunque su efecto en la mujer premenopáusica es controvertido. Así, mientras Israel et al27 observaron una pérdida de masa ósea en mujeres premenopáusicas que seguían dicho tratamiento, Fujita el al28 no confirmaron estos resultados.
Osteoporosis idiopática
Existen pocos estudios que analicen la osteoporosis idiopática en la mujer. En líneas generales, se considera que esta enfermedad tiene una incidencia similar en ambos sexos4. Aunque se desconoce la causa exacta de esta entidad, es probable que se trate de un proceso heterogéneo en cuanto a sus mecanismos etiopatogénicos. Así, algunos pacientes presentan antecedentes familiares de osteoporosis17, mientras que en otros se ha descrito la existencia de una hipercalciuria asociada; esta última oscila alrededor del 40-50% de los casos, y con relativa frecuencia se asocia a litiasis renal17,29. De hecho, tanto la litiasis renal recidivante como la hipercalciuria idiopática se han asociado con una pérdida de la masa ósea30-33, y aunque la causa de esta pérdida no está totalmente aclarada, se supone que el balance negativo de calcio, y posiblemente el aumento de los valores de 1-25-dihidroxivitamina D, que se han observado en algunos pacientes, podrían favorecer la pérdida ósea mediante un incremento de la resorción ósea34-36.
La elevada frecuencia de antecedentes familiares de osteoporosis que se observa en estos pacientes confirma la relevancia que los factores genéticos tienen en la adquisición del pico de masa ósea. De hecho, la historia familiar de fracturas por insuficiencia es un conocido factor de riesgo relacionado con la presencia de osteoporosis1,37,38. En este sentido, un estudio previo evidenció que alrededor del 50% de las hijas de mujeres adultas con osteoporosis tenían una osteopenia39. Estos hallazgos coinciden con los aportados por Cohen-Solal et al40 en varones con osteoporosis idiopática, en los que observan una disminución de la masa ósea en los familiares de primer grado, y con la reciente asociación del polimorfismo del gen del COL1A1 en algunos de estos pacientes41,42, aunque este último hallazgo no se ha confirmado en otras poblaciones43.
Si bien no existen unas características específicas que identifiquen a las pacientes con osteoporosis idiopática, estas mujeres suelen tener un menor índice de masa corporal y una mayor escala Z en el cuello del fémur que las mujeres con osteoporosis secundaria17. Algunos autores atribuyen este hallazgo a una afectación predominante del hueso trabecular en la osteoporosis idiopática44. Por otro lado, el índice de masa corporal es un conocido factor de riesgo en relación con el desarrollo de osteoporosis y fracturas. De hecho, este parámetro se asocia a los valores de masa ósea en las mujeres premenopáusicas, y valores inferiores a 19 kg/m2 en el índice de masa corporal se consideran un factor de riesgo de osteoporosis37.
Diagnóstico
La definición de osteoporosis indica que se trata de un desorden esquelético que cursa con una disminución de la resistencia ósea (reflejo de la calidad y de la DMO) que predispone a presentar fracturas18, y su diagnóstico se basa principalmente en la detección de una masa ósea baja asociada o no al desarrollo de fracturas. Es por todos conocido que en 1994 se establecieron unos criterios de diagnóstico, los criterios de la OMS válidos para las mujeres caucásicas posmenopáusicas45. Sin embargo, la utilización de estos criterios en la población joven no está aclarada. A pesar de ello, la mayoría de los estudios incluyen este valor como criterio diagnóstico de osteoporosis en este grupo de población. Se ha sugerido que, dada la edad de los pacientes, un valor de escala Z < 1 asociado a la presencia de fracturas por fragilidad podría considerarse indicativo de una osteoporosis17. Sean o no válidas estas sugerencias, no hay normas establecidas, y es probable que el criterio actual (escala T < 2,5) sea adecuado.
Una vez realizado el diagnóstico de osteoporosis se deberá realizar un estudio minucioso para descartar una osteoporosis secundaria que inicialmente incluya: hemograma, sideremia, ionograma, proteínas, función hepática y renal, y calcio en orina de 24 h. También es aconsejable determinar en todos los casos los valores de estradiol y gonadotrofinas y la concentración sérica de 25-hidroxivitamina D. Se valorarán otras determinaciones hormonales, como hormona paratiroidea, hormonas tiroideas, prolactina, IGF-I o cortisol en orina, así como la determinación de los anticuerpos antigliadina y antiendomisio (si se sospecha una enfermedad celíaca). El diagnóstico de osteoporosis idiopática se establecerá sólo cuando se hayan excluido otras causas secundarias.
En las pacientes con osteoporosis idiopática e hipercalciuria, se deberán descartar otras enfermedades que induzcan un aumento de la excreción urinaria de calcio, especialmente la enfermedad de Cushing, el hipertiroidismo y el hiperparatiroidismo. Además de la cuantificación de la excreción urinaria de calcio, es aconsejable la determinación de sodio, potasio, oxalato y citrato, con el fin de evaluar la influencia de la dieta en la hipercalciuria.
La determinación de marcadores bioquímicos del remodelado óseo puede aportar información adicional sobre el recambio óseo en estas pacientes y sobre la respuesta al tratamiento.
Tratamiento
Es aconsejable una serie de normas básicas en todas las pacientes, que deben incluir un estilo de vida que comporte ejercicio físico y una ingesta adecuada de calcio46, además de evitar el consumo de tabaco y alcohol.
Existen muy pocos estudios sobre el tratamiento farmacológico en este grupo de población, que dependerá de la etiología de la osteoporosis. Así, se valorará el tratamiento hormonal sustitutivo (THS) o anovulatorios en las pacientes que presentan alteraciones menstruales, siempre que no esté contraindicado. Este hecho es especialmente frecuente en la anorexia nerviosa en donde, además del tratamiento estrogénico20,47,48, también se han ensayado otros tratamientos, como la dihidroepiandrosterona que se han mostrado igualmente efectivos en la prevención de la pérdida de masa ósea49. Sin embargo, en esta entidad la recuperación del peso corporal es uno de los factores más importantes en relación con el incremento de la DMO20.
Los moduladores selectivos de los receptores estrogénicos, como el raloxifeno, no deben utilizarse en la mujer premenopáusica para el tratamiento de la osteoporosis; sólo pueden indicarse en mujeres jóvenes menopáusicas. Un estudio realizado en mujeres jóvenes con amenorrea secundaria a tratamiento con análogos de las gonadotrofinas evidenció que el tratamiento con raloxifeno prevenía la pérdida ósea en estas mujeres50.
En pacientes con osteoporosis idiopática asociada a hipercalciuria se recomendará una restricción del sodio de la dieta con el fin de disminuir la excreción de calcio en la orina51. En estas pacientes se debe evitar la reducción de la ingesta de calcio en la dieta, para evitar un balance negativo de calcio36. De hecho, se ha descrito que la ingesta baja de calcio (< 500 mg/día) puede aumentar el riesgo de presentar litiasis renal, en individuos sin historia previa de litiasis52, y estudios recientes indican que la ingesta de 1.200 mg de calcio al día mediante la dieta, junto a una restricción del sodio y de las proteínas de origen animal, disminuye la calciuria y previene nuevos episodios de litiasis en pacientes con litiasis hipercalciúrica53. Los diuréticos tiacídicos, la clortalidona, la indapamida y el amiloride son anticalciúricos. De hecho, las tiazidas pueden reducir la excreción urinaria de calcio alrededor de un 50% y aumentan la reabsorción tubular de calcio54, aunque en la hipercalciuria absortiva su efecto disminuye con el tiempo55. Su utilización en pacientes con osteoporosis asociada a hipercalciuria se ha relacionado con un aumento de la DMO y una disminución de la calciuria55,56. Además, el uso prolongado de este fármaco se ha asociado con un aumento de la DMO y con una reducción del riesgo de fractura de fémur en población de edad avanzada58-61.
También se ha propuesto el tratamiento con somatotropina (GH) o IGF-I, aunque con resultados controvertidos, ya que mientras algunos autores demuestran un aumento de masa ósea62, otros no confirman estos resultados63,64, y un estudio multicéntrico en adultos con deficiencia de GH no evidencia variaciones en la masa ósea tras un año de tratamiento65. Estas discrepancias podrían estar relacionadas con la duración y las dosis utilizadas. Aunque también se ha indicado que la respuesta al tratamiento con GH puede depender de la edad y del sexo del paciente, los pacientes más jóvenes y los varones son los que obtienen la mejor respuesta con esta terapia66.
El tratamiento de la osteoporosis secundaria a otras enfermedades y/o fármacos debe abordarse dependiendo de la causa asociada. Así, el tratamiento de la propia enfermedad puede asociarse a un marcado aumento de la masa ósea en algunos pacientes. Este hecho es especialmente frecuente en los pacientes con síndrome de Cushing, en los que se ha descrito un aumento de la masa ósea superior al 15% al año de la intervención67, y también en pacientes con hiperparatiroidismo primario e hipertirodismo68,69. Del mismo modo, las mujeres con osteoporosis asociada al embarazo presentan un aumento espontáneo y progresivo de la masa ósea tras el embarazo70. Sin embargo, a pesar de este aumento, los valores de masa ósea no alcanzan los valores normales, por lo que algunos autores sugieren que estas pacientes probablemente tienen una masa ósea baja antes del embarazo71. Aunque se desconoce el tratamiento de este proceso, es aconsejable una ingesta correcta de calcio y vitamina D durante el embarazo y se desaconseja la lactancia (debido a la pérdida ósea que se produce durante este período); no se contraindican nuevos embarazos72.
Existen varias opciones en el tratamiento de la osteoporosis corticoidea. Así, el tratamiento con bisfosfonatos, como etidronato73, alendronato74 y risedronato75, se ha mostrado efectivo en la prevención de la pérdida de masa ósea y en la disninución de fracturas vertebrales en estas pacientes. Sin embargo, debe recordarse que el número de mujeres premenopáusicas que se incluye en estos estudios es muy pequeño, por lo que la información sobre el tratamiento y la prevención de la osteoporosis con glucocorticoides y bisfosfonatos en este grupo concreto de pacientes es escasa. A pesar de ello, se recomienda iniciar tratamiento antirresortivo en pacientes de riesgo, con dosis de 5 mg/día de alendronato o bien de 5 mg/día de risedronato76. La calcitonina se considera un agente de segunda línea en esta enfermedades, y puede utilizarse en las pacientes que presenten contraindicaciones o que no toleren los bisfosfonatos76,77.
En otros procesos, como en la osteogénesis imperfecta, especialmente en las formas graves asociadas a múltiples fracturas, el tratamiento con bisfosfonatos, concretamente con pamidronato EV, se ha asociado a un aumento de la masa ósea y a una disminución de las fracturas, con resultados similares en pacientes con osteoporosis juvenil78,79. Sin embargo, el efecto a largo plazo de los bisfosfonatos en el tejido óseo no está totalmente aclarado. Así, recientemente se ha indicado el desarrollo de un caso de osteopetrosis en un niño tratado con dosis altas de pamidronato80, y resultados preliminares apuntan hacia un retardo en la consolidación de las fracturas en niños con osteogénesis imperfecta que siguen tratamiento con este fármaco81. Es probable que la dosis acumulada de estos preparados deba controlarse en este grupo de población, así como su efecto sobre el remodelado óseo82. En individuos adultos con osteogénesis imperfecta también se ha observado un aumento de la masa ósea y una disminución de las fracturas tras tratamiento con bisfosfonatos, en este caso con neridronato EV83. Los temas principales a tener en cuenta al utilizar este tipo de tratamiento en población joven premenopáusica son su efecto sobre la consolidación de las fracturas y la teratogenidad. Debido a que se ha observado un retardo de la mineralización ósea en pacientes con osteogénesis imperfecta a los que se les ha realizado osteotomías correctoras, algunos facultativos aconsejan retirar el tratamiento con bisfosfonatos 6 meses antes de la intervención y no introducirlo hasta que se haya formado el callo de fractura82. Se desconoce si el depósito de bisfosfonatos en el tejido óseo de mujeres jóvenes puede causar efectos teratógenos tras su movilización ósea. Sin embargo, hasta la fecha no se han descrito anomalías congénitas en los niños de casos aislados de mujeres que han sido tratadas con alendronato82.
Por todo ello, la Sociedad Canadiense de Metabolismo Mineral84 señala que el tratamiento de la osteoporosis en la mujer premenopáusica debe abordarse con cautela, e indica la utilización de bisfosfonatos en la osteoporosis secundaria, especialmente en la osteoporosis por glucocorticoides, y también en otros casos aislados de osteoporosis (probablemente en aquellos en los que las pacientes presentan una disminución de la masa ósea asociada al desarrollo de fracturas). Además contraindican la utilización de estos preparados durante el embarazo. Asimismo, sugieren que la calcitonina puede ser un fármaco útil en este grupo de población debido a su seguridad, aunque indican la falta de estudios que confirmen la utilidad de este fármaco en este grupo de población84. De hecho, el tratamiento con calcitonina por vía nasal a dosis de 100 UI/día se ha mostrado insuficiente en la prevención de la pérdida de masa ósea en mujeres jóvenes85. Por último, se debe recordar que el empleo de teriparatida (PTH intermitente) podría ser una opción terapéutica en este grupo de población, aunque son precisos estudios que confirmen esta hipótesis.