Introducción
La leflunomida (LFN) es un agente inmunomodulador que se ha incorporado recientemente, como fármaco modificador de la enfermedad (FME), al tratamiento de la artritis reumatoide (AR)1-4; es en realidad un profármaco que, tras su administración oral, se transforma en el metabolito activo A77 1726. Químicamente es un derivado isoxazólico capaz de inhibir la síntesis de pirimidinas y, por tanto, la proliferación de linfocitos T activados5. Esto se debe a la capacidad que tiene esta molécula de inhibir la dihidroorotato-deshidrogenasa1,6, enzima clave para la síntesis de novo de pirimidinas. Además, la leflunomida presenta otras actividades interesantes desde el punto vista de la patogenia de la AR, como son: la capacidad de inhibir la activación de NF-κB, factor de transcripción clave en el estímulo de la síntesis de citocinas proinflamatorias, como el TNF-α o la IL-17,8; inhibición de la expresión de moléculas de adhesión celular9; inhibición de la síntesis de metaloproteasas10; reducción de la producción de radicales de oxígeno y reducción de la capacidad quimiotáctica de leucocitos11.
Varios ensayos clínicos han contribuido a configurar el perfil de eficacia y seguridad de la LFN en el tratamiento de la AR. De hecho, los estudios con este fármaco representan la mayor base de datos de pacientes con AR estudiados en un entorno de ensayos clínicos, habiendo sido incluidos, a mediados del año 2001, más de 2.200 pacientes (tabla 1).
Eficacia de la leflunomida en la artritis reumatoide
Eficacia clínica
La eficacia clínica de la LFN en el tratamiento de la AR ha sido claramente establecida en tres estudios controlados de fase III: a) el US301, realizado en Norteamérica, que incluyó a 482 pacientes tratados con LFN (20 mg/día, tras carga de 100 mg/día durante 3 días), metotrexato (MTX) (7,5 mg/semana, incrementados a 15 mg/semana si persistía actividad), o placebo12, y que duró 12 meses, con extensión a 24; b) el MN301, con 358 pacientes tratados con LFN (misma dosis que el anterior), sulfasalacina (SSZ) (2 g/día) o placebo13, con una duración de 6 meses con posible extensión a dos años, y el MN302, 999 pacientes, LFN (misma dosis) frente a MTX (misma pauta que en el US301)14, de un año de duración con extensión a dos. Estos dos últimos ensayos fueron desarrollados en Europa y otros continentes.
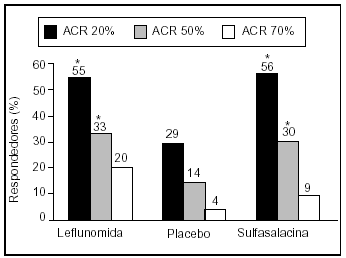
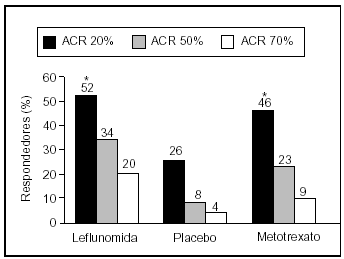
En estos tres estudios la LFN demostró una clara capacidad de mejorar los síntomas y signos de la enfermedad, evaluados mediante los criterios del American College of Rheumatology (ACR). Así, los pacientes tratados con LFN en el MN301 (LFN frente a SSZ frente a placebo) presentaron respuestas ACR 20, ACR 50 y ACR 70 del 55, el 33 y el 20%, respectivamente13, cifras claramente superiores a las del 29, el 14 y el 4% de los pacientes tratados con placebo (fig. 1a). En el estudio US301 se obtuvieron respuestas muy similares; los pacientes tratados con LFN presentaron respuestas ACR 20, 50 y 70 en un 52, un 34 y un 20% de los casos, respectivamente12, cifras superiores a las de los pacientes tratados con placebo y similares a las del grupo que recibió MTX (fig. 1b). En el MN302 la respuesta ACR 20 de los pacientes tratados con LFN fue del 51%, similar a la de los estudios anteriores14; los pacientes tratados con MTX en este ensayo clínico presentaron una respuesta ACR 20 algo superior (65%; p < 0,0001%); sin embargo, en el período de extensión a dos años, la respuesta fue similar en ambos grupos (fig. 2).
Figura 1a. Índice de respuestas ACR en estudio MN301 (leflunomida frente a sulfasalacina frente a placebo) a los 6 meses de seguimiento. *p < 0,015 frente a placebo.
Figura 1b. Índice de respuesta ACR en estudio US301 (leflunomida frente a metotrexato frente a placebo) al año de seguimiento. *p < 0,001 frente a placebo.
Figura 2. Índice de respuesta ACR 20% al año y a los dos años en estudio MN302 (leflunomida [LFN] frente a metotrexato [MTX]). *p < 0,0001.
Recientemente se han presentado los resultados del estudio RELIEF a un año15. Se trata de un ensayo clínico abierto en el que 969 pacientes con AR activa reciben LFN (100 mg/día durante 3 días, seguidos de 20 mg/día) durante 24 semanas inicialmente; al término de las mismas, los pacientes pueden permanecer en el mismo tratamiento durante otras 24 semanas adicionales en el caso de presentar respuesta favorable. En caso de falta de respuesta, los pacientes son aleatorizados para recibir SSZ + LFN o SSZ + placebo. Los datos de la cohorte que recibe LFN hasta 48 semanas corroboran la eficacia observada con este fármaco en estudios anteriores. Un 71% de los pacientes presentan una respuesta al menos moderada, evaluada mediante el DAS 28, a las 48 semanas. Los porcentajes de pacientes que alcanzaron respuestas ACR 20, 50 y 70 en este tiempo, fueron del 60, el 33 y el 10%, respectivamente.
Rapidez y mantenimiento de la eficacia clínica
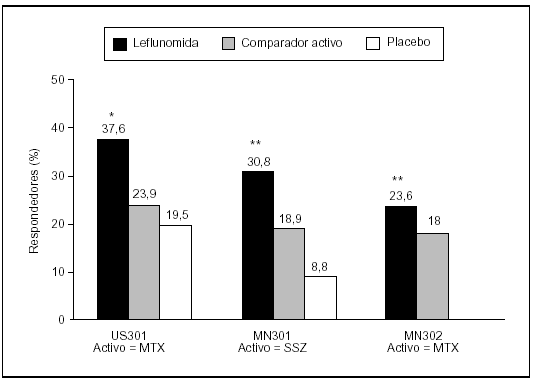
Una de las características observadas repetidamente en el tratamiento con LFN de los pacientes con AR es su rapidez de acción. En los tres estudios referidos12-14, la eficacia terapéutica de la LFN se detectaba antes que la de los comparadores activos. Esto puede comprobarse en la figura 3, en la que se recogen las respuestas ACR 20 en estos estudios a las 4 semanas de iniciarse el tratamiento. En este tiempo, la LFN presentaba un mayor porcentaje de respuesta que la SSZ o el MTX.
Figura 3. Respuesta ACR 20% a las 4 semanas en los estudios US301, MN301 y MN302. *p < 0,032 frente a placebo. **p < 0,031 frente a sulfasalacina (SSZ) y (MTX).
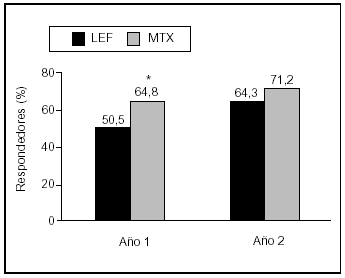
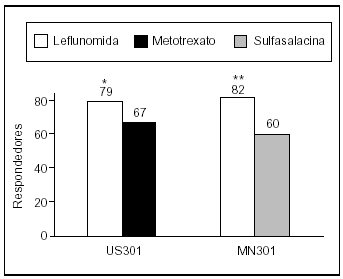
Además de su rapidez de acción, la LFN induce mejoría clínica que se mantiene en el tiempo. Incluso se observa una menor pérdida de eficacia en los pacientes tratados con LFN que en los tratados con el correspondiente comparador activo. Esto se demuestra por los resultados de la extensión de los estudios antes mencionados. En el US301, el 79% de los pacientes que formaban la cohorte de la extensión tratada con LFN presentaban una respuesta ACR 20 a los dos años, cifra significativamente superior a la de los pacientes tratados con MTX (67%; p = 0,049)16 (fig. 4). De manera similar, la extensión del estudio MN301 demostraba que, al cabo de dos años, la respuesta en los pacientes tratados con LFN (82%) era superior a la de los tratados con SSZ (60%; p < 0,05)17 (fig. 4).
Figura 4. Respuesta ACR 20 a los 24 meses en los estudios US301 y MN301. *p < 0,049; **p < 0,008.
De gran interés resultan los datos a los 5 años de un estudio abierto, extensión de dos de los estudios fase III antes mencionados. Los pacientes que completaron los dos años de tratamiento en los estudios europeos fueron incluidos en un nuevo período de extensión hasta 5 años. Los datos de este estudio, recientemente presentados18, demuestran cómo la eficacia de la LFN se mantiene a lo largo de los años, con porcentajes de respuesta ACR 20, 50 y 70 a los 5 años del 69, el 43 y el 19%, respectivamente, calculados sobre los 214 pacientes que entraron en el estudio de extensión.
Eficacia sobre la capacidad funcional y calidad de vida
La evaluación del efecto de un tratamiento sobre la situación funcional de los pacientes con AR mediante cuestionarios como el HAQ (Health Assessment Questionnaire) ha adquirido una gran importancia en los últimos años. La razón es fácil de entender, dado que constituye un buen indicador de la repercusión del tratamiento sobre las actividades diarias del paciente.
La LFN ha demostrado un efecto claramente beneficioso sobre la capacidad funcional en la AR. En el estudio MN301 (LFN frente a SSZ frente a placebo), los pacientes tratados con LFN experimentaron una mejoría en el HAQ de 0,5 puntos, cifra superior a la del grupo tratado con SSZ (0,28; p < 0,09) o con placebo (0,04; p < 0,0001)13. Esta cifra no es sólo altamente significativa desde el punto de vista estadístico, sino que refleja una magnitud de gran relevancia clínica, dado que mejorías de 0,22 puntos ya implican una clara repercusión en la capacidad funcional del paciente. Los estudios MN302 (LFN frente a MTX) y US301 (LFN frente a MTX frente a placebo) también demostraron un efecto favorable de la LFN sobre la capacidad funcional evaluada mediante el HAQ, con mejorías de 0,48 y 0,46 puntos, respectivamente12,14,19.
De manera similar a la capacidad funcional en estos ensayos clínicos, se ha evaluado la calidad de vida dependiente de la enfermedad. Los cuestionarios SF-36 y el PET (Problem Elicitation Technique) se utilizaron para tal fin. De manera consistente, los pacientes tratados con LFN mejoraron significativamente en la calidad de vida relacionada con la enfermedad. Así, en el estudio US301, los pacientes tratados con LFN experimentaron una mejoría del 35% en el PET, en comparación con un 3% en el grupo placebo (p < 0,0001) y un 17% en el grupo de MTX (p < 0,05 frente a LFN)20. De manera similar, se observó una mejoría del 25% en el componente físico del SF-36 en los pacientes tratados con LFN, en comparación con un 3% con placebo y un 15% con MTX. No hubo diferencias significativas, en este estudio, en el componente mental del SF-36.
Eficacia sobre la progresión radiológica
Resulta fuera de toda duda que un componente esencial de la discapacidad producida por la AR a largo plazo es el daño estructural y las deformidades articulares originadas a consecuencia de la acción del pannus sinovial sobre el cartílago y hueso articulares. De ahí que uno de los objetivos fundamentales de los tratamientos con FME en la AR sea la prevención del deterioro radiológico de la enfermedad.
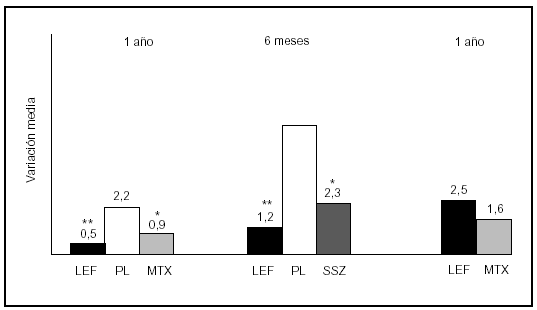
El efecto de la LFN sobre la progresión radiológica de la AR se ha evaluado específicamente en estos 3 estudios. En la figura 5 se presentan los resultados analizados mediante el método de Sharp et al21. Los pacientes que recibieron LFN tuvieron progresiones radiológicas significativamente menores que los que recibieron placebo en los estudios US301 y MN301 (p = 0,0007 y p = 0,0004, respectivamente). No se detectaron diferencias significativas entre LFN, MTX y SSZ en ninguno de los tres estudios. El análisis mediante el método de Larsen et al en el estudio MN301 confirma el efecto protector de la LFN a los 2 años22.
Figura 5. Ensayos clínicos con leflunomida (LEF). Efecto sobre la progresión radiológica. Variación media en índice total de Sharp. *Activo frente a placebo, p < 0,05; **LEF frente a placebo (PL) y p < 0,01. MTX: metotrexato; SSZ: sulfasalacina.
Eficacia clínica adicional en combinación con metotrexato
Teniendo en cuenta el interés creciente de los tratamientos combinados con FME en la AR23, y la posible existencia de mecanismos de acción complementarios entre estos dos agentes24, se planteó la posible utilidad de la combinación entre LFN y MTX para esta enfermedad. Un primer estudio piloto incluyó a 30 pacientes que estaban activos a pesar del tratamiento con MTX, en un ensayo abierto de 52 semanas de duración25. La adición de LFN (10-20 mg/día) supuso que el 53% de los pacientes obtuviera una respuesta ACR 20 al año de tratamiento. La tolerancia al tratamiento fue buena, por lo que se planteó la realización de un estudio controlado.
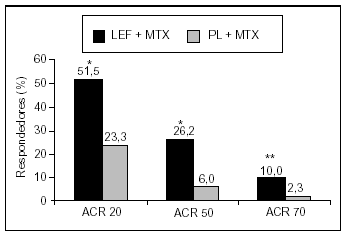
Éste se realizó en EE.UU. e incluía a 266 pacientes con enfermedad activa a pesar de monoterapia con MTX26. Los pacientes fueron distribuidos aleatoriamente en dos grupos, uno de los cuales recibió LFN (10 mg/día tras 100 mg/día ×2 días) y el otro placebo; se permitieron subidas de dosis a 20 mg/día por ineficacia o descensos a 10 mg/48 h por toxicidad. La respuesta se evaluó a los 6 meses. El 51, el 26 y el 10% de los pacientes tratados con la combinación LFN-MTX obtuvieron respuestas ACR 20, 50 y 70, respectivamente, en comparación con un 23, un 6 y un 2%, respectivamente, en el grupo control, según análisis por el método LOCF (last observation carried forward) (fig. 6). La eficacia también se reflejó en la capacidad funcional de los pacientes, con mejorías en el HAQ (0,42 en el grupo LFN-MTX, frente a 0,09 en el placebo-MTX; p < 0,02) y en el componente físico del SF-36 (p < 0,02).
Figura 6. Eficacia de la combinación LFN-MTX frente a placebo-MTX. Respuesta ACR semana 24 (last observation carried forward). *p ≤ 0,0001; **p ≤ 0,02. LFN: leflunomida; MTX: metotrexato.
Recientemente se han presentado los resultados del estudio de extensión, abierto, a un año. Los resultados demuestran que se mantiene la eficacia de la combinación MTX-LFN, con respuestas ACR 20, 50 y 70 del 56, el 35 y el 16% al año de tratamiento, para el grupo que recibía la combinación desde el principio27. Los pacientes que recibieron placebo-MTX durante los primeros 6 meses recibieron la combinación MTX-LFN durante las segundas 24 semanas, obteniendo unas tasas de respuesta prácticamente iguales.
Por tanto, el estudio demuestra que la adición de LFN al tratamiento con MTX es eficaz en pacientes con respuesta insuficiente a este último. Esto se refleja tanto en parámetros de eficacia clínica como de capacidad funcional y calidad de vida.
Seguridad de la leflunomida en la artritis reumatoide
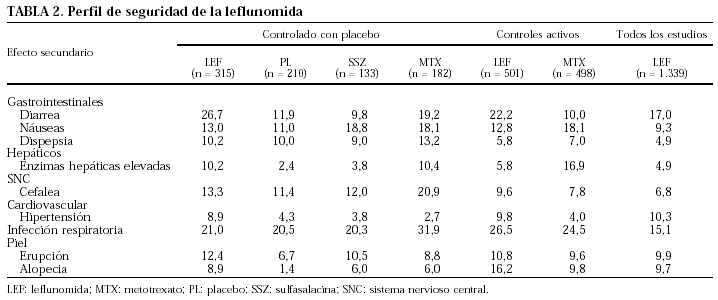
Los diferentes estudios comentados han permitido establecer el perfil de seguridad de la LFN en la AR. En general, se puede afirmar que este fármaco presenta una buena tolerancia y seguridad1,12-14. Los efectos adversos más frecuentemente observados son de tipo gastrointestinal (tabla 2). La diarrea ocurrió en uno de cada 6 pacientes aproximadamente; en general fue de intensidad leve o moderada y sólo ocasionó el abandono del tratamiento en el 1,4% de los casos. Las náuseas y vómitos ocurrieron en el 9 y el 3% de los casos, respectivamente, siendo también transitorios y excepcionalmente condicionantes del abandono del tratamiento. Los efectos adversos cutáneos siguieron a los digestivos en frecuencia. La erupción se detectó en un 10% de los pacientes, siendo causa de interrupción del tratamiento en 1,3% de los casos. También en cerca de un 10% de los pacientes se detectó alopecia significativa, que fue reversible con la suspensión del tratamiento y causa muy excepcional de abandono del mismo. Otro tipo de efecto adverso que se detectó con mayor frecuencia en pacientes en tratamiento con LFN fue la hipertensión arterial, en alrededor de un 10% de los casos, en contraste con un 4% de los casos tratados con placebo o MTX. Recientemente se ha llamado la atención sobre la posible aparición de pérdida de peso en pacientes tratados con LFN; en una serie de 70 pacientes, tratados en un entorno de práctica clínica habitual, se detectaron 5 casos de pérdida de peso significativa, no explicable por otras razones28. Sin embargo, esto no supuso en general un problema de cara a la continuación del tratamiento; el interés de este dato reside en que su conocimiento puede evitar la realización de innecesarias pruebas diagnósticas en los pacientes tratados con LFN que presenten este efecto secundario.
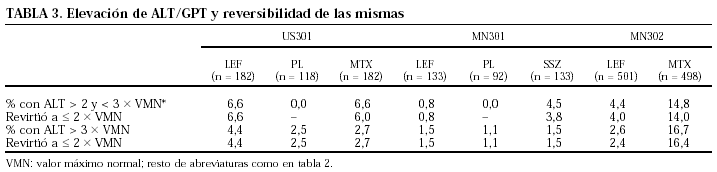
La elevación de transaminasas se observó en cerca del 5% de los casos1,13. Esta frecuencia fue similar a la detectada con MTX en el estudio norteamericano (US301), en el que se utilizaron suplementos de ácido fólico12; sin embargo, en el estudio europeo (MN302), en el que no se requería la coadministración de ácido fólico, la hepatotoxicidad fue significativamente superior en el grupo de MTX14. Entre un 2,3 y un 11% de los casos, las elevaciones de transaminasas fueron mayores de dos veces el límite superior de la normalidad (tabla 3). No obstante, estas elevaciones se normalizaron en casi todos los casos al disminuir la dosis o interrumpir el tratamiento con LFN1.
Con la extensión del uso de LFN a la práctica clínica, se han detectado casos de toxicidad hepática seria29. Recientemente se ha hecho pública una comunicación sobre farmacovigilancia de la Agencia Europea del Medicamento (EMEA), en la que se llama la atención sobre la aparición de casos de afectación hepática grave en pacientes tratados con LFN. Sobre un total de 104.000 pacientes/año que habían recibido el fármaco, se han detectado 121 casos de afectación hepática grave, lo que supone una incidencia de 1,2/1.000; de ellos, 17 casos fueron considerados muy graves, incluyendo dos de cirrosis y 15 de insuficiencia hepática (de los que 9 fallecieron). Se llama la atención sobre el hecho de que en la mayoría de los casos existían factores coadyuvantes que podían haber contribuido a estas situaciones. De hecho, en un 78% de los casos los pacientes recibían otros fármacos potencialmente hepatotóxicos; además en un 27% se daban situaciones de riesgo, como la ingesta habitual de alcohol o la coexistencia de procesos tales como hepatopatía previa o insuficiencia cardíaca. Por último, se insistía en que en gran número de ocasiones no se habían seguido las recomendaciones de monitorización establecidas (tabla 4). Por tanto, no es posible valorar hasta qué punto es la LFN, o los otros factores coexistentes, los causantes de estos casos. El hecho de que no se hayan detectado situaciones de esta gravedad en los estudios clínicos plantea la posibilidad de que, realizando los controles de forma adecuada (tal y como ocurre en situaciones de ensayos clínicos), puedan evitarse en gran medida estos casos de hepatotoxicidad importante.
Resulta interesante señalar la ausencia de dos tipos de efectos adversos frecuentes con otros FME, tales como el MTX. No se han detectado casos de neumonitis intersticial, ni mayor riesgo de infecciones serias en pacientes tratados con LFN1. En cuanto a la posibilidad de toxicidad medular, los estudios clínicos controlados en fase III no han detectado citopenias significativas. Sin embargo, hay que señalar también la notificación por farmacovigilancia de 16 casos (sobre 76.100 pacientes/año) de pancitopenia en pacientes tratados con LFN; éstos ocurrieron al utilizarse este fármaco concomitante o inmediatamente antes o después, de otros agentes potencialmente mielotóxicos. Por ello, es preciso estar alerta sobre esta posible eventualidad y valorar de forma individualizada los posibles riesgos y las monitorizaciones necesarias, antes de iniciar, y durante el tratamiento con LFN. En sentido contrario, merece la pena señalar la existencia de al menos un caso publicado de mejoría de la leucopenia en un paciente con síndrome de Felty30.
Seguridad de la leflunomida en combinación con metotrexato
Los datos de seguridad del estudio controlado de LFN-MTX frente a placebo-MTX ya comentado26 reflejaron el siguiente perfil: los efectos adversos clínicos fueron similares a los vistos en anteriores estudios, siendo la diarrea el problema más frecuentemente detectado (22% en el grupo LFN-MTX, frente al 10% en el placebo-MTX) y originando el abandono del tratamiento en el 3% de los casos; se refirieron náuseas en un 12% de los pacientes tratados con la combinación, frente al 8% del grupo placebo-MTX. No hubo diferencias en la frecuencia de erupción cutánea (cerca del 8% en ambos grupos), mientras que la alopecia se reseñó en el 6% de los pacientes del grupo de la combinación y en el 4% del placebo-MTX. En cuanto a la evolución de las enzimas hepáticas, se detectó un aumento de GPT mayor de 3 veces el límite superior de normalidad en el 2,3% de los pacientes tratados con la combinación, en comparación con el 0,8% de los tratados sólo con MTX.
El estudio de extensión, abierto, a un año, reflejó una toxicidad similar, siendo la diarrea y la erupción cutánea los efectos clínicos adversos más frecuentes. Sin embargo, resulta de gran interés la observación de que, en el grupo de pacientes que no se utilizó dosis de carga, la frecuencia de estos efectos adversos fue significativamente inferior, lo que plantea la posibilidad de que esta pauta sin dosis de carga pueda ser preferible en casos de mayor riesgo de efectos secundarios. Se detectó una elevación de GPT mayor de 3 veces el límite alto de la normalidad en el 2,1% de los pacientes cruzados de placebo a LFN durante los segundos 6 meses, y en ninguno de los pacientes que había recibido LFN durante las primeras 24 semanas27. Todas las elevaciones significativas de transaminasas fueron reversibles al disminuir la dosis o interrumpir el tratamiento, mientras que los aumentos leves con frecuencia se resolvieron sin intervención alguna.
Desde el punto de vista farmacocinético, el primer estudio piloto que se realizó no demostró interacciones significativas entre ambos fármacos25.
Por tanto, estos estudios demuestran que, además de eficaz, la combinación de MTX con LFN presenta un perfil de seguridad muy razonable, pudiendo ocurrir ocasionalmente alteraciones hepáticas que son generalmente manejables de forma adecuada realizando los oportunos controles analíticos. De todas formas, es preciso señalar que la utilización conjunta de LFN y MTX en la AR no ha sido todavía aprobada por las agencias reguladoras europea y americana.
Seguridad de la leflunomida en combinación con infliximab
El infliximab (INF), un anticuerpo monoclonal quimérico dirigido frente al TNF-α, está aprobado para su uso en la AR en combinación con MTX. La necesidad de esta asociación se debe a la capacidad del MTX de inhibir la inmunogenicidad que el INF puede producir en monoterapia. Sin embargo, en la práctica clínica habitual, un número importante de pacientes con AR presentan intolerancia al MTX, lo que impide la utilización de esta combinación. En este contexto, el posible uso de la LFN en sustitución del MTX, asociada al INF, ha despertado gran interés.
Aunque no existen datos en ensayos clínicos sobre el uso conjunto de LFN e INF, en el último congreso del 2001 del ACR, se han presentado dos estudios que analizan la utilización de esta asociación en la práctica clínica diaria. Un total de 77 y 84 pacientes, respectivamente, fueron identificados en estos dos estudios31,32. El perfil de toxicidad fue similar al conocido de ambos fármacos individualmente. Los efectos adversos más frecuentes detectados en el primero de los estudios fueron náuseas y vómitos (6%), alopecia (2%) y reacciones a la infusión (6%) . En el segundo, un 3 y un 6% de los pacientes suspendieron el tratamiento con LFN e INF, respectivamente, debido a efectos adversos. En ambos casos, el tratamiento combinado demostró eficacia clínica.
Aunque las características de estos dos estudios y los períodos de seguimiento cortos (de 6 a 8 meses aproximadamente) no permiten extraer conclusiones firmes, estos datos apuntan a que el uso conjunto de LFN e INF puede realizarse de forma razonablemente segura en pacientes con AR.
Comentarios finales
La evidencia acumulada en una gran base de datos de pacientes en estudios clínicos demuestra que la LFN es un tratamiento eficaz y seguro para la AR. Características significativas son su rapidez de acción y, especialmente, el mantenimiento de la actividad terapéutica tras su uso continuado, tal como demuestran los datos recientemente presentados de seguimiento a 5 años18. Merece también la pena señalar la capacidad de este fármaco para mejorar la función física y retrasar el daño estructural de los pacientes con AR.
La LFN tiene un buen perfil de seguridad. La información recientemente aparecida sobre su potencial hepatotoxicidad debe valorarse en su justa medida, teniendo presente el probable papel que han desempeñado otros factores concomitantes (fármacos coprescritos, alcohol, procesos coexistentes, etc.). Por tanto, la principal consecuencia de estos datos debe ser la de inducirnos a actuar con la suficiente diligencia para detectar tempranamente las posibles alteraciones analíticas y actuar en consecuencia. Al fin y al cabo los reumatólogos tenemos amplia experiencia en el abordaje de este tipo de problemas con otros FME como, por ejemplo, el MTX. Sabemos que es un fármaco potencialmente hepatotóxico, pero con el que hemos aprendido a controlar este riesgo, de forma que se puede utilizar con seguridad en nuestros pacientes aplicando las precauciones y monitorizaciones adecuadas.
Una vía de enorme interés futuro es la de la utilización de la LFN en combinación con otros tratamientos. Al fin y al cabo, la complejidad y heterogeneidad de los mecanismos patogénicos en la AR hacen muy probable que la eficacia terapéutica óptima sólo pueda lograrse combinando tratamientos. Esta idea se está extendiendo rápidamente entre la comunidad reumatológica, de manera que el tratamiento combinado con FME es práctica habitual en pacientes con respuesta insuficiente a un agente único. En este contexto resultan de gran interés los datos presentados recientemente sobre el uso de LFN en combinación con MTX o con INF. No obstante, de momento estas combinaciones deben considerarse con precaución, teniendo en cuenta que aún no han sido aprobadas y la posibilidad de aumento de toxicidad en alguna de ellas. Sin embargo, es altamente probable que de su uso futuro pueda obtenerse un beneficio añadido para el mejor control de los pacientes que padecen esta invalidante enfermedad.