La eficacia del tratamiento con infliximab está bien establecida en la artritis reumatoide (AR), en la enfermedad de Crohn y cada vez más en las espondiloartropatías. Su utilidad en estos casos se ha discutido ampliamente en otros capítulos de este volumen monográfico.
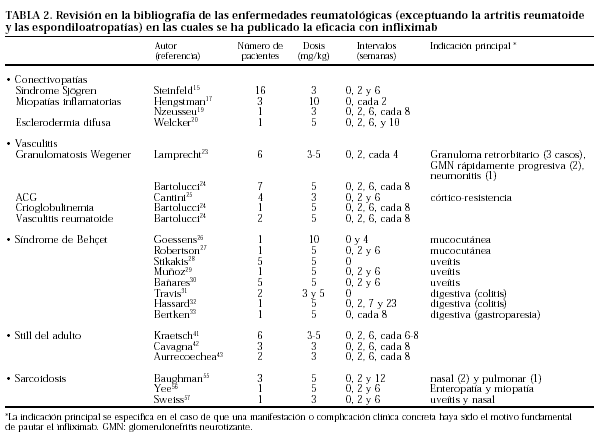
Por otra parte, el TNF-α también está implicado en la patogenia de otras enfermedades inflamatorias1-14. En muchas de ellas, debido a su baja prevalencia, será muy difícil poder disponer de estudios clínicos amplios, controlados y prospectivos. En estas situaciones será de gran utilidad el conocimiento de los casos clínicos publicados (tabla 1). Sin embargo, se deben considerar las limitaciones de estas observaciones clínicas entre las que podrían estar que no se suelen publicar los fracasos terapéuticos o no disponer de un esquema terapéutico estandarizado. En este sentido, ocasionalmente se utilizan las mismas pautas de la AR con infliximab (3-5 mg/kg por infusión), las semanas 0, 2, 6 y después cada 8, pero algunos autores han utilizado pautas muy distintas, habitualmente sin una argumentación clara (tabla 2). Por lo tanto, aunque la individualización terapéutica sea un principio básico de la Medicina, en estos casos raros será si cabe más importante.
Probablemente los pacientes refractarios al tratamiento convencional con enfermedad de Still del Adulto (ESA), vasculitis sistémicas, síndrome de Behçet (SB), artritis crónica juvenil (ACJ) y uveítis parecen los que más claramente se podrían beneficiar del tratamiento con infliximab. También existen evidencias en determinadas conectivopatías como el Síndrome de Sjögren (SS) o la enfermedad muscular inflamatoria. Es de destacar el potencial efecto terapéutico del infliximab en las enfermedades en las que es característica la formación de granulomas como la arteritis de células gigantes, granulomatosis de Wegener o la Sarcoidosis.
Revisamos en este capítulo también otras enfermedades o situaciones clínicas en las que la terapia anti-TNF puede tener un futuro prometedor, pero que en el momento actual no dejan de ser más que hipótesis terapéuticas más o menos fundamentadas, como es la prevención y tratamiento de la enfermedad injerto frente a huésped, o del rechazo de las prótesis articulares, así como la lumbociática.
Conectivopatías
El TNF-α es un mediador importante tanto en el desarrollo como en el mantenimiento de las conectivopatías. Así, es razonable considerar a los agentes anti-TNF en estas enfermedades, especialmente en aquellas que o son refractarias o no se dispone de tratamientos claramente eficaces como es el caso de la esclerodermia difusa (ED). A continuación se expone la experiencia más reciente con terapia anti-TNF en estas enfermedades (tabla 3).
El SS se caracteriza por la infiltración linfocitaria de las glándulas exocrinas, manifestándose por xerostomía y xeroftalmía. Muchos pacientes pueden tener afectación extraglandular. Recientemente se ha publicado un trabajo con terapia anti-TNF en el SS15. Se trata de un estudio de 14 semanas de duración en el que se administraron 3 infusiones de infliximab (3 mg/kg) a 16 pacientes con SS primario en las semanas 0, 2 y 6. Debido a la falta de criterios validados de actividad del SS, los autores definieron arbitrariamente como enfermedad activa la presencia de una velocidad de sedimentación globular (VSG) mayor de 25 mm/1 h o una hipergammaglobulinemia mayor de 1,4 g/l. Durante el período de estudio no se permitió ningún otro fármaco excepto lágrimas artificiales. Se realizó una valoración exhaustiva de las manifestaciones clínicas, así como de la secreción lacrimal y salival, y de parámetros analíticos en las visitas basal, en la semana 2 y posteriormente cada 4 semanas hasta la finalización del estudio. Todas las medidas de actividad mejoraron de forma significativa tras la primera infusión de infliximab, especialmente la xerostomía y la xeroftalmía, persistiendo dicha mejoría hasta la finalización del estudio. El tratamiento fue muy bien tolerado en general y no hubo abandonos por efectos secundarios. Un paciente ya presentaba anticuerpos anti-DNAn antes del inicio del tratamiento y estos se mantuvieron durante el mismo sin desarrollar ninguna manifestación sugestiva de lupus eritematoso sistémico.
Miopatías inflamatorias
Las miopatías inflamatorias, aunque afectan de forma predominante al músculo, también pueden comprometer órganos vitales, acompañándose de una importante morbimortalidad. Su tratamiento inicial está basado en la administración de dosis altas de corticoides y, en aquellos casos refractarios, o con efectos secundarios esteroideos, pueden ser de utilidad entre otros la azatioprina, metotrexato (MTX), la ciclosporina, o las gammaglobulinas endovenosas (ev). A pesar de todo, en una proporción no despreciable de pacientes la enfermedad permanece activa. La eficacia de las terapias anti-TNF se ha observado tanto en niños como en adultos16-19. Hasta el momento, se ha comunicado la experiencia con infliximab en 3 pacientes. En un primer estudio holandés, dos pacientes de sexo femenino, una con dermatomiositis y otra con polimiositis, fueron tratadas únicamente con infliximab a una dosis de 10 mg/kg cada 2 semanas17. En ambas se produjo una mejoría clínica significativa de la fuerza muscular tras la primera infusión de infliximab, acompañada de un descenso marcado de los enzimas musculares y, en la paciente con dermatomiositis, de la desaparición de las lesiones cutáneas. La mejoría clínica se acompañó de mejoría electromiográfica y de la desaparición de fibras necróticas y del descenso de los infiltrados linfocitarios en la biopsia muscular realizada tras la segunda administración. Desafortunadamente, en su comunicación no se especifica la evolución posterior de estos dos enfermos ni la duración de la terapia anti-TNF. El tercer paciente se trataba de un varón con dermatomiositis juvenil, tratado durante 7 años con dosis altas de corticoides, azatioprina, MTX, ciclosporina, ciclofosfamida, gammaglobulinas ev y plasmaféresis19. A pesar de estos tratamientos, persistía con una debilidad muscular importante que le tenía confinado a la cama, así como alteraciones en la deglución y en la musculatura diafragmática que condicionaban infecciones respiratorias de repetición. La actividad de la miopatía se complicaba aún más por el desarrollo de importantes efectos secundarios esteroideos. El paciente recibió infliximab a una dosis de 3 mg/kg con una pauta similar a la utilizada en AR, con una mejoría espectacular, mejorando clínica y analíticamente y pudiendo volver a caminar sin ayuda.
Esclerodermia
Recientemente se ha comunicado la eficacia con infliximab en una paciente con esclerodermia (ED)20. Se trataba de una paciente de casi 2 años de evolución y que era refractaria a D-penicilamina y ciclofosfamida, necesitándose para su control esteroides a dosis altas. Se pautó infliximab 3 mg/kg las semanas 0, 2, 6 y 10 observándose una clara mejoría en las úlceras cutáneas, dispepsia, disnea, apertura bucal, así como en el movimiento manual. Esto permitió, además, la reducción esteroidea. Por otra parte, también se han presentado resultados favorables con etanercept21. Diez pacientes con ED de menos de 5 años de evolución se trataron con 25 mg subcutáneos de etanercept 2 veces a la semana durante 6 meses. El objetivo principal del estudio fue la evaluación de la afectación cutánea (índice de Rodnan), y como objetivos secundarios se evaluaron la función pulmonar, la valoración global de la enfermedad por parte del paciente y del médico, la apertura bucal y la extensión de la mano y un HAQ modificado. La duración media de la enfermedad al entrar en el estudio era de 17 meses y todos los pacientes, exceptuando uno, lo completaron. De los 9 enfermos que finalizaron el tratamiento, 4 presentaron una mejoría significativa de las lesiones cutáneas (aproximadamente un 44%) y los 5 restantes permanecieron estables. En tres pacientes que presentaban úlceras digitales se apreció una mejoría durante el estudio. Las pruebas de función pulmonar permanecieron estables durante el mismo. No se observó mejoría en la apertura bucal ni en la extensión de la mano. Hay que destacar que los pacientes que mejoraron de la piel, tenían una enfermedad mucho menos evolucionada (9 meses menos). Así, es posible que la terapia anti-TNF pueda ser una alternativa terapéutica eficaz en la ED, especialmente en las de corta evolución. No obstante, nuestra experiencia con terapia anti-TNF en la ED, aunque muy reducida, no es tan positiva y sugiere que quizás la bibliografía puede estar desviada a la publicación de pacientes con respuesta satisfactoria, por lo que probablemente se precise de una mayor experiencia antes de confirmar la utilidad de esta terapia en pacientes de ED. Últimamente hemos tratado a una paciente con ED y afectación cutánea difusa muy extensa y de evolución relativamente breve (9 meses), con afectación pulmonar y esofágica. Inicialmente se administró etanercept 25 mg/subcutáneo 2 veces semanales, suspendiéndolo a los 2 meses por exacerbación de las lesiones cutáneas con marcado edema y eritema. Se sustituyó por infliximab (10 mg/kg) que también se suspendió tras la segunda infusión a las 2 semanas de iniciado tratamiento, por aumento de la sintomatología pulmonar, fiebre y persistencia de los fenómenos inflamatorios cutáneos.
Vasculitis
Hasta el momento se han publicado datos sobre la utilidad de la terapia con infliximab en las siguientes vasculitis: a) de pequeño tamaño, como la crioglobulinemia; b) de mediano-pequeño calibre como la granulomatosis de Wegener (GW) y la vasculitis reumatoide, y c) de gran vaso como la arteritis de células gigantes (ACG).
La GW es la vasculitis con más experiencia publicada con terapia anti-TNF22-24. Recientemente se han comunicado dos trabajos europeos en los que el infliximab se añadía al tratamiento esteroideo y citotóxico con objeto de inducir la remisión clínica23,24. El grupo de Gross23 presenta 6 pacientes con GW. Todos eran refractarios al tratamiento clásico con esteroides a dosis altas y ciclofosfamida. La clínica predominante era: pérdida de visión por granulomas retrorbitarios (3 pacientes), glomerulonefritis rápidamente progresiva (2 casos) y afectación pulmonar (1 enfermo). Al tratamiento previo, se añadió infliximab (3 o 5 mg/kg) las semanas 0, 2 y después cada 4 semanas. Se evaluó la respuesta de acuerdo con el BVAS/WG (Birmingham vasculitis score for Wegener Granulomatosis). Una vez conseguida la remisión de la enfermedad se suspendía el infliximab y se reducían los esteroides. El infliximab se suspendió en un enfermo por infección y en el resto al inducirse la remisión. Sólo en un caso fue necesario continuar con infliximab. La dosis con 5 mg/kg pareció más eficaz que la de 3 mg/kg. El grupo de Guillevin24 presenta 10 enfermos con vasculitis sistémicas, siete con GW, dos con vasculitis reumatoide y uno con crioglobulinemia. Todos eran refractarios a esteroides y al menos un citotóxico. Se añadió infliximab (5 mg/kg) las semanas 0, 2, 6 y después cada 8 semanas. La respuesta también se evaluó de acuerdo al índice de Birmingham. En todos los casos se observó una remisión parcial o total posibilitando la retirada del citotóxico y generalmente la disminución de la dosis de esteroides.
Se ha publicado la eficacia del infliximab en 4 casos de ACG córtico-resistentes, que habían recibido esteroides durante más de 3 años presentando una iatrogenia importante25. La pauta de infliximab fue 3 dosis de 3 mg/kg las semanas 0, 2 y 6. La tercera dosis se ponía si con las dos primeras se observaba cierto beneficio. Las dos primeras semanas se mantenía prednisona a la dosis de 5 mg/día. Se evaluó la eficacia terapéutica de acuerdo a una serie de datos clínicos (sintomatología general, polimialgia, etc) y analíticos (VSG, proteína C reactiva, etc). Tres de los pacientes respondieron a las dos primeras dosis de infliximab y un cuarto al no responder se consideró refractario y se suspendió. En el momento de la publicación del artículo (5 y 6 meses después de la última infusión de infliximab) los 3 pacientes permanecían en remisión y sin esteroides.
Síndrome de Behçet
Se han publicado varios artículos de pacientes con SB refractarios a otros tratamientos en los que se pautó el infliximab fundamentalmente por alguna de las siguientes circunstancias: a) manifestaciones mucocutáneas, b) uveítis, y/o c) afectación digestiva. Independientemente de los distintos esquemas terapéuticos, en general se lleva a cabo un tratamiento corto con objeto de inducir la remisión y posteriormente se pauta otro fármaco de mantenimiento, como corticoides a dosis bajas, talidomida, etc.
Goosens et al26 publican un estudio donde presentan un paciente con lesiones mucocutáneas intensas y refractarias a esteroides, azatioprina, ciclofosfamida, talidomida y MTX. Se trató con dos dosis de infliximab de 10 mg/kg separadas por un intervalo de un mes. A los 15 días de la primera dosis el enfermo ya había mejorado espectacularmente y tras 12 meses de seguimiento permanecía en remisión. Robertson et al27 presentan una paciente con úlceras orogenitales rebeldes a esteroides, colchicina, talidomida, azatioprina y ciclosporina. Se pautó infliximab (5 mg/kg) en 3 ocasiones, las semanas 0, 2 y 6. Tras la primera infusión ya se observó una mejoría importante permaneciendo el paciente en remisión en el momento de la publicación.
El infliximab puede ser especialmente útil en las uveítis refractarias. Sfikakis et al28 estudian 5 pacientes con SB con panuveítis. Todos los pacientes eran refractarios a esteroides y ciclosporina A, en ocasiones asociada a azatioprina. Se pautó una única dosis de infliximab (5 mg/kg). Se midió la agudeza visual, la inflamación anterior y posterior así como las lesiones retinianas. En todos los casos se observó una mejoría rápida, generalmente en las primeras 24 horas y prácticamente total en la primera semana. La última evaluación se realizó a los 28 días del infliximab, con lo que no se pueden sacar conclusiones a largo plazo. Además de la uveítis, algún paciente presentaba manifestaciones extraoculares, como úlceras orales o artritis que también experimentaron mejoría o incluso remisión clínica. Muñoz et al29 publican un caso similar de panuveítis refractaria a esteroides, ciclosporina y MTX. Se trató con infliximab (5 mg/kg) en tres dosis (semanas 0, 2 y 6) que produjo una mejoría rápida y espectacular en el infiltrado inflamatorio pero más lenta en la agudeza visual. Una vez inducida la remisión con infliximab, el paciente se controló con prednisona a dosis bajas y MTX. Bañares et al30 comunican 7 enfermos (5 con SB) con uveítis posterior refractaria a tratamiento esteroideo y al menos un fármaco inmunosupresor. La pauta de infliximab fue de 3 dosis de 5 mg/kg las semanas 0, 2 y 6. Tras un seguimiento de al menos 16 semanas se observó una mejoría en la mayoría de los casos.
Una situación clínica relativamente infrecuente pero que si se presenta suele ser grave es la afectación intestinal en forma de úlceras en colon. Travis et al31 publicaron dos mujeres con SB y ulceración colónica que se manifestaba por rectorragias, dolor abdominal y pérdida de peso. Además, tenían úlceras orogenitales, lesiones cutáneas pustulosas y artritis. Se habían tratado ineficazmente con esteroides y talidomida en un caso y esteroides, colchicina y ciclosporina en el otro. Se pautó una dosis de infliximab de 3 mg/kg en un caso y 5 mg/kg en el otro. La remisión se consiguió en los primeros 10 días, tanto en las manifestaciones intestinales como extraintestinales y después se mantuvo tratamiento de fondo con talidomida. En una de las pacientes se repitió un bolo de infliximab a las 8 semanas por reactivación de la enfermedad. Hassard et al32 presentan otro enfermo con SB refractario al tratamiento habitual con afectación especialmente intestinal sobre todo en forma de afectación colónica. Se pautaron 4 dosis de infliximab (5 mg/kg) a las semanas 0, 2, 7 y 23. Se observó una respuesta en la sintomatología intestinal rápida y espectacular. Además se comprobó una mejoría endoscópica-histológica en una colonoscopia realizada a las 10 semanas. También se ha comunicado la respuesta espectacular en una paciente con SB y gastroparesia grave33, cuya relación con el SB era incierta pero que requirió yeyunostomía para nutrirla. La paciente presentaba náuseas, vómitos y pérdida de peso, y además úlceras oro-genitales, lesiones cutáneas, fiebre y sintomatología articular. Se trató con infliximab (300 mg/8 semanas), MTX (20 mg/semana) y dapsona (75 mg/día). A los 6 meses la paciente había recuperado el peso, había remitido la paresia y por lo tanto se retiró la yeyunostomía. Tras un seguimiento de 11 meses la paciente estaba asintomática.
Artritis crónica juvenil
En la ACJ se ha demostrado la eficacia con etanercept en un estudio doble-ciego34. Trabajos más recientes indican que también el infliximab parece útil, incluso en los casos refractarios a etanercept. Un grupo italiano35 presenta un estudio prospectivo y abierto de 20 mujeres con ACJ grave y refractaria: 4 de inicio sistémico, 5 poliarticular, 9 oligoarticular, y 2 con artritis psoriásica. La mediana de edad fue de 21 años, la de duración de la ACJ de 17 años, y de haber recibido 4 fármacos de fondo. En todas la enfermedad era muy activa tanto clínica como analíticamente. La pauta de tratamiento fue la siguiente: a) AINE y esteroides a la misma dosis, b) MTX subcutáneo (media de 15 mg/semana), y c) infliximab (3-10 mg/kg, mediana 4 mg) las semanas 0, 2, 6 y después cada 8 semanas. Se realizó un seguimiento estándar de articulaciones inflamadas, reactantes de fase aguda, HAQ, etc, observándose generalmente una respuesta terapéutica rápida y eficaz.
Kimura et al36 comunican 4 pacientes con ACJ sistémica. Los enfermos eran refractarios a prednisona y a MTX, ciclosporina, etanercept e infliximab a dosis estándar; por lo que fueron tratados con dosis altas de infliximab, 2 con 10 mg/kg y otros 2 con 20 mg/kg, inicialmente cada 2 semanas y después mensualmente. Tras un seguimiento medio de 4 meses, los 4 enfermos habían respondido al tratamiento.
Honkanen et al37 se centran en una complicación relativamente frecuente y potencialmente grave como es la uveítis de la ACJ en 8 niños con uveítis crónica, grave y refractaria al tratamiento estándar. Se les trató con infliximab 3-5 mg/kg cada 4 o 6 semanas. Esto permitió en la mayoría de los casos mejorar la uveítis (menor celularidad), así como disminuir la dosis de esteroides sistémicos y/o tópicos. Finalmente, los autores recomiendan para esta situación administrar el infliximab cada 4 semanas.
Enfermedad de Still del adulto
El TNF-α es un mediador de la ESA y su inhibición con agentes como la talidomida puede ser eficaz38. Aunque la IL-18, perteneciente a la familia de la IL-1, es la citocina más recientemente implicada en la ESA; ésta a su vez puede inducir la producción de TNF-α39,40.
Kraetsch et al41 publican un estudio donde presentan 6 pacientes con ESA muy activa clínica y analíticamente pese al tratamiento esteroideo y en varios casos con fármacos inductores de remisión (MTX, ciclosporina A, azatioprina y ciclofosfamida). Se les trató con infliximab (3-5 mg/Kg) las semanas 0, 2, 6 y después cada 6-8 semanas. En el momento de su publicación y tras 5 a 28 meses de tratamiento, los 6 pacientes habían mejorado aceptablemente siendo característico que esta mejoría se alcanzó relativamente pronto. Cavagna et al42 presentan 3 enfermos de ESA activa clínica y analíticamente a pesar de recibir tratamiento esteroideo y MTX. La pauta de infliximab fue similar a la utilizada en la AR, dosis de 3 mg/kg las semanas 0, 2, 6 y después cada 8 semanas. En todos los casos se mantuvo el MTX a dosis de 15 mg/semana. Todos los pacientes mejoraron con el tratamiento con infliximab.
Nuestro grupo43 ha comunicado 2 pacientes con ESA agresiva y refractaria al tratamiento con esteroides, MTX y algún otro fármaco de fondo. Se pautó infliximab en la pauta estándar de 3 mg/kg las semanas 0, 2, 6 y después cada 8 semanas. Además se mantuvo el tratamiento con MTX. Los dos pacientes experimentaron una mejoría rápida y espectacular. Uno de los dos pacientes cuando se encontraba en remisión de la ESA hubo que suspender transitoriamente el infliximab por un quiste y absceso en la zona sacra. Esto llevó a una reactivación importante de la ESA. Una vez superado el proceso infeccioso se pautó nuevamente infliximab a la misma dosis 3 mg/kg consiguiendo sólo una mejoría parcial, por lo que precisó un aumento a 5 mg/kg, induciéndose de nuevo la remisión.
Enfermedad ocular inflamatoria
Entendemos por enfermedad ocular inflamatoria la inflamación de diversas estructuras oculares que se traducirán clínicamente por xeroftalmia, uveítis y/o escleritis. Todas ellas pueden ser primarias o secundarias a diversas enfermedades, especialmente reumatológicas. Ya se ha comentado la eficacia del infliximab en la xeroftalmía de pacientes con SS primario15. No obstante, la mayor parte de las publicaciones sobre la terapia anti-TNF hacen referencia a las uveítis. Una de sus causas más frecuentes son las espondiloartropatías, que han sido tratadas en otro capítulo. Ya se ha comentado la eficacia con infliximab en la uveítis del SB y de la ACJ28-30,35,37. También se ha publicado la eficacia con etanercept en 10 niños con uveítis refractaria con la misma dosis inicial utilizada en la ACJ de 0.4 mg/kg/ subcutánea dos veces a la semana44.
La mayoría de los casos hasta aquí comentados reunían en general al menos una de estas condiciones: a) eran refractarios al tratamiento inmunosupresor sistémico o b) eran uveítis posteriores o globales (panuveítis). En cambio, en el último congreso del ACR45 se ha comunicado la indicación del infliximab como único tratamiento en casos no refractarios de uveítis únicamente anteriores. Eran 7 enfermos HLA B27 positivos que se trataban con una dosis de infliximab (10 mg/kg). En un caso se repitió otra dosis. Se consiguió una recuperación total y rápida en 6 casos. Tras un seguimiento de un año, 3 pacientes tuvieron algún brote que fueron tratados con esteroides locales y/o sistémicos.
Por el contrario, el grupo de Rosenbaum46 ha publicado un trabajo sobre la terapia anti-TNF, tanto con infliximab como etanercept en uveítis y escleritis, que lleva al autor a una serie de consideraciones menos optimistas. En total se incluyeron 16 pacientes; 9 con uveítis y 7 con escleritis. En 14 casos se pautó etanercept y en los otros dos infliximab (3 mg/kg) en un caso cada 5 y en el otro cada 8 semanas. Respecto a la eficacia, la uveítis mejoró en 3 de los 9 pacientes (33%), curiosamente en 2 de estos 9 enfermos la uveítis se presentó cuando ya estaban en tratamiento con etanercept. La escleritis mejoró en 3 de los 7 pacientes, pero otros 3 presentaron la escleritis estando también en tratamiento con etanercept. En los casos de enfermedad ocular inflamatoria secundaria a enfermedad reumatológica (13 casos), la terapia anti-TNF pareció más útil para controlar la sintomatología articular que la ocular. Los autores concluyen que sus resultados con anti-TNF en las uveítis no son tan satisfactorios como otros publicados. También comentan que probablemente los mecanismos patogénicos de la clínica ocular y articular sean distintos. De todas formas, el diseño del trabajo tiene una serie de limitaciones que debemos destacar. Se trata de un estudio retrospectivo, con enfermos procedentes de cuatro hospitales, con enfermedades de base y tratamientos heterogéneos y en los que el tratamiento se había pautado por reumatólogos con el objetivo principal de controlar la enfermedad articular.
Enfermedades dermatológicas: psoriasis y pioderma gangrenoso
El grupo de Gottlieb47 fue probablemente el primero en publicar el caso de una paciente con psoriasis que con una dosis de 5 mg/kg de infliximab experimentó una mejoría importante en las lesiones cutáneas. El mismo grupo realiza un estudio aleatorio, prospectivo y doble ciego recientemente publicado48 cuyos resultados histológicos han sido recientemente comunicados49. Se incluyeron 33 pacientes con psoriasis en placas moderada-grave. Se diseñaron tres brazos terapéuticos de 11 enfermos cada uno: infliximab 10 mg/kg, infliximab 5 mg/kg y placebo en las semanas 0, 2 y 6. Previamente al tratamiento y en la semana 10 postratamiento se realizaba una evaluación estándar: PGA (Physician Global Assessment), el NPF (National Psoriasis), PS (Psoriasis Score) y el PASI (Psoriasis Area and Severity Index). La respuesta se alcanzaba tras una mediana de 4 semanas. En los dos grupos tratados con infliximab se observó una respuesta importante en el PGA: del 91% en los de 10 mg, 82% en los de 5 mg y del 18% en placebo. En el PASI se observó una mejoría en el 73% de los de 10 mg/kg, 82% en los de 5 mg/kg y 18% en el placebo. Además se habían obtenido biopsias cutáneas antes y en la semana 10 de iniciado el tratamiento. Se observó una disminución en el infiltrado CD3 epidérmico y un adelgazamiento en las lesiones estadísticamente significativas respecto al grupo placebo. Además, se encontró una correlación entre la mejoría del PASI y de las lesiones histológicas.
El pioderma gangrenoso es una complicación cutánea inflamatoria que puede observarse de forma primaria o secundaria generalmente a una enfermedad inflamatoria intestinal. Tan et al50 presentan 3 pacientes con enfermedad de Crohn activa, 2 con pioderma gangrenoso y otro con psoriasis cutánea. Se pautó infliximab que además de la sintomatología digestiva consiguió mejorar las lesiones cutáneas. El pioderma gangrenosum periestomal es una variante clínica que se localiza generalmente alrededor del estoma quirúrgico de una enfermedad inflamatoria intestinal. Suele ser relativamente refractaria al tratamiento inmunosupresor habitual y en estos casos también puede ser útil el infliximab51.
Colitis ulcerosa y cirrosis biliar primaria
Como es bien sabido, la enfermedad de Crohn es una de las indicaciones más claras de infliximab como ha sido comentado ampliamente en otro lugar de este volumen monográfico. Por el contrario, en la colitis ulcerosa no se dispone de estudios controlados. Chey et al52 publican un estudio en el que presentan 8 pacientes con colitis ulcerosa refractarias al tratamiento habitual que se trataron con una dosis de infliximab (5 mg/kg). Todos los pacientes respondieron eficazmente tanto clínica, colonoscópica como histológicamente. Sin embargo, en un editorial en ese mismo número se cuestiona dicho artículo53.
Recientemente, se comunica una paciente con cirrosis biliar primaria y AR54. Era refractaria a esteroides e hidroxicloroquina, por lo que se decidió tratamiento con MTX (5 mg/semana) e infliximab (3 mg/día) las semanas 0, 2, 6 y después cada 8 semanas. La paciente experimentó una mejoría rápida y muy eficaz tanto en la clínica articular como en los parámetros analíticos hepáticos (fosfatasa alcalina, gamma GT y transaminasas).
Infliximab en otras enfermedades y nuevas perspectivas terapéuticas
Sarcoidosis
Se han publicado 5 casos de sarcoidosis tratados con infliximab. Baughman et al55 presentan 3 pacientes con sarcoidosis refractaria a tratamiento esteroideo e inmunosupresor, dos de ellos con lupus pernio y el tercero con afectación pulmonar. Se administró infliximab (5 mg/kg) las semanas 0, 2 y 12. Los pacientes con lupus pernio mejoraron significativamente. El paciente con afectación pulmonar mejoró un 26% en la capacidad vital. Yee et al56 publica una paciente con sarcoidosis refractaria a esteroides con enteropatía grave, hipoalbuminemia, miopatía proximal y fracaso renal. Con infliximab (5 mg/kg las semanas 0, 2 y 6) se consiguió una mejoría de la miopatía y la enteropatía. Tras la aparición de una trombosis venosa profunda asociada con anticuerpos anticardiolipina se decidió suspender el infliximab. Sweiss et al57 presentan dos pacientes con sarcoidosis refractaria a corticoides y citotóxicos. Un caso se trató con infliximab y el otro con etanercept con una respuesta satisfactoria en ambos. El paciente tratado con infliximab presentaba uveítis bilateral recurrente y sarcoidosis nasal con obstrucción respiratoria importante. Se había tratado con esteroides y MTX (20 mg/semana) sin controlar la enfermedad. Se trató entonces con infliximab (3 mg/kg) las semanas 0, 2 y 6. Ya en la primera semana se observó una mejoría clara que se mantenía en la octava semana que permitió suspender el MTX y los corticoides.
Enfermedad de injerto frente a huésped
Una de las principales complicaciones del trasplante de médula ósea continúa siendo la enfermedad de injerto frente a huésped. Su profilaxis y tratamiento actual se fundamenta entre otros, en los corticoides, ciclosporina, MTX o micofenolato. Aún así siguen existiendo casos refractarios de desenlace habitualmente fatal. Recientemente se ha publicado un estudio en el que se demuestra la eficacia del infliximab58 en 4 casos refractarios a corticoides a dosis altas, ciclosporina A y en 3 casos también a micofenolato. Se trataron con infliximab 10 mg/kg una vez por semana hasta la resolución del cuadro clínico. Dos pacientes recibieron sólo una dosis, otro 2 y el otro 3. En 3 casos se consiguió el control de la enfermedad.
Lumbociática
Es bien conocido que en la lumbociática existe un proceso inflamatorio, lo cual explica en parte la mejoría obtenida con los corticoides. Una publicación reciente sugiere de forma novedosa que este proceso podría estar desencadenado por microorganismos de baja virulencia59. Varios trabajos se han centrado en la patogenia inflamatoria de la lumbociática, la cual parece al menos en parte mediada por el TNF-α60-62. Lo que sí parece bien establecido es que los pacientes con lumbociática experimentan una serie de cambios histológicos como son el edema intraneural y la trombosis de los vasos intraneurales. Al mismo tiempo es característica la reducción de la velocidad de conducción nerviosa medida con electromiografía. Olmaker et al63 publican recientemente un trabajo experimental en cerdos en los que inducen lumbociática mediante la aplicación de núcleo pulposo en las raíces nerviosas. Como es sabido, el núcleo pulposo contiene condrocitos productores de TNF-α. El grupo de cerdos que son tratados con anti-TNF (etanercept o infliximab) tuvieron menor daño estructural asociado a la lumbociática (edema y trombosis intraneural), así como una menor disminución de la velocidad de conducción. Por su alto coste, es cuestionable que este nuevo enfoque terapéutico sea viable. Sin embargo, desde un punto de vista etiopatogénico el trabajo es muy interesante al centrarse más en aspectos más bien cualitativos (producción de TNF-α por el disco herniado) que meramente cuantitativos (grado de compresión radicular). Esto podría explicar la no tan rara falta de correlación entre grado de compresión y sintomatología en algunos casos de lumbociática.
Osteolisis periprotésica
La movilización de las prótesis articulares debida a una osteolisis periprotésica es una causa relativamente frecuente del fallo de las mismas. Cada vez hay más evidencias de que el TNF-α es un mediador importante de esta situación64. Las pequeñas partículas procedentes del desgaste de la prótesis serían fagocitadas por los macrófagos desencadenándose la respuesta inflamatoria que al liberar TNF-α produciría la activación de los osteoclastos y por lo tanto la osteolisis periprotésica. Hipotéticamente serían de utilidad varios tipos de fármacos como los bifosfonatos, bien conocidos por su uso en la osteoporosis precisamente por inhibir los osteoclastos. En este sentido, ya se dispone de un estudio piloto con alendronato65. Otro grupo de fármacos estaría formado por los inhibidores del TNF-α. Los resultados preliminares con etanercept e infliximab tanto en animales de investigación como en humanos voluntarios parecen ser prometedores66-68.
En conclusión, la terapia anti-TNF es una nueva posibilidad terapéutica en muchos procesos inflamatorios, especialmente en los casos graves y refractarios a los tratamientos convencionales. La experiencia en casos clínicos puntuales o en series pequeñas debería seguirse de estudios multicéntricos que permitan confirmar los resultados preliminares, precisar los pacientes que podrían beneficiarse de su uso y establecer la dosis e intervalos de administración en cada una de las enfermedades. Por último, debemos considerar que las posibles indicaciones médicas con agentes anti-TNF es un campo de gran dinamismo y es muy probable que en el momento de la publicación de este capítulo se disponga de datos nuevos en la bibliografía.