Introducción
Los procesos implicados en la aparición de la artrosis incluyen la destrucción y la reparación tisular, así como una inflamación crónica moderada. Con independencia de la etiología de la artrosis, el deterioro del cartílago es el elemento patológico que protagoniza la afección1.
La función articular está fuertemente relacionada con las propiedades del líquido sinovial (LS), cuyo componente macromolecular primario es el ácido hialurónico (AH). El LS es causante de la lubricación, soporte de carga y presión y protección del cartílago y otros tejidos. Sus propiedades viscoelásticas dependen principalmente de la concentración, peso molecular e interacciones con otras moléculas2.
Durante el desarrollo de la artrosis, tanto la concentración de AH en el LS como su grado de polimerización disminuyen debido a la acción de los iones superóxido y a un descenso de la síntesis por parte de los sinoviocitos3. Por tanto, la elasticidad y la viscosidad del LS se ven reducidas, lo que se traduce en una disminución de sus propiedades como lubricante y amortiguador, haciendo que el cartílago articular sea más vulnerable.
Los antiinflamatorios no esteroideos (AINE), junto con los analgésicos, son considerados como tratamiento estándar para la artrosis de rodilla. Las últimas recomendaciones del American College of Rheumatology (ACR) incluyen como alternativa la utilización de la terapia intraarticular, bien con los ya conocidos glucocorticoides, bien con los nuevos productos a base de AH4.
Las inyecciones de glucocorticoides son útiles en el tratamiento del dolor agudo de rodilla en pacientes con signos de inflamación local con derrame articular4, pero sus efectos son de corta duración, como concluyó el grupo de trabajo sobre la articulación de la British Society of Rheumatology5, y se recomienda que el uso de esteroides intraarticulares esté restringido a 3-4 administraciones/año6.
El AH es una terapia con características diferentes a las anteriores. Actúa sobre los síntomas pero más lentamente y pertenece al grupo de los denominados SYSADOA (symptomatic slow acting drugs for treatment of osteoarthritis)7. Su uso ha introducido, en la práctica médica, el término viscosuplementación, que se refiere a la administración intraarticular de AH para el alivio del dolor y la mejoría de la función articular. La viscosuplementación tiene como objetivo restablecer las propiedades reológicas del LS.
En la actualidad se han desarrollado para uso médico varios AH con un peso molecular que oscila entre 6 × 105 y 6 × 106 Da8-10.
La eficacia y la seguridad del AH se ha demostrado en diferentes ensayos clínicos tanto abiertos como controlados frente a placebo, mucopolisacáridos y esteroides11-17, con resultados prometedores.
En 1987, Meiji Seika Kaisha, Ltd. comenzó un programa de producción de hialuronato sódico utilizando cultivos celulares y tecnologías de purificación, que le eran familiares, debido a su experiencia en la producción de antibióticos. Este proceso de obtención y purificación de hialuronato sódico incluye el cultivo de Streptococcus zooepidemicus (una bacteria productora de ácido láctico) y un proceso de purificación por biotecnología.
El presente estudio se diseñó para evaluar la eficacia y la seguridad de cinco inyecciones intraarticulares de AH (Adant®) administradas con intervalos semanales en pacientes con artrosis de rodilla. Esta pauta de tratamiento está registrada y se utiliza en la actualidad en Europa y Japón, basándose en la eficacia clínica y en estudios de dosis-respuesta18.
Pacientes, material y método
Este ensayo multicéntrico, abierto y no controlado se realizó en 10 hospitales.
Selección de los pacientes
El ensayo se realizó de acuerdo con la Declaración de Helsinki y las normas de buena práctica clínica. El protocolo y la información al paciente fueron aprobados por los comités éticos correspondientes.
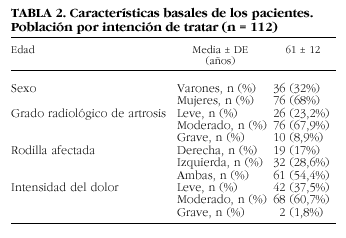
Entre septiembre de 1996 y enero de 1998 se reclutó y monitorizó a 112 pacientes de ambos sexos con diagnóstico clínico y radiológico de artrosis de rodilla que dieron el consentimiento informado por escrito antes de su entrada en el estudio. El diagnóstico de artrosis se basó en los signos clínicos (Criterios ARA)19 y en el examen radiológico. Las alteraciones encontradas se agruparon basándose en el estrechamiento del espacio articular y en la presencia y número de osteófitos en la forma siguiente: artrosis leve, pacientes que presentan estrechamiento leve del espacio articular (incluiría a los pacientes con artrosis grados 1 y 2 de Kellgren); artrosis moderada, pacientes con estrechamiento moderado del espacio articular, signos de esclerosis y presencia de osteófitos (grado 3 de Kellgren), y artrosis grave, con presencia de esclerosis, estrechamiento acusado del espacio articular, deformidad manifiesta de las terminaciones óseas y numerosos osteófitos (grado 4 de Kellgren).
Como principales criterios de exclusión se consideraron los siguientes: pacientes con tratamiento analgésico (excepto paracetamol); existencia de derrame; mujeres embarazadas o en edad fértil que no utilizaran anticonceptivos eficaces; mujeres en período de lactancia; pacientes que radiográficamente no presentasen evidencia de artrosis de rodilla; pacientes inmunocomprometidos o en tratamiento con terapia inmunosupresora sistémica; sensibilidad conocida al AH; pacientes que, a juicio del investigador, fueran incapaces de cumplir el tratamiento o el seguimiento; pacientes que ya hubieran participado en este protocolo; artrosis de rodilla grave que implicase tratamiento quirúrgico, y artrosis de rodilla que cursara con inflamación en la articulación.
También se excluyó a los pacientes que hubieran recibido tratamiento con corticoides por vía intraarticular en los 3 meses previos o AINE 14 días previos al comienzo del estudio o en tratamiento con algún fármaco en investigación en los 30 días anteriores a la primera visita.
En los pacientes con afección bilateral sólo se permitió el tratamiento de la rodilla que presentara mayor dolor.
Procedimientos del estudio
Antes de comenzar el tratamiento se realizó una evaluación clínica basal (V1). El tratamiento consistió en cinco inyecciones de AH con una semana de intervalo entre cada administración (V2-V6). La evaluación de la eficacia se realizó en cada visita de seguimiento: una semana (V7), 3 meses (V8) y 6 meses (V9) después de la última inyección.
La administración se realizó en condiciones de asepsia con el paciente en decúbito supino y la rodilla en extensión, utilizando aguja de calibre 22-23. La dirección de la aguja fue horizontal desde el exterior hacia el margen superior de la rótula.
Antes de entrar en el estudio, se comprobaron los criterios de elegibilidad de los pacientes (diagnóstico clínico, radiografía y pruebas de laboratorio) y se completó la historia clínica. Además, el investigador registró en el cuaderno de recogida de datos (CRD) toda la medicación previa (7 días antes del comienzo del estudio) y concomitante. Para el tratamiento del dolor artrósico, durante el estudio sólo se permitió el consumo de paracetamol.
Para la valoración de la eficacia se utilizó la escala de puntuación que aparece en la tabla 1, basada en la establecida por The Knee Society20. La versión utilizada estaba compuesta por los siguientes subtotales: intensidad del dolor, grado de movilidad y función (incluyendo deambulación, subida/bajada de escaleras y utilización de apoyos). A cada parámetro individual se le atribuyó una escala de puntuación diferente basada en su relevancia clínica. La puntuación total se calculó sumando las puntuaciones parciales. Se analizó el cambio en la puntuación total a lo largo del estudio y la eficacia del tratamiento con AH se clasificó según el porcentaje de incremento de la puntuación en cada visita de seguimiento respecto al basal.
Se consideraron evaluables desde el punto de vista de eficacia los pacientes que recibieron el 100% del tratamiento y realizaron las tres visitas de seguimiento (n = 100). También se llevó a cabo un análisis por intención de tratar en toda la población para comprobar la consistencia del análisis anterior.
La evaluación de seguridad se realizó en los pacientes que recibieron al menos una inyección intraarticular de Adant®. En cada visita del estudio, incluidas las de seguimiento, se registraron todos los posibles acontecimientos adversos. El protocolo incluye la definición de acontecimiento adverso en el contexto de un ensayo clínico, de acuerdo con las normas de buena práctica clínica y la legislación aplicable. Para determinar el grado de imputabilidad al producto en estudio se utilizó el algoritmo de Naranjo21, clasificándose en cinco categorías: enfermedad concomitante no relacionada, dudoso, posible, probable, cierto. Se consideraron relacionados con el producto en estudio los acontecimientos calificados como posible, probable y cierto.
Tratamiento estadístico
Se partió de la hipótesis de realizar un estudio no controlado que permitiese estimar la eficacia en la población, considerando como variable objetivo un aumento en la puntuación > 40% (excelente) en la valoración clínica y funcional.Utilizando la hipótesis de un intervalo de confianza (IC) del 95% (nivel de significación del 5% o p < 0,05), el IC máximo permitido es de un 10%. Según lo anterior, el caso más desfavorable, desde un punto de vista estadístico sería estimar el intervalo de confianza para una proporción del 50% (p = q = 0,05) para lo que serían necesarios 100 pacientes evaluables. Estimando hasta un 10% de abandonos, el tamaño de muestra final se estableció en 112 pacientes.
Para el análisis estadístico de los datos se ha utilizado el sistema SAS (versión 6.12) y más específicamente el módulo SAS/STAT (SAS Institute Inc. SAS/STAT User's Guide, versión 6, 4th ed. Cary, EE.UU., 1990). En cuanto a la estadística descriptiva, para las variables continuas se han obtenido la media, la desviación estándar (DE), la mediana, el rango intercuartílico, el mínimo, el máximo y el coeficiente de variación utilizando el PROC UNIVARIATE. Para la descripción de las variables cagóricas se han utilizado número y porcentaje. En algunos casos se ha incluido también el IC binomial exac-to del 95%, de forma que los datos puedan generalizarse a la población global. El método utilizado es el PROC FREC y un macro para el IC binomial.
Por tratarse de un ensayo no controlado, se llevó a cabo un análisis intragrupo, comparando los datos pre y postratamiento. Para las variables continuas se utilizó el test de Friedman para examinar la tendencia a lo largo de las visitas. Se hicieron comparaciones múltiples dentro del ámbito no paramétrico para comparar los datos entre las visitas22. Este procedimiento se llevó a cabo utilizando PROC FREC y las fórmulas incluidas en la referencia. Cuando se compararon sólo dos visitas, se aplicó el test de Wilcoxon utilizando el PROC NPAR1WAY. Para todos los tests bilaterales el nivel de significación se estableció en el 5%. Los datos detallados de cada paciente se incluyeron en varios listados, creados mediante el PROC REPORT. Los acontecimientos adversos se codificaron mediante el diccionario COSTART, buscando los términos sinónimos.
Resultados
Se incluyó a un total de 112 pacientes, 36 varones y 76 mujeres. Los datos basales se resumen en la tabla 2. Cien pacientes completaron el tratamiento de 5 semanas y las tres visitas de evaluación (población evaluable para eficacia). Doce pacientes (10,7%) no pudieron ser incluidos en esta población por diferentes motivos: perdido en el seguimiento (n = 1), abandono voluntario (n = 1), enfermedad concomitante (n = 3), acontecimiento adverso (n = 2), y «otros» (n = 5). Los cinco incluidos en la categoría «otros» lo fueron por las razones siguientes: un paciente tomó AINE durante el estudio para tratamiento de dolor lumbar; un paciente sufrió un episodio de lumbociática que requirió medicación no permitida y que dificultó la evaluación del tratamiento en la rodilla; un paciente no acudió a la visita V7 aunque sí realizó V8 y V9; un paciente requirió intervención quirúrgica, practicándole osteotomía de tibia izquierda y un paciente sufrió traumatismo en la rodilla en estudio.
Por tanto, podemos concluir que, de los 12 pacientes que no completaron el ensayo, seis fueron excluidos del estudio antes de la primera visita de seguimiento: dos recibieron las cinco infiltraciones; tres recibieron solamente tres infiltraciones debido a abandono voluntario, necesidad de intervención quirúrgica y acontecimiento adverso posiblemente relacionado (reacción local de intensidad leve); finalmente, otro paciente recibió sólo dos infiltraciones debido a acontecimiento adverso no relacionado. Los 6 pacientes restantes recibieron todo el tratamiento y completaron al menos una visita de seguimiento. Todos fueron incluidos en el análisis exploratorio por intención de tratar (ITT) con independencia de la causa que les impidió la finalización del ensayo.
Eficacia
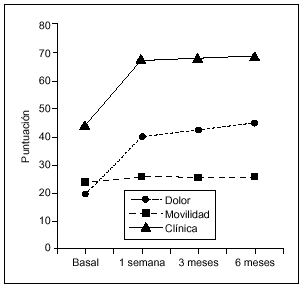
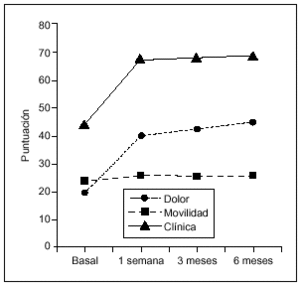
En todas las visitas de seguimiento se observaron diferencias estadísticamente significativas respecto al basal (Wilcoxon, p = 0,0001) para todos los parámetros considerados, como dolor, movilidad, deambulación y subida/bajada de escaleras (figs. 1 y 2). La mejoría más significativa fue en dolor. Las puntuaciones medias ± DE en dolor oscilaron desde 22,6 ± 10,7 puntos en V1 hasta 37,6 ± 12,5 en V9.
Figura 1. Puntuación clínica (mediana) a lo largo del estudio. La mejoría en las puntuaciones en cada visita de seguimiento fue estadísticamente significativa respecto al basal (Wilcoxon, p = 0,0001) tanto para el dolor como para el grado de movilidad.
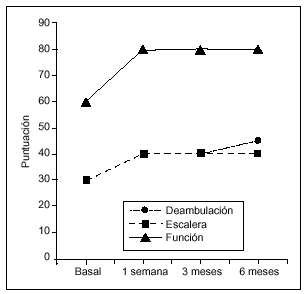
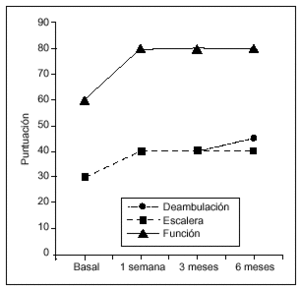
Figura 2. Evolución de la función a lo largo del estudio (medianas). La mejoría respecto a la puntuación basal fue estadísticamente significativa en cada una de las visitas de seguimiento tanto para la deambulación como para la subida/bajada de escaleras (Wilcoxon, p = 0,0001).
Comparando las diferencias entre las tres visitas de seguimiento (V7, V8 y V9) mediante el test de Friedman, se observa que no existen diferencias entre V7 y V8. Sin embargo, la mediana de la puntuación en V9 (6 meses después de la última dosis) difiere de forma significativa respecto a V7 y V8 (p = 0,003).
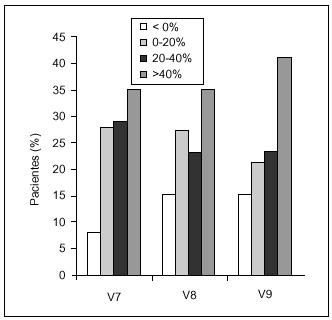
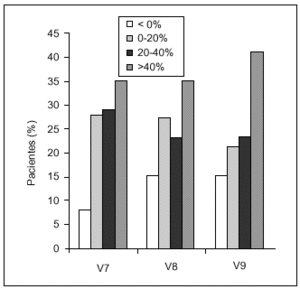
La respuesta global al tratamiento se clasificó en función del porcentaje de incremento de la puntuación total en cada visita de seguimiento respecto a V1 (fig. 3). Se detectó una correlación entre la puntuación basal y el porcentaje de incremento en las visitas de seguimiento, observándose que a mayor puntuación basal menor incremento. Un incremento del porcentaje > 20% se consideró como respuesta «muy buena», lo que ocurrió en el 64% de los pacientes 6 meses tras la última administración. Entre el 35 y el 40% de los pacientes tuvieron una respuesta > 40%, respuesta «excelente», en todas las visitas de seguimiento.
Figura 3. Respuesta al tratamiento, que se clasificó en función del porcentaje de incremento de la puntuación en cada una de las visitas de seguimiento (V7, V8 y V9) respecto al basal.
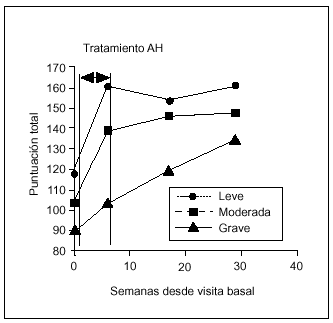
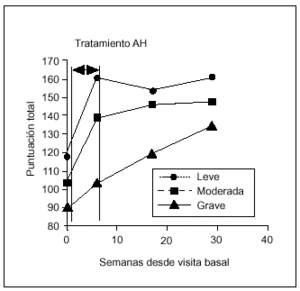
La eficacia de la terapia con AH estratificada de acuerdo con el grado radiológico (leve, moderado, grave) se recoge en la figura 4. En los grupos clasificados como leve, moderado y grave, se encontraron diferencias estadísticamente significativas (p < 0,05) en todas las visitas de seguimiento respecto al basal. En la artrosis grave estas diferencias se encontraron sólo entre V9 y V1. Por tanto, en pacientes afectados por artrosis de rodilla grave, son necesarios 6 meses para conseguir una mejoría significativa. Esto nos llevaría a pensar que la respuesta al tratamiento con AH dependería del grado radiológico de artrosis. Para comprobar esta hipótesis se estudió la relación entre el grado y la respuesta en cada una de las visitas de seguimiento, y no se observó correlación alguna (χ2).
Figura 4. Relación entre la eficacia del tratamiento y el grado radiológico de artrosis.
Seguridad
Todos los pacientes (n = 112) se evaluaron desde el punto de vista de seguridad. De ellos, 108 pacientes recibieron cinco inyecciones intraarticulares cada uno, 3 pacientes recibieron tres inyecciones cada uno y un paciente recibió dos dosis. Esto da como resultado un total de 551 inyecciones intraarticulares administradas.
Durante el estudio (incluyendo tanto las visitas de tratamiento como las de seguimiento) se registró un total de 66 acontecimientos adversos; sólo 7 de ellos fueron posible/probablemente relacionados con AH y 13 se clasificaron como dudosos. No hubo ningún acontecimiento adverso clasificado como cierto. Los 46 restantes fueron enfermedades concomitantes no relacionadas.
De los siete acontecimientos relacionados, seis se describieron como posibles y uno como probable. La descripción de estos acontecimientos fue: vértigo (n = 2), dolor de rodilla (n = 2), edema (n = 1), prurito (n = 1) y reacción de hipersensibilidad (n = 1), y afectaron a un total de 6 pacientes. Esto significa una incidencia de acontecimientos adversos posible/probablemente relacionados del 5,3%.
De estos acontecimientos adversos posible/probablemente relacionados tres podrían deberse a la técnica de administración (incidencia, 2,7%). Los cuatro restantes corresponden a 3 pacientes (incidencia, 2,7%) y son de etiología desconocida (hipersensibilidad, vértigo y dolor de rodilla). La reacción de hipersensibilidad se describió en un paciente con historia previa de alergia y como consecuencia se interrumpió el tratamiento. En todos los casos la intensidad fue leve excepto en el caso del vértigo, que se clasificó como moderada.
La incidencia de acontecimientos adversos por inyección, con independencia de la causalidad, fue del 3,6% y la de acontecimientos posible/probablemente relacionados, del 1,3%.
Discusión
Se ha observado un claro beneficio clínico de la viscosuplementación con AH en pacientes afectados de artrosis de rodilla. Somos conscientes de las limitaciones y sesgos asociados que conlleva un estudio no controlado, pero también es cierto que se trata de una aproximación más realista a lo que constituye la práctica clínica diaria. Los datos obtenidos deben contemplarse dentro de este contexto, si bien nosotros consideramos que la respuesta clínica observada estaría por encima de la esperada tras la administración de un placebo, tanto en la intensidad como en la duración de los efectos. Los resultados de eficacia demuestran una mejoría en todas las medidas de desenlace respecto a los valores basales (p = 0,0001), que se observa una semana después de la última inyección. Por tanto, un único ciclo de cinco inyecciones proporciona una prolongada disminución del dolor y una mejoría de la funcionalidad de la rodilla.
Las recomendaciones para ensayos clínicos en artrosis indican la conveniencia de utilizar un grupo control, aunque no se pueden extraer conclusiones claras de los estudios controlados frente a placebo, ya que el control tiene una viscosidad diferente del verdadero, por lo que el carácter ciego del investigador puede no haberse mantenido durante el estudio. Esto podría afectar a algunas medidas de desenlace, como la necesidad de tratamientos adicionales y la valoración global por el investigador23.
Si la comparación se hace entre un analgésico por vía oral (que puede beneficiar a ambas rodillas) y un fármaco/producto sanitario de administración intraarticular (que única o preferentemente tiene efecto sobre una rodilla), podría producirse un sesgo a favor del fármaco administrado por vía oral24.
Henderson et al25 no consiguieron demostrar diferencias en un estudio controlado frente a placebo. Este estudio de 6 meses tiene un elevado porcentaje de abandonos lo que puede tener como consecuencia una potencia insuficiente para detectar diferencias entre los pacientes que completaron el estudio.
Recientemente Huskinsson et al26 compararon AH y placebo con el objetivo de establecer si el producto es eficaz en artrosis de rodilla. Este estudio demostró claramente que un ciclo de cinco inyecciones semanales de AH era eficaz, superior al placebo y aceptado por los pacientes con artrosis de rodilla, confirmando los resultados de otros muchos estudios que han demostrado resultados similares.
Especial relevancia tiene un estudio reciente12 que compara un ciclo de cinco inyecciones de AH frente a otras cinco intraarticulares de placebo y frente a naproxeno por vía oral de forma continuada. El AH fue superior a placebo y al menos tan eficaz como el naproxeno por vía oral.
Se puede concluir que la medida de desenlace más importante para este tipo de tratamientos es el grado de dolor relatado24. En nuestro estudio, la mejoría más acusada se observó en el dolor de la rodilla tratada con puntuaciones finales próximas a un estado no sintomático.
El elevado porcentaje de pacientes que alcanzaron una respuesta > 40%, así como el de respuesta a largo plazo, pone de manifiesto en este estudio una eficacia similar a la descrita en otros estudios controlados y no controlados. Namiki et al27 describieron una respuesta excelente/buena en el 57,8% de los pacientes. Los resultados de nuestro estudio demuestran que un ciclo de cinco inyecciones de AH por vía intraarticular con periodicidad semanal es eficaz en el 64% de los pacientes al menos hasta 6 meses después de terminar el tratamiento.
De acuerdo con los datos farmacocinéticos del AH administrado de forma exógena, el AH comienza a abandonar el espacio articular 2 h después de su administración y se ha eliminado por completo al cabo de 4 días28. El hecho de que los beneficios terapéuticos sean más duraderos que su permanencia en el organismo justifica la hipótesis de que el mecanismo de acción va mucho más allá que un efecto mecánico. De hecho, hay una tendencia a aceptar que el efecto terapéutico del AH se debe a una combinación de sus propiedades fisicoquímicas y farmacológicas29,12.
En la actualidad se dispone de varios preparados de AH para la viscosuplementación en artrosis, que difieren en el peso molecular y en su origen (biotecnología frente a extracción animal). En relación con la importancia del peso molecular, se ha identificado un receptor de membrana30 que podría permitir la acción del AH mediante un mecanismo que depende del peso molecular. Según esto, el AH de elevado peso molecular sería más eficaz en el tratamiento de la artrosis; sin embargo, no hay estudios comparativos entre las diferentes formulaciones de AH en sus dosis recomendadas y en el mismo grupo de pacientes.
El peso molecular y la viscosidad no están directamente relacionados. La concentración de AH tiene un mayor peso específico sobre la viscosidad del LS que su peso molecular31. Los cambios en las propiedades reológicas del LS en artrosis se atribuyen principalmente a las bajas concentraciones de AH y no a un déficit de AH de peso molecular elevado.
El AH utilizado en este ensayo presenta un excelente perfil de seguridad, evitando cualquier tipo de reacciones relacionadas con el origen animal de otros preparados. Los resultados obtenidos en este estudio confirman esta información, ya que la incidencia de acontecimientos adversos relacionados de etiología desconocida fue del 2,7%.
Ya se ha demostrado en estudios preclínicos8 que es posible restablecer los bajos valores de AH en la articulación artrósica mediante la administración exógena de AH. El grado de distribución del AH administrado depende de la proporción entre AH endógeno y cantidad utilizada. Cuanto mayor es esta proporción, mayor es la cantidad de AH distribuido.
A pesar de que existe una importante acción mecánica, una vez dentro de la articulación, el AH produce varios efectos: a) actividad antiinflamatoria: el AH de alto peso molecular inhibe la migración y quimiotaxis de leucocitos, fagocitos, así como la adherencia y la proliferación inducida por mitógenos, y b) actividad analgésica: el AH produce un efecto modulador del dolor mediante la reducción de moléculas hiperálgicas como prostaglandinas E2 y bradicininas.
Algunos autores indicaron que en pacientes con grados leves de artrosis obtenían mejores tasas de respuesta que con mayor grado de afección34, mientras que otros concluían que la gravedad radiográfica de la artrosis no afectaba a la eficacia de los resultados35, al igual que los resultados obtenidos en nuestro estudio. La eficacia del tratamiento con AH es independiente del grado radiológico basal de la artrosis. Sin embargo, las diferencias entre la situación basal y postratamiento aparecen antes en artrosis leves y moderadas que en el grupo de pacientes con artrosis grave, en el que es necesario esperar un período de 6 meses para obtener una mejora significativa.
La terapia intraarticular con AH retrasa el proceso degenerativo de la artrosis. Se ha observado que la administración de AH muy purificado retrasa igualmente el catabolismo de los condrocitos eliminando sustancias tóxicas del espacio articular a través del sistema linfático. Este mecanismo justificaría la reducción observada en el deterioro del cartílago gracias al tratamiento intraarticular con AH35.
En conclusión, la terapia con AH parece que es una alternativa eficaz, segura y bien tolerada para el tratamiento de la artrosis de rodilla, con al menos 6 meses de duración de los efectos. Los datos de este estudio apoyarían, además, la tendencia actual de considerar el AH como un tratamiento sintomático de acción lenta (SYSADOA). El estudio de esta terapia a través de ensayos controlados, a largo plazo (2-4 años), con ciclos repetidos cada 6 meses permitirá analizar si, como algunos autores indican, el AH es además capaz de retrasar los procesos degenerativos de la artrosis y estudiar así su posible efecto como modificador del curso de la enfermedad.
Grupo de estudio Adant®:
Blanco Pozo, A. Hospital General Yagüe (Burgos)
Forner Valero, V. Hospital La Fe (Valencia)
García Alonso, M. Hospital del Río Hortega (Valladolid)
González Buendía, R. Hospital Universitario Virgen del Rocío (Sevilla)
Martínez Grande, M. Clínica Ubarmín (Pamplona)
Sánchez Sierra, B. Hospital General de Galicia (Santiago de Compostela)
Iglesias Blanco, R. Hospital General de Galicia (Santiago de Compostela)
Moreno Pérez, J. Hospital Virgen de la Salud (Toledo)
Marti Ciruelos, R. Hospital Doce de Octubre (Madrid)
De Lucas Aguilar, R. Hospital Doce de Octubre (Madrid)
Pérez Sanz, C. Hospital Nuestra Señora de Aránzazu (San Sebastián)
Larraz del Arco, J. Hospital Nuestra Señora de Aránzazu (San Sebastián)
Cuellar Gutierrez, R. Hospital Nuestra Señora de Aránzazu (San Sebastián)
González Galárraga, J.I. Hospital Nuestra Señora de Aránzazu (San Sebastián)
Perales Ruiz, J.M. Hospital General Yagüe (Burgos)
Núñez-Cornejo Piquer, C. Hospital La Fe (Valencia)
Cevelló Guixeves, E. Hospital La Fe (Valencia)
Valverde García, J.A. Hospital del Río Hortega (Valladolid)
Álvarez Ramos, A. Hospital del Río Hortega (Valladolid)
Muela Velasco, R. Hospital Universitario Virgen del Rocío (Sevilla)
Rodríguez Martínez, M. Hospital Universitario Virgen del Rocío (Sevilla)
Retamino García, S. Hospital Universitario Virgen del Rocío (Sevilla)
Sagasti Beltza, J. Clínica Ubarmín (Pamplona)
Urtiaga, I. Clínica Ubarmín (Pamplona)
González Arteaga, J. Clínica Ubarmín (Pamplona)
Correspondencia: Dra. P. Coronel Granado. Tedec-Meiji Farma, S.A. Ctra. M-300, Km 30,500. 28820 Alcalá de Henares. Madrid. España. Correo electrónico: p.coronel@tedecmeiji.com
Manuscrito recibido el 4-4-2002 y aceptado el 28-11-2002.