Infliximab: del empirismo a la evidencia
Desde que en 1929 Forrestier comenzara a utilizar las sales de oro en el tratamiento de la artritis reumatoide (AR) hasta finales de los años ochenta, el acercamiento al tratamiento de la AR ha sido fundamentalmente empírico. El tratamiento con fármacos que mejoraban los síntomas, como los antiinflamatorios no esteroideos (AINE) o los propios esteroides, enlenteció durante muchos años el planteamiento de la enfermedad como un proceso activo, destructivo, bajo la falsa apariencia de un paciente medianamente satisfecho, cuando no resignado, a una enfermedad que progresaba de forma silente e inexorable hacia la incapacidad. Esta actitud condescendiente fue compartida durante décadas por los reumatólogos, en parte fundamentada en la impotencia para combatir un proceso cuyos mecanismos de iniciación y progresión se desconocían.
A medida que progresaba la inmunología y el concepto de autoinmunidad encabezaba las líneas de investigación, se fueron introduciendo junto a la crisoterapia los llamados fármacos modificadores de la enfermedad (FAME) clásicos, basados en propiedades inmunomoduladoras in vitro, como los antipalúdicos o la D-penicilamina, o en su carácter antimicrobiano para combatir una posible etiología infecciosa como la sulfasalazina o las tetraciclinas1. Sin embargo, el desconocimiento de los verdaderos mecanismos de acción en los procesos patológicos presidía la desorientación respecto al uso racional de estos medicamentos, algunos de los cuales se han rescatado posteriormente para usarlos en combinación, con niveles mayores de eficacia. La inclusión en el tratamiento de los inmunosupresores como ciclofosfamida, azatioprina o metotrexato, obedecía a sus mecanismos de acción sobre células tumorales, asimilando su posible efecto sobre el comportamiento seudotumoral del pannus en la AR, mediado por la interacción de múltiples tipos celulares. La inhibición del ciclo celular con la consiguiente disminución de la células de alta replicación no es suficiente para explicar su eficacia en la enfermedad reumatoide, y precisamente de este mecanismo derivan sus importantes efectos tóxicos que en muchos casos no se pueden asumir como la inmunosupresión severa o la oncogenicidad.
Las particularidades del uso del metotrexato en cuanto a la terapia de la AR, que difieren notablemente de su utilización en el cáncer, se explican en gran parte por mecanismos de acción alternativos a la inhibición del metabolismo del folato que bloquea el ciclo celular2, y han permitido obviar muchos de sus peores efectos tóxicos. Hoy sabemos que además de modular la respuesta humoral y celular, el metotrexato inhibe en macrófagos la producción de múltiples mediadores inflamatorios entre los que se encuentran citocinas proinflamatorias como IL-1β, IL-8 y TNF-α. Por tanto, es el mejor conocimiento de las interacciones celulares entre macrófagos y otras células en el microambiente sinovial, con las consiguientes consecuencias funcionales, lo que ha permitido entender mejor el efecto antiinflamatorio del metotrexato en la AR. Desde su introducción en la práctica reumatológica a mediados de los ochenta, este conocimiento ha permitido racionalizar mejor su uso, con un perfil de eficacia/seguridad que lo han convertido en el FAME más utilizado hasta ahora para el tratamiento de la enfermedad.
De igual modo, se conoce bien el mecanismo de ciclosporina A inhibiendo la síntesis de citocinas linfocitarias, pero otros mecanismos coadyuvantes sobre moléculas señalizadoras en células T pueden explicar mejor su eficacia en AR3, y por qué ésta reside fundamentalmente en el tratamiento combinado. Recientemente, la leflunomida4, un inmunomodulador que inhibe la expansión clonal de los linfocitos mediante la inhibición de la síntesis de pirimidinas, se ha añadido al arsenal terapéutico de la AR, con una eficacia similar a metotrexato o sulfasalazina.
De cualquier modo, el extraordinario avance en el conocimiento de las vías celulares y moleculares implicadas en la patogenia de la AR, junto con el avance de la biología molecular y la biotecnología, han permitido el desarrollo de fármacos cuya eficacia farmacológica está explicada por su mecanismo de acción conocido: es lo que ocurre con los llamados medicamentos biológicos5,6-8. Sin embargo, no debemos olvidar que frente a la profusión de citocinas recombinantes, anticuerpos monoclonales, receptores solubles, proteínas de fusión y otros agentes que han sido o están siendo probados en pacientes con AR, el nivel de eficacia frente a la toxicidad sigue siendo el mayor determinante para el uso en la práctica clínica de estos agentes. La demostración de esta eficacia con los mayores niveles de evidencia posible nos introduce en otro de los condicionantes para el uso racional de fármacos en los últimos años: la necesidad de que un fármaco o estrategia esté apoyado por eficacia a largo plazo en ensayos clínicos bien diseñados, controlados, distribuidos de forma aleatoria y doble ciego, frente a fármacos con eficacia demostrada.
Esta puede ser la explicación por la que numerosas estrategias de inmunoterapia y terapia antiadhesiva, aplicadas extensivamente y con éxito en modelos animales durante los años ochenta y noventa, no hayan llegado a consolidarse tras los estudios inicialmente abiertos y luego controlados en humanos. Los efectos beneficiosos relativamente modestos y muy transitorios, que se observan con terapias frente a moléculas de superficie de células T como anti CD4, CD5, CD7 o ICAM-1 pueden reflejar una dosis inadecuada o pueden sugerir que la depleción o el bloqueo indiscriminado de células T no es suficiente como diana terapéutica8. Estos datos negativos contrastan con los de ensayos clínicos con terapias anticitocinas, que han resultado particularmente eficaces en el caso de los antagonistas de TNF-α (etanercept e infliximab)9-11, aunque estos dos agentes difieren en su estructura, mecanismo de acción y farmacocinética.
En 1992, infliximab fue el primer agente anti-TNF-α utilizado en un ensayo clínico en pacientes con AR, y ya en el primer ensayo abierto demostró su eficacia para controlar los síntomas de la AR y la actividad inflamatoria12. Posteriormente, en asociación con metotrexato, en múltiples ensayos controlados, ha demostrado la capacidad para detener la progresión del daño estructural irreversible, de forma similar a otros agentes anti-TNF-α, y superior a otros FAME como metotrexato o leflunomida13.
Puesto que ya se han expuesto en otros artículos las bases y justificación para un uso racional de infliximab en la AR, en esta breve revisión resumiremos la evidencia acumulada sobre la eficacia de infliximab en AR, que nos permite aludir a esta terapia como uno de los avances cualitativos más relevantes en el control de la enfermedad en los últimos 20 años. Los aspectos de seguridad y tolerancia serán expuestos en otro capítulo.
Uso terapéutico de infliximab
Eficacia en ensayos clínicos
El uso de infliximab en la AR establecida e incluso refractaria ha sido evaluado en 9 ensayos clínicos inicialmente abiertos y posteriormente controlados, distribuidos de forma aleatoria, doble ciego, que incluyen a más de 1.000 pacientes14-16 , y actualmente está en marcha un ensayo en fase III en AR precoz (< 2 años), que incluye a 1.050 pacientes en todo el mundo. Tras su aprobación por la FDA (Food and Drug Administration) en 1998, aproximadamente 200.000 pacientes han sido tratados en todo el mundo, la mayoría de ellos con AR17, y en nuestro país, según el número de pacientes recogido en la base de datos de seguridad de terapias biológicas (BIOBADASER), podemos estimar que supera el millar.
Los primeros estudios con infliximab en el tratamiento de la AR se llevaron a cabo en monoterapia y posteriormente en combinación con metotrexato, pero en todos ellos se permitían dosis estables de AINE o de corticoides orales (< 10 mg de prednisona/día o equivalente), previa incorporación al estudio. La mayoría de los estudios han utilizado como primera medida de eficacia los criterios de mejora recogidos en índices compuestos por el American College of Rheumatology (ACR)18 o Paulus19 y en los que se incluyen: recuento de articulaciones dolorosas e inflamadas, duración de la rigidez matutina, escalas visuales análogas (EVA) o semicuantitativas (Likert) de dolor, valoración global de la enfermedad por el paciente y el médico, cuestionarios de valoración funcional (Health Assesment Questionaire [HAQ]) y reactantes de fase aguda como la velocidad de sedimentación globular (VSG) o la proteína C reactiva (PCR). Como veremos más adelante, en los últimos ensayos a más largo plazo se han incorporado otras medidas de desenlace relevantes tales como los índices de progresión radiológica, discapacidad o índices de calidad de vida.
Monoterapia. El primer estudio abierto fase I/II12 se llevó a cabo durante 8 semanas, en 20 pacientes con AR activa a pesar de tratamiento con FAME, en el que se evaluó el efecto de 20 mg/kg de infliximab (2 infusiones de 10 mg/kg, o cuatro de 5 mg/kg) basado en la premisa de que los pulsos cortos podrían inducir remisión. El tratamiento fue bien tolerado, con una reducción rápida de más del 60% del número de articulaciones inflamadas y de la PCR, que se comenzó a evidenciar ya desde la primera semana. Durante el seguimiento, varios de los enfermos presentaron recidivas y fueron retratados con varios ciclos de 10 mg/kg, con lo que se obtuvo una respuesta media de mejora del 80%, en las medidas de actividad de la enfermedad y en la PCR20. Asimismo, se fue observando una progresiva reducción del tiempo de mejora con infusiones repetidas, que inicialmente se relacionó con la aparición de anticuerpos antiquiméricos humanos contra la porción murina del infliximab. El siguiente estudio multicéntrico, de distribución aleatoria y doble ciego, permitió objetivar la relación dosis-respuesta de diferentes dosis, en infusión única, en 73 pacientes con AR activa. Aunque tanto 1 como 10 mg/kg alcanzaron una mejora significativa Paulus del 20%, la mitad de los pacientes con dosis de 10 mg/kg alcanzaron una respuesta Paulus del 50%21.
Terapia combinada con metotrexato. La eficacia de infliximab en combinación con metotrexato se evaluó inicialmente en infusión única a diferentes dosis (5,10 y 20 mg/kg) en pacientes que no habían respondido a dosis bajas de metotrexato (10 mg/semana)16. El 71 y el 86% de los pacientes que recibieron 5 y 20 mg/kg de infliximab más metotrexato alcanzaron una respuesta clínica ACR del 20% durante las 12 semanas del seguimiento, y la respuesta ACR 50% se constató en el 43 y en el 71%, respectivamente, comparado con un 14% del grupo placebo que sólo recibía metotrexato. Quedaba entonces por evaluar si la asociación de metotrexato podía añadir eficacia al tratamiento con diferentes dosis de infliximab en infusiones repetidas. Para ello se diseñó un ensayo multicéntrico en fase II, distribuido al azar, doble ciego, controlado con placebo, en 101 pacientes que permanecían en actividad a pesar de dosis bajas de metotrexato oral22. El infliximab se administró a dosis de 1, 3 o 10 mg/kg en una pauta de 0, 2, 6, 10 y 14 semanas, o bien solo, o bien asociado a 7,5 mg semanales de metotrexato, con un período de seguimiento de 26 semanas. Otro grupo control recibía metotrexato a dosis de 7,5 mg/semana más infusiones de placebo. Este estudio corroboró que en monoterapia las dosis de infliximab de 3 y 10 mg/kg inducían respuesta más prolongada y en mayor número de pacientes que la dosis baja de 1 mg/kg. Sin duda, el principal hallazgo fue que, a cualquier dosis de infliximab, la asociación con metotrexato demostró mayor eficacia que el anticuerpo monoclonal solo, y la respuesta tras la suspensión de la terapia se mantuvo a las 26 semanas en el 50-60% de los pacientes con terapia combinada de 3 y 10 mg/kg de infliximab y metotrexato. Estos datos sugerían que la asociación con dosis bajas de metotrexato podía ejercer un efecto inmunosupresor que reduciría los niveles de anticuerpos antiquiméricos; sin embargo, estudios posteriores no han podido corroborar esta hipótesis.
Los datos de este último estudio proporcionaron la base para el diseño del estudio más importante a largo plazo, de eficacia de infliximab en pacientes con AR refractaria. Este ensayo multicéntrico internacional doble ciego, controlado con placebo en fase III, denominado ATTRACT (Anti-TNF- αTrial in Rheumatoid Artritis with Concomitant Therapy)23 incluyó a 428 pacientes con AR activa a pesar de una dosis media de metotrexato de 15 mg semanales (rango 10-35). El factor reumatoide era positivo en el 80%, la mediana de duración de la AR era de 8,4 años, casi el 50% presentaba una clase funcional III de la ACR y había fracasado a una mediana de 3 FAME previos. En las terapias previas se incluía necesariamente el metotrexato, que era el tratamiento de más del 50% de los pacientes en los últimos 3 años. En total, el 37% de los casos se había sometido a una intervención quirúrgica previa, y a una cuarta parte de los pacientes se les había practicado anteriormente cirugía de sustitución articular. Se definió la enfermedad activa como seis o más articulaciones inflamadas, seis o más articulaciones dolorosas, y dos de los tres siguientes criterios: rigidez matutina > 45 min, VSG > 28 mm/h y PCR > 2 mg/dl.
Se permitía el uso concomitante de corticosteroides orales o AINE a dosis estables, pero no el de otros FAME, y se administraron suplementos de ácido fólico. Se dividió a los pacientes en 5 grupos con características homogéneas para evaluar la dosis óptima de infliximab (3 o 10 mg/kg) y el intervalo óptimo de infusión (4 u 8 semanas) después de una pauta común de inducción en las semanas 0, 2 y 6 (fig. 1). Inicialmente diseñado para 30 semanas, se continuaron estudios de extensión para conocer el beneficio clínico a las 54 semanas15 y se han comunicado ya datos a las 102 semanas24.
Figura 1. Esquema del diseño del ensayo ATTRACT21, que ilustra las diferentes modalidades de tratamiento y el flujo de pacientes cuando se había completado el primer año de tratamiento. EA: efectos adversos; FE: falta de eficacia. *"otros" incluye retirada de consentimiento informado o falta de cumplimiento.
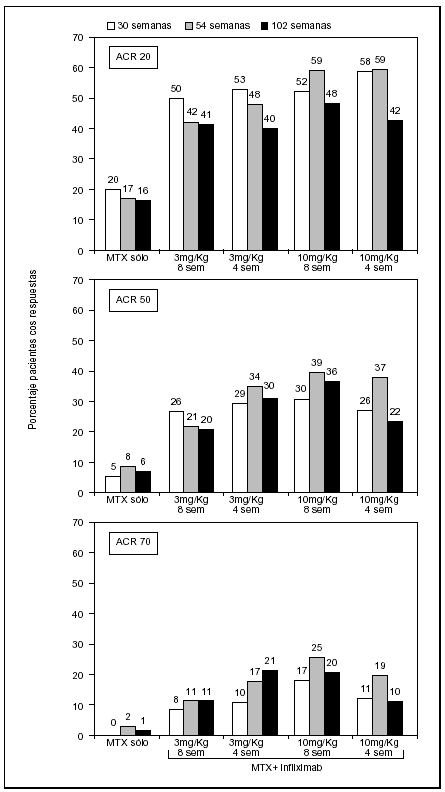
La asociación de infliximab y metotrexato fue significativamente más eficaz en la reducción de los signos y síntomas de la AR a las 30, 54 y 102 semanas que metotrexato solo, lo que fue valorado mediante los criterios por intención de tratar del American College of Rheumatology (ACR) (fig. 2). La respuesta a infliximab fue rápida, y se observó mejora frente a MTX sólo, ya en las 2 primeras semanas (p < 0,001). A las 6 semanas, aproximadamente el 90% de los que respondían habían alcanzado una respuesta ACR del 20%, lo que indicaba un rápido inicio de acción. A las 30 semanas, la respuesta ACR20 fue alcanzada en el 53 y el 50% de los pacientes que recibían 3 mg/kg cada 4 u 8 semanas, y en el 58 y 52% de los pacientes con 10 mg/kg cada 4 u 8 semanas respectivamente, comparado con sólo el 20% de los pacientes con metotrexato más placebo (p < 0,001 de cada grupo con infliximab respecto a metotrexato solo). Como se aprecia en la figura 2, un 50% de mejora (ACR50) se logró en el 29, 27, 26 y 30% de los pacientes en los cuatro grupos de tratamiento combinado frente a un 5% de los pacientes con metotrexato solo (p < 0,001).
Figura 2. Resultados de las variables clínicas del ensayo ATTRACT23 y sus extensiones a 5215 y 102 semanas24, expuestas mediante el porcentaje de pacientes que alcanzan los criterios de mejora del American College of Rheumatology (ACR). Los datos corresponden a la mejora del 20, 50 y 70%, analizados según intención de tratar.
En cuanto a la supervivencia del tratamiento, al año del inicio el 73-80% de los pacientes con infliximab seguían en el ensayo, frente a un 50% de los pacientes en el grupo control con metotrexato (fig. 1). Los abandonos por ineficacia en este grupo supusieron el 36% del total de los 88 pacientes que iniciaron el estudio frente a un 8% que lo hicieron por efectos secundarios. En los 4 grupos de tratamiento combinado, el porcentaje de abandonos por ineficacia varió del 20% en los 2 grupos con menor dosis (3 mg/kg), al 7-9% en los pacientes con dosis alta de 10 mg/kg, sin influencia del intervalo de infusión dentro de cada dosis. El porcentaje de abandonos por efectos secundarios (10%) fue mayor en los 2 grupos con mayor número de infusiones, cada 4 semanas, que en los de cadencia cada 8 semanas (5-6%) sin que se aprecien diferencias entre dosis. No obstante, estas cifras no son significativas respecto a los abandonos en el grupo de metotrexato más placebo.
Los resultados del estudio de extensión a las 54 semanas demostraron que el 42-59% de los pacientes en terapia combinada alcanzaron una respuesta ACR20, comparado con el 17% de los que recibían metotrexato sólo (fig. 2). Un porcentaje significativamente mayor de pacientes en los grupos con infliximab alcanzaron respuestas clínicas más sustanciales definidas por criterios ACR50 y 70 (fig. 2). Sólo el 2% de los pacientes control con metotrexato consiguió una respuesta ACR70 al año de tratamiento, frente al 11 y el 21% de los pacientes con la dosis más baja de infliximab (3 mg/kg). Muy llamativa fue la respuesta de la PCR en el grupo activo, que permaneció por debajo de 1 mg/dl prácticamente desde la segunda semana hasta completar el año, frente a las cifras del grupo control, que en valores medios permaneció superior a 2 mg/dl. En el análisis realizado a 2 años (102 semanas) la eficacia en los parámetros clínicos sigue siendo superior en los grupos con infliximab. Con la dosis de 3 mg/kg cada 8 semanas los porcentajes de pacientes con respuestas ACR20, 50 y 70 son respectivamente 50, 20 y 11% respecto a 16, 6 y 1% del grupo con metotrexato solo (fig. 2). La utilización de las mayores dosis (10 mg/kg cada 4 semanas) no suponía un aumento significativo de la mejora.
Pero además de la eficacia en la supresión de los síntomas y de la actividad biológica, otras dos importantes variables de desenlace se establecieron en el ensayo ATTRACT a las 54 y 102 semanas: 1) el grado de progresión radiológica, y 2) la capacidad funcional y calidad de vida. El grado de progresión radiológica se estimó en las radiografías de pies y manos, mediante el cambio en el índice articular total de daño estructural respecto al basal, medido por un índice radiológico de Sharp modificado por van der Heijde25. Este índice radiológico compuesto, sensible y consistente entre grupos de pacientes, cuantifica tanto el pinzamiento articular por pérdida de cartílago como las erosiones óseas, dos parámetros de daño estructural que inexorablemente progresan en la AR a pesar de los FAME clásicos26. El primer análisis realizado a las 54 semanas mostraba una media de progresión radiológica de 7 en el grupo de metotrexato solo, frente a un índice de progresión de 0,6 en el conjunto de los 340 pacientes que recibían infliximab15. Aproximadamente el 50% de los pacientes en este último grupo no mostró ninguna progresión radiológica, pero además aquéllos con un índice de progresión basal más alto fueron los más beneficiados por el tratamiento27. La reducción de la progresión radiológica se objetivaba tanto en el primero como en el segundo año (fig. 3), incluso en aquellos pacientes que no alcanzaban criterios de eficacia clínica ACR2028.
Figura 3. Cambios respecto a la basal en la media del índice radiológico de Sharp, modificado por van der Heijde25. Este índice compuesto recoge tanto el pinzamiento articular como las erosiones óseas. Se exponen los cambios en el grupo control de metotrexato solo frente a los alcanzados en terapia combinada con la dosis estándar de 3 mg/kg cada 8 semanas, y en comparación con la media alcanzada en todos los grupos con infliximab más metotrexato.
Estos datos añaden relevancia al beneficio obtenido con infliximab tanto a corto como a largo plazo, y pueden explicar la mejora significativa que se obtiene en la capacidad funcional medida por el índice HAQ. En los primeros estadios de la enfermedad, la discapacidad parece depender fundamentalmente de los síntomas inflamatorios y sistémicos, pero a medida que la enfermedad avanza, el daño estructural articular puede seguir progresando a pesar de que los síntomas estén controlados, y las destrucciones y deformidades que produce son las principales responsables de la incapacidad29. El tratamiento combinado con infliximab no sólo permite el control rápido de los síntomas inflamatorios, sino que también es capaz de detener o prevenir los procesos destructivos óseos, responsables a largo plazo de la incapacidad. Se objetivó una mejora media de 0,5 del índice funcional medido por HAQ en los pacientes con infliximab durante los 2 años del estudio, significativamente superior a la alcanzada en el grupo control. Cuando se investigaron parámetros de calidad de vida mediante el cuestionario SF 36, se objetivó mejora significativa en el grupo de tratamiento activo a las 54 semanas, en al menos 6 parámetros: estado físico y función, dolor corporal, percepción del estado de salud general, vitalidad y sociabilidad. No se observó deterioro emocional ni de salud mental. Por tanto, a través de la mejora rápida de los síntomas articulares y sistémicos y de la capacidad funcional y de relación social, infliximab era capaz de mejorar notablemente la calidad de vida.
Experiencia en la práctica clínica: efectividad
Como hemos visto, los ensayos clínicos han proporcionado suficiente evidencia de que el infliximab, fundamentalmente asociado a metotrexato, es un tratamiento rápido y eficaz, que puede ser usado de forma prolongada en el tratamiento de la AR y del que además pueden beneficiarse pacientes refractarios a otros FAME, incluido el metotrexato.
Se han comunicado hoy día resultados de varios estudios abiertos, observacionales, de pacientes tratados con infliximab en condiciones de práctica clínica habitual30,31, incluida la experiencia en nuestro país32,33. Uno de los primeros hechos constatados es que las tasas de respuesta clínica son bastante similares a las de los ensayos clínicos si se utiliza la dosis recomendada de 3 mg/kg cada 8 semanas, pero en muchos pacientes la respuesta ACR20 no puede considerarse satisfactoria. Aproximadamente, entre el 10 y el 20% de los pacientes requieren un aumento de dosis hasta una media de 5 mg/kg (4-10) para alcanzar una respuesta satisfactoria. Sin embargo, hay pacientes que, a pesar de escalar la dosis, no alcanzan una respuesta suficientemente duradera, por lo que probablemente se beneficien más de un acortamiento en el período entre infusiones.
Por otro lado, se ha constatado que el tratamiento con infliximab en combinación con otros fármacos permite reducir la dosis de esteroides y de otros FAME, e incluso la suspensión de estos fármacos concomitantes34. El gran interrogante sigue siendo si se puede suspender cuando se realiza el tratamiento con infliximab. El uso fuera de los ensayos clínicos ha permitido observar que la suspensión del tratamiento produce recidiva de la enfermedad prácticamente en todos los pacientes. En 16 pacientes seguidos tras completar 2 años en el estudio ATTRACT, la recidiva se produjo en el 100% tras una media de 16 semanas, pero todos los pacientes retratados con infliximab tuvieron una respuesta satisfactoria, similar a la previa35, si se usaban las mismas dosis. En los pacientes en los que se reintrodujeron las infusiones no hubo mayor evidencia de efectos secundarios, incluidas reacciones a la infusión.
Otra conclusión que puede extraerse de los estudios observacionales es que su efectividad es similar a la de etanercept en población general de AR, y que la falta de respuesta a este agente anti-TNF-α no presupone ausencia de respuesta a infliximab. Por tanto, hay una población AR refractarias a etanercept que pueden beneficiarse de infliximab, sin un aumento significativo de efectos secundarios36.
Posición del infliximab en el tratamiento de la AR
Durante la última década, uno de los cambios más importantes en el abordaje de la AR ha sido probablemente el reconocimiento de la importancia crítica de diagnosticar y tratar de forma precoz a nuestros pacientes37. Hoy reconocemos que ninguna AR es benigna, pero no todos los pacientes van a tener un mismo grado de agresividad en la progresión, por lo que se hace imperativo encontrar factores que identifiquen a aquéllos con peor pronóstico y sean subsidiarios de un tratamiento inicial más agresivo37,38. La hipótesis de que se puede aprovechar una ventana terapéutica en el inicio de la enfermedad, para evitar el daño irreversible y preservar la función, preside los nuevos esquemas terapéuticos en el manejo de la AR. Esta nueva estrategia, cuyo objetivo es la remisión y el control de la enfermedad, preconiza el uso precoz de los FAME (< 3 meses del inicio), el uso más racional de los FAME clásicos y la leflunomida (tanto en monoterapia como en terapias combinadas), el uso más racional de los corticoides y, finalmente, el uso de los nuevos agentes biológicos39. Situar el infliximab en este esquema terapéutico exige conocer los aspectos relativos a su seguridad y tolerancia, y los aspectos farmacoeconómicos, que son analizados en este mismo monográfico. La experiencia clínica hasta ahora es muy prometedora, pero sigue habiendo interrogantes que despejar antes de su recomendación generalizada como primer fármaco de elección en la AR: su seguridad y el mantenimiento de la efectividad a largo plazo, la supervivencia en el tiempo como fármaco, y el alto riesgo en un subgrupo de pacientes con comorbilidad importante, sobre todo tumoral o infecciosa. Según los consensos de expertos nacionales e internacionales para el uso de terapias anti-TNF-α40,41, su uso estaría indicado cuando se hubiera constatado el fracaso terapéutico con al menos 2 FAMES relevantes, siendo metotrexato uno de ellos. Según los expertos, esta situación sugeriría un curso desfavorable de una enfermedad especialmente agresiva.
Para terminar, permítanme explicar nuestra posición mediante un viejo proverbio húngaro: "Si tu espada es demasiado corta, adelántate un paso."