*Los centros participantes en BIOBADASER se relacionan al final del artículo.
BIOBADASER se realiza en colaboración con la División de Farmacoepidemiología y Farmacovigilancia de la Agencia Española del Medicamento.
Comité científico de BIOBADASER:
Juan Gómez-Reino Carnota, Reumatología, Hospital Universitario de Santiago de Compostela, Santiago de Compostela. Loreto Carmona, Reumatología, Hospital Clínico San Carlos, Madrid. Dolores Montero, División de Farmacoepidemiología y Farmacovigilancia, Agencia Española del Medicamento, Madrid. Emilio Martín Mola, Reumatología, Hospital la Paz, Madrid. Jordi Carbonell Abelló, Reumatología, Hospitales del Mar y de la Esperanza, Barcelona. Vicente Rodríguez Valverde, Reumatología, Hospital Marqués de Valdecilla, Santander. Eliseo Pascual Gómez, Reumatología, Hospital General de Alicante, Alicante. Jesús Tornero Molina, Reumatología, Hospital General de Guadalajara, Guadalajara. Manuel Figueroa Pedrosa, Reumatología, Hospital Nuestra Señora de Aranzazu, San Sebastián. Rafael Cáliz Cáliz, Reumatología, Hospital Virgen de las Nieves, Granada. Juan Mulero Mendoza, Reumatología, Hospital Puerta de Hierro, Madrid. Armando Laffón Roca, Reumatología, Hospital de la Princesa, Madrid. José Luis Marenco de la Fuente, Reumatología, Hospital de Valme, Sevilla. Luis Carreño Pérez, Reumatología, Hospital Gregorio Marañón, Madrid. Xavier Tena Marsa, Reumatología, Hospital Germans Trias i Pujol, Badalona, Barcelona. José M. Álvaro-Gracia, Reumatología, Hospital de la Princesa, Madrid.
Introducción
BIOBADASER es un registro prospectivo de pacientes en tratamiento con terapias biológicas por enfermedades reumáticas establecido en febrero de 2000 para el seguimiento activo de su seguridad, que se nutre de notificaciones, tanto espontáneas como activas cada 6 meses, por parte de los centros participantes. La información completa sobre el protocolo del registro puede consultarse en la página web de la SER (http://biobadaser.ser.es) y en publicaciones previas. Los pacientes registrados en BIOBADASER son aquellos con enfermedades reumáticas en los centros participantes que inician tratamiento con agentes biológicos desde el segundo semestre de 1998. Este informe corresponde al corte semestral del registro realizado en junio de 2003.
Resultados
Hasta el 26 de junio de 2003 en BIOBADASER se han registrado 2.866 pacientes procedentes de 86 centros (véase lista de centros participantes posteriormente), con un total de 3.005 ciclos de tratamientos (135 pacientes han estado en tratamiento con más de un agente biológico en momentos distintos de su evolución).
Descripción de los pacientes registrados
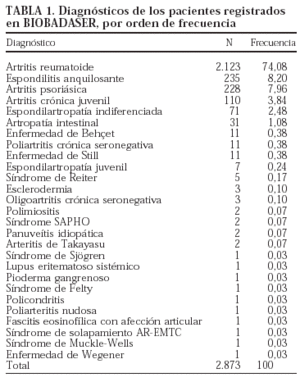
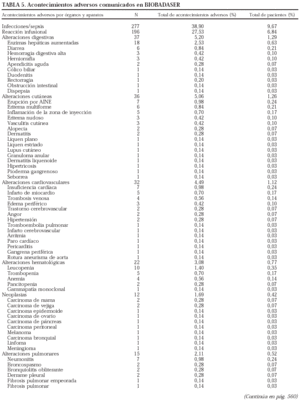
El 69,4% de los pacientes registrados son mujeres (n = 1.989). La edad media al inicio del tratamiento es de 51 ± 15 años, y la proporción de niños menores de 16 años al inicio de la terapia, del 1,6% (n = 47). En la tabla 1 se exponen los diagnósticos de los pacientes que recibieron terapias biológicas y se registraron en BIOBADASER. En la mayoría de ocasiones, las indicaciones son por artritis reumatoide y espondilitis anquilosante.
Los pacientes empiezan el tratamiento con el primer agente biológico después de una evolución media de la enfermedad de 11 ± 8 años (14,2 ± 9,6 años en el caso de la espondilitis anquilosante y 10,8 ± 8,0 años en el de la artritis reumatoide).
Descripción de los ciclos de tratamiento registrados
Los agentes biológicos registrados hasta el momento son: etanercept, infliximab, anakinra y adalimumab. El 84,3% de los 3.005 tratamientos registrados corresponde a infliximab (n = 2.534). La distribución de los tratamientos por tipo de agente biológico se expone en la tabla 2.
Supervivencia del fármaco
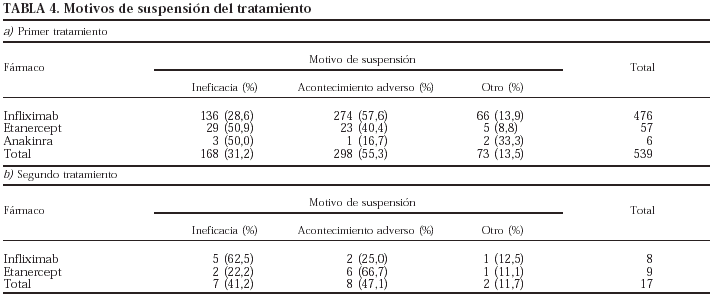
Se han registrado 557 interrupciones del tratamiento (18,5%), en la mayoría de las ocasiones como resultado de un acontecimiento adverso (n = 306; 54,9%), seguido de ineficacia (n = 176; 30,6%). En 75 casos (13,2%) el motivo de la interrupción fue distinto: decisión del paciente (43), mejoría (6), embarazo (6) y otros (20). En 135 ocasiones, como ya se ha mencionado, la interrupción se siguió del inicio de tratamiento con otro agente biológico.
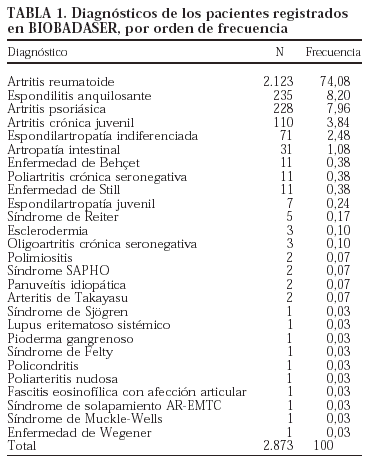
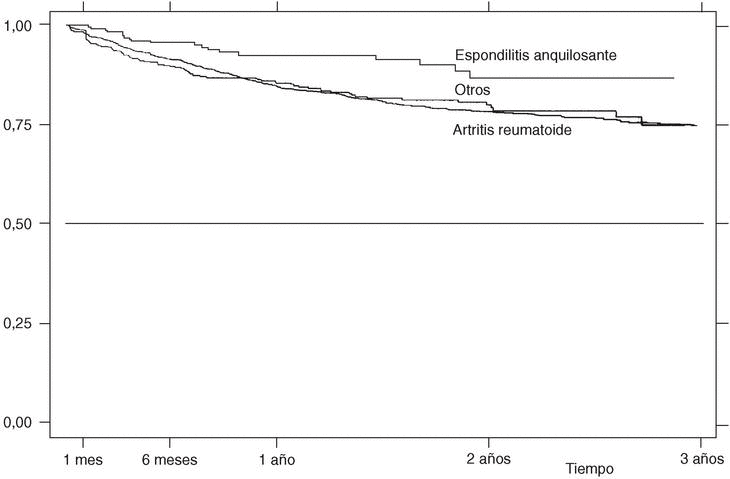
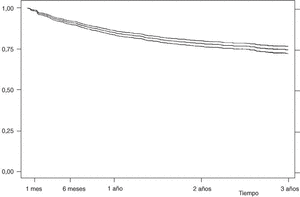
En la figura 1 se presenta la curva de supervivencia global de las terapias biológicas registradas en BIOBADASER. La supervivencia del fármaco a uno y 6 meses, y a 1, 2 y 3 años es, respectivamente, del 98,62% (98,13-98,98), el 91,38% (90,30-92,35), el 85,37% (83,98-86,65), el 79,02% (77,29-80,65) y el 75,23% (72,98-77,33). Hasta 255 pacientes han estado en tratamiento con etanercept o infliximab durante más de 3 años.
Figura 1. Curva de supervivencia de las terapias biológicas en BIOBADASER. Supervivencia (e intervalo de confianza del 95%) estimada por el método de Kaplan-Meier.
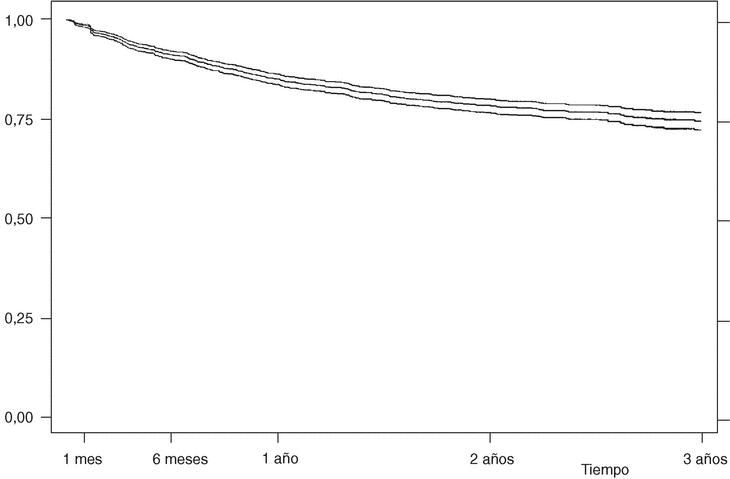
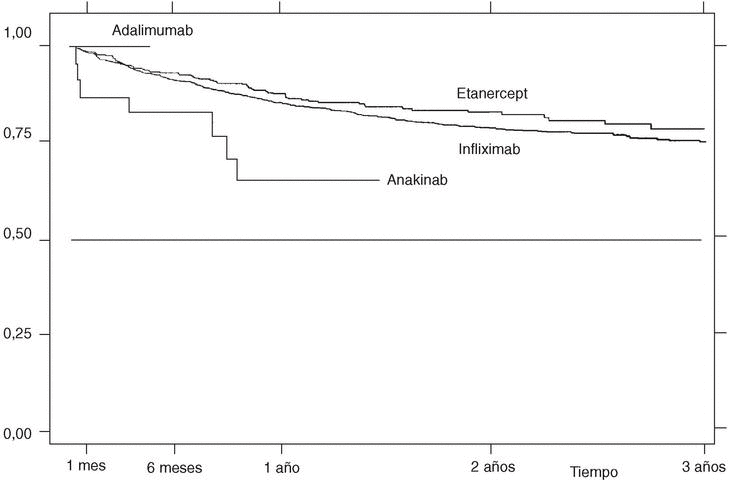
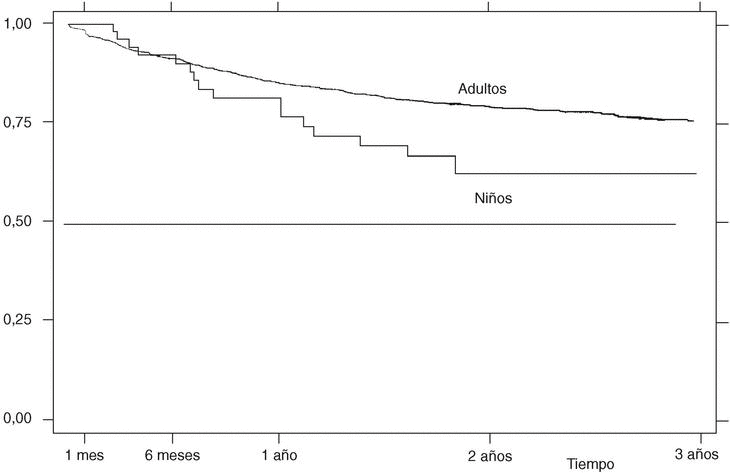
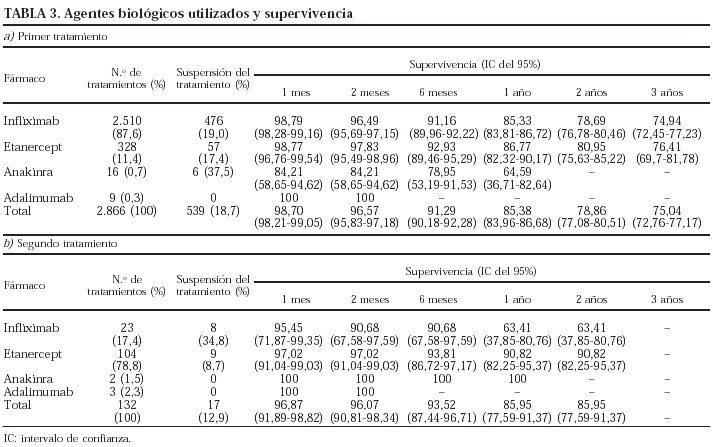
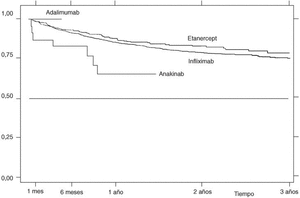
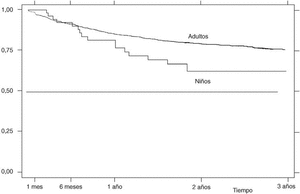
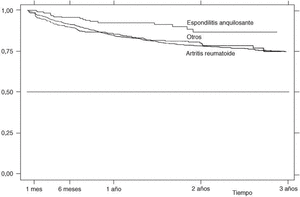
La supervivencia del fármaco a un año es similar para el infliximab y el etanercept, mientras que el anakinra presenta menor supervivencia y el adalimumab, mejor supervivencia (prueba de rangos logarítmicos: p = 0,03) (fig. 2), si bien es precipitado establecer conclusiones con estos 2 últimos agentes biológicos, ya que la mayoría de estos pacientes aún no llevan un año de seguimiento. La supervivencia del fármaco es algo menor en mujeres pero no es estadísticamente significativa (prueba de rangos logarítmicos: p = 0,12). Los pacientes que inician tratamiento con terapias biológicas antes de los 16 años de edad tienen mejor supervivencia del fármaco al principio del tratamiento, pero a partir de los 6 meses la supervivencia es menor (prueba de rangos logarítmicos: p = 0,03) (fig. 3). El motivo de 11 de las 16 suspensiones de tratamiento en niños ha sido su ineficacia, mientras que en el caso de los adultos el principal motivo de la suspensión ha sido la aparición de un acontecimiento adverso (p = 0,002). Finalmente, se han encontrado diferencias significativas en cuanto a la duración del tratamiento en función del diagnóstico, que es mayor en el caso de la espondilitis anquilosante (prueba de rangos logarítmicos: p = 0,02) (fig. 4).
Figura 2. Curva de supervivencia en función del tipo de fármaco. Supervivencia estimada pore l método de Kaplan-Meier.
Figura 3. Curva de supervivencia en función de la edad de inicio del tratamiento. Supervivencia estimada por el método de Kaplan-Meier.
Figura 4. Curva de supervivencia en función del diagnóstico. Supervivencia estimada por el método de Kaplan-Meier.
Cambios entre agentes biológicos
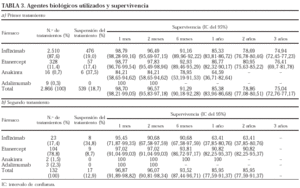
Los agentes biológicos utilizados como primer (a) y segundo (b) tratamientos y la supervivencia del tratamiento por cada agente biológico se presentan en la tabla 3.
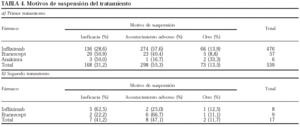
Los motivos de suspensión en el caso del primer (a) y segundo (b) tratamiento se presentan en la tabla 4. Para el primer tratamiento, en el caso del infliximab el principal motivo de suspensión es la aparición de un acontecimiento adverso (el 57,6% de todas las interrupciones), mientras que en el del etanercept lo es la ineficacia (50,9%), siendo las diferencias estadísticamente significativas (p = 0,002). Para el segundo tratamiento, las suspensiones se deben más a la ineficacia en el caso del infliximab (62,5%) y a los acontecimientos adversos en el caso del etanercept (66,7%).
Descripción de los acontecimientos adversos
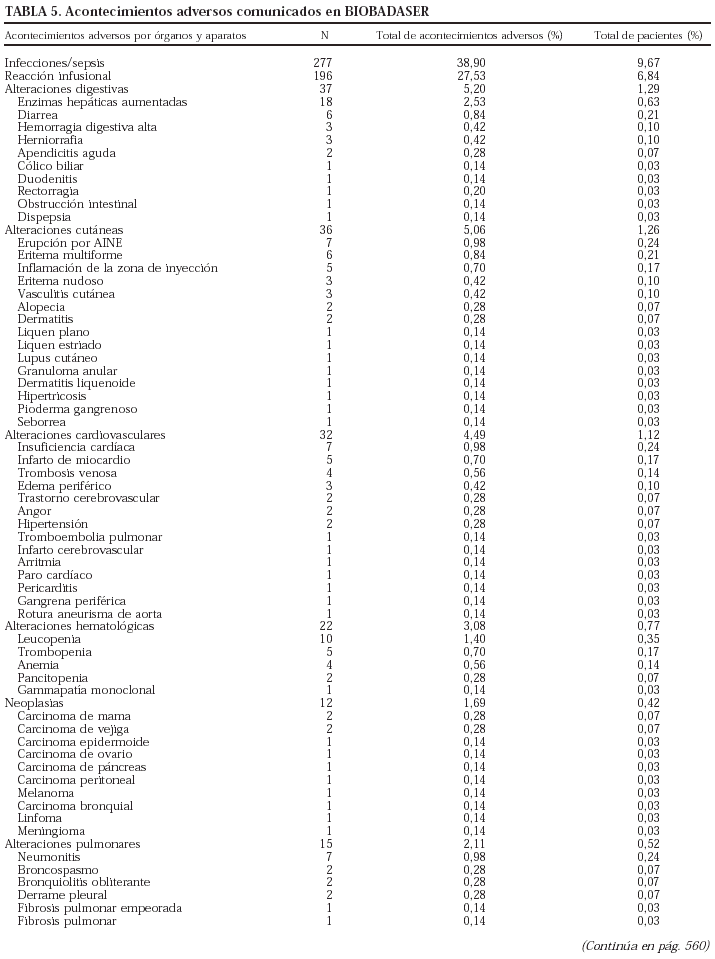
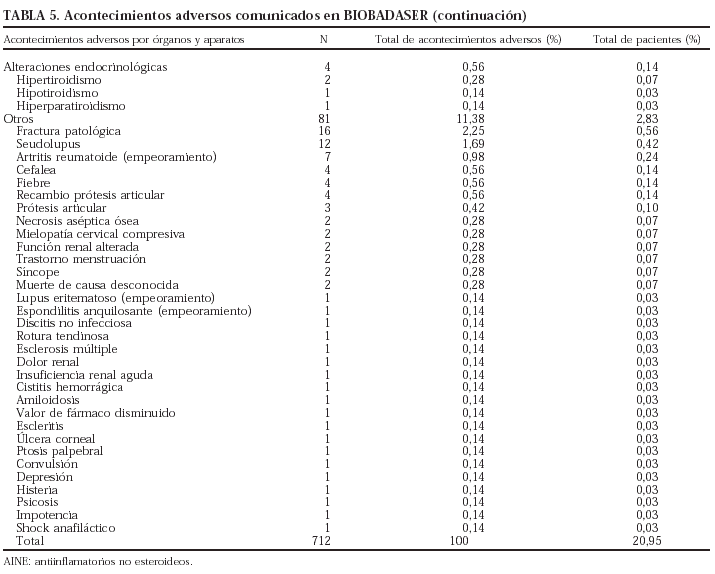
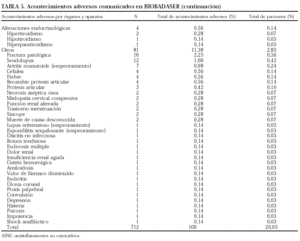
Se comunicaron 712 acontecimientos adversos en 565 pacientes (en 108 pacientes se comunicaron 2, en 27 pacientes, 3 y en 12 pacientes, 4 o más), lo que supone un 19,7% de todos los pacientes registrados.
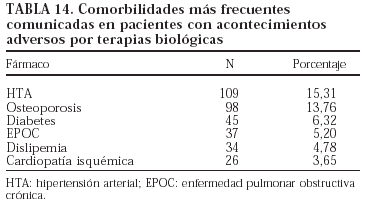
En la tabla 5 se presenta un listado de todos los acontecimientos notificados. El tipo de acontecimiento adverso más frecuente fue la infección (n = 277; 38,9%), seguida de las reacciones infusionales (n = 196; 27,5%) y las alteraciones digestivas (n = 37; 5,2%). Se han registrado 12 neoplasias, entre ellas un linfoma, que ocurrió a los 10 meses de tratamiento con etanercept en un paciente con antecedente de enfermedad de Paget lumbar. Tres de las neoplasias se identificaron antes de los 4 meses con el tratamiento correspondiente.
Descripción de las infecciones
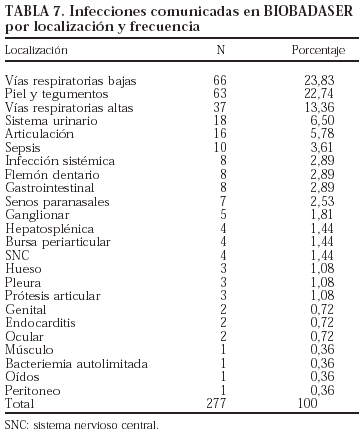
Se comunicaron 277 infecciones en 251 pacientes (25 pacientes con 2 infecciones y un paciente con 3). De los 26 pacientes con más de una infección, 23 habían estado en tratamiento sólo con infliximab, uno sólo con etanercept y otro con más de un agente biológico.
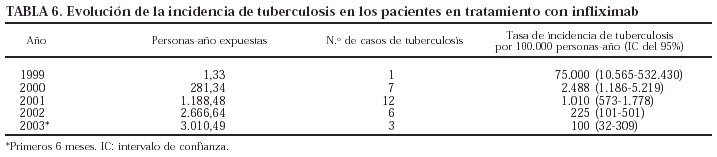
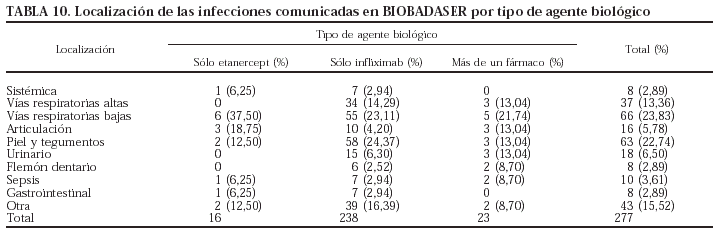
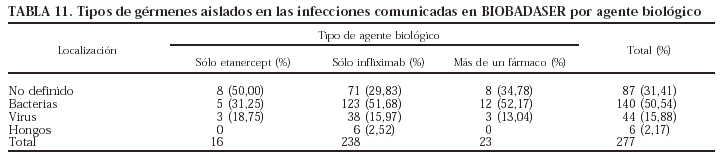
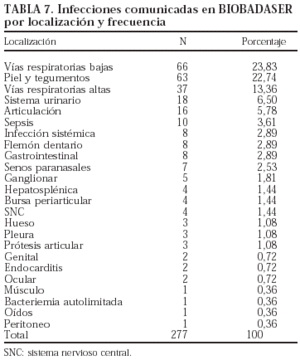
El germen implicado con más frecuencia fue Mycobacterium tuberculosis (n = 29; el 10% de todas las infecciones). Todos los pacientes registrados con tuberculosis habían estado en tratamiento sólo con infliximab. La evolución de la incidencia de tuberculosis en los pacientes en tratamiento con infliximab se presenta en la tabla 6. La incidencia de tuberculosis claramente se ha reducido, aunque el problema no ha desaparecido. Es importante señalar que no se ha registrado ningún caso de tuberculosis en los pacientes que han iniciado tratamiento con infliximab después del 4 de febrero de 2002, fecha de publicación de la nota informativa de la Agencia Española del Medicamento, con las advertencias sobre la aparición de infecciones graves, incluida la tuberculosis, y las precauciones que deben tomarse antes de iniciar el tratamiento con este fármaco. Los nuevos casos de tuberculosis registrados en 2003 habían empezado el tratamiento antes de la fecha mencionada. Aunque la tasa de incidencia de tuberculosis en pacientes en tratamiento con infliximab ha disminuido claramente, sobre todo en los últimos 2 años, se mantiene en valores superiores a la de la población general, que fue de 18,83/100.000 habitantes en el año 2001 (Boletín Epidemiológico Semanal 2002;10[6]:49-60). En las tablas 7 y 8 se indican, respectivamente, las localizaciones y los gérmenes implicados en las infecciones.
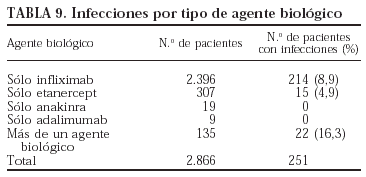
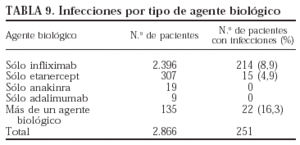
Se registraron más infecciones en los pacientes que recibieron más de un agente biológico y ninguna en los pacientes que recibieron sólo adalimumab o anakinra (p = 0,001). Sin embargo, la experiencia con estos 2 últimos fármacos es limitada, por lo que los resultados deben interpretarse con precaución. En la tabla 9 se presenta el número de pacientes que presentaron infecciones por cada agente biológico. No se encontraron diferencias estadísticamente significativas entre los fármacos en cuanto a la localización y los gérmenes implicados (tablas 10 y 11).
Insuficiencia cardíaca
Se han notificado 7 casos en los pacientes registrados en BIOBADASER, todos en pacientes mayores de 50 años (un caso en el grupo de 50-60 años; 4 en el grupo de 60-70 años; uno en el grupo de 70-80 años, y otro en mayores de 80 años). La incidencia de insuficiencia cardíaca fue de 212/100.000, ajustando según la distribución por grupos de edad de la población española. Un caso ocurrió cuando el paciente estaba en tratamiento con etanercept; todos los demás recibían infliximab. En todos los casos registrados hasta junio de 2003 el tiempo transcurrido desde el inicio del tratamiento hasta el acontecimiento fue superior a 4 meses.
Reacciones infusionales
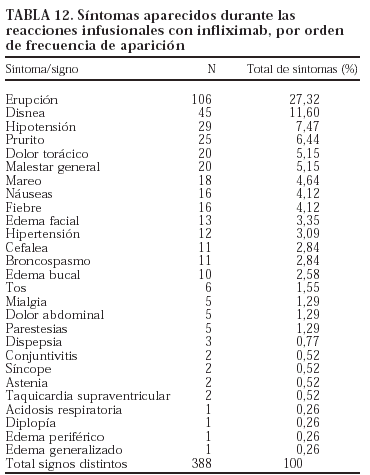
En la tabla 12 se enumeran los 388 tipos de síntomas y signos aparecidos en las 196 reacciones infusionales con infliximab. La mediana del tiempo de aparición de la reacción respecto de la infusión fue de 0 h, con un rango entre las 0 y las 240 horas (P25-75 = 0-0). Se registraron todas las reacciones que los médicos consideraron relevantes, según la definición operativa de BIOBADASER.
Mortalidad
Se han registrado en total 28 fallecimientos de pacientes que habían estado en tratamiento con agentes biológicos (26 con infliximab y 2 con etanercept). La causa de la muerte fue infecciosa en 17 casos: en 3 casos por tuberculosis (una diseminada, una de vías respiratorias altas y otra de vías respiratorias bajas); en 7 casos por sepsis (Pseudomonas, Staphylococcus aureus, Legionella, polimicrobiana y 3 no identificadas); en 4 por neumonía (3 por gérmenes no identificados y una por Pseudomonas aeruginosa); en 2 casos por absceso cerebral por germen no identificado, y en un caso por endocarditis por Staphylococcus epidermidis. En el caso de tuberculosis diseminada, la muerte sobrevino por fallo hepático secundario a isoniazida. El caso de sepsis polimicrobiana presentaba también un absceso hepático polimicrobiano (E. coli, Klebsiella oxytoca, Bacteroides fragilis, Enterococcus avium). Uno de los casos de neumonía por germen no identificado presentaba también pancitopenia. En 4 casos la causa del fallecimiento fue el fallo pulmonar: un caso de bronquiolitis obliterante, 2 de neumonitis intersticial aguda y uno de muerte por progresión de fibrosis pulmonar en paciente con artritis reumatoide. Otras causas de muerte registradas fueron: complicaciones cardiovasculares (3 casos: paro cardíaco, derrame cardíaco y rotura de un aneurisma de aorta), amiloidosis (un caso) y carcinoma de páncreas (un caso); en 2 ocasiones la causa de la muerte no pudo identificarse. Dos pacientes recibían terapia con etanercept, y fallecieron por neumonía por Pseudomonas y sepsis de origen intestinal, respectivamente.
Tratamientos concomitantes y comorbilidad
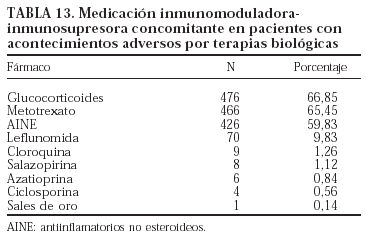
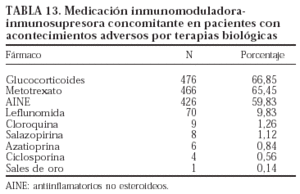
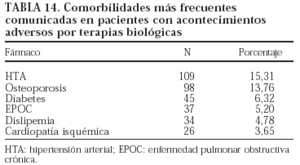
En las tablas 13 y 14 se exponen, respectivamente, los fármacos que utilizaban los pacientes con acontecimientos adversos y la comorbilidad que presentaron.
Discusión
La cifra de pacientes en tratamiento con agentes biológicos continúa creciendo. Desde el primer informe en diciembre de 2001, se ha incrementado desde 1.309 hasta el número actual a un ritmo de 500 pacientes al año, por lo que se comprueba el uso cada vez más profuso en enfermedades del ámbito reumatológico. Más de un 10% de los pacientes registrados en BIOBADASER en junio de 2003 reciben el tratamiento por uso compasivo, aun teniendo en cuenta las nuevas indicaciones del etanercept y el infliximab.
Este nuevo informe recoge ciertas singularidades. En primer lugar, es el primer informe que incluye el registro de los 2 nuevos agentes biológicos, anakinra y adalimumab, si bien la experiencia fuera de los ensayos clínicos es aún limitada (< 5% de los tratamientos registrados), y cualquier conclusión a la que se pueda llegar con los datos aquí mostrados ha de tomarse con muchas reservas.
Este informe recoge también por primera vez lo que ocurre con los cambios de tratamiento biológico. No parece que la suspensión por ineficacia sea elevada en los segundos tratamientos con agentes biológicos distintos al primero, lo que sugiere que los cambios entre agentes biológicos pueden suponer una estrategia terapéutica válida.
En cuanto a los acontecimientos adversos relevantes, se confirma que aparecen en una proporción superior al 15%, con una tasa de mortalidad del 0,9% en 3 años; si bien la supervivencia del fármaco a 3 años sigue siendo elevada, cercana al 80%. Se ha confirmado un descenso en la tasa de tuberculosis en pacientes en los que se ha realizado detección de tuberculosis latente antes del tratamiento, aunque se sigue comunicando la presencia de tuberculosis en pacientes que iniciaron el tratamiento con biológicos antes de la introducción de las medidas, lo que se refleja en una tasa de infección por tuberculosis similar con respecto a informes previos (un 8,7% en julio de 2002, un 9% en diciembre de 2002 y un 9,6% en el informe actual). La elevada tasa de neoplasias debe interpretarse aún con cautela, ya que casi la mitad de los casos se han identificado antes de un año con el tratamiento y la mayoría ha ocurrido en población mayor de 60 años. Al no haberse repetido un tipo de neoplasia en concreto es prácticamente imposible establecer una comparación con la población normal, de la que tenemos datos por tipo de cáncer y estrato de edad y sexo, ya que el intervalo de confianza sería excesivamente amplio para extraer alguna conclusión.
En resumen, los agentes biológicos tienen una supervivencia óptima a los 3 años, si bien se asocian a una proporción elevada de acontecimientos adversos, lo que ha de tenerse en cuenta a la hora del seguimiento de estos pacientes.
Centros participantes en BIOBADASER:
Ciudad Sanitaria Vall d'Hebron, Hospital General Universitario de Alicante, Hospital Clínico Universitario de Santiago, Hospital Gregorio Marañón, Hospital Universitario Marqués de Valdecilla, Hospital de Donostia, Hospital la Paz, Hospital Clínico Universitario San Carlos, Hospital Universitario de la Princesa, Hospital General Carlos Haya, Hospital Virgen de la Arrixaca, Hospital Clinic i Provincial, Hospital Virgen de las Nieves, Hospital 12 de Octubre, IMAS, Hospital de l'Esperança y Hospital del Mar, Hospital Universitario Miguel Servet, Hospital Universitario Virgen Macarena, Hospital Ramón y Cajal, Hospital de Gran Canaria Dr. Negrín, Hospital General San Jorge, Hospital Universitario de Valme, Hospital Virgen Blanca, Complejo Hospitalario de Ourense, Hospital Severo Ochoa, Hospital Txagorritzu, Hospital de Navarra, Hospital de Bellvitge Princeps d'Espanya, Hospital Juan Canalejo, Clínica Puerta de Hierro, Hospital General Universitario de Elche, Hospital Fundación de Alcorcón, Hospital Comarcal Sierrallana, Hospital Mutua de Terrassa, Hospital General de Teruel Obispo Polanco, Hospital Infantil La Paz, Instituto Provincial de Rehabilitación (IPR), Consorci Hospitalari Parc Taulí, Hospital Virgen de la Luz, Hospital General Universitario de Guadalajara, Hospital Universitari Germans Trias i Pujol, Hospital Son Dureta, Hospital General de Segovia, Hospital Xeral-Calde, Complejo Hospitalario San Millán-San Pedro, Hospital Clínico Universitario Lozano Blesa, Hospital Nuestra Señora del Prado, Hospital del Bierzo, Hospital General de Elda, Hospital de Basurto, Hospital de Tortosa, Hospital Nuestra Señora del Carmen, Hospital General Universitario de Valencia, Hospital Reina Sofía, Hospital Militar Universitario Gómez Ulla, Hospital Sant Jaume de Calella, Hospital de Mataró, Hospital Nuestra Señora de Sonsoles, Hospital de Mendaro, Hospital General de Onteniente y Lluís Alcanyis de Xátiva, Clinica Nuestra Señora de la Concepción, Hospital Comarcal de Laredo, Fundación Hospital Son Llàtzer, Hospital San Juan de Alicante, Hospital del INSALUD, Ceuta, Hospital de La Santa Creu i Sant Pau, Hospital General de Mérida, Hospital General de Castellón, Hospital Universitario de Getafe, Hospital Internacional Medimar, Hospital General de Manresa, Hospital General de Granollers, Centre Hospitalari Manresa, Hospital de Cruces, Hospital de la Santísima Trinidad, Hospital de la Ribera, Hospital de Figueres, Hospital de Viladecans, Hospital de l'Esperit Sant, Hospital General de Requena, Hospital General de Vic, Hospital Arnau de Vilanova, Hospital de San Rafael, Hospital Comarcal de Monforte, Hospital Santa Teresa, Hospital de Sant Pau i Santa Tecla, Hospital General Río Carrión.