Introducción
La artritis idiopática juvenil (AIJ), previamente llamada artritis crónica juvenil, en Europa, y artritis reumatoide juvenil, en Norteamérica, no es una entidad única sino que engloba a varios grupos diagnósticos1-3 muy diferentes entre sí y distintos de la artritis reumatoide (AR) del adulto. Las manifestaciones clínicas, tanto articulares como sistémicas, así como el curso evolutivo, varían según el grupo, por lo que el tratamiento terapéutico es diferente. El hecho de que la enfermedad afecte a un niño condiciona unas características especiales que es preciso tener en cuenta.
Hoy día se sabe que el pronóstico de la AIJ no es tan bueno como se creía4-8; así, aunque algunas veces sigue una evolución benigna, con brotes de actividad leves o moderados y se alcanza la remisión, en otras la actividad inflamatoria se mantiene durante años. Esta cronicidad del proceso, con algunas formas graves refractarias incluso a las nuevas terapias, produce un grave deterioro de la calidad de vida del niño y de sus expectativas de futuro, y puede ocasionar una importante distorsión familiar.
Existen diversos trabajos que tratan de identificar variables clínicas tempranas o marcadores genéticos capaces de predecir el curso y el pronóstico de la enfermedad, pero los resultados son aún poco concluyentes9,10. Por otra parte, hay pocos estudios con suficiente número de pacientes y con el rigor científico necesario para evaluar la eficacia de los distintos regímenes terapéuticos. La mayor dedicación de algunos profesionales al estudio de las enfermedades reumáticas infantiles así como la relación internacional más intensa están permitiendo el desarrollo de estudios multicéntricos necesarios para consensuar criterios (nomenclatura, clasificación, mejoría, etc.) y para la investigación de nuevos fármacos.
Tratamiento general del niño con artritis idiopática juvenil
Aunque el objetivo del tratamiento de la AIJ debe ser la remisión total de la enfermedad, en muchas ocasiones esto no es posible, por lo que los intentos deben ir dirigidos a controlar la inflamación a escala articular y sistémica (fiebre, serositis), a disminuir el dolor, a prevenir las deformidades, a minimizar la iatrogenia a corto y largo plazo y a conseguir un crecimiento y un desarrollo normales11-13.
Para su tratamiento, como en otras enfermedades sistémicas, se precisa un equipo multidisciplinario, coordinado por un reumatólogo pediátrico, que incluya fisioterapeuta, oftalmólogo, odontólogo, nutricionista, psicólogo, cirujano ortopeda y otros profesionales, según las necesidades del paciente. Por otra parte, se ha de evitar que la enfermedad o su tratamiento interfieran en la escolarización y en las actividades lúdicas propias de la infancia.
Tratamiento farmacológico
Antiinflamatorios no esteroideos
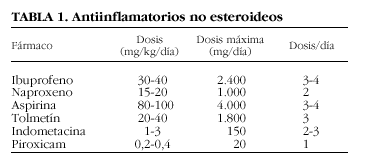
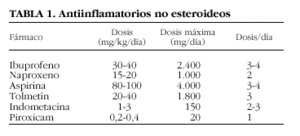
Forman parte del tratamiento inicial de la AIJ y durante las reagudizaciones14,15. A largo plazo su efectividad es relativa. Los principales antiinflamatorios no esteroideos (AINE) utilizados en niños y sus dosis se exponen en la tabla 1. En general son bien tolerados, aunque no están exentos de efectos colaterales; los más frecuentes son las molestias gastrointestinales y la hepatotoxicidad16-19. Hoy día la aspirina se utiliza poco debido a su mayor toxicidad y a que no se ha demostrado que sea más eficaz que otros AINE. Por otro lado, los inhibidores selectivos de la COX-2 no han sido estudiados en población pediátrica, y en las formas pauciarticulares están indicados especialmente cuando las articulaciones afectadas no son accesibles a infiltración, como la columna cervical o los tarsos. Además, en las formas sistémicas aumenta la toxicidad debido a que se precisan dosis elevadas para controlar las manifestaciones extraarticulares y a que los valores séricos del fármaco son más elevados por la hipoalbuminemia que suele existir.
Fármacos modificadores de la enfermedad
También llamados fármacos de acción lenta o de segunda línea. Alguno de ellos, como la D-penicilamina, no se usan en la actualidad, y otros como las sales de oro y la hidroxicloroquina sólo se utilizan de forma excepcional, ya que su eficacia no se ha demostrado en ensayos controlados y además tienen una toxicidad elevada20-22.
Metrotrexato. Es un análogo del ácido fólico y un inhibidor de la dihidrofolato reductasa. En los niños su metabolismo es más rápido, lo que justifica que deban usarse dosis más elevadas. La eficacia del metotrexato (MTX) sugerida por los primeros estudios fue confirmada por el trabajo controlado, doble ciego, llevado a cabo conjuntamente en Estados Unidos y en la antigua URSS, en el que valorando un índice compuesto por diversas variables se encontró mejoría en el 63% de los pacientes que habían recibido una dosis de 10 mg/m2/semana, frente al 36% del grupo placebo y al 32% de los que tomaron 5 mg/m2/semana23. En otro estudio, también doble ciego y controlado, se analizó la respuesta en las formas pauciarticular extendida y sistémica. El resultado fue mejor en la primera forma y se encontró una mejoría significativa en tres de las cinco variables evaluadas. En el grupo sistémico sólo mejoraron significativamente dos variables (evaluación del médico y de los padres), sin que se apreciara mejoría de las manifestaciones extraarticulares24. En un análisis sistemático de ambos trabajos llevado a cabo por Takken et al para la Cochrane Library se concluyó que, a la luz de la evidencia actual, el MTX tenía mínimos efectos clínicamente significativos en las variables evaluadas: dolor, tumefacción y limitación de la movilidad articular, así como en la valoración de la actividad de la enfermedad por los padres y el médico25. En un trabajo reciente de la PRINTO (Paediatric Rheumatology International Trials Organization) se com-paró la eficacia y la seguridad del MTX a dosis intermedias (15-20 mg/m2/semana) frente a dosis elevadas (30-40 mg/m2/semana) en pacientes que no habían respondido a dosis estándar (10 mg/m2/semana). Los resultados pusieron de manifiesto que la eficacia del MTX alcanza un plateau a los 15 mg/m2/semana y que un incremento mayor no añadía ningún beneficio terapéutico26. El MTX parece enlentecer la destrucción del cartílago articular según mediciones radiológicas de la longitud del carpo27. La dosis inicial es de 10 mg/m2/semana por vía oral, pudiéndose usar los comprimidos o la preparación parenteral, y si no se produce respuesta se recomienda aumentar a 15 mg/m2/semana y utilizar la vía subcutánea. Los efectos secundarios más frecuentes son las náuseas y los vómitos28, que pueden disminuir con suplementos de ácido fólico. La toxicidad hepática, con elevación moderada de las transaminasas, habitualmente se resuelve al rebajar la dosis. Estudios histológicos a largo plazo no han evidenciado daño hepático grave29,30. Por otro lado, se han publicado cinco casos de linfoma en pacientes con AIJ sistémica tratados con MTX31. En este sentido, una de nuestras pacientes, con una forma sistémica, desarrolló un linfoma parotídeo asociado con las mucosas. Además el MTX puede causar anomalías congénitas fetales, por lo que es necesario advertir a las adolescentes de la necesidad de prevenir un embarazo. Finalmente, tras una remisión mantenida, considerada en general no inferior a un año, el MTX puede retirarse32,33.
Sulfasalazina. También llamada salazopirina, es un análogo del ácido 5-aminosalicílico unido por un puente azo a una sulfonamida, la sulfapiridina. Su empleo está basado en la idea de que la artritis podría ser una enfermedad infecciosa y responder a un tratamiento combinado de antimicrobianos y antiinflamatorios. Existen varios estudios abiertos en que se ha sugerido la eficacia de este fármaco en la AIJ34-36. Un estudio multicéntrico, doble ciego, controlado, llevado a cabo en 52 pacientes con formas no sistémicas de la enfermedad, evidenció una mejoría significativa en la mayoría de los parámetros estudiados37. Otro estudio reciente, en pacientes con espondiloartropatías de comienzo juvenil, encontró que la mayoría de las variables mejoraron con el fármaco, pero sólo la evaluación del médico y la del paciente mostraron diferencias significativas al compararlas con el grupo placebo38. La dosis inicial es de 12,5 mg/kg/día, con incrementos semanales hasta llegar a 50 mg/kg/día con un máximo de 2 g. Sus efectos tóxicos más frecuentes son exantemas, úlceras orales, intolerancia digestiva y neutropenia. Además, precisa controles hematológicos cada 2-3 meses, y no debe usarse en las formas sistémicas ni en los pacientes con sensibilidad a las sulfamidas o a los salicilatos.
Corticoides
Actúan en múltiples ámbitos del sistema inmunitario y son los antiinflamatorios más potentes. Por sus importantes efectos colaterales deben usarse tras un plan terapéutico bien establecido39. En las formas sistémicas se utilizan por vía oral a 0,3-1 mg/kg/día. Por otro lado, es preferible administrarlos en una sola toma por la mañana, aunque puede intentarse la administración de una dosis más alta en días alternos40. Cuando las manifestaciones clínicas están controladas se inicia el descenso progresivo, en general el 10% de la dosis total diaria cada 2-3 semanas o incluso más lentamente. Las reagudizaciones se tratan con un incremento moderado de la dosis. Los pulsos intravenosos se usan en situaciones graves como miocarditis o en el síndrome hemofagocítico secundario, así como ocasionalmente para disminuir la dosis oral. Suele utilizarse un bolo diario, a 30 mg/kg/día (máximo 1 g) durante 3 días consecutivos, seguidos de la dosis oral que se considere necesaria41-43. La poliartritis puede precisar corticoides, en general a una dosis menor (0,1-0,5 mg/kg/día), asociados con los fármacos modificadores de la enfermedad (FAME). La toxicidad de los corticoides es sobradamente conocida, y uno de los efectos más importantes en la infancia es el retraso del crecimiento44. El derivado oxazolínico de la prednisona (deflazacort) permite un crecimiento espinal adecuado en relación con el resto del organismo45.
Corticoides intraarticulares. Son la alternativa terapéutica más eficaz y con menos efectos colaterales en las formas pauciarticulares46-50. En las formas poliarticulares y sistémicas también son útiles asociados con FAME51-54. En estos casos se pueden realizar poliinfiltraciones bajo anestesia, con un porcentaje de remisión del 68 al 100% según las series, aunque con recaídas frecuentes. Los fármacos utilizados son el acetónido y el hexacetónido de triamcinolona. El porcentaje y el tiempo de remisión parecen mayores con el último55, aunque no se ha comercializado en España.
Inmunosupresores e inmunomoduladores
Azatioprina. Es un análogo de la purina, inactivo hasta su transformación en 6-mercaptopurina, que inhibe la síntesis de guanina y adenina, interfiriendo en la formación de ADN, y suprime la inmunidad celular e inhibe las funciones de los monocitos. Se ha demostrado su eficacia en un estudio doble ciego, llevado a cabo en 32 pacientes, aunque la mejoría a las 16 semanas sólo fue significativa en dos parámetros: capacidad funcional y evaluación subjetiva56. Un estudio de seguimiento a largo plazo en 129 pacientes mostró efectos bene-ficiosos, aunque el análisis del trabajo es difícil de evaluar57. La dosis recomendada es de 2-3 mg/kg/día, que se absorbe bien por vía oral. Su principal efecto secundario es la neutropenia y la posibilidad de infecciones.
Ciclofosfamida. Es un agente alquilante derivado de la mostaza nitrogenada. Se ha usado en un pequeño número de pacientes con forma sistémica refractaria en pulsos intravenosos, a dosis de 400-1.000 mg/m2, asociado con pulsos de metilprednisolona y con metotrexato subcutáneo semanal. Los resultados tras un año de seguimiento fueron buenos, con mejoría de todos los parámetros y disminución de la dosis de corticoides58,59. El principal problema es la citopenia, por lo que debe llevarse a cabo un hemograma completo antes de la perfusión y en el cenit de la acción inmunosupresora, a los 12-15 días del tratamiento.
Ciclosporina A. Al igual que el tacrolimus (FK506), es un péptido cíclico de origen fúngico que tiene un efecto potente sobre el sistema inmunitario, inhibiendo la producción de interleucina (IL) 2 y la fase temprana de activación de las células T. Algunos estudios evidencian una mejoría de los síntomas sistémicos, con menor eficacia sobre la artritis60,61, aunque no se ha llevado a cabo ningún estudio controlado. La dosis no debe exceder los 5 mg/kg/día, y sus efectos adversos más importantes son hipertensión arterial, elevación de los valores de creatinina sérica y de las enzimas hepáticas, así como temblores e hipertricosis.
Leflunomida. Es un agente inmunomodulador que inhibe la síntesis de novo de las pirimidinas, con acción preferente sobre los linfocitos T activados. Hasta el momento sólo se ha publicado un estudio abierto en AIJ de curso poliarticular en 27 pacientes, de los que 11 respondieron favorablemente y nueve lo abandonaron, cuatro de ellos por falta de eficacia62. El efecto adverso más frecuente fue la diarrea. En la actualidad está en curso un estudio multicéntrico, controlado, de leflunomida frente a metotrexato en AIJ de evolución poliarticular.
Inmunoglobulina intravenosa. A la vista de los buenos resultados obtenidos en otras enfermedades autoinmunes, Silverman et al trataron con inmunoglobulina intravenosa (IGIV) a un pequeño número de pacientes con AIJ sistémica, con la que obtuvieron unos resultados muy prometedores63. En un estudio multicéntrico, controlado, en 31 niños con la misma forma de enfermedad, no se demostró mejoría significativa en las manifestaciones sistémicas ni articulares64. En otro trabajo retrospectivo se concluyó que la IGIV era capaz de disminuir la fiebre, el número de articulaciones activas y la dosis de corticoterapia65. En las formas poliarticulares, el 75% de los pacientes mejoró significativamente, pero el beneficio cesaba al interrumpir el tratamiento66. La dosis es de 1,5 g/kg cada 15 días durante 2 meses y mensualmente durante otros cuatro. Los efectos colaterales más frecuentes observados durante la perfusión fueron escalofríos, fiebre, vómitos y cefalea. En resumen, puede decirse que después de más de 10 años el tratamiento con IGIV no ha demostrado de forma evidente su eficacia en AIJ, mientras que en menos de cinco se consideró de elección para los pacientes con enfermedad de Kawasaki67.
Terapia biológica
Los avances en el conocimiento de los mecanismos que participan en el proceso inflamatorio han dado lugar al desarrollo de agentes biológicos dirigidos a modificar selectivamente alguno de los escalones responsables de la respuesta inmune68,69. La estrategia más reciente se dirige al bloqueo de las moléculas inflamatorias, que puede ejercerse a escala sistémica (terapia antifactor de necrosis tumoral [TNF] o frente a otras citocinas), o a escala local, mediante la terapia génica. Otro abordaje consiste en eliminar las células T autorreactivas, bien mediante la inducción de tolerancia oral, bien mediante su eliminación por el transplante de médula ósea.
Inhibidores del factor de necrosis tumoral alfa. El TNF-α es una citocina proinflamatoria con un papel relevante en la patogenia de la AIJ70. Su acción se puede bloquear mediante el empleo del receptor soluble o de los anticuerpos monoclonales. Están indicados en la AIJ de curso poliarticular, activa, refractaria o intolerante a otros FAME, especialmente al MTX. Hasta la actualidad no se ha publicado ningún caso con tuberculosis activa ni con neoplasia en pacientes pediátricos71, pero deben seguirse las normas y los controles aconsejados en las fichas técnicas de los productos y las indicaciones de las autoridades sanitarias. Durante el tratamiento los niños no deben recibir vacunas con virus vivos o atenuados.
El etanercept es un producto de ingeniería genética consistente en la fusión de dos unidades de la porción extracelular del receptor p75 del TNF-α, con el fragmento Fc de la IgG-1 humana. Hasta el momento es el único aprobado por la Agencia Europea de Evaluación de Medicamentos y por la Food and Drug Administration (FDA) para el tratamiento de los niños con AIJ. El primer estudio en pacientes pediátricos se publicó en 200072. Se administró a 0,4 mg/kg (máximo 25 mg) por vía subcutánea, dos veces a la semana, en 69 pacientes con AIJ de curso poliarticular. A los 3 meses, 51 casos (74%) cumplían los criterios de mejoría (CM) para AIJ establecidos por un grupo de expertos73 y fueron incluidos en un estudio doble ciego, en el que 25 recibieron etanercept y 26 placebo. A los 4 meses se observó que el 80% de los que habían recibido etanercept mantenían CM, frente al 35% del grupo placebo. Una continuación del estudio puso de manifiesto que de los 43 pacientes tratados durante 2 años, el 81% mantenía un CM de 30, el 79% de 50 y el 67% de 7074. Se observaron dos infecciones graves, una varicela que cursó con meningitis aséptica y una sepsis complicada. Otros estudios abiertos también han mostrado su eficacia75. Además, se ha utilizado a 0,8 mg/kg (máximo 25 mg) con buena tolerancia, aunque sin mejorar su eficacia76. Por otro lado, en combinación con el MTX resultó muy eficaz en un pequeño estudio observacional77. En las formas sistémicas el efecto es más pobre, como lo evidencian los resultados de varios estudios abiertos78-80, en que se produjeron exacerbaciones en algunos pacientes. La experiencia para el tratamiento de la espondiloartropatía juvenil es escasa, y en este sentido la administración a 8 niños con espondilitis anquilosante refractaria disminuyó significativamente la rigidez, el número de articulaciones afectadas y los marcadores de actividad inflamatoria81.
El infliximab es un anticuerpo monoclonal quimérico IgG-1, un 75% humano y un 25% murino, construido también mediante ingeniería genética que aún no ha sido aprobado para su uso en pacientes con AIJ. Un estudio abierto, en 26 pacientes, mediante dosis de 3-5 mg/kg, según la pauta intravenosa habitual, evidenció mejoría inicial en todos ellos. Al final del estudio 6 pacientes no tenían ninguna articulación activa y la velocidad de sedimentación se había normalizado, mientras que siete habían abandonado el tratamiento (tres por ineficacia y cuatro por efectos secundarios)82. En otro trabajo llevado a cabo en 3 pacientes con AIJ sistémica, el infliximab fue bien tolerado y resultó eficaz para la artritis, aunque no controló la actividad sistémica, a pesar de utilizar dosis de hasta 10 mg/kg83. Por su capacidad inmunogénica este fármaco debe administrarse asociado con MTX, y en la actualidad está en curso el primer estudio multicéntrico, controlado, en pacientes pediátricos.
El adalimumab es el primer anticuerpo monoclonal totalmente humano creado por ingeniería genética, indistinguible en estructura y función de la inmunoglobulina IgG-1 humana, con una vida media similar, de 2 semanas. Se ha desarrollado por su menor poder inmunogénico, por lo que se puede evitar la asociación de un inmunosupresor como el MTX84. Se utiliza por vía subcutánea cada 2 semanas. Recientemente se ha iniciado un estudio multicéntrico, doble ciego, en pacientes con AIJ de curso poliarticular.
Terapia anti-IL-1ra. La IL-1 desempeña un papel relevante en la inflamación articular de la AIJ68. El antagonista del receptor de IL-1 (IL-1ra) es un inhibidor natural de la IL-1ß e IL-1α. Una versión recombinante de esta molécula (anakinra) ha sido evaluada en pacientes con AR85-87, con la que en la actualidad se está llevando a cabo un estudio multicéntrico abierto en 60 niños con AIJ poliarticular en Estados Unidos, utilizando una dosis de 1 mg/kg/día administrada por vía subcutánea88. Aunque un 10% de los pacientes tuvo que suspender el tratamiento, a las 12 semanas el 61% respondió de acuerdo con los criterios de mejoría de la AIJ73.
Terapia anti-IL-6. Los valores séricos de IL-6 presentan una buena correlación tanto con los índices de actividad como con las manifestaciones sistémicas en pacientes con AIJ89,90. Existe muy poca información sobre los efectos del tratamiento anti-IL-6 in vivo, y éste se limita a series pequeñas de pacientes con AR. En un estudio abierto se apreció que la administración quincenal de un anticuerpo recombinante humanizado anti-IL-6, denominado MRA, produjo a los 6 meses una respuesta ACR 20 en el 80% y ACR 50 en el 40% de los pacientes91. Más recientemente se ha publicado el efecto de la infusión intravenosa de una dosis única variable (entre 0,1 y 10 mg/kg) de MRA, con resultados prometedores, aunque con un alto porcentaje de efectos colaterales92. Asimismo, se ha comunicado la eficacia de este anticuerpo en el tratamiento de la enfermedad de Still refractaria al tratamiento convencional93.
Terapia anti-CD 20. A pesar del papel central que se atribuye a los linfocitos T en la patogenia de la AIJ, existe evidencia de que las células B también contribuyen a la enfermedad, al menos en algún subgrupo de pacientes94. Estudios realizados utilizando un anticuerpo anti-CD 20 (rituximab) en series pequeñas de pacientes con AR agresiva refractaria al tratamiento han demostrado su eficacia, tanto en monoterapia95 como asociado con dosis elevadas de corticoides y ciclofosfamida96. Estos prometedores resultados se han confirmado en el análisis preliminar de un extenso estudio multicéntrico en el que se observó que la combinación rituximab-MTX producía una respuesta ACR 50 y 70 en el 50 y el 23% de los pacientes, respectivamente, y la combinación rituximab-ciclofosfamida ocasionaba una respuesta ACR 50 y 70 en el 45 y el 16% de los sujetos, respectivamente97.
Colágeno oral
Los estudios de inducción de tolerancia inmunológica mediante la administración oral de colágeno ofrecieron inicialmente unos resultados muy esperanzadores en sujetos con AR98. Estos resultados no se han confirmado en estudios ulteriores ya que no se apreciaba efecto alguno99 o bien éste era muy moderado100. En una serie de pacientes con AIJ el tratamiento con colágeno oral produjo la mejoría transitoria en 8 de 11 pacientes101. Los beneficios de esta terapia parecen ser marginales comparados con la eficacia de los nuevos agentes biológicos, por lo que su papel exacto en el arsenal terapéutico de la AIJ está aún por determinar.
Terapia génica
La terapia génica puede definirse como la transferencia de genes a pacientes con propósito terapéutico. En el caso de las enfermedades autoinmunes la base para este tratamiento es aumentar la expresión local de productos que bloquean moléculas proinflamatorias (receptor soluble de TNF o IL-1ra) o que presentan efectos antiinflamatorios (IL-10, IL-4). Esta transferencia puede realizarse ex vivo (transfiriendo el gen deseado en el laboratorio a células previamente extraídas del paciente sinoviocitos, por ejemplo que se readministran posteriormente) o in vivo (el gen que se transfiere se coloca en un vector, habitualmente viral, que se administra al paciente). Este prometedor tratamiento ha sido objeto de revisiones recientes102-105 donde se abordan con mayor profundidad los posibles genes que se pueden transferir, las ventajas y los inconvenientes de cada uno de ellos, así como la viabilidad y la seguridad de las diferentes técnicas de transferencia. Aunque esta forma de tratamiento resulta especialmente atractiva en pacientes con AIJ, donde cerca del 50% de los pacientes presentan una artritis restringida a pocas articulaciones, no existe ninguna experiencia hasta la fecha.
Trasplante de médula ósea
A pesar de la aplicación temprana de tratamientos agresivos, algunos pacientes padecen una enfermedad persistentemente activa y su calidad de vida es bastante pobre. La ausencia de otras opciones ha sido el motivo del empleo terapéutico del trasplante autólogo de médula ósea. La evolución de 29 pacientes, seguidos de 2 a 36 meses después del trasplante, fue la siguiente: 16 en remisión, seis en remisión parcial, dos en recaída, uno sin respuesta y cuatro (14%) fallecidos (uno por toxicidad cardíaca y tres por síndrome hemofagocítico, precedido de infección por el virus de Epstein-Barr o por toxoplasmosis). En la actualidad es un tratamiento experimental, que sólo se debe realizar, siguiendo los criterios de inclusión y exclusión establecidos, en centros capacitados para evaluar la relación riesgo/beneficio de la técnica106,107.
Tratamiento de las complicaciones
Uveítis crónica anterior
Es una de las manifestaciones extraarticulares con mayor morbilidad en la AIJ. Afecta más a las niñas con enfermedad pauciarticular asociada con anticuerpos antinucleares y de comienzo antes de los 6 años108,109. Con frecuencia es asintomática, por lo que el examen oftalmológico periódico es fundamental para un diagnóstico temprano110. El tratamiento inicial consiste en colirios de corticoides y midriáticos; si no hay respuesta se deben asociar corticoides orales. En algunos casos resistentes se puede llevar a cabo infiltración periocular de corticoides, controlando la tensión intraocular111. En las formas recidivantes se suele asociar MTX o ciclosporina A112-114. Un estudio prospectivo con etanercept en un pequeño grupo de pacientes mostró mejoría en el 63% de los ojos115. Sin embargo, otra revisión retrospectiva no resultó tan favorable, y en ella sólo mejoró el 38% de pacientes y en el 31% apareció el primer brote de uveítis, mientras el paciente estaba recibiendo el anti-TNF por las manifestaciones articulares116. Un estudio doble ciego, aleatorio, no mostró diferencias entre los tratados con etanercept y los que recibieron placebo117.
Síndrome de activación del macrófago
El síndrome de activación macrofágica es un síndrome hemofagocigótico secundario118,119 producido por la activación y proliferación incontrolada, no maligna, de linfocitos T y macrófagos. Cursa con valores elevados de citocinas, interferón gamma y TNF, entre otras. Representa una complicación aguda y grave de la AIJ, especialmente de la forma sistémica, que puede aparecer al inicio o durante la evolución de la enfermedad. Su causa es desconocida, aunque se ha relacionado con medicamentos (AINE, sulfasalazina, sales de oro y otros) e infecciones (virus de Epstein-Barr, varicela zoster, parvovirus B19)120. Se manifiesta principalmente por fiebre, coagulopatía y aumento de las enzimas hepáticas. Histológicamente, el signo característico es la hemofagocitosis en médula ósea u otros órganos hemopoyéticos. Su tratamiento no admite demora y consiste en corticoides a dosis altas, en general en forma de bolos intravenosos, a 30 mg/kg/día, durante 3 días, seguidos de dosis orales decrecientes, y según la experiencia de algunos autores121,122 la ciclosporina A mejora la respuesta. En ocasiones se ha observado recidiva en un mismo paciente. Recientemente se ha publicado la evolución favorable de un paciente tratado con etanercept123.
Amiloidosis
Se ha descrito fundamentalmente en la forma sistémica de AIJ. En los últimos 20 años su incidencia ha disminuido, posiblemente por el uso temprano de tratamientos más agresivos en los casos graves de enfermedad inflamatoria articular124-126. El diagnóstico de sospecha se establece por la presencia de proteinuria y se confirma por la demostración histológica del depósito de amiloide mediante la tinción con rojo Congo y la inmunohistoquímica. La gammagrafía con amiloide P sérico, marcado con un isótopo radiactivo, puede ser útil para el diagnóstico y la monitorización127. El clorambucil mejora la esperanza de vida, aunque supone un riesgo elevado de leucemia e infección128. El control del proceso inflamatorio de base sigue siendo la clave para la prevención de esta complicación.
Hipocrecimiento
El retraso en el crecimiento en pacientes con AIJ es de origen multifactorial, incluyendo la actividad inflamatoria, la corticoterapia y la malnutrición129-133, por lo que su prevención está basada en controlar la enfermedad, usar los corticoides a la «dosis mínima eficaz» y asegurar una alimentación adecuada. La hormona de crecimiento (GH) es normal en la mayoría de los pacientes, pero los factores de crecimiento similar a la insulina (IGF) pueden estar disminuidos, especialmente el IGF-1. Varios estudios controlados han puesto de manifiesto un aumento en la velocidad de crecimiento en estos niños, tras la administración de GH, aunque aún no se conocen los resultados a largo plazo134-136.
Osteoporosis
Éste es un problema importante en pacientes con largos períodos de actividad, agravado por el uso de corticoides137-139. La prevención de esta enfermedad es básica por el riesgo de fracturas y por el hecho de que una disminución en el pico de masa ósea al final de la adolescencia favorece el riesgo de osteoporosis en la vida adulta140. En este sentido, es necesario aportar suplementos de calcio y de vitamina D, especialmente cuando se utiliza corticoterapia. Además, debe estimularse el ejercicio físico dentro de las actividades cotidianas del niño o en el contexto de un programa de rehabilitación-fisioterapia. Aunque sólo existen estudios preliminares sobre el uso de bisfosfonatos en la infancia, éstos deben ser considerados en la osteoporosis con fracturas o cuando haya factores de riesgo elevados141-144.
Tratamiento según la forma clínica de la enfermedad
En las tablas 2-6 se expone el esquema terapéutico según la forma clínica de la enfermedad. Los autores aconsejan revisar los algoritmos publicados recientemente11,12,145.
Correspondencia: Dra. J. García-Consuegra Molina. Unidad de Reumatología Pediátrica. Hospital Universitario La Paz. P.º de la Castellana, 261. 28046 Madrid. España. Corrreo electrónico: reumaped.hulp@salud.madrid.org
Manuscrito recibido el 27-3-2003 y aceptado el 8-4-2003.