Se presenta un caso de linfoma pulmonar primario no Hodgkin con invasión de miocardio, evento que no ha sido previamente descrito en la literatura. Estos tumores se extienden por proximidad, habiéndose descrito invasión de pericardio, de la pared torácica y del esófago. La paciente falleció de insuficiencia cardíaca y la infiltración tumoral miocárdica fue el factor determinante por un fallo de la contractilidad miocárdica. La infiltración miocárdica se ve facilitada por el mayor volumen del tumor que infiltra la pared pleural.
A case of primary pulmonary non-Hodgkin's lymphoma is presented. On this occasion, the lymphoma invaded the myocardium, an event which has not previously been reported in the literature. These neoplasms spread by proximity, and invasion of the pericardium, thoracic wall and oesophagus have been described. Our patient died from heart failure. Tumour myocardial infiltration may well have been the determinant cause through various mechanisms, including a decrease in myocardial contractility. Spread into the myocardium may be facilitated by bulky tumour infiltrates in the pleural space.
El linfoma pulmonar primario (LPP) se define como un linfoma que solo involucra al parénquima pulmonar y abarca un amplio espectro histológico de linfomas malignos1. La afectación intratorácica linfomatosa normalmente ocurre en el marco de un proceso sistémico, aunque las formas primarias de linfoma no Hodgkin (LNH) y de enfermedad de Hodgkin (EH) pueden también originarse en pulmón. El LNH pulmonar primario no es frecuente, comprende menos del 1% de todos los LNH, y el pico de incidencia es en la sexta década de la vida, con un ligero predominio en varones2.
El subtipo histológico más frecuente de LPP es el linfoproliferativo de grado bajo, que corresponde a un tumor de células B bien diferenciado que aparece en los bronquios asociado al tejido linfático (BALT). El segundo en frecuencia es el linfoma difuso de células B gigante y los otros trastornos linfoproliferativos son mucho menos frecuentes3.
El LPP suele propagarse por continuidad y se ha descrito la invasión de estructuras contiguas como la pared torácica, el esófago y el pericardio. A continuación, se presenta el primer caso de un LNH pulmonar primario con invasión del miocardio.
Caso clínicoMujer de 87 años que ingresa procedente de urgencias por disnea y nódulos pulmonares bilaterales. Como antecedentes personales tenía historia de hipertensión tratada con metildopa, insuficiencia mitral y tricúspide leve, hipertensión pulmonar moderada, insuficiencia cardíaca clase II de la NYHA y un ictus hemisférico derecho sin secuelas. Intervenida de un carcinoma basocelular de frente y herniorrafia umbilical.
Valoración geriátrica: índice de Barthel 100, índice de Lawton 5, estado mental normal.
Quince días antes del ingreso, la paciente presenta de forma brusca un aumento de su disnea habitual hasta hacerse de reposo, con ortopnea y episodios de disnea paroxística nocturna, así como aumento de sus edemas en los miembros inferiores. No presentaba ninguna otra sintomatología.
A su llegada a urgencias su temperatura era 36,6°C y la presión arterial 140/70 mmHg. Presentaba cianosis y desorientación. Se detectó un aumento de los ganglios linfáticos en cara lateral del cuello, ingurgitación yugular y pulsos carotídeos arrítmicos. La auscultación cardiaca era arrítmica a 100 latidos por minuto y a nivel pulmonar tenía crepitantes bibasales. La exploración abdominal resultó normal y existían edemas hasta las rodillas en las extremidades inferiores.
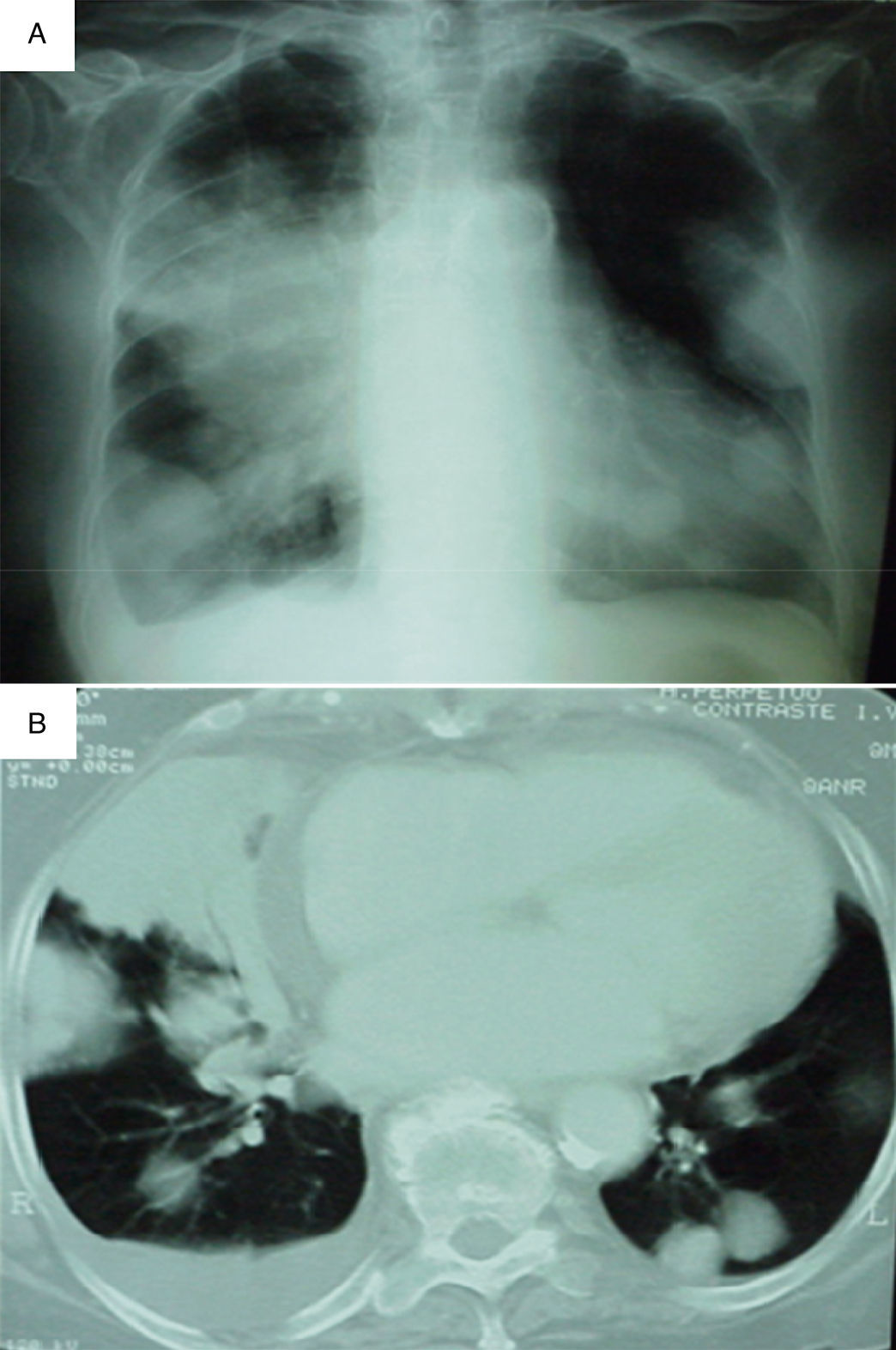
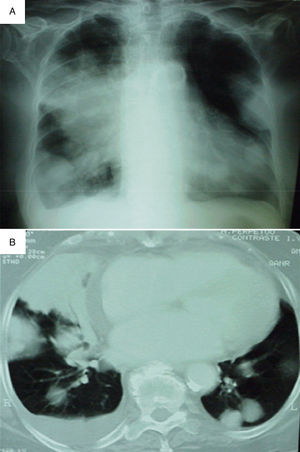
En la bioquímica y el hemograma de urgencias solo destacaba transaminasa glutamicoxalacética 53 U/l, lactatodeshidrogenasa 1378 U/l, sodio 133 mmol/l y urea 61mg/dl. La orina no presentaba alteraciones. La gasometría arterial basal detectaba una presión parcial de O2 43, presión parcial de CO2 53,7 y saturación de oxígeno 72%, con un gradiente alveolo-arterial de oxígeno de 31. El electrocardiograma presentaba una fibrilación auricular con elevación del segmento ST en V3, V4 y V5. En la radiografía de tórax se observaban múltiples masas pulmonares predominantemente en el hemitórax derecho, derrame pleural derecho y una condensación triangular en el lóbulo superior derecho (fig. 1).
A) Radiografía de tórax que muestra múltiples masas en ambos campos pulmonares, predominantemente en el hemitórax derecho, derrame pleural derecho y una condensación triangular en el lóbulo superior derecho. B) Tomografía computarizada donde se objetiva derrame pleural derecho y múltiples nódulos y masas de distintos tamaños, muchos de ellos en contacto con el espacio pleural. La masa de mayor tamaño está en posición anteromedial del lóbulo superior derecho y tiene 9cm en su eje mayor.
Se realizaron distintas pruebas complementarias para intentar filiar el patrón pulmonar. Las pruebas microbiológicas fueron negativas para virus de la hepatitis C, antígeno de superficie de la hepatitis B, virus de la inmunodeficiencia humana, test de serología luética, Mycoplasma, Mantoux y equinococo granuloso. En cambio, existió positividad para anticuerpo del core y de superficie de la hepatitis B. El perfil autoinmunitario fue normal para C3, C4, anticuerpos antinucleares, IgG, IgM e IgA. La beta-2 microglobulina, CA 19,9 y antígeno carcinoembrionario fueron normales, y el CA 125 estaba ligeramente aumentado.
Se realizó una TC toracoabdominal en la que se apreciaron múltiples nódulos y masas de distinto tamaño, la mayor de 9cm de diámetro en el lóbulo superior derecho anteromedial; la mayoría estaba en contacto con la superficie pleural. También existía derrame pleural derecho. No se apreciaron adenopatías mediastínicas, abdominales ni pélvicas (fig. 1).
Se practicó una PAAF de pulmón obteniéndose una muestra insuficiente.
A los 15 días de ingreso, la paciente presentó un episodio de fibrilación auricular con respuesta ventricular rápida, que provocó un edema agudo de pulmón refractario a tratamiento y su posterior fallecimiento.
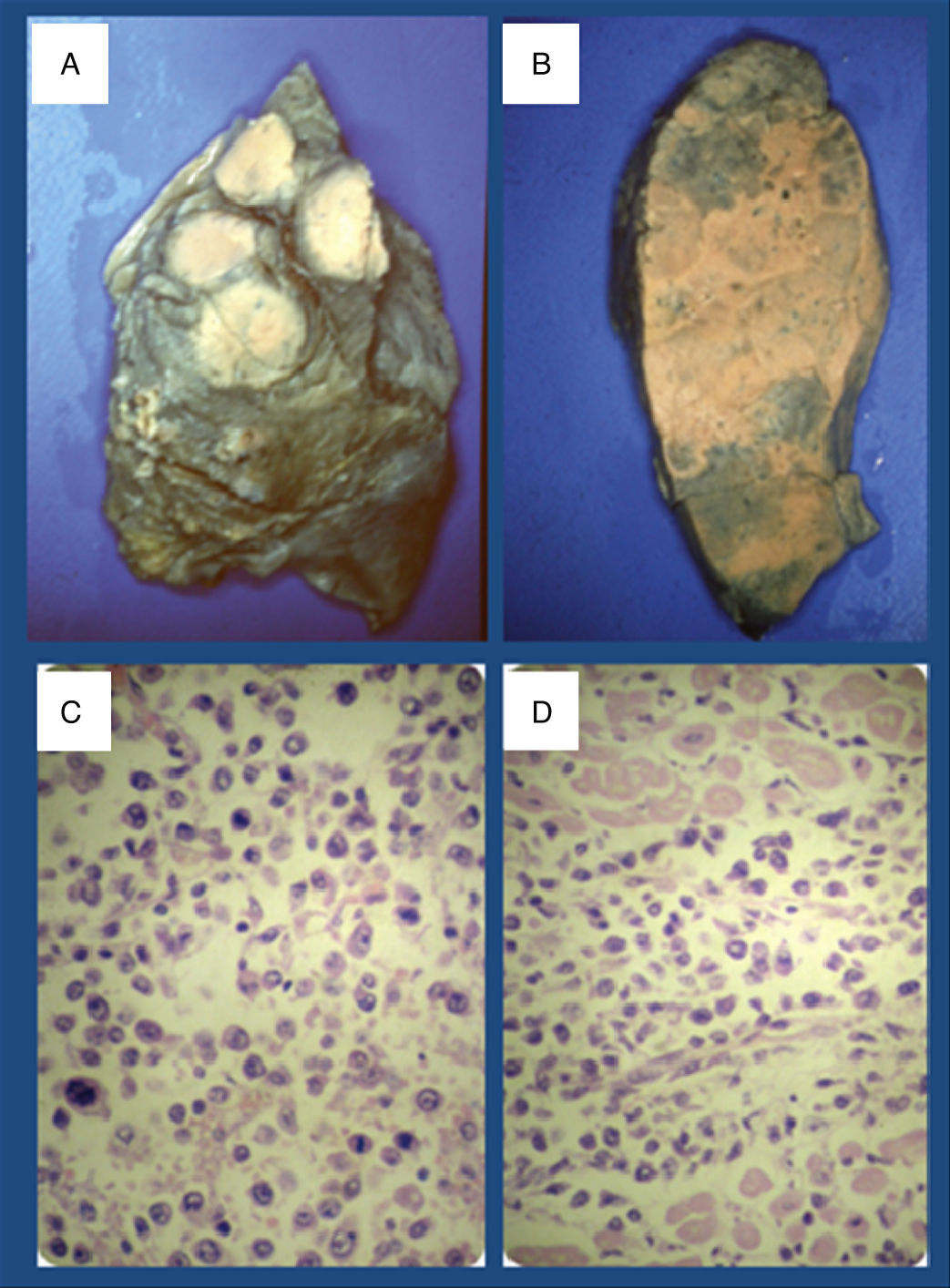
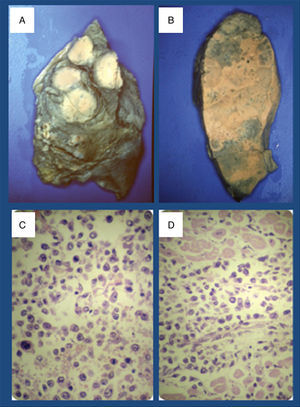
Informe patológicoDescripción macroscópica: a la apertura de la cavidad pleural se observan adherencias pleurocostales densas, encontrándose algunos ganglios linfáticos en mediastino de aspecto antracótico. Los pulmones contenían múltiples nódulos y masas blanquecinas de tamaño y consistencia variable, distribuidos por todos los lóbulos de ambos pulmones (fig. 2).
A y B) Imágenes de ambos pulmones que muestran las masas linfomatosas. C) Células neoplásicas de tamaño medio a grande, se identifican formas centrocitoides, plasmocitoides y numerosas células de aspecto blástico. Varias imágenes de mitosis. (hematoxilina-eosina, original x 400). D) Invasión del miocardio por células linfomatosas (hematoxilina-eosina, original x 200).
Descripción microscópica: las lesiones pulmonares corresponden a una proliferación neoplásica maligna constituida por células de hábito linfoide que invaden ampliamente el parénquima pulmonar, borrando la arquitectura subyacente. Se observan múltiples zonas de necrosis, a veces extensa. Las células neoplásicas son, en general, de tamaño medio a grande y se identifican formas centrocitoides, plasmocitoides y numerosas células de aspecto blástico. Son frecuentes las figuras de mitosis. Se observa infiltración pleural. A veces, se identifican focos de infiltrado linfoide intersticial de características similares a los acúmulos tumorales más extensos. Con técnicas de inmunohistoquímica, las células neoplásicas son positivas para marcadores linfoides (CD45RB) y marcadores linfoides de fenotipo B (CD79a y CD20), y son negativas para marcadores de linfocito T (CD3 y CD45R0) y para los epiteliales (Cam 5.2 y AE1-AE3). Además de la neoplasia descrita, se observan colecciones focales broncoalveolares dispersas de leucocitos polimorfonucleares. En el corazón se observan áreas de invasión de pericardio y miocardio por células neoplásicas de características similares a las observadas en los pulmones (fig. 2).
No se realizó el estudio histológico de las adenopatías laterocervicales existentes.
DiscusiónEl LPP es un trastorno poco común, con un pronóstico generalmente favorable, con tasas de supervivencia al año y a los 5 años que se aproximan al 90 y el 65%, respectivamente. Sin embargo, su perfil clínico, los factores pronósticos y el manejo no están claramente definidos.
Presentamos un caso de LPP no Hodgkin con invasión del miocardio, evento no publicado en la literatura. El pico de incidencia de esta patología se produce en la sexta década de la vida, mientras que nuestra paciente fue diagnosticada con 87 años. La histología del tumor fue de un linfoma difuso de células B gigante, el segundo en frecuencia3, que representa el 19% de las series revisadas. De acuerdo a la clasificación REAL, el tipo más frecuente es el BALT, que representa del 73 a 77%. Este tipo de linfoma tiene un mejor pronóstico cuando el paciente no presenta síntomas de tipo B, como era nuestro caso. Hasta el momento, el tipo histológico, el hábito tabáquico, la bilateralidad en la presentación, la estadificación preoperatoria o el tratamiento adyuvante no han demostrado ninguna significación pronóstica.
Nuestra paciente presentaba tos, disnea y síntomas de insuficiencia cardíaca congestiva. La mayoría de los pacientes con LPP están asintomáticos en el momento del diagnóstico y cuando aparecen síntomas éstos son más frecuentemente pulmonares, incluyéndose tos, disnea, dolor torácico y hemoptisis. En nuestro caso, la insuficiencia cardíaca podría haberse debido a un empeoramiento de la miocardiopatía hipertensiva subyacente, aunque del mismo modo, la invasión linfomatosa del miocardio podría haber desencadenado un trastorno en la contractilidad, actuando también como factor agravante.
Con respecto a los estudios por imágenes, los hallazgos más frecuentes en la presentación son un nódulo solitario, una masa o un infiltrado en la radiografía de tórax. El nódulo o masa es típicamente de 2 a 8cm de diámetro y es más frecuente en lóbulos inferiores. El broncograma aéreo puede verse en la radiografía, pero es más frecuentemente observable en la TC, apareciendo en el 51% de los casos4. En el 25% de los pacientes aparecen múltiples áreas de condensación y se observan nódulos múltiples entre un 5 y un 10% de los pacientes. El infiltrado puede simular un carcinoma broncoalveolar. Un infiltrado alveolar y/o intersticial puede observarse en menos de un 10% de los casos y la infiltración pleural se demuestra en un 12% de los mismos5. Las linfadenopatías intratorácicas están ausentes por definición.
Nuestra paciente mostró varias masas bilaterales, predominantemente adyacentes a la pleura, la mayor de 8cm, pero ésta no es una presentación típica. Habitualmente, la radiografía de tórax sugiere el diagnóstico, que se confirma mediante TC y biopsia. En la obtención de muestras histológicas, la broncoscopia no suele ser concluyente, aunque la biopsia transbronquial se ha demostrado útil. La PAAF no es fiable dada la posibilidad de obtener insuficiente tejido significativo, como en nuestro caso, donde se realizó toma de muestras del centro de la necrosis6. Además, esta técnica no permite etiquetar de forma precisa los linfomas. Tanto la toracotomía, como la toracoscopia o la mediastinoscopia, son las más recomendadas para la obtención de una muestra de tejido. La extensión del tumor por proximidad al esófago, produciendo erosión de la parrilla costal en el 6% de los casos según Castellino7, y la invasión del pericardio han sido descritas con anterioridad en la literatura. Sin embargo, no hemos encontrado publicaciones donde se detalle la invasión del miocardio. El derrame pericárdico sugiere la invasión directa del mismo, en un 6% de los casos, según Castellino7, es más frecuente en la EH y ocasionalmente puede presentarse como masas voluminosas en éste. En nuestro caso, el gran tamaño de las lesiones apunta a un largo período asintomático, el cual facilitó la infiltración del miocardio y la alteración de la contractilidad.
El tratamiento quimioterápico estándar difiere dependiendo del grado. El protocolo CHOP es el preferido para los linfomas de tipo B difusos de células grandes.
Declaración de conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.