La población con infección por VIH está envejeciendo debido al aumento de la supervivencia gracias al tratamiento antirretroviral y al aumento de casos nuevos en personas mayores de 50 años. A pesar de un buen control inmunovirológico tras el tratamiento, el VIH provoca por diferentes vías un estado de inflamación crónica con cambios en el sistema inmunológico similares a los que tienen lugar con el envejecimiento fisiológico dando como resultado el envejecimiento precoz del sistema inmune o inmunosenescencia. Esta inmunosenescencia tiene su manifestación clínica en un aumento de la prevalencia de comorbilidades asociadas a la edad no asociadas al VIH y en un aumento de la prevalencia de fragilidad a edades más tempranas que en la población general. El paciente con infección por VIH es biológicamente mayor de lo que su edad cronológica indica y presenta problemas propios de las personas mayores como la fragilidad que deben ser abordados.
The HIV-infected population is aging due to the success of combination antiretroviral therapy, which prolongs survival, as well as the growing number of newly diagnosed cases in adults 50 years old and over. HIV-infected individuals suffer from an accelerated aging due to the persistent and chronic activation of the immune system that leads to immune exhaustion and accelerated immunosenescence, even when on optimal immuno-virological control treatment. The clinical expression of the immunosenescence state is an increased prevalence of aging-related non-HIV associated comorbidities and a rising prevalence of frailty occurring earlier than in the general population. Thus, HIV-infected patients are biologically older than their chronological age, and they suffer from aging-related problems, such as frailty, which should be assessed.
La instauración del tratamiento antirretroviral de gran actividad ha supuesto un aumento en la esperanza de vida de los pacientes con infección por el VIH permitiendo a los individuos convivir con la infección como con una enfermedad crónica. El escenario ha cambiado radicalmente desde el inicio de la pandemia. El objetivo principal no es ya solo la supervivencia. La población con infección por VIH está envejeciendo y por eso el abordaje de estos pacientes hoy trasciende el control de la infección y el manejo del tratamiento antirretroviral, sus efectos adversos y posibles interacciones e incluye el manejo de la infección a largo plazo, el abordaje de la comorbilidad asociada y problemas asociados a la edad como la fragilidad y los síndromes geriátricos1,2.
A día de hoy el 50% de las personas que viven con la infección por el VIH son mayores de 50 años3 y el modelo predictivo de Smit et al. estima que para el año 2030 la edad media de la población con la infección habrá aumentado de 43,9 (basándose en datos de 2010) a 56,6 años y, el 73% de las personas con infección por VIH serán mayores de 50 años, siendo el 39%≥65 años4. En España, según los datos aportados por la Encuesta Hospitalaria de pacientes con VIH/sida en contacto con el Sistema Nacional de Salud, se observa un aumento progresivo del grupo de individuos de 50 años o más, desde un 7,7% en el año 2000 hasta un 36,1% en 20145. No solo es mayor el número de individuos en esa franja de edad que conviven con la infección, también se ha detectado un aumento de nuevos diagnósticos. Según el Registro Nacional de casos de sida, los nuevos diagnósticos de infección por el VIH en individuos de 50 años o más fue del 13,7% en 2014, de un total de 3.366 nuevos diagnósticos6, siendo el dato más alto de los registrados desde 2008 para ese grupo de edad.
Este envejecimiento de la población con infección por el VIH se debe fundamentalmente a un aumento de la supervivencia y al diagnóstico de nuevos casos en personas mayores de 50 años. Hoy en día los pacientes con acceso al tratamiento tienen una esperanza de vida cercana a la de la población general7 y las condiciones crónicas concomitantes típicamente relacionadas con la edad como causa de muerte1 tienen mayor peso que los eventos definitorios de sida.
Similitudes entre el efecto de la infección por el VIH y el envejecimiento fisiológicoLos individuos que envejecen con la infección por el VIH tienen ciertas particularidades. El tratamiento antirretroviral no restaura la salud por completo, incluso en pacientes con adecuada respuesta al tratamiento, existe un aumento de prevalencia de comorbilidades no asociadas al VIH sino relacionadas con la edad, como la enfermedad cardiovascular, el cáncer, la insuficiencia renal, la hepatopatía, la osteopenia y osteoporosis y también la afectación neurocognitiva8.
Inicialmente se pensaba que esto era debido a que en esta población suele darse una mayor exposición a factores de riesgo como el consumo de tabaco, alcohol y otros tóxicos que producen daños a nivel molecular y celular. A esto se suma la toma de determinados fármacos antirretrovirales que tienen efecto nocivo sobre algunos sistemas, como por ejemplo, a nivel del riñón, o a nivel de la distribución grasa, produciendo lipoatrofia periférica y acumulación central, que se relacionan con el desarrollo de resistencia a la insulina, diabetes e hiperlipemia8. Sin embargo, estos factores solo explican en parte el aumento de prevalencia de enfermedades no asociadas al VIH y asociadas al envejecimiento. Cada vez hay más datos que indican que existe una mayor concentración de marcadores de inflamación en individuos con la infección por el VIH correctamente tratados, respecto a controles no infectados. Estos marcadores de inflamación son el reflejo de una activación crónica del sistema inmune que –como detallaremos más adelante– está asociada con el desarrollo de numerosas enfermedades, incluso con un aumento en la mortalidad por cualquier causa, como se ha visto en los individuos de mayor edad en la población general8.
Bases biológicas del envejecimientoEl envejecimiento es un proceso complejo. En última instancia se trata de una acumulación de daños a nivel molecular como son entre otros: mutaciones del ADN, acortamiento de los telómeros, alteración en la síntesis y estabilización de las proteínas y los lípidos. Estas alteraciones son inicialmente controladas por mecanismos genéticos de reparación y mantenimiento, que disminuyen el daño celular, pero su activación prolongada hace que estos mecanismos de regulación dejen de funcionar con el tiempo9.
Uno de estos mecanismos reguladores tiene lugar a nivel mitocondrial. Con el envejecimiento, se produce una alteración en la función mitocondrial, contribuyendo al envejecimiento celular tanto por la liberación de radicales libres de oxígeno como por la activación de la proteína p53 implicada en procesos de apoptosis. Algunos fármacos antirretrovirales (inhibidores de la transcriptasa inversa análogos de nucleósidos) inhiben la síntesis mitocondrial, produciendo liberación de ADN mitocondrial con potencial daño oxidativo9.
Los cambios en el sistema inmune, el estado proinflamatorio y la exposición a tóxicos ambientales y al tratamiento antirretroviral producen un daño genómico y mitocondrial en los individuos con infección por el VIH comparable al que se produce durante el envejecimiento fisiológico en la población general9.
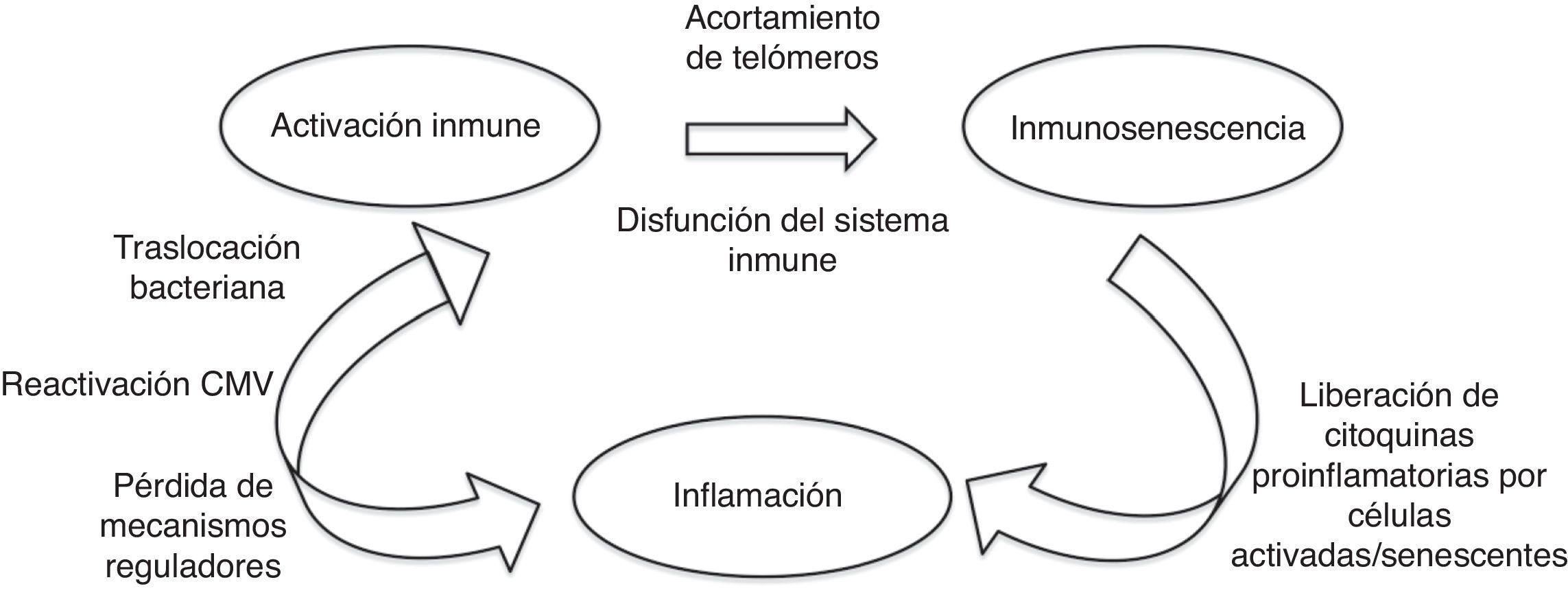
Cuando el nivel de acumulación de alteraciones moleculares es elevado o bien la célula ha pasado por múltiples ciclos de división, se convierte en senescente, deja de dividirse y secreta citoquinas proinflamatorias, que promueven un estado crónico de inflamación, que a su vez puede generar daño molecular y celular. La senescencia celular se traduce en una afectación del tejido del que forma parte y finalmente en una alteración de la función de los distintos órganos. La disfunción de algunos sistemas contribuye a la vulnerabilidad en otros10,11. En la figura 1 se muestra la relación entre la activación del sistema inmune, la inmunosenescencia y la inflamación.
Activación del sistema inmune, inmunosenescencia e inflamación.
Adaptado de Hearps et al.14
La inmunosenescencia se define como una limitación de la función inmune derivada de cambios asociados con el envejecimiento en células relacionadas con inmunidad innata y adaptativa y a un desequilibrio entre las dos respuestas12. Como cualquier órgano, el sistema inmune experimenta cambios característicos a medida que los individuos se hacen mayores. Comparado con los individuos de menor edad, el sistema inmune de las personas de edad avanzada está marcado por las siguientes características9:
- -
Disminución del número y función de las células madre hematopoyéticas.
- -
Involución del timo.
- -
Disminución de las células T naïve circulantes.
- -
Aumento de los linfocitos T memoria, CD28- con limitado potencial proliferativo.
- -
Aumento de niveles de citoquinas proinflamatorias incluyendo la interleuquina 6 y el factor de necrosis tumoral α.
- -
Disminución del cociente de linfocitos T CD4+/CD8+.
La disminución de las células madre hematopoyéticas que se produce con el envejecimiento se debe a un excesivo recambio, daños ambientales, exposición a estrés oxidativo y acumulación de alteraciones genéticas. En la infección por el VIH también disminuye esta producción, además de por los mecanismos descritos anteriormente, por la capacidad de infectar directamente estas células o bien alterar el microambiente donde se encuentran, afectando a la síntesis de nuevas células9. Tanto el envejecimiento fisiológico como la infección por el VIH se asocian con una pérdida de función del timo, lo que puede contribuir de forma teórica a la disfunción inmune9. A nivel periférico, los cambios en las poblaciones linfocitarias asociados al envejecimiento, son los mismos que se producen en la infección por el VIH. Tras repetidos ciclos de activación y división, los linfocitos T CD8+ se vuelven senescentes y pierden la expresión de la molécula CD28, apareciendo en su superficie CD57. Estos cambios las marcan como células diferenciadas, con menor capacidad para proliferar y con un perfil secretor de citoquinas proinflamatorias9,13. Otros cambios que se producen son la disminución de los linfocitos T CD4+, con predominio de linfocitos T CD8+, siendo el cociente entre ellos (CD4+/CD8+) menor de 1. Y la disminución de los linfocitos T y B naïve9,14,15.
Estos cambios que se producen, tanto durante el envejecimiento fisiológico como en la infección por el VIH, van a alterar la función del sistema inmune y su capacidad para responder a agresiones externas. Encontraremos mayor susceptibilidad a infecciones, un aumento en la incidencia de cáncer y fenómenos autoinmunes, y una menor respuesta a la vacunación16,17. La menor capacidad del organismo para defenderse ante agresiones externas supone un aumento en el daño molecular en diferentes tejidos, conduciendo a la senescencia y/o a la apoptosis celular9.
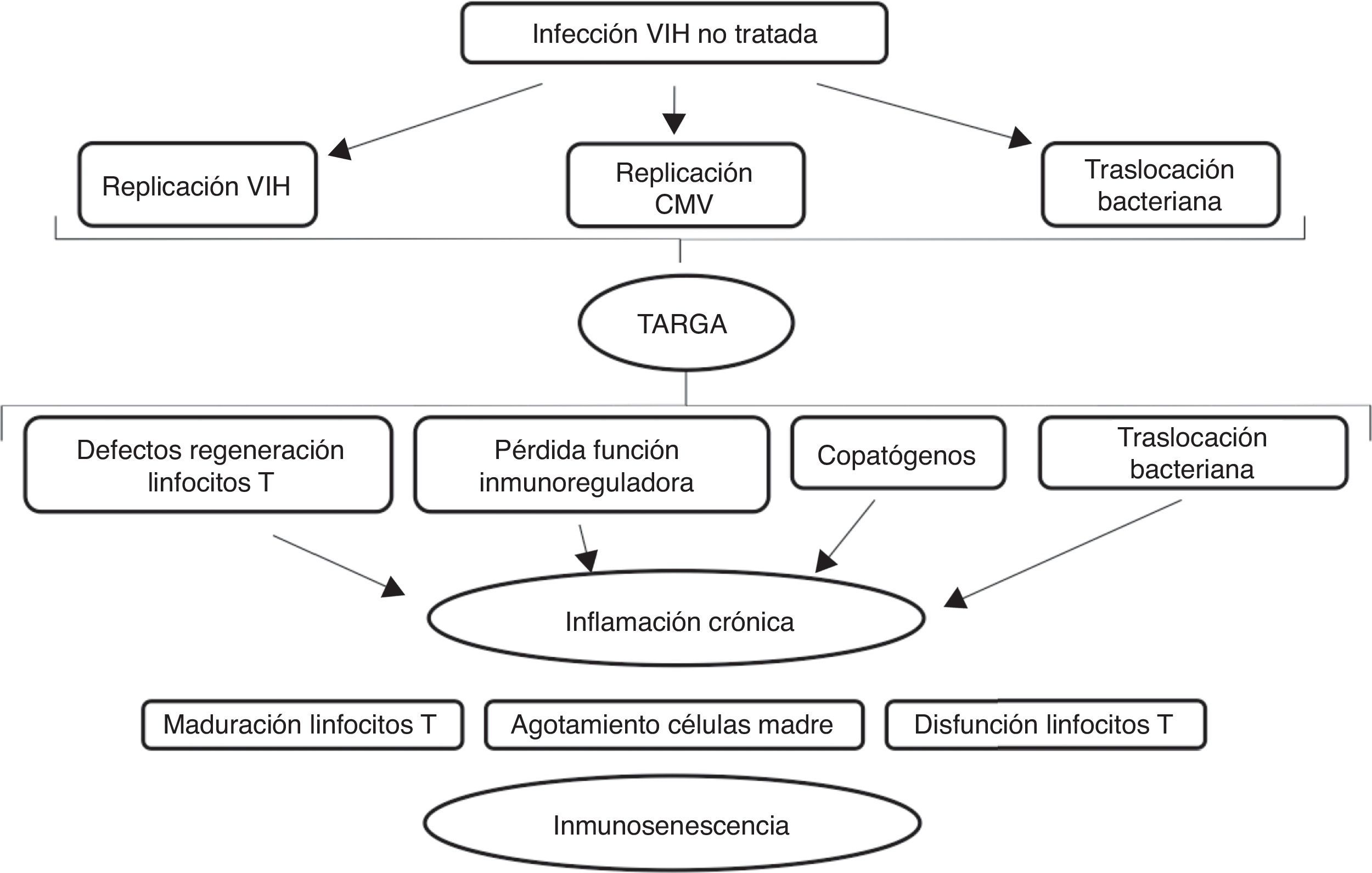
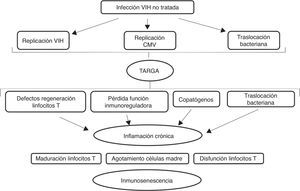
La alteración del sistema inmune se atribuye a una activación crónica. En el caso del envejecimiento fisiológico en relación con infecciones y agresiones que se producen durante la vida. En el caso de la infección por el VIH la activación crónica del sistema inmune se debe a la persistencia de la replicación viral a nivel de reservorios, a coinfección por otros virus que también pueden tener un estado de replicación crónica (virus de la hepatitis B y C y citomegalovirus) y a la traslocación bacteriana14–17 como se representa gráficamente en la figura 2.
Efecto de la infección por el VIH en el sistema inmune.
Adaptado de Deeks9
La coinfección con el citomegalovirus es de gran importancia, por su frecuencia (con tasas de coinfección del 90-100%) y por los cambios que produce a nivel del sistema inmune12. Tiene un papel fundamental en la senescencia de los linfocitos T. Al igual que el VIH, produce activación persistente del sistema inmune y cambios en las poblaciones linfocitarias. Su importancia radica también en que puede infectar las células endoteliales, lo que puede ser un paso temprano en la cascada de eventos que conducen a la formación de la placa de ateroma, primer paso de la enfermedad cardiovascular16.
La traslocación bacteriana se debe a la pérdida de la barrera intestinal. El VIH produce importantes alteraciones a nivel intestinal. Por un lado, a nivel de las proteínas de unión entre las células, favoreciendo el paso de bacterias y productos de degradación de las bacterias desde la luz intestinal a la sangre e interfiriendo en la absorción de nutrientes. Por otro lado, afectando a los distintos componentes del sistema inmune intestinal, cuya función principal es la de defendernos de los patógenos y tolerar antígenos presentes en la comida y en las bacterias comensales. Todo ello se ve interferido por la infección y no se recupera completamente tras el inicio del tratamiento antirretroviral18. La traslocación bacteriana implica una elevación en la circulación de los niveles de lipopolisacáridos procedentes de los productos de degradación bacteriana. Es capaz de activar la respuesta inmune y mantener un estado proinflamatorio como defensa del organismo, y de activar la cascada de coagulación. La hepatopatía empeora este proceso, por alteración en la producción de factores de la coagulación y por disminución del aclaramiento de lipopolisacárido8.
Estado proinflamatorioComo consecuencia de la activación crónica del sistema inmune y del daño celular que transforma las células en senescentes, se produce un estado proinflamatorio en los individuos infectados por la infección por el VIH. Otro factor de gran peso para la generación de este estado, es el cambio en la distribución de la grasa corporal que se produce tanto por la infección por el VIH como por su tratamiento, con aumento de tejido adiposo a nivel visceral. A ese nivel, el tejido adiposo se convierte en un potente secretor de citoquinas proinflamatorias9. Tanto en individuos de mayor edad como en aquellos con infección por el VIH, se ha observado un aumento de niveles de inflamación. En individuos con infección por el VIH podemos encontrar en sangre periférica niveles de interleuquina 6 de 50-100% mayores que en la población no infectada8,14, además de otras citoquinas proinflamatorias como es el factor de necrosis tumoral α y la proteína C reactiva y marcadores de activación de monocitos y macrófagos como son CD14 y CD163. La mayoría de estos marcadores de inflamación disminuyen con el inicio del tratamiento antirretroviral, pero no desaparecen por completo8,9. Existe una estrecha relación entre la elevación de marcadores de inflamación en la sangre con un estado procoagulante. Encontramos datos de activación de la cascada de coagulación y niveles elevados de dímero D en individuos con infección por el VIH y en ancianos19. La importancia de presentar niveles elevados de estas moléculas proinflamatorias y procoagulantes en el organismo es que están asociadas a largo plazo con el desarrollo de enfermedad cardiovascular, demencia, fragilidad, discapacidad o muerte17,18. Pequeños aumentos en los niveles de dichos marcadores se relacionan con un aumento importante en el riesgo de desarrollar enfermedades y de mortalidad por cualquier causa8,14.
Envejecimiento prematuroLa hipótesis de un envejecimiento prematuro asociado a la infección por el VIH se debe a la alta carga de comorbilidad que se observa en estos pacientes, incluyendo enfermedad cardiovascular, neuropatía, anemia, osteoporosis, hepatopatía e insuficiencia renal. Estas condiciones habitualmente asociadas con el envejecimiento, se producen de forma temprana en los individuos con infección por el VIH, de 10-20 años antes que en la población general1,8. Esto se debe a la asociación de varios factores: exposición a factores de riesgo nocivos como son el consumo de tabaco o de alcohol, el uso de numerosos fármacos (polifarmacia), la disfunción del sistema inmune y la presencia de un estado proinflamatorio y de hipercoagulabilidad. Estos cambios, producen un agotamiento de las reservas funcionales de los individuos con infección por el VIH de forma precoz, encontrando condiciones asociadas al envejecimiento a edades más tempranas. El daño a nivel de los distintos órganos va a depender de la cantidad de agresiones ambientales recibidas y de la respuesta reparadora del organismo. Algunos individuos con infección por el VIH han recibido mayores tasas de daño extrínseco: consumo de tabaco, alcohol y otras sustancias, coinfección con otros virus, estrés psicosocial, o exposición a fármacos antirretrovirales de primera generación durante largos periodos de tiempo8,14. La compleja relación entre la infección por el VIH, el tratamiento antirretroviral, el envejecimiento y el desarrollo y tratamiento de múltiples comorbilidades hace que el abordaje completo de los pacientes mayores con infección por VIH, sea un reto16.
Infección por VIH y fragilidadDesde que la infección por VIH se ha convertido en una enfermedad crónica en la mayoría de los casos, la fragilidad ha crecido en importancia entre estos pacientes.
La activación del sistema inmune y la existencia de un estado de inflamación crónica se ven implicados en el deterioro de distintos sistemas fisiológicos, que persiste a pesar de una adecuada supresión de la replicación viral como hemos comentado. De forma progresiva, se produce en el organismo una pérdida de reserva funcional, de homeostasis y de capacidad para reaccionar ante agresiones externas, lo que ha hecho de la fragilidad un importante campo de estudio del estado de salud en la población con infección por VIH.
En los últimos años están aumentando los datos sobre fragilidad en individuos con infección por VIH, observando una mayor prevalencia con respecto a población no infectada11,15,20 y con un desarrollo precoz, adelantándose de 10 a 15 años respecto a la población general (65 años), al igual que ocurre con muchas condiciones asociadas al envejecimiento12,15. Se ha visto que existen factores de riesgo comunes para el desarrollo de fragilidad entre la población general y los individuos con infección por VIH: menor nivel de estudios, peor situación económica, presencia de comorbilidades, malnutrición y obesidad central y elevación de niveles de marcadores de inflamación como IL-6, y dímero D21–23. Pero también hay factores específicos de la infección como es la cifra de linfocitos T CD4+ y la carga viral23,24.
Actualmente, una gran mayoría de la población con infección por VIH alcanza una adecuada recuperación inmunológica y la supresión virológica tras iniciar el tratamiento antirretroviral por lo que el recuento de linfocitos T CD4+ y de la carga viral en sí mismos no van a ser adecuados marcadores de vulnerabilidad. La fragilidad, al ser un predictor de eventos adversos en salud, es una buena herramienta para identificar a aquellos individuos que se encuentran en situación de vulnerabilidad y en riesgo de tener un peor estado de salud. Su estudio permite revelar déficits de forma precoz sobre los que poder actuar, priorizar los cuidados de estos pacientes y diseñar estrategias para un mejor uso y mayor rendimiento de los recursos en el sistema de salud10,15.
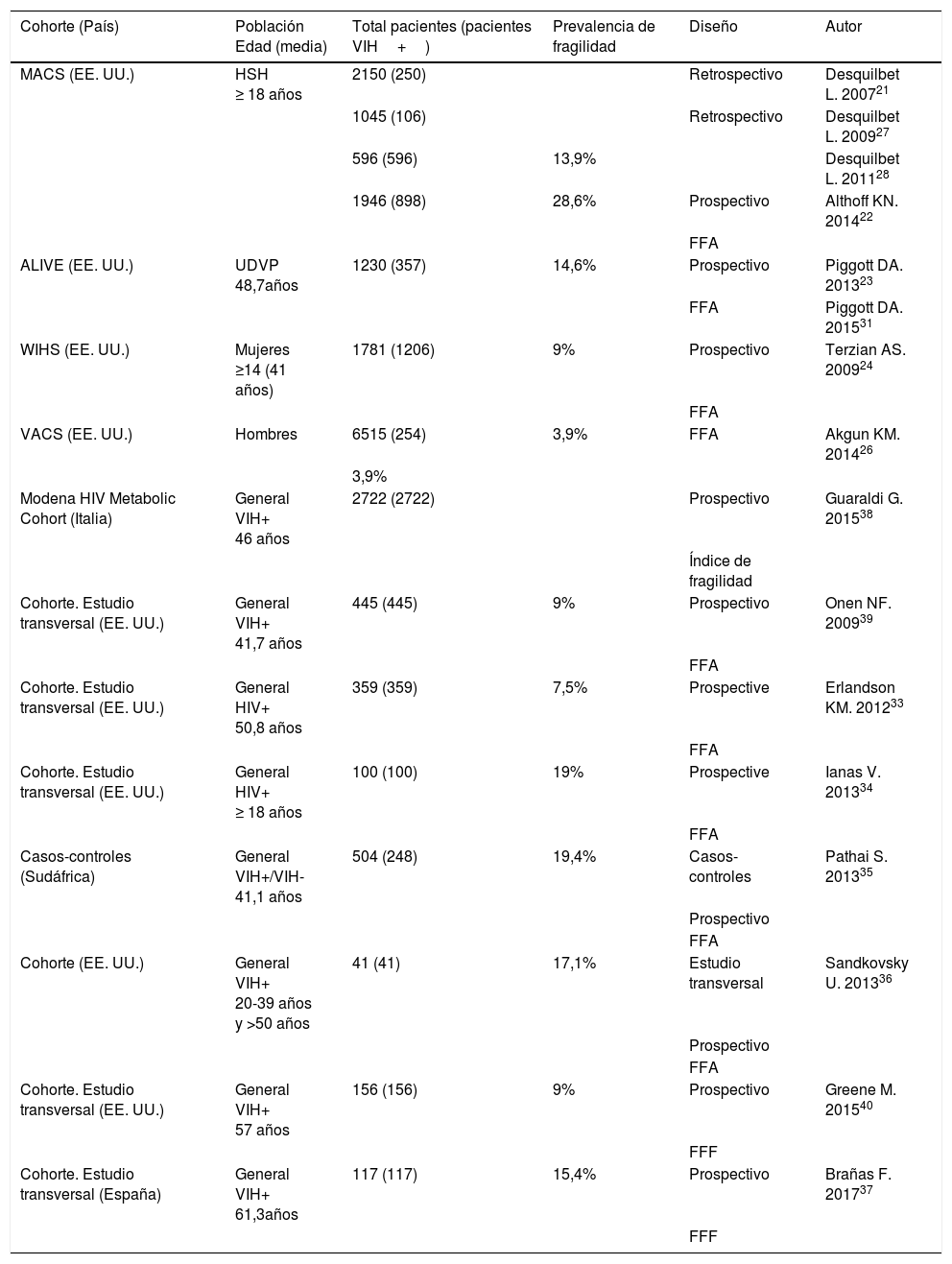
Gran parte de lo publicado hasta el momento sobre el síndrome de fragilidad en la población con infección por VIH procede de estudios epidemiológicos de cohortes diseñados con objetivos distintos al estudio de la fragilidad: el estudio del comportamiento de la infección por el VIH en subgrupos poblacionales22–24, el riesgo de fracturas por fragilidad ósea25, o el riesgo de mortalidad asociado al VIH26. Sus resultados no son extrapolables a la población general con infección por VIH pues se han realizado en subpoblaciones con características específicas: hombres que tienen sexo con hombres21,22,27,28, mujeres24, veteranos de guerra29,30, usuarios de drogas por vía parenteral23. Además, aunque en todos los trabajos utilizan el fenotipo de fragilidad de Fried, la mayoría utilizan adaptaciones de los criterios originales21,23,24,26–28,31–36 y los estudios se han realizado en poblaciones de edades muy diversas lo que explica la variabilidad en los resultados de prevalencia de fragilidad y factores asociados y limita la posibilidad de comparar datos entre estudios y sacar conclusiones. En la tabla 1 se detalla toda la evidencia científica disponible hasta el momento sobre el estudio de la fragilidad en la población VIH+.
Estudios sobre fragilidad en la población con infección por VIH
| Cohorte (País) | Población Edad (media) | Total pacientes (pacientes VIH+) | Prevalencia de fragilidad | Diseño | Autor |
|---|---|---|---|---|---|
| MACS (EE. UU.) | HSH ≥ 18 años | 2150 (250) | Retrospectivo | Desquilbet L. 200721 | |
| 1045 (106) | Retrospectivo | Desquilbet L. 200927 | |||
| 596 (596) | 13,9% | Desquilbet L. 201128 | |||
| 1946 (898) | 28,6% | Prospectivo | Althoff KN. 201422 | ||
| FFA | |||||
| ALIVE (EE. UU.) | UDVP 48,7años | 1230 (357) | 14,6% | Prospectivo | Piggott DA. 201323 |
| FFA | Piggott DA. 201531 | ||||
| WIHS (EE. UU.) | Mujeres ≥14 (41 años) | 1781 (1206) | 9% | Prospectivo | Terzian AS. 200924 |
| FFA | |||||
| VACS (EE. UU.) | Hombres | 6515 (254) | 3,9% | FFA | Akgun KM. 201426 |
| 3,9% | |||||
| Modena HIV Metabolic Cohort (Italia) | General VIH+ 46 años | 2722 (2722) | Prospectivo | Guaraldi G. 201538 | |
| Índice de fragilidad | |||||
| Cohorte. Estudio transversal (EE. UU.) | General VIH+ 41,7 años | 445 (445) | 9% | Prospectivo | Onen NF. 200939 |
| FFA | |||||
| Cohorte. Estudio transversal (EE. UU.) | General HIV+ 50,8 años | 359 (359) | 7,5% | Prospective | Erlandson KM. 201233 |
| FFA | |||||
| Cohorte. Estudio transversal (EE. UU.) | General HIV+ ≥ 18 años | 100 (100) | 19% | Prospective | Ianas V. 201334 |
| FFA | |||||
| Casos-controles (Sudáfrica) | General VIH+/VIH- 41,1 años | 504 (248) | 19,4% | Casos-controles | Pathai S. 201335 |
| Prospectivo | |||||
| FFA | |||||
| Cohorte (EE. UU.) | General VIH+ 20-39 años y >50 años | 41 (41) | 17,1% | Estudio transversal | Sandkovsky U. 201336 |
| Prospectivo | |||||
| FFA | |||||
| Cohorte. Estudio transversal (EE. UU.) | General VIH+ 57 años | 156 (156) | 9% | Prospectivo | Greene M. 201540 |
| FFF | |||||
| Cohorte. Estudio transversal (España) | General VIH+ 61,3años | 117 (117) | 15,4% | Prospectivo | Brañas F. 201737 |
| FFF |
ALIVE: AIDS Linked to the Intravenous Experience Study; FFA: fenotipo de fragilidad de Fried adaptado; FFF: fenotipo de fragilidad de Fried; HSH: hombres que tienen sexo con hombres; MACS: Multicenter AIDS Cohort Study; UDVP: usuarios de drogas vía parenteral; VACS: The Veterans Aging Cohort Study; WIHS: The Women's Interagency HIV Study.
El primer estudio español y europeo sobre fragilidad y función física en los mayores con infección por VIH se ha publicado recientemente37. Se evaluaron 117 personas con edad igual o mayor a 55 años con infección por VIH, con seguimiento regular en las consultas de Infecciosas-VIH. Encontramos una prevalencia de fragilidad de 15,4%, el doble de lo descrito en los estudios más representativos de fragilidad en población general al menos 10 años mayor y 52,1% de prefrágiles. Presentar síntomas depresivos multiplicaba por 9 el riesgo de fragilidad y el cociente de linfocitos CD4/CD8 se asociaba de forma independiente e inversa con el riesgo de fragilidad.
Son necesarios más estudios que permitan definir mejor el fenotipo de fragilidad y su valor pronóstico independiente en este grupo poblacional tan específico.
ConclusiónLa población con infección por VIH está envejeciendo y lo hace además de forma precoz. La acción del VIH en el organismo persiste a pesar de un óptimo control inmunovirológico tras el tratamiento antirretroviral de gran actividad, generando cambios en el sistema inmune similares a los que produce el envejecimiento fisiológico. Las personas que viven con la infección por VIH son biológicamente más mayores de lo que sugiere su edad cronológica por lo que la edad aceptada para definir paciente mayor en la población VIH+ es la edad de 50 años. La fragilidad en este grupo poblacional se ha demostrado altamente prevalente. Por todo ello el escenario de la pandemia VIH/sida tiene que centrarse ya en un grupo creciente de pacientes mayores y en sus problemas de salud específicos –fragilidad, función física, síndromes geriátricos– más allá del control de la infección, el manejo de los fármacos y sus interacciones y el abordaje de la comorbilidad. Los geriatras debemos implicarnos en la atención a estos pacientes mayores especialmente complejos, trabajando en colaboración con los especialistas de VIH y aportando todo nuestro conocimiento de la complejidad y el abordaje global y holístico del paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.