INTRODUCCIÓN
Las teorías1-4 sobre las 2 cuestiones clave del proceso de envejecimiento, que son: a) las causas de este proceso, desde los puntos de vista molecular y de la evolución biológica, y b) los mecanismos que fijan un límite a la duración de la vida de los animales y de los sujetos humanos, surgen con el progreso de las ciencias experimentales que tuvo lugar en el siglo xix. Estas teorías gerontológicas ofrecen explicaciones parciales de los mecanismos del envejecimiento, y en cada época se centran en los aspectos de este proceso relacionados con los avances contemporáneos de la biología y de la medicina. Y, así, la actual investigación gerontológica incluye desde el análisis de las curvas de supervivencia de las poblaciones y la pérdida de rendimiento de los sistemas fisiológicos hasta un creciente interés en los mecanismos del control genético del envejecimiento y su relación con la longevidad.
En su revisión de 1990, afirma Medvedev5: «Hay más de 300 teorías del envejecimiento y el número sigue aumentando. Esto es la consecuencia natural del progreso muy rápido de nuestra comprensión de los fenómenos biológicos y de la aplicación a la investigación gerontológica de muchos enfoques y métodos nuevos. Casi cada descubrimiento importante en biología celular y molecular ha dado lugar a una nueva familia de teorías de envejecimiento, o nuevas versiones avanzadas de teorías más antiguas». También comenta que la tarea de revisar las teorías del envejecimiento se ha vuelto mucho más difícil y que un gran número de estas teorías son «muy selectivas» o están «anticuadas». Por otra parte, Vijg y Müller6 afirman que algunas antiguas hipótesis de los comienzos de la ciencia gerontólogica hicieron posible la gran revolución científica en nuestra comprensión del envejecimiento que ahora presenciamos. Estamos de acuerdo con estas opiniones y con la conclusión de Medvedev5 de que la expectativa de que surja una teoría «verdaderamente unificada», o de «causa única» del envejecimiento no es realista. Y se acepta generalmente que aún no disponemos de todas las piezas del puzzle del envejecimiento. No obstante, sí que creemos posible ofrecer soluciones preliminares a dicho puzle7-8 integrando varias teorías complementarias, clásicas (tabla 1) y modernas, que ofrecen explicaciones lógicas de los cambios que tienen lugar a los principales niveles de organización biológica.
Las teorías que revisamos, junto con una selección de datos que las apoyan (incluidos algunos de nuestro laboratorio obtenidos en Drosophila y ratón), se refieren al envejecimiento normal in vivo (caracterizado por la involución fisiológica) y no a las enfermedades asociadas al envejecimiento que pueden incluir uno o más síndromes degenerativos específicos.
DEFINICIÓN DEL ENVEJECIMIENTO NORMAL Y ESTUDIO DE SUS MECANISMOS DESDE EL PUNTO DE VISTA DEL «ANÁLISIS DE SISTEMAS»
Para definir el proceso de envejecimiento normal aún son relevantes los comentarios de Strehler9, de 1959, y sus observaciones posteriores10. Afirmaba este autor que los requisitos que debe tener un cambio ligado a la edad para ser considerado parte del envejecimiento natural (que considermos equivalente a normal, biológico o fisiológico) son los siguientes: a) universalidad; b) naturaleza intrínseca; c) carácter progresivo, y d) efectos perjudiciales. Así, las alteraciones características del envejecimiento natural deben ocurrir en todos los individuos de una especie en lugar de en casos aislados que podrían sufrir las consecuencias de accidentes o genotipos anormales. Además, el carácter intrínseco de los cambios se considera necesario para distinguir el envejecimiento natural de otras alteraciones que pueden surgir con el paso del tiempo a causa de factores nocivos del medio ambiente. Y el carácter progresivo del envejecimiento está de acuerdo con el concepto de que se trata de un proceso y no de un fenómeno repentino.
De acuerdo en lo fundamental con Strehler, el presente autor define al envejecimiento normal de los metazoos como «un proceso de desorganización gradual e irreversible que ocurre con el paso del tiempo, causa una pérdida progresiva de la capacidad bioenergética y el rendimiento funcional e imposibilita la supervivencia ilimitada de los sujetos humanos y miembros de otras especies de metazoos, incluso en un hábitat óptimo».
Puesto que el envejecimiento se acompaña de una gran variedad de procesos fisiopatológicos, ya hemos comentado anteriormente1 que conviene aplicar el método del análisis de sistemas11, que requiere, para revelar las relaciones causa/efecto en sistemas de gran complejidad, que los datos obtenidos en cada nivel de organización se contrasten con los datos obtenidos en los niveles superior e inferior. La aplicación de este método permite una prueba rigurosa de la validez de las teorías gerontológicas, pues los mecanismos que se proponen como causa del envejecimiento deben ser compatibles con las alteraciones que se encuentran en los metazoos viejos no sólo en el ámbito particularmente estudiado (tabla 2).
Teorías evolucionistas y genéticas
Según Strehler12, esencialmente el proceso del envejecimiento se debe comprender en el caso de cada especie como un resultado de la evolución en un sentido positivo o negativo. Por el contrario, Medawar13 opina que la muerte por envejecimiento ocurre tan tarde en comparación con la muerte por causas accidentales (como falta de alimento o predación) en el hábitat natural de las especies, que retrasar el envejecimiento (o incluso el evitarlo totalmente) tendría una influencia mínima en la supervivencia de la especie. Y, según Williams14, el envejecimiento es el resultado de unos genes que programan el máximo vigor, especialmente para la reproducción, pero que desencadenan con el paso del tiempo la degeneración de las células y los órganos.
En cuanto al problema inverso, o sea los efectos del envejecimiento sobre los genes, dado el papel fundamental del genoma nuclear (nADN), es lógico suponer que las alteraciones que ocurren en las células que envejecen podrían derivar de una inestabilidad de la información molecular que reside en dicho genoma. La idea básica de esta teoría genética del envejecimiento es que una mutación del nADN debe alterar la fidelidad de la síntesis de proteínas, con la consiguiente involución funcional. Esta teoría del envejecimiento se ha abandonado al no cumplirse su predicción de que el envejecimiento se debe acelerar en relación directa con el número de mutaciones causadas por las radiaciones ionizantes o sustancias mutagénicas9-10.
Por otra parte, Orgel15 propuso, en 1963, que el envejecimiento podría derivar de errores en los mecanismos de transcripción del ARN que llevarían a la síntesis de proteínas anormales (teoría del error catastrófico). Este concepto está en desacuerdo con los datos experimentales, incluidos algunos de nuestro laboratorio16, que sugieren que si el envejecimiento efectivamente se iniciara en el genoma nuclear, la alteración genética sería cuantitativa («agotamiento») en lugar de cualitativa («mutación»), ya que no aparecen proteínas anormales en los tejidos al envejecer.
Control genético de la longevidad y efecto del envejecimiento sobre los genes
Según la revisión de Benard y Hekimi17, el hecho de que la máxima duración de la vida puede variar considerablemente entre las diversas especies apoya el concepto de que la longevidad tiene una base genética. Además, la selección de cepas de Drosophila y ratón de distinta longevidad muestra que incluso dentro de esta especie puede haber grandes diferencias, genéticamente controladas, en la duración de la vida.
Actualmente, se utilizan las técnicas del análisis genético para aclarar el papel del nADN en el envejecimiento y sus alteraciones con la edad, y según se deduce de un estudio sobre los perfiles de expresión de los genes en el músculo de ratones viejos, sólo un 1,8% de los genes investigados muestran cambios en su expresión durante el envejecimiento18. Una técnica complementaria a la del análisis genético18,19, que está siendo objeto de numerosas publicaciones es la selección de mutantes longevos para facilitar la detección de «genes del envejecimiento». Esta técnica utiliza preferentemente al nematodo C. elegans, del que se han obtenido numerosos mutantes con una longevidad mayor que la normal17,20. No obstante, aunque se acepta que la comprensión del efecto de los genes sobre el proceso de envejecimiento puede avanzar gracias a un análisis de mutantes longevos, la identificación de los mecanismos específicos del aumento de la longevidad es muy difícil a causa de la complejidad de las redes de regulación genética, con sus numerosas interacciones, y los miles de genes implicados en cada tipo celular.
En resumen, los datos revisados sugieren que casi todos los organismos que, a causa de las mutaciones genéticas, aumentan su longevidad con respecto a la longevidad normal de los miembros de su especie, muestran otros cambios fenotípicos que son marcadamente nocivos, o sea que «el aumento de la duración de la vida se hace a costa de una disminución del rendimiento funcional y menor capacidad de supervivencia de los animales en su hábitat natural»17.
Por otra parte, como ya hemos señalado, los genes no parecen controlar directamente el proceso de envejecimiento sino indirectamente a traves de múltiples mecanismos protectores o destructores de la organización biológica inicial del organismo adulto21-23.
Es obvio que el creciente uso de las técnicas genéticas permitirá avanzar en la comprensión de las causas del envejecimiento y de los factores que controlan la longevidad, aunque los logros conseguidos aún son escasos. Hasta ahora sólo se han descubierto unos pocos genes implicados en el envejecimiento, sobre todo en el nematodo C. elegans y el insecto D. melanogaster, y aún no se ha demostrado que los datos obtenidos en estos organismos sean relevantes para comprender mejor el envejecimiento humano23.
Teorías fisiológicas
Según los datos obtenidos en sujetos humanos24, el envejecimiento se acompaña de una pérdida progresiva de rendimiento fisiológico y homeostasis y, por tanto, de una menor capacidad para responder a un estrés tanto interno como del medio ambiente, y de coordinación de las funciones del organismo. Esta pérdida de rendimiento funcional con el aumento de la edad también se ha observado en animales de experimentación, como es el caso de los ratones (en los que se aprecia un deterioro de los sistemas homeostáticos, es decir el neuroendocrino25-28 y el inmunitario29,30) así como de Drosophila (cuyo envejecimiento se acompaña de un descenso de su geotaxis negativa y capacidad reproductora1).
Dada la importancia que tienen los sistemas neuroendocrino e inmunitario en la regulación de todos los procesos fisiológicos11,12, no puede sorprender que la involución de estos dos sistemas haya atraido la atención de los proponentes de mecanismos causantes del envejecimiento28,31. Se atribuyó a las glándulas endocrinas y especialmente a las gónadas un papel clave en el envejecimiento, que justificaba los tratamientos «rejuvenecedores» de Brown-Sequard y Voronov, basados en la inyección de extractos de testículo y la implantación de estas glándulas, respectivamente32. También se han publicado numerosos trabajos sobre el envejecimiento del sistema neuroendocrino, al que se ha asignado un papel regulador del envejecimiento de todo el organismo. No obstante, según Hayflick33: «Igual que la teoría inmunológica, la teoría endocrina carece de universalidad. En primer lugar, no todos los organismos que envejecen tienen complejos sistemas neuroendocrinos. En segundo lugar, el déficit que ocurre en el sistema neuroendocrino al envejecer puede ser el resultado de alteraciones básicas que ocurren, por ejemplo, en el genoma de todas las células viejas. Por ello, no existe una razón para dar al sistema neuroendocrino o a cualquier otro sistema el papel de coordinador de las alteraciones por el envejecimiento. Todos los sistemas de órganos envejecen y, probablemente, a diferente velocidad. Una vez más tenemos que distinguir entre causa y efecto».
Teorías del «desgaste»
Los conceptos relacionados con la teoría del desgaste que sufren las células somáticas como «efecto secundario» de su trabajo fisiológico34,35 están de acuerdo con los datos obtenidos por Loeb y Northrop36 y Alpatov y Pearl37 en el poiquilotermo Drosophila melanogaster (confirmados por estudios de nuestro laboratorio38-40 que muestran que, en el rango de temperatura al que estos insectos están adaptados, la duración de su vida es inversamente proporcional a la temperatura ambiente).
Aunque se ha propuesto que reacciones de desnaturalización de las proteínas por el calor podrían estar implicadas en el envejecimiento acelerado de insectos y otros poiquilotermos mantenidos a temperaturas relativamente elevadas40, estas reacciones probablemente no tienen un papel importante en el envejecimiento a causa de sus altas energías de activación10. Además, como ya demostraron Loeb y Northrop36, la energía de activación del proceso de envejecimiento en Drosophila es más parecida a la de reacciones catalizadas por enzimas que a las que desnaturalizan las proteínas.
De acuerdo con lo anterior y con la teoría del rate-of-living, de Pearl35, nuestros estudios han confirmado que el efecto de los cambios en la temperatura ambiente sobre la longevidad de las Drosophila adultas se debe al efecto modulador de estos cambios sobre el consumo de oxígeno de este insecto (Miquel et al38,39) igual que ocurre con otros poiquilotermos. Además, el consumo de oxígeno in vivo por miligramo de peso corporal de Drosophila adulta tiene una relación inversa con la duración de la vida en distintas cepas de este insecto mantenidas a la misma temperatura de 25 ºC41. Y esta relación inversa entre metabolismo aerobio y longevidad también se observa en moscas Drosophila alojadas en satélites espaciales, en los que, a causa de la acción estresante de la ingravidez, realizan un vuelo desordenado que aumenta su consumo de oxígeno42. Los probables mecanismos por los que el consumo de oxígeno (con formación de radicales libres y consiguiente estrés oxidativo) influye en la longevidad y causa el envejecimiento celular se presentan seguidamente.
MECANISMOS DEL ENVEJECIMIENTO CELULAR
Conceptos de Weissman y Minot sobre el envejecimiento in vivo de las células germinales y las células somáticas diferenciadas terminalmente
De acuerdo con Weissman34, definir los mecanismos del envejecimiento celular es el principal objetivo de la investigación gerontológica. Por ello, el envejecimiento celular in vivo e in vitro ha sido objeto de intensa investigación.
Numerosos estudios demuestran la coexistencia en los tejidos animales de células diferenciadas, que envejecen (figs. 1 y 2), y células indiferenciadas que, al preservar su capacidad mitótica, pueden regenerarse durante el proceso de crecimiento y división celular y no muestran signos de envejecimiento morfológico, bioquímico o funcional (fig. 2). Ya en 1891 las diferencias entre estos dos tipos celulares inspiraron el siguiente comentario de Weissman34, que a pesar del tiempo transcurrido no ha perdido validez: «Consideremos qué sucedió para que los animales y las plantas multicelulares, que surgieron de las formas de vida unicelular e inmortal, perdieran su capacidad de vivir para siempre. La explicación deriva del principio de la división del trabajo que apareció en los organismos multicelulares en una temprana etapa evolucionaria y ha producido estructuras cada vez más complejas (...). Pronto las células somáticas sobrepasaron en número a las reproductoras y se subdividieron, a causa del principio de la división del trabajo, en sistemas de tejidos claramente diferenciados. Simultáneamente, se perdió el poder regenerador de partes considerables del organismo, mientras se concentraba en las células sexuales la capacidad de reproducir el organismo entero».
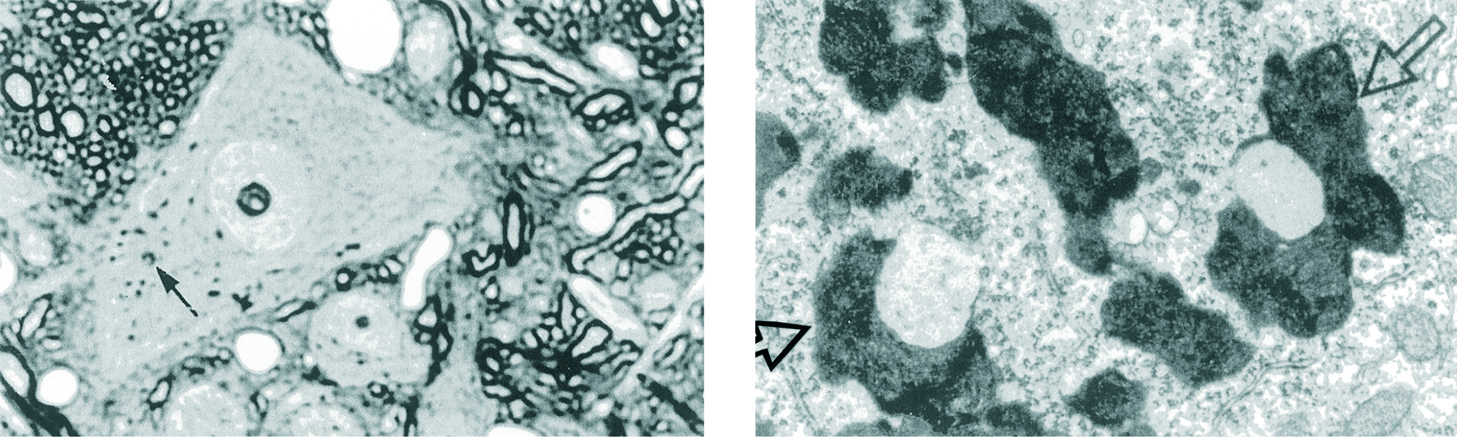
Figura 1.La acumulación de pigmento de envejecimiento (lipofuscina) en las células posmitóticas terminalmente diferenciadas es uno de los efectos más evidentes de la senescencia normal. Esto apoya los conceptos de Weissman y Minot sobre el contraste entre el envejecimiento de las células somáticas diferenciadas y la supervivencia de las células germinales indiferenciadas. Puesto que la mayoría del pigmento deriva de una degeneración autofágica de las mitocondrias que han sufrido estrés oxidativo, nuestros datos apoyan la teoría mitocondrial del envejecimiento. Izquierda: gránulos de lipofuscina (flechas) en una neurona del núcleo vestibular lateral del cerebro de una rata de 8 meses de edad. (x500). Derecha: estructura de la lipofuscina en una neurona piramidal del hipocampo de un ratón de 30 meses. Las flechas señalan 2 gránulos de pigmento que contienen gotas de grasa. (x22.000). (Modificado de Miquel3.)
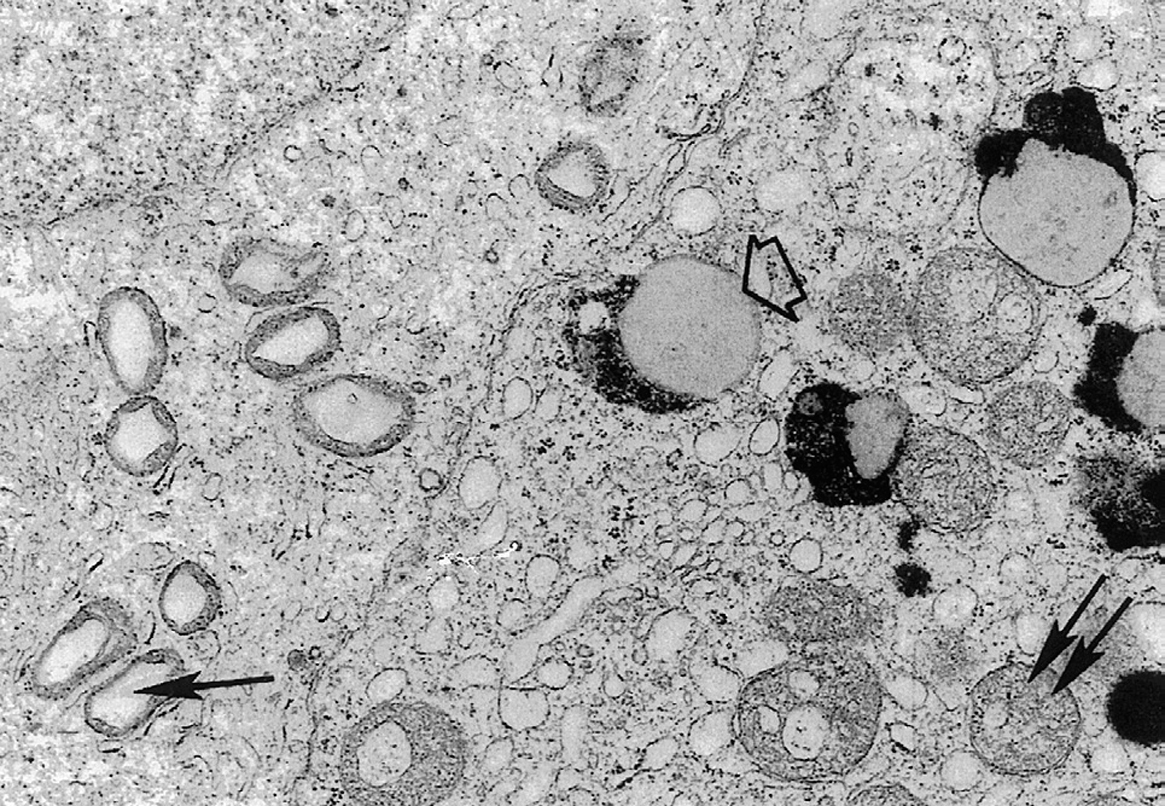
Figura 2.Esta microfotografía de testículo de ratón apoya la hipótesis que propone que los efectos desorganizadores de los radicales libres de oxígeno en las células están relacionados con el grado de diferenciación de dichas células. Así, en el testículo, nuestros datos muestran que con el paso del tiempo se desorganizan las células diferenciadas terminalmente (célula de Sertoli, a la derecha) mientras que no envejece la población de espermatogonios, que se renueva a través de su frecuente división celular. (Área citoplasmática de un espermatogonio, a la izquierda.) Las flechas finas señalan las mitocondrias en ambos tipos celulares y la flecha ancha un gránulo de lipofuscina similar a los que se muestran en la neurona de la figura 1. x17.000. (Modificado de Miquel et al1.)
Estas opiniones se complementan con el concepto propuesto por Minot43 en 1907 de que «el envejecimiento es el precio pagado por la diferenciación celular». Por ello, la investigación de los cambios que muestran las células diferenciadas con el paso del tiempo tiene un gran interés para la comprensión del proceso de envejecimiento, pues numerosos datos apoyan la hipótesis de que dicho proceso se asocia con la incapacidad de las células diferenciadas de contrarrestar con una eficacia del 100% el desorden que acumulan como consecuencia no programada de su actividad metabólica (fig. 2).
Teoría del límite mitótico de Hayflick
Según las observaciones de Moorhead y Hayflick44, los fibroblastos humanos mantenidos en cultivo pierden su capacidad mitótica tras aproximadamente 50 divisiones in vitro. La hipótesis inicial45 mantenía erróneamente que la pérdida de capacidad mitótica equivale a envejecimiento celular, y este malentendido pudo dificultar la definición de mecanismos del envejecimiento de las células, de aplicación general tanto en un medio de cultivo como en su hábitat normal en los tejidos de los metazoos. Así, según el prestigioso gerontólogo Bernard L. Strehler12, estos estudios sugieren que el simple paso del tiempo (aunque no haya división celular) reduce el número de mitosis posteriores que muestran las células. Por ello, concluye Strehler: «No existe ninguna razón para creer que el envejecimiento clonal o pérdida de capacidad mitótica es causa importante del envejecimiento del organismo ni de sus importantes poblaciones de células germinales, tales como las que proporcionan su capacidad regeneradora a la piel, el intestino y la médula ósea (...). No parece razonable que el límite de Hayflick se aplique a células normales en el cuerpo».
De acuerdo con estos comentarios, se acepta que los cultivos experimentan una diferenciación terminal in vitro similar a la que se observa en muchos tipos de células in vivo, como las células hematopoyéticas o los mioblastos. Los datos obtenidos por microscopia electrónica en nuestro laboratorio apoyan esta hipótesis, pues numerosos fibroblastos mantenidos en cultivo muestran fibras de colágeno y cilios, que son estructuras características de los fibroblastos diferenciados46. Además, se ha demostrado que la enzima respiratoria mitocondrial citocromo oxidasa aumenta su actividad específica en un 300% en los fibroblastos que «envejecen» in vitro47. Puesto que la biogénesis mitocondrial y la diferenciación celular in vivo también se acompañan de un marcado aumento de los valores de enzimas respiratorias, estos datos también apoyan la hipótesis de que las células dejan de dividirse porque se diferencian irreversiblemente. Por ello, es probable que, en vez de estudiar el envejecimiento, lo que a menudo se está investigando in vitro son los mecanismos de la diferenciación celular.
Papel de los telómeros y la telomerasa
Según se ha revisado anteriormente, los telómeros (secuencias repetidas de ADN presentes en los 2 extremos de los cromosomas) se acortan cada vez que una célula se divide, y este acortamiento «cuenta» el número de mitosis que ha experimentado una población celular48-50. Los telómeros protegen a los cromosomas y apoyan la transcripción exacta del ADN nuclear, y cuando se vuelven demasiado cortos para permitir una nueva división celular se observa el fin de la capacidad mitótica in vitro48. Por el contrario, las células inmortales se protegen contra el acortamiento de los telómeros gracias a la actividad de la telomerasa, que reemplaza las secuencias teloméricas perdidas. Así, manteniendo telómeros de tamaño constante se preserva la capacidad de división celular in vitro48,49, de acuerdo con la observación de que aumenta la longevidad de dichos cultivos si se introduce telomerasa en fibroblastos humanos mantenidos en cultivo51. Esto apoya la hipótesis de Dice52 de que un acortamiento excesivo de los telómeros bloquea la mitosis y desencadena el envejecimiento celular, probablemente precedido, según ya hemos comentado al revisar la teoría del límite de Hayflick, de un proceso de diferenciación in vitro.
En cuanto a la implicación de los telómeros y la telomerasa en el envejecimiento celular in vivo según Goyns50: a) en las células posmitóticas (de escasa o nula proliferación), los telómeros no se acortan significativamente durante la vida del animal; b) las células germinales (que proliferan con mucha frecuencia) muestran una gran actividad de telomerasa, que preserva su capacidad mitótica, y c) los fibroblastos, células epiteliales y otras células intermitóticas (que experimentan un número relativamente escaso de divisiones a lo largo de la vida en el organismo adulto) carecen de telomerasa, probablemente porque no la necesitan, ya que no llegan a agotar su capacidad mitótica in vivo.
Además, la telomerasa sí que puede tener un papel importante preservando la composición tisular y la función de ciertos sistemas, interviniendo especialmente en el envejecimiento de algunos tipos celulares del sistema inmunológico. Así, en la mayoría de las poblaciones de linfocitos se reactiva la telomerasa cuando son estimulados con mitógenos, lo que les permite activar las mitosis con el consiguiente aumento del número de linfocitos y preservación funcional53. Por otra parte, según Effros54, la imposibilidad de reactivar la telomerasa lleva a la senescencia a algunos tipos de linfocitos como las células T.
En resumen, a pesar del indudable interés de los telómeros y telomerasa en relación con los procesos normales de la mitosis y diferenciación celular55 y algunas alteraciones fisiopatológicas de dichos procesos, Carlson y Riley56 concluyen que no hay prueba de que las relaciones entre los telómeros y la mortalidad in vitro de las células en cultivo sean relevantes para comprender el envejecimiento del organismo, pues incluso en tejidos de alto turnover, los mamíferos no mueren como resultado del agotamiento de su potencial mitótico. Por ello, no parece justificado proponer una teoría general del envejecimiento normal basada en la acción de los telómeros y la telomerasa.
Muerte celular apoptótica
Según la reciente revisión de Zhang et al57, la apoptosis o muerte celular programada (a menudo inducida por glucocorticoides, estrés oxidativo y déficit de energía celular) ha sido implicada en la senescencia in vitro de fibroblastos, linfocitos T, células epiteliales y endoteliales, y neuronas.
En relación con el envejecimiento in vivo, ya que aparecen nuevas neuronas en el hipocampo de roedores, monos y sujetos humanos adultos58-60 mientras que el número de neuronas del hipocampo permanece aproximadamente constante a lo largo de la vida60, es probable que cierto número de neuronas mueran por apoptosis en el hipocampo así como en otras áreas del sistema nervioso. No obstante, aún no se ha valorado la repercusión funcional de esta pérdida de neuronas, y se acepta generalmente que el efecto más importante de la senescencia neuronal es la pérdida de conexiones sinápticas61.
En contraste con la escasa frecuencia de muerte apoptótica en las células que nunca se dividen en la edad adulta o lo hacen muy raramente, la apoptosis es un mecanismo esencial para evitar la acumulación de un exceso de células en las poblaciones celulares que proliferan a menudo. Aparentemente, si en los organismos viejos se observa un aumento del número de células apoptóticas en los tejidos que preservan la mitosis, esto puede ser beneficioso, pues al envejecer se acumulan células con lesiones genéticas, que conviene eliminar para prevenir las neoplasias62.
En resumen, los datos sugieren que si la producción de nuevas células a través de la mitosis normal equilibra la pérdida de células por apoptosis, la apoptosis tendrá un efecto positivo, pues se eliminarán células lesionadas (que pueden dar lugar a tumores) y el tejido continuará funcionando normalmente. En cambio, si la apoptosis se desequilibra aumentando con la edad, un exceso de actividad apoptótica no compensado por las mitosis, con la consiguiente disminución de la población celular, tendrá un efecto negativo sobre el rendimiento fisiológico63.
Teorías de los radicales libres (de Denham Harman) y de la «toxicidad residual» del oxígeno (de Rebeca Gerschman)
Estos 2 autores, trabajando independientemente en la Universidad de California, en Berkeley, publicaron en las décadas de los años cincuenta y sesenta una serie de trabajos que implicaban a los radicales libres del oxígeno (y su toxicidad) en el envejecimiento celular. En un artículo de 1956 Harman64 propuso que los radicales libres (fragmentos moleculares muy reactivos que pueden dar lugar a reacciones desorganizadoras) no sólo podían causar el envejecimiento sino también otros procesos degenerativos, como el cáncer, la arteriosclerosis, la amiloidosis y la inmunodeficiencia. Según Harman65, estos síndromes son el resultado de las reacciones nocivas de los radicales libres que tienen lugar contínuamente en las células y los tejidos, y Harman también propuso que la desorganización de las mitocondrias causada por los radicales libres podría ser «el reloj del envejecimiento».
Los conceptos similares de Rebeca Gerschman66 derivan de sus estudios sobre el efecto del oxígeno, es decir del hecho de que la acción nociva de la radiación ionizante aumenta en presencia del oxígeno, mientras que la falta de este gas tiene un efecto protector en las células irradiadas. No había una explicación satisfactoria para este fenómeno hasta que Rebeca Gerschman desarrolló una teoría general del envenenamiento por oxígeno, que mantiene que la toxicidad de este gas está ligada a un aumento en la concentración intracelular de radicales libres, igual que sucede en las células irradiadas. Esto la llevó a extrapolar que la toxicidad del oxígeno de la atmósfera causa el envejecimiento, debido a que las defensas antioxidantes del organismo no contarrestan exactamente el ataque oxidativo. Por lo tanto, «las oxidaciones incontroladas que derivan de una pequeña insuficiencia en el sistema de defensa antioxidante, podrían ser un factor crucial en el proceso del envejecimiento y en la duración de la vida».
Las teorías de Harman y Gerschman aportan una explicación razonable de ciertos cambios celulares que ocurren al envejecer, pero no resuelven dos problemas fundamentales: a) ¿por qué las células de los metazoos, a diferencia de los organismos unicelulares, son incapaces de protegerse eficazmente contra las lesiones causadas por los radicales libres?, y b) ¿por qué surgieron en el curso de la evolución biológica las células destinadas a envejecer?
Según comentaremos, nuestro concepto67 de que las ROS que se forman en las mitocondrias de las células diferenciadas de los metazoos lesionan su mtADN, con resultante pérdida de regeneración mitocondrial y descenso de la síntesis de adenosín trifosfato (ATP), puede ofrecer una respuesta lógica a estas preguntas.
Teoría integradora del «estrés oxidativo/lesión genética mitocondrial» del envejecimiento de las células diferenciadas
Esta teoría que integra en su denominación al agente agresor (ROS) y a la diana fundamental de la agresión (mtADN), y es compatible con los conceptos de Harman, Pearl, Minot y otras teorías clásicas, tiene su origen en los estudios de nuestro laboratorio, que fue el primero en demostrar que las células terminalmente diferenciadas de Drosophila acumulan al envejecer el resíduo de membranas oxidadas lipofuscina, igual que las neuronas de los sujetos humanos68. También demostramos la formación de lipofuscina (o pigmento del envejecimiento) en otro tipo de célula somática terminalmente diferenciada: la célula de Sertoli (fig. 2) de testículo de ratones viejos69. Estos datos, y nuestra observación de que la lipofuscina deriva de membranas mitocondriales oxidadas igual en los insectos que en los mamíferos, nos llevó a proponer en 1980 una teoría mitocondrial del envejecimiento67, incluida por Medvedev5 en su clásica revisión de 1999 en el grupo de «teorías que explican los cambios que ocurren a los niveles genético y celular». A diferencia del concepto inicial de Harman70, que proponía como un mecanismo fundamental del envejecimiento la desorganización de mitocondrias en toda clase de células (en desacuerdo con los datos de nuestro laboratorio), nuestro concepto especifica que la desorganización mitocondrial causante del envejecimiento sólo ocurre en las células somáticas diferenciadas (fig. 3).
Según la presentación inicial de esta teoría67, el envejecimiento está ligado a la desorganización por los radicales libres de oxígeno de las membranas y genoma de las mitocondrias de las células terminalmente diferenciadas. También señalábamos que las células que se dividen frecuentemente están protegidas contra el envejecimiento por su moderado consumo de oxígeno y la regeneración de las mitocondrias que acompaña a la mitosis. Por el contrario, las células posmitóticas fijas requieren un intenso metabolismo aerobio para sintetizar en la cadena respiratoria mitocondrial el abundante ATP que apoya su función especializada (con la consiguiente formación de altos niveles de radicales libres de oxígeno) y además han perdido la capacidad de renovar sus orgánulos a través de los procesos de crecimiento celular y mitosis.
También comentábamos67 que, como el mtADN es necesario para el mantenimiento de la población mitocondrial, las lesiones oxidativas de dicho genoma pueden bloquear el turnover mitocondrial, sentando así las bases para una progresiva desorganización oxidativa de los lípidos y proteínas de las membranas mitocondriales. Este proceso lleva a la digestión autofágica de las mitocondrias, con la consiguiente disminución en la síntesis de ATP y de las proteínas necesarias para el trabajo celular especializado y acumulación de pigmento del envejecimiento (fig. 3).
En versiones posteriores de nuestra teoría7,8,71-73 nos hemos centrado en los mecanismos genéticos del envejecimiento, comentando que, a causa del entorno oxidativo/mutagénico y relativa falta de protección del genoma mitocondrial de las células diferenciadas, este genoma es más vulnerable al ataque oxidativo que el genoma nuclear, pues está situado cerca de los lugares de intensa producción de ROS en la cadena respiratoria y carece de la protección por histonas y de mecanismos de reparación eficaces. Por ello, las mitocondrias de estas células sufren con el paso del tiempo mutaciones u otros cambios que impiden su regeneración con el consiguiente descenso de rendimiento bioenergético y función celular. Y en niveles más altos de organización biológica tiene lugar un descenso de la capacidad funcional de los órganos, sistemas fisiológicos y organismos, que podría ser frenado mediante la suplementacion de la dieta con antioxidantes eficaces a nivel mitocondrial73.
Conceptos similares sobre el papel de las mitocondrias en el envejecimiento han sido publicados por numerosos autores que incluyen a Richter74, Linnane et al75, Trounce et al76, y Kowald y Kirkwood77.
Correspondencia: Dr. J. Miquel.
Departamento de Biotecnología. Universidad de Alicante.
Marqués de Campo, 66. 03700 Denia. Alicante. España.
Correo electrónico: kiri_miquel@yahoo.com
Recibido el 22-06-05: aceptado el 4-07-05.