El deterioro biológico asociado al envejecimiento favorece el deterioro del sistema inmunitario y, en consecuencia, el aumento en la incidencia y prevalencia de enfermedades infecciosas y afecciones oncológicas, además de la escasa respuesta a las vacunas. Entre todos los tipos celulares que componen el sistema inmunitario, los linfocitos T parecen acumular una mayor cantidad de defectos asociados a la edad. Dado que los linfocitos T maduran en el timo, y este sufre un acusado proceso de atrofia asociado a la edad, la involución del timo ha sido propuesta como el desencadenante inicial del deterioro que experimenta la inmunidad. Durante tiempo se ha asumido que el timo fijaba el repertorio de linfocitos T durante la infancia tras lo cual comenzaba a atrofiarse y llegaba al anciano como un vestigio evolutivo sin función. Sin embargo, un creciente cuerpo de conocimiento apunta hacia un timo funcional durante toda la edad adulta. En el anciano, una mayor función tímica se asocia a un sistema inmune más joven y mejor preservado, mientras que el fallo tímico se asocia a la mortalidad. Por lo tanto, toda nueva estrategia que pretenda mejorar la calidad de vida en el anciano, especialmente si la misma incide en el sistema inmunitario, deberá tener en cuenta, además de la homeostasis periférica, la funcionalidad del timo como una pieza clave para poder hacer más lento el deterioro asociado a la edad.
Age-related biological deterioration also includes immune system deterioration and, in consequence, a rise in the incidence and prevalence of infections and cancers, as well as low responses to vaccination strategies. Out of all immune cell subsets, T-lymphocytes seem to be involved in most of the age-related defects. Since T-lymphocytes mature during their passage through the thymus, and the thymus shows an age-related process of atrophy, thymic regression has been proposed as the triggering event of this immune deterioration in elderly people. Historically, it has been accepted that the young thymus sets the T-lymphocyte repertoire during the childhood, whereupon atrophy begins until the elderly thymus is a non-functional evolutionary trace. However, a rising body of knowledge points toward the thymus functioning during adulthood. In the elderly, higher thymic function is associated with a younger immune system, while thymic function failure is associated with all-cause mortality. Therefore, any new strategy focused on the improvement of the elderly quality of life, especially those trying to influence the immune system, should take into account, together with peripheral homeostasis, thymus function as a key element in slowing down age-related decline.
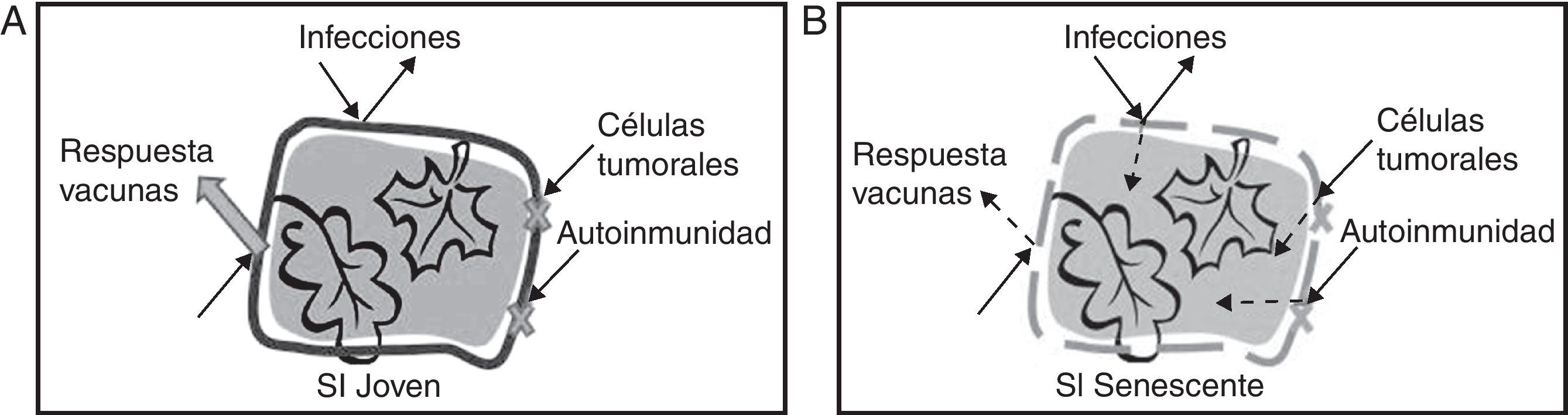
Con el envejecimiento disminuye la capacidad de adaptación y de respuesta a agentes lesivos de las células, los órganos y los sistemas. El sistema inmunitario, como cualquier otro sistema del organismo humano, también envejece. Al avanzar la edad sufre una serie de cambios que, más allá de disminuir la funcionalidad de los diferentes componentes, produce una restructuración del sistema inmunitario cuyos efectos se engloban en el concepto de «inmunosenescencia». Esta inmunosenescencia, con una clara relevancia debido al envejecimiento progresivo de la población global, se manifiesta clínicamente en el aumento de morbilidad y mortalidad derivadas de enfermedades infecciosas, afecciones oncológicas y, probablemente, enfermedades autoinmunes1,2 (fig. 1). Pese a ser todavía muy controvertido, el paradójico aumento de las enfermedades autoinmunes podría deberse a la suma de mecanismos centrales, como la pérdida de la diversidad de TCR debida al fallo tímico3–5, y mecanismos periféricos, al fallar la coestimulación de células T6,7. Además, la falta de respuesta a las vacunas, un problema de creciente interés para la medicina geriátrica, también se ha asociado a debilidad inmunológica debida al envejecimiento8,9. Tanto la respuesta inmunitaria innata como la adaptativa se ven alteradas en la inmunosenescencia. Sin embargo, el mayor número de alteraciones y fallos han sido descritos en los linfocitos T (LT).
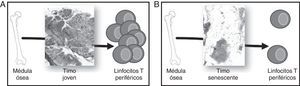
Relevancia clínica de la inmunosenescencia. A) Un sistema inmune (SI) joven es capaz de responder a diversos patógenos además de controlar las células tumorales y la autoinmunidad. La inmunización por vacunas genera una fuerte respuesta que protege eficazmente frente a nuevas infecciones. B) Un SI inmune senescente responde de forma ineficaz a nuevas infecciones y, además, la respuesta a la vacuna se ve en gran parte atenuada. Las células tumorales escapan de su control con mayor facilidad y se incrementan los procesos autoinmunes.
El timo es el órgano en el que maduran los LT y, por lo tanto, es uno de los principales órganos implicados en la generación y mantenimiento del sistema inmunitario10. Los complejos procedimientos de maduración que se llevan a cabo en el timo aseguran la generación de LT funcionales no auto-reactivos. La función tímica es máxima en los primeros meses de vida, tras lo cual comienza una proceso de atrofia que disminuye enormemente la generación de LT de novo11,12. El descenso en la función del timo supone una disminución gradual del aporte de nuevos LT a sangre periférica y se postula como el principal desencadenante (o, por lo menos, como el desencadenante inicial) de la inmunosenescencia11,13. No hace tanto tiempo se asumía que el repertorio de LT se fijaba durante la infancia y el timo no era necesario ni funcional durante la edad adulta. En consecuencia, la mayoría de los trabajos que tratan de «rejuvenecer» el sistema inmunitario se han centrado en identificar y revertir los defectos que los LT muestran en sangre periférica.
Durante la década de los 90, estudios centrados en escenarios clínicos de linfopenia14–16 mostraron que los timos adultos eran capaces de incrementar su funcionalidad para compensar la pérdida de LT periféricos en afecciones tan divergentes como la reconstitución inmunológica tras la quimioterapia14 o la infección por el virus de la inmunodeficiencia humana (VIH)15,16. Estos resultados despertaron un renovado interés en la funcionalidad del timo adulto y sus implicaciones clínicas. Rejuveneciendo el timo, principal desencadenante de la inmunosenescencia a nivel periférico, podría atenuarse la fragilidad del sistema inmunitario durante más tiempo, lo que incidiría positivamente en la calidad de vida de las personas mayores. Así, el objetivo de esta revisión es proporcionar una visión general sobre la función e involución del timo y profundizar en las alteraciones del sistema inmunitario asociadas a la ausencia de aporte tímico.
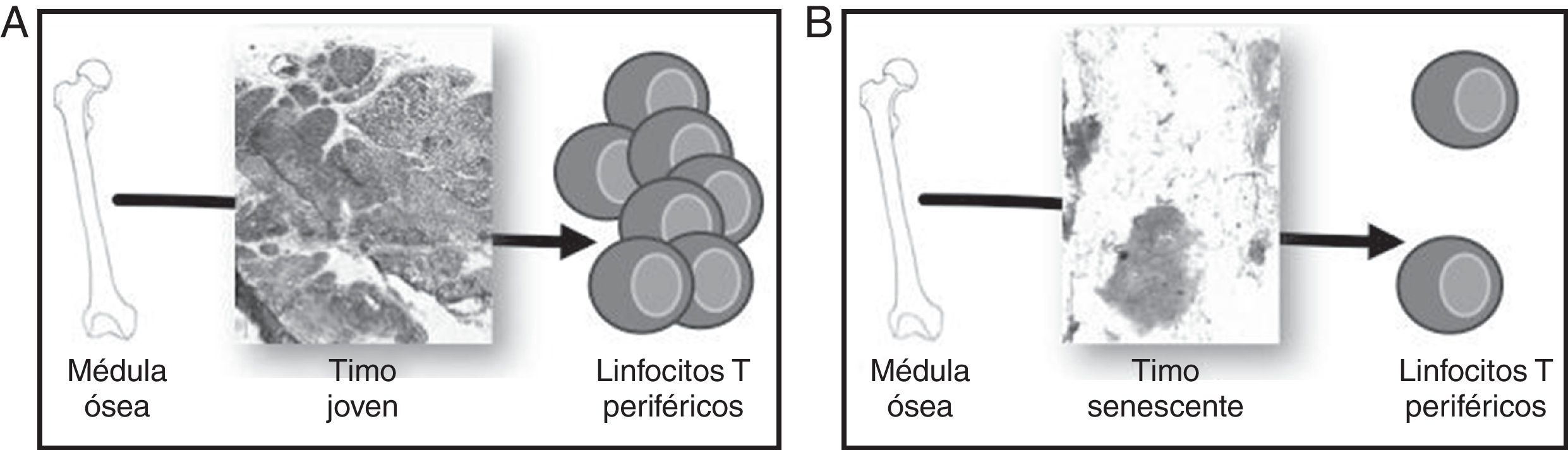
Desarrollo y función del timoDurante la época fetal el timo se forma como un órgano linfoepitelial que será colonizado por células madre hematopoyéticas multipotenciales derivadas de la médula ósea. Estos precursores maduran bajo la influencia de las células epiteliales del timo (TEC) y serán liberados a la periferia como LT vírgenes (sin experiencia de antígeno) completamente funcionales (fig. 2A).
Involución del timo y generación de linfocitos T (LT) periféricos. Los precursores hematopoyéticos migran de médula ósea y colonizan el timo, donde se comprometen con el linaje T, maduran y finalmente son vertidos a sangre periférica. A) Un timo joven, con un gran porcentaje de epitelio timico (TES) es capaz de madurar un alto número de LT. B) Un timo senescente, con el TES atrofiado, solo puede madurar LT en los islotes linfoepiteliales, por lo que su aporte timico se ve en gran parte disminuido.
Gracias al riguroso control del proceso de maduración intratímica (selección positiva y negativa) se asegura que el brazo adaptativo del sistema inmunitario sea capaz de generar una respuesta eficaz ante patógenos y tumores, evitando la autoinmunidad y controlando el desarrollo canceroso. Para conseguirlo, cerca del 99% de los precursores que colonizan el timo serán catalogados como «no satisfactorios» según los estrictos criterios necesarios para circular sin riesgo por sangre periférica. Estos LT «peligrosos» activarán programas de muerte celular y nunca saldrán del timo. Sin embargo, pese a lo estricto de su selección, el sistema inmunitario humano está compuesto por un repertorio de, aproximadamente, 109 LT con diferentes especificidades. Para poder conseguirlo, durante las primeras etapas de la vida el timo tiene una tasa muy elevada de mitosis y muerte celular. Desde un punto de vista evolutivo, la involución del timo ha sido propuesto como un método de ahorro para disminuir el alto gasto energético que esta tasa de división y muerte celular suponen y que no puede ser mantenido de forma rentable a lo largo de la vida17,18.
Fallo tímico asociado a la edadEl timo comienza a ser funcional ya durante el desarrollo embrionario, pero su actividad es máxima tras el nacimiento. En un timo joven los timocitos se condensan en la periferia de cada lobulillo tímico, mientras que el centro está solo ligeramente poblado. El córtex y la médula, que quedan así delimitados sin necesidad de barreras anatómicas, componen el «espacio epitelial verdadero» (TES, por sus siglas en inglés) donde la timopoyesis se hace efectiva. En el timo humano existe, además, una parte estromal no timopoyética conocida como espacio perivascular (PVS).
El timo sufre un proceso de atrofia que comienza en el primer año de vida12 y se acelera por los cambios hormonales sufridos en la pubertad11. En este proceso involutivo el PVS (adipocitos, linfocitos de sangre periférica y estroma) aumenta, mientras disminuye notablemente la cantidad de TES. La pérdida de TES (que puede llegar a ser inferior al 10% en un timo anciano) y la pérdida de la estructura córtex/medula en el TES que permanece provocan que el proceso de timopoyesis disminuya su eficiencia. El porcentaje de timocitos doble positivos (DP, marcador de funcionalidad del timo) desciende y la reordenación del receptor de células T (TCR) se dificulta19. Además, el tejido linfoide disminuye inexorablemente, perdiéndose un 3% anual entre los 35 y los 45 años de vida y un 1% anual a partir de esta edad20,21. En consecuencia, en los timos ancianos se observa PVS totalmente infiltrado de tejido adiposo, y la timopoyesis solo puede ser llevada a cabo en los islotes linfoepiteliales que se han quedado8. Las grandes diferencias histológicas entre el timo joven y el timo anciano se muestran en la figura 2.
La principal consecuencia de la atrofia es la reducción en el aporte tímico a sangre periférica. Por este motivo durante mucho tiempo se asumió que el repertorio de los LT quedaba fijado durante la niñez y un timo funcional no era necesario para el adulto. Bajo está hipótesis, la senescencia inmunológica (su alcance, la edad en la que aparece, sus manifestaciones clínicas) depende exclusivamente de la homeostasis periférica. Sin embargo, la información que se discute más adelante apoya la relevancia del timo en la edad adulta, proporcionándonos una diana principal para desarrollar estrategias que puedan mejorar la calidad de vida del paciente geriátrico.
Disminución de la función tímica tras la cirugía cardíaca: implicaciones clínicasTimectomía neonatal: enfermedad cardíaca congénitaLas enfermedades cardíacas congénitas (CHD) engloban defectos septales, defectos obstructivos en el corazón o los grandes vasos y anormalidades complejas. La prevalencia en la población general se estima en el 1% de todos los nacidos vivos22. Esta frecuencia puede incrementar hasta el 4% de los partos de mujeres que han sido diagnosticadas con CHD durante la infancia. Los casos con gravedad media normalmente necesitan poco o ningún tratamiento, pero la formas mortales requieren cirugía invasiva para garantizar la supervivencia de los pacientes.
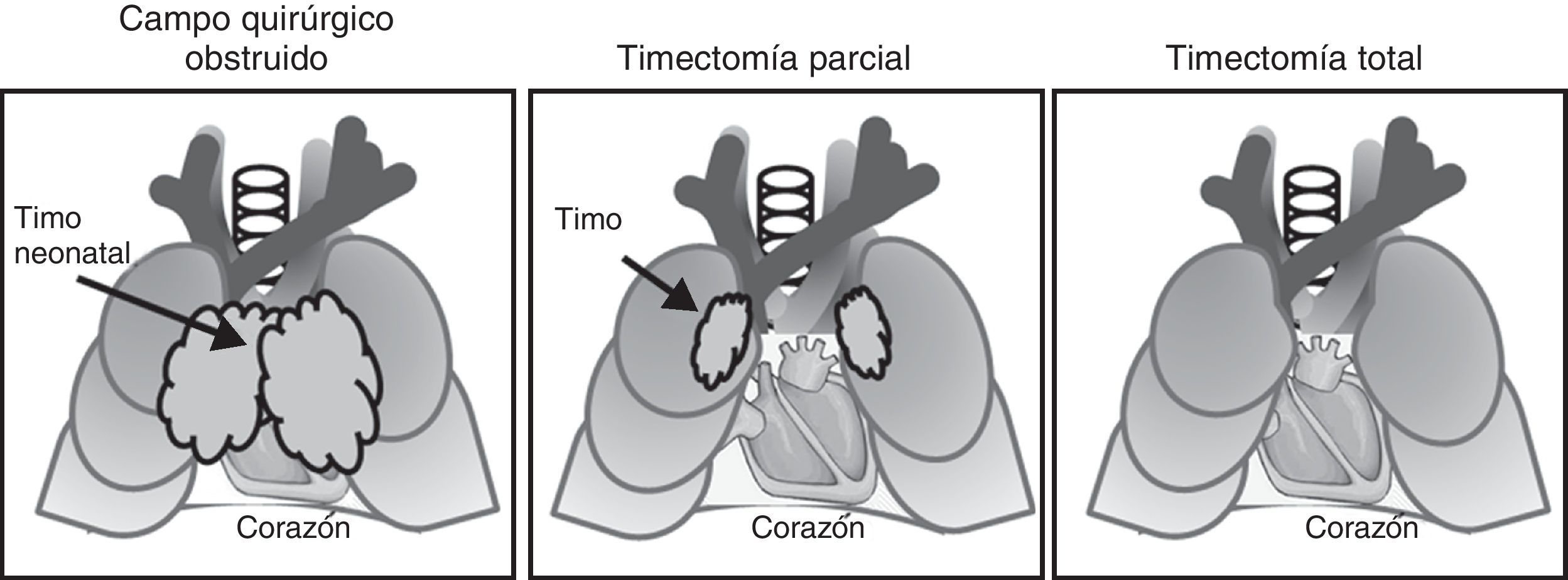
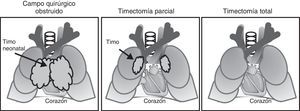
Como puede observarse en la figura 3 el timo está situado en el mediastino anterior, detrás del esternón, en frente del corazón y los grandes vasos y, por lo tanto, en el campo quirúrgico de la cirugía a corazón abierto. Durante estos procedimientos el campo quirúrgico debe ser despejado y el timo se extrae, total o parcialmente, de forma rutinaria. Desde que se iniciaron en España, hace ya 40 años, los procesos de cirugía neonatal para corregir trastornos CHD son cada vez más habituales y, en consecuencia, la timectomía se ha convertido en una práctica habitual. Hasta el momento no hay descrita ninguna consecuencia clínica a corto plazo de la timectomía de neonatos.
Diferentes estudios transversales y longitudinales han estudiado el potencial fallo inmunológico de los niños timectomizados. A pesar de que los datos son todavía escasos y la metodología heterogénea, se han descrito numerosas alteraciones periféricas en las subpoblaciones de LT CD4 y CD8. Durante el primer año postimectomía se ha observado una disminución en los niveles de LT23,24. A medio plazo (de uno a cinco años poscirugía) los niveles LT periféricos siguen siendo bajos25,26 sugiriendo que la homeostasis periférica no es suficiente para mantener unos niveles normales de LT en ausencia de función tímica, al menos en este escenario clínico. A medio plazo también se ha descrito la disminución de los niveles de sjTRECs127 (círculos de escisión de la señal de unión del receptor de células T) y la pérdida de diversidad del TCR28. Los sjTRECs, moléculas de ADN circular que solo se generan durante la maduración tímica y pueden cuantificarse en sangre periférica, se han utilizado históricamente como marcadores indirectos de función tímica. Actualmente, los sjTRECs se consideran como marcadores de dilución periférica, por lo que los niveles bajos tras la timectomía podrían estar reflejando alteraciones en la homeostasis periférica más que un fallo tímico persistente. Así, la dinámica tímica tras la cirugía neonatal (especialmente tras la timectomía parcial y en los potenciales casos de regeneración del tejido) todavía es desconocida y debe ser reevaluada con nuevas herramientas que nos den una visión clara de la cinética del aporte tímico en este escenario clínico.
Respecto a los efectos a largo plazo (más de cinco años poscirugía) hay que indicar que persisten los bajos niveles de LT y de sjTRECs. Algunos estudios apuntan hacia una normalización tras 20-30 años29, mientras otros describen que las alteraciones se mantienen a lo largo de la vida30. Estas diferencias podrían estar poniendo de manifiesto diferencias constitutivas entre las cohortes o diferencias en el potencial de regeneración del tejido tímico dependiendo de la edad a la que se realizó la timectomía31. Además de las alteraciones en los LT, también se han descrito alteraciones generales del sistema inmunitario a nivel periférico como la disminución de los niveles de LT vírgenes, aumento en la biodisponibilidad de IL-7, respuestas Th2 alteradas, aumento en el número de neutrófilos y bajo número de plaquetas pese a los niveles normales de linfocitos B y células NK30,32. Además, los individuos que han sido timectomizados tras el nacimiento muestran alteraciones inmunológicas definitorias de fragilidad inmune en el anciano: mayor tasa de proliferación de LT vírgenes, fuertes respuestas oligoclonales frente a citomegalovirus (CMV), LT que expresan el marcador de agotamiento CD57, biomarcadores de inflamación y menor capacidad de respuesta a vacunas (nuevos antígenos) pese a una respuesta memoria conservada33,34.
Una conclusión tranquilizadora que puede extraerse de estos estudios es que no existen consecuencias clínicas tras 20-30 postimectomía. Este resultado puede ser explicado parcialmente por la regeneración del timo tras una resección parcial de la glándula y/o por la restauración del sistema inmunitario durante la edad adulta. Sin embargo, esto niños timectomizados están creciendo con un sistema inmunitario especialmente frágil, prematuramente envejecido, en el que se observan numerosas alteraciones. Estos resultados sugieren que la timectomía temprana sí podría tener consecuencias cuando la inmunosenescencia prematura se una al deterioro general del organismo propio de la edad, pero esta hipótesis deber ser comprobada.
Timectomía en el adulto: cirugía a corazón abiertoLa cardiopatía isquémica y la sustitución valvular son procedimientos a corazón abierto habituales donde la timectomía, para conseguir un campo quirúrgico sin restricciones, se realiza a cualquier edad. En este escenario clínico diversos factores deberían ser tenidos en cuenta. Lo primero que se debería considerar es que la función tímica parece tener una implicación directa en la supervivencia del anciano35. Este punto será discutido con detalle más adelante. Además, también hay que tener en cuenta que el sistema inmunitario del adulto y el anciano, en el momento de la intervención y, por lo tanto, de la timectomía, ya presentan el agotamiento y la fragilidad propios de su edad1,2. Todos aquellos defectos descritos en los niños operados se añadirán a un sistema inmunitario previamente envejecido. Sin embargo, las consecuencias clínicas de esta agresión no han sido estudiadas. Analizar las comorbilidades asociadas a una cohorte anciana con importantes complicaciones cardíacas no es fácil, pero es necesario que se realicen futuros estudios para determinar el potencial efecto de la timectomía en las tasas de recuperación y supervivencia de individuos adultos y ancianos que necesitan cirugía a corazón abierto.
Función tímica y supervivencia en el anciano sanoLa involución del timo, que comienza tras el nacimiento, se acepta como el desencadenante inicial de la fragilidad inmunológica asociada a la edad, o inmunosenescencia que se observa en el anciano11,13. Pese a la relevancia clínica de la inmunosenescencia (falta de respuesta a las vacunas, aumento en enfermedades infecciosas e incluso aumento de la afección oncológica), durante mucho tiempo se ha asumido que la funcionalidad del timo adulto era insignificante y que, en consecuencia, el repertorio de LT se fijaba durante el primer año de vida. En línea con esta asunción, la investigación sobre el timo adulto ha sido escasa. Pese a ello, estudios centrados en diferentes escenarios de linfopenia clínica han mostrado que el timo adulto no solo es funcional sino que es capaz de incrementar su función para acelerar la reconstitución inmunológica de los sujetos cuyo sistema inmunitario se ve afectado por la quimioterapia14 o por el VIH15,16. Estos estudios apuntaban hacia una potencial funcionalidad del timo adulto y han incrementado enormemente durante la última década el interés hacia el estudio de la función tímica en diversos escenarios. Posteriores estudios mostraron que los timocitos preservados en los islotes linfoepiteliales de timos ancianos mantienen la misma capacidad para generar LT maduros que los timocitos obtenidos de tejido joven31. Esto sugiere que es la desestructuración del epitelio tímico la que impide la maduración de la parte linfopoyética preservada, por lo que aquellos islotes linfoepiteliales que mantienen la arquitectura tímica son capaces de generar LT maduros y funcionales, independientemente de la edad del sujeto.
Una vez demostrado que el timo adulto era capaz de generar nuevos LT, el problema era determinar si la cantidad de linfocitos vírgenes maduros que se generaban en el adulto y/o el anciano eran suficientes como para tener un impacto directo sobre la población periférica de LT. En esta línea, nuestro grupo de investigación ha demostrado que en la población anciana aparece una gran heterogeneidad en la función tímica36. En nuestra cohorte la mediana de función tímica disminuye al aumentar la edad de los individuos analizados, pero se pudo observar fallo tímico en sujetos con una edad de 51-60 años (≈20%), y alta función tímica en ciertos sujetos con edades superiores a los 71 años (≈25%). Además, una mayor función tímica estaba asociada a un menor estado inflamatorio y a un sistema inmunitario periférico más preservado. Por lo tanto, el timo en el anciano tiene un impacto directo sobre la periférica y actúa manteniendo la estabilidad, «rejuveneciendo», a la población periférica de LT vírgenes36. Por otra parte, aquellos ancianos con menor función tímica mostraban importantes alteraciones en todas las subpoblaciones de LT periféricos, incluyendo agotamiento y acortamiento telomérico de las células vírgenes37. Esto indica que un fallo tímico no solo induce fragilidad inmunológica al comprometer las células memoria, sino que la respuesta a nuevos antígenos también puede estar afectada.
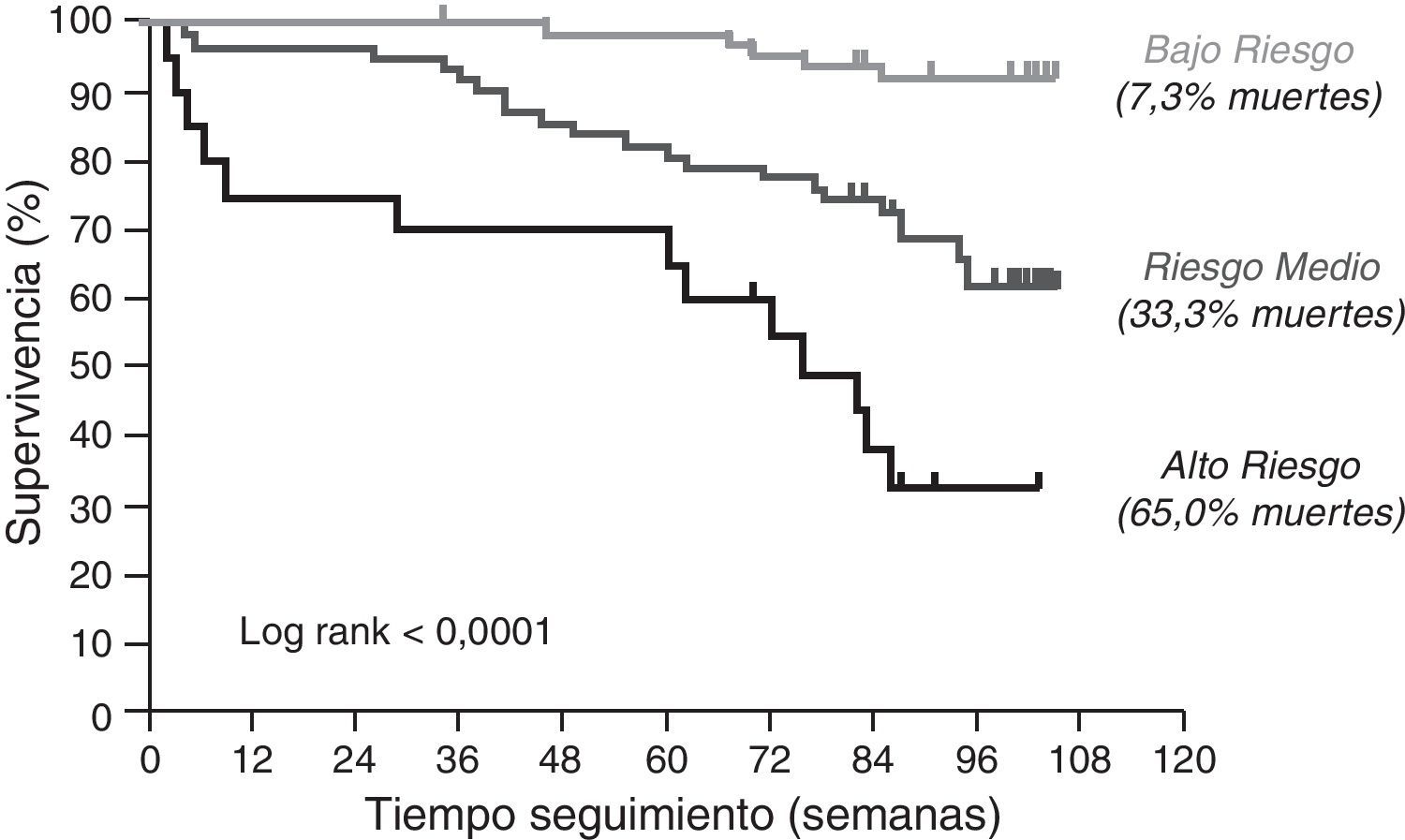
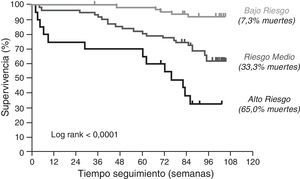
En conjunto, estos datos sugieren que la función tímica es un factor importante en la supervivencia del anciano. Para profundizar en esta hipótesis realizamos un estudio de supervivencia en individuos ancianos sanos en el área sanitaria del Aljarafe (Sevilla)35. En este trabajo analizamos si la función tímica (medida por la relación entre sj/B-TRECs, técnica de vanguardia para determinar indirectamente la aportación del timo38,39 y los marcadores de inflamación se asociaban a la mortalidad por cualquier origen. De la cohorte CARRERITAS (voluntarios mayores de 50 años) se seleccionaron 151 sujetos, todos ellos mayores de 65 años que cumplían unos estrictos criterios de exclusión para asegurar que era una cohorte «sana». Los criterios de exclusión fueron: no presentar demencia ni ninguna de las siguientes situaciones en los seis meses anteriores a la toma de la muestra: 1) datos clínicos de infecciones activas; 2) admisión hospitalaria; 3) tratamiento antitumoral; y 4) cualquier tratamiento que pueda influir en el estado de su sistema inmunitario (en esta población esto se focaliza principalmente a la utilización de corticosteroides). En esta cohorte se determinó, en el punto basal, la edad, el género, la relación de LT CD4:CD8 –cuya inversión se había relacionado previamente con mortalidad40 – la función tímica, la presencia de neutrofilia no explicable por parámetros clínicos36, los niveles plasmáticos de interleucina (IL)-6 y proteína C reactiva (PCR). Tras 2 años se observó la tasa de mortalidad por cualquier causa. Nuestros resultados mostraron que solo el descenso de función tímica y el aumento de PCR se asociaban independientemente a mortalidad en individuos sanos mayores de 65 años, incluso considerando la edad en todo momento como un factor de confusión crítico (fig. 4). Con este trabajo se determinó, por primera vez, que la función tímica en el anciano tiene un papel directo sobre la supervivencia, argumentando fuertemente en contra de la hipótesis que supone la glándula tímica adulta como un vestigio evolutivo.
Función tímica y supervivencia. Los sujetos fueron clasificados, según los valores basales de función tímica y de proteína C reactiva (PCR), en diferentes grupos de riesgos. La supervivencia fue significativamente diferente entre los grupos. Bajo riesgo = timo activo y PCR<15mg/l; riesgo medio = fallo tímico o PCR>15mg/l; alto riesgo = fallo tímico y PCR>15mg/l.
Hasta el momento, pese a la relevancia clínica de las actuaciones en geriatría, no existen estudios centrados en incrementar la función tímica en ancianos. Sin embargo, el fallo tímico puede comprometer otras actuaciones clínicas importantes como el trasplante de médula ósea, donde la reconstitución inmunológica completa necesita que el timo genere un repertorio adecuado en células T. En este escenario, durante la última década se han considerado diferentes estrategias terapéuticas prometedoras encaminadas a mejorar las deficiencias inmunológicas postrasplante41. Los tratamientos analizados incluyen la administración de factores de crecimiento42,43, esteroides sexuales44, transferencia adoptiva de precursores de células T generados in vitro e incluso la generación in vitro del tejido estromal tímico para después ser trasplantado45,46. Estas aproximaciones, hasta el momento estudiadas en modelos animales, podrían ser exploradas en un futuro a los diferentes escenarios de fallo tímico en humanos.
ConclusionesEn conclusión, a pesar de que la Inmunología, la Gerontología y los estudios centrados en las enfermedades infecciosas han infravalorado la relevancia de la función tímica en el adulto, estudios recientes han mostrado la importancia de mantener el timo funcionando en las últimas épocas de la vida. El timo adulto y anciano es funcional e impacta tanto en el sistema inmunitario periférico –retardando las alteraciones asociadas a la edad en las subpoblaciones de LT– como en la supervivencia del anciano. En conjunto, es crítico identificar claramente los efectores y vías por los que el timo sufre el proceso de atrofia para identificar diana capaces de enlentecer, o incluso revertir, la pérdida de aporte tímico asociada a la edad. La mejora en la respuesta a vacunas y en el pronóstico de las enfermedades infecciosas; el retraso en la aparición de enfermedades oncológicas y autoinmunes o incluso la prevención de enfermedades cardiovasculares (controlando la inflamación sistémica mediante la normalización del sistema inmunitario), son algunos de los importantes beneficios que podrían derivarse de aquellas estrategias futuras que permitan mantener y/o incrementar la funcionalidad del timo tanto en adultos como en ancianos. Por lo tanto, cualquier estrategia innovadora cuyo objetivo sea incrementar la «health span» (tiempo que vivimos con la mejor salud posible) en personas mayores, debería tener en cuenta el hecho de poder mantener o restablecer la función del timo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores quieren agradecer a las Redes de Investigación del Instituto de Salud Carlos III (ISCIII RETICS) la participación y financiación. En este trabajo participan la Red temática de investigación cooperativa en envejecimiento y fragilidad (RETICEF RD06/0013/003; RD06/0013/001; RD12/0043/0018 y RD12/0043/0012) y la Red de investigación en SIDA (RIS RD06/0006/0021; RD06/006/0035; RD12/0017/0037 y RD12/0017/0029). SFM tiene un contrato «Sara Borrell» del Fondo de Investigaciones Sanitarias (CD10/00382).
Los sjTRECs (signal-joint T cell Receptor Excision Circles) son fragmentos circulares y estables de ADN generados en la maduración intratímica. Al ser generados exclusivamente en el timo se han utilizado como marcadores subrogados de función tímica. Posteriores estudios mostraron que los sjTRECs se veían fuertemente afectados por la dilución periférica (independientemente de la función tímica), por lo que en la actualidad son más aceptados como marcadores de historia proliferativa. La relación de sj/B-TRECs (que incluye los B-TRECs, generados en un paso diferente de maduración y será discutida más adelante) es una medida de función tímica independiente de la proliferación periférica y es aceptada en la actualidad como el mejor marcador periférico de función tímica en humanos.