INTRODUCCIÓN
El ratón de envejecimiento acelerado (senescence-accelerated mouse [SAM]) es un múrido que se caracteriza por su rápida progresión hacia el envejecimiento una vez ha alcanzado la edad de reproducción. El SAM se obtuvo en la Universidad de Kyoto, por selección fenotípica de un grupo de ratones de la cepa AKR/J que mostraban manifestaciones seniles de forma temprana1. La reproducción endogámica de estos ratones permitió establecer la cepa de animales SAM, que tiene un ciclo vital de unos 12 meses, prona al envejecimiento (SAM-P), mientras que otro grupo sirvió para instituir la línea retardada (SAM-R) que tiene una longevidad de unos 17 meses2.
La selección específica de diferentes grupos de SAM-P y SAM-R (basados en su longevidad, características fenotípicas y patológicas) ha dado origen a una serie de subcepas de ratones que se caracterizan, además de por un envejecimiento acelerado, por la manifestación específica de alguna alteración asociada (acumulación de amiloide, cataratas, deterioro cognitivo, artrosis, etc.). En la actualidad la cepa SAM está formada por 9 subcepas de SAM-P y 3 de SAM-R2,3.
Este modelo animal de envejecimiento acelerado se ha utilizado para analizar las características morfológicas4, del comportamiento, incluidos aspectos de la memoria y el aprendizaje5 , y moleculares3 relacionados con la senectud. El SAM-P8 se utiliza en investigación biogerontológica debido a que su rápido envejecimiento cursa con deterioro cognitivo y un déficit en el aprendizaje y la memoria a medida que progresa su ciclo vital. Cuando se comparan ratones SAM-P8 jóvenes y viejos, se observa una clara alteración en los procesos de respuestas aprendidas a medida que progresa la edad6,7. Se ha propuesto que este deterioro cognitivo está asociado, entre otras razones, al progresivo depósito cerebral de betaamiloide (βA) y se ha visto que el empleo de anticuerpos contra el βA mejora las capacidades cognitivas en estos ratones8,9.
Los SAM-P8 muestran un elevado estrés oxidativo, hallazgo coherente con los efectos de la acción de los radicales libres de oxígeno en diversas biomoléculas que producen alteraciones en las funciones celulares10. El tratamiento de estos ratones con antioxidantes mejora sus capacidades cognitivas, lo que indica que el estrés oxidativo también guarda una estrecha relación con las alteraciones de los sistemas de aprendizaje y memoria. La identificación de diversos genes (EIF-2B y el de la fosfolipasa tipo D) que se expresan de forma específica en el hipocampo del SAM-P8 ha ayudado a entender las bases moleculares de los déficit cognitivos asociados al envejecimiento11. También se ha observado que en el SAM-P8 la expresión del ARNm del factor neurotrófico derivado de la glía (GDNF) y la del factor de crecimiento neural (NGF) son menores que en los ratones control SAM-R112, lo que indica que la baja expresión de estos factores tróficos pudiera ser la base genética de las alteraciones neurocognitivas de estos ratones12. Además se han descrito cambios morfofuncionales en la barrera hematoencefálica específicos del envejecimiento cerebral13.
El hipocampo, por medio de las conexiones que establece, es fundamental en los procesos de aprendizaje y memoria y sus alteraciones determinan un deterioro cognitivo. El hipotálamo, por otra parte, actúa en el control de la actividad endocrina cuyas alteraciones repercuten en el proceso de envejecimiento (teoría neuroendocrina del envejecimiento). El sistema neurosecretor del hipotálamo es el centro regulador-integrador de diversas funciones endocrinas14 y se ha propuesto que su actividad tiene parte fundamental en la cinética del envejecimiento por su relación con algunos procesos endocrinos de la senectud14-17.
El SNS está constituido por grupos de células que se agregan para formar los denominados núcleos neurosecretores, formados por neuronas neurosecretoras que sintetizan oxitocina o vasopresina18,19. Los núcleos neurosecretores son el núcleo supraóptico y el paraventricular. Estos núcleos están situados de forma bilateral en el hipotálamo anterior; el núcleo supraóptico a ambos lados del quiasma óptico, y el núcleo paraventricular a ambos lados de la porción anterolateral del III ventrículo cerebral. Estos centros envían axones que contienen vesículas con las neurohormonas (oxitocina o vasopresina) hacia la neurohipófisis, donde se liberan con determinados estímulos (lactancia, deshidratación, etc.).
El núcleo supraquiasmático (NSQ) se caracteriza por estar situado dorsalmente sobre el quiasma óptico y en la base del III ventrículo. Este núcleo está formado por neuronas de pequeño tamaño que sintetizan vasopresina pero no proyectan a la neurohipófisis. El NSQ proyecta a la glándula pineal y es el encargado del mantenimiento de los ritmos circadianos (pace-maker). Además, otros grupos de neuronas neurosecretoras se localizan dispersas por el hipotálamo anterior y no se agregan para formar núcleos neurales definidos; estas formaciones variables se denominan, en conjunto, núcleos accesorios20.
En un trabajo previo presentamos las características morfofuncionales de los ritmos circadianos de estos ratones, y observamos que no existen diferencias cuantitativas en las neuronas vasopresinérgicas del núcleo supraquiasmático cuando se comparan SAM-P8 y R1, aunque sí hay diferencias en el ritmo vigilia-sueño21. El hecho de que también la actividad del sistema neurosecretor participa en la modulación del aprendizaje y la memoria, por medio de las neurohormonas oxitocina y vasopresina, nos ha llevado a analizar las características neuromorfológicas de este sistema neural en un modelo múrido de envejecimiento acelerado.
MATERIAL Y MÉTODOS
Para realizar este estudio hemos utilizado ratones de la cepa SAM-P8 y SAM-R1 que proceden de 4 parejas reproductoras amablemente cedidas por el Prof. Takeda de la Universidad de Kyoto. Estos animales se han criado en nuestras instalaciones en condiciones estándar de mantenimiento y control veterinario. La longevidad de nuestros animales es de 13 ± 3 meses para la cepa P8 y 16 ± 5 para la R1. Hemos utilizado ratones de ambos sexos a 2 edades diferentes; un grupo de 5 meses de edad y otro grupo de 12 meses. Cada grupo estaba formado por 5 animales. Además, hemos utilizado un grupo de 5 animales de 5 meses de edad de la cepa AKR/J y otro del mismo número de animales de la cepa Swiss.
Los animales fueron anestesiados con una inyección intraperitoneal de pentobarbital sódico (50 mg/kg), perfundidos con suero salino para lavar el árbol circulatorio, y fijados con una solución de parafolmaldehído (4%), glutaraldehído (0,1%) y ácido pícrico saturado (15%) en buffer fosfato 0,1 mol a un pH 7,3. Una vez fijados, se procedió a la extracción de los cerebros, y tras una posfijación en la misma solución de perfusión durante 24 horas a 4 °C, se procedió a su procesamiento histológico. Los cerebros se cortaron con la ayuda de un vibrátomo en secciones coronales de 50 μm de espesor. Las secciones histológicas se colocaron en portaobjetos y se seriaron de forma sistemática. Cada corte se seleccionó para una de las siguientes técnicas histológicas: tionina, antivasopresina y antioxitocina.
Para la técnica de tionina, los cortes histológicos (el primero de cada 3), colocados ordenadamente en los portaobjetos, se tiñeron en una solución de tionina diluida al 0,1% durante 5 min. Una vez se alcanzó la intensidad de tinción deseada, los portaobjetos se lavaron en agua destilada, se deshidrataron en alcoholes ascendentes hasta finalizar en alcohol absoluto y posteriormente se montaron los cubreobjetos con DPX.
Para las técnicas inmunocitoquímicas, antioxitocina (la segunda sección de cada 3) y antivasopresina (la tercera sección de cada 3), los portaobjetos se colocaron en una solución de albúmina bovina (1%), Triton X-100 (0,3%) y azida sódica (0,1%) en buffer fosfato salino. Posteriormente se incubaron durante 20 h a temperatura ambiente en una solución que contenía un suero antioxitocina (1/1.000, Sigma) o antivasopresina (1/50, ICN) obtenidos en conejo. Pasado ese tiempo, se lavaron en una solución de PBS y posteriormente se colocaron en una solución de IgG anticonejo durante 1 h. Posteriormente, se lavaron en PBS y se incubaron en una solución de 1/100 de peroxidasa-antiperoxidasa (PAP). Posteriormente los cortes se revelaron en una solución que contenía diaminobenzidina (0,05%), luego se lavaron en buffer fosfato salino y se deshidrataron en soluciones progresivas de alcoholes; finalmente se colocó DPX sobre las secciones y un cubreobjetos. La naturaleza de la reacción inmunocitoquímica se comprobó en un grupo de secciones que fueron procesadas del mismo modo pero en ausencia de la incubación en el antisuero específico.
Para el análisis de las proyecciones hipotalámicas en 8 ratones viejos (4 SAM-P8 y 4 R-1) de ambos sexos, se procedió a realizar cortes histológicos de 400 μm que contenían el hipotálamo. Bajo observación binocular, se colocó un cristal de DiI (perclorato de dioctodeciltetrametilindocarcianina) en la eminencia media, y se cubrió con una gota de agar. Estos bloques de tejido se incubaron, en oscuridad, durante 4 días en una estufa a 35 °C. Una vez pasado ese tiempo, los bloques se cortaron con un vibrátomo a 50 μm y se observaron con un microscopio de epifluoroscencia.
El análisis estereológico se realizó como ya hemos publicado previamente21-23. En resumen, se procedió a estimar el número de neuronas en ambos núcleos accesorios (NA). Para ello utilizamos un microscopio Opympus con un microcator (CAST-grid) que permite realizar estudios estereológicos y cuantificar el espesor de los cortes histológicos. En cada sección, el número de neuronas del NA, N(neu) se calculó por medio de la siguiente fórmula: N(neu) = V(ref) × Nv(neu,ref), donde V(ref) es el estimado por el método de Cavalieri y Nv(neu,ref) es la relación del número de neuronas respecto al volumen de referencia. Así, V(ref) = Tx(a/p) × ΣP(ref), μl, donde T = 3 × 0,05 = 0,15 mm es la distancia entre los puntos medios de los cortes y ΣP(ref), el número total de puntos contados en la zona estudiada con un sistema de prueba de a/p mm2 de área (corregido para la magnificación empleada). Nv(neu,ref) se calculó utilizando un disector óptico muestreado de forma sistemática en cada corte. El grosor final de los cortes, tras el procesamiento histológico, fue de 24 μm para los cortes teñidos con tionina y 37 μm para los de la técnica ICQ. De esta manera, el grosor del disector (h) fue h = 10 × 50/24 = 20,8 μm y h = 10 × 50/37 = 13,5 μm, respectivamente. Finalmente, el número total de neuronas contadas en todos los disectores en el volumen total de la región corresponde al número de neuronas de esa región. Para establecer las diferencias significativas en el número de neuronas contadas se realizó una ANOVA y una p < 0,05 fue el criterio de diferencia significativa entre grupos.
RESULTADOS
El análisis comparativo de los cortes del hipotálamo de los SAM-P8 y SAM-R1 teñidos con tionina mostró las mismas características histológicas en lo que se refiere a la disposición de los núcleos hipotalámicos y su topografía. Los núcleos supraóptico y paraventricular del sistema neurosecretor aparecían bien definidos. El núcleo supraquiasmático aparece situado dorsalmente al quiasma óptico y relacionado con la porción más ventral del tercer ventrículo (fig. 1A). La característica más interesante del hipotálamo de los ratones SAM fue la presencia de un núcleo accesorio (NA) muy desarrollado en comparación con los ratones AKR/J y Swiss, donde no era apreciable su existencia. El NA aparecía tanto en el ratón macho como en la hembra y tenía las mismas características independientemente de su edad (5 o 12 meses).
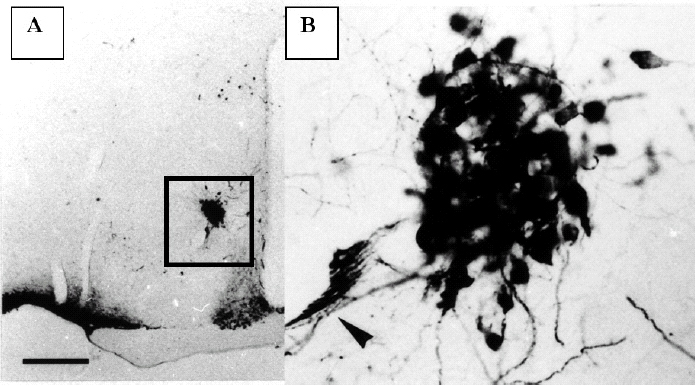
Figura 1.Corte histológico del hipotálamo de un ratón macho SAM-P8 de 12 meses, teñido para poner de manifiesto las neuronas que sintetizan vasopresina. En A se observa a pocos aumentos la fuerte inmunopositividad de las neuronas neurosecretoras del núcleo supraóptico y las del núcleo supraquiasmático. En B se observa a mayor aumento la zona marcada en A que corresponde al núcleo accesorio. Obsérvese el compacto agrupamiento de las neuronas del núcleo accesorio y las dendritas que envían hacia el vaso sanguíneo próximo (flecha).
El NA tiene una forma redondeada y se sitúa a media distancia entre el núcleo supraóptico y el paraventricular a ambos lados del tercer ventrículo. Es frecuente observar un gran vaso sanguíneo que lo cruza y las neuronas de este núcleo se asocian a las paredes vasculares. En los ratones Swiss y AKR/J este núcleo no se observa y sólo unas pocas neuronas aparecen localizadas en la zona que corresponde al NA del SAM.
En los cortes teñidos para mostrar las neuronas que sintetizan vasopresina en el hipotálamo, se observó la presencia de neuronas vasopresinérgicas en el núcleo supraóptico y el paraventricular. En el NA había una importante población de neuronas positivas para la vasopresina que se agrupaban formando una masa esférica (fig. 1B). En algunas ocasiones estas neuronas se asociaban al curso del vaso sanguíneo, de mediano calibre, que generalmente atraviesa el NA. Estas neuronas vasopresinérgicas tienen una forma oval y poseen dos tipos de procesos; unos gruesos, y por lo tanto muy inmunopositivos, que se agrupan formando una especie de red alrededor del vaso sanguíneo que cruza el núcleo accesorio o se dirigen hacia la pared del III ventrículo, donde se mezclan con las células ependimarias. Las prolongaciones más delgadas (axones) se unen con las procedentes del núcleo paraventricular y se dirigen hacia la eminencia media. Las neuronas que sintetizan oxitocina se distribuyen de la misma forma que las que sintetizan vasopresina, pero su número es menor. El estudio cuantitativo demostró que sólo el 13% de las neuronas del NA son oxitocinérgicas. En los hipotálamos de las otras cepas estudiadas (AKR/J y Swiss) no hemos encontrado este tipo de neuronas en esa área.
El empleo de DiI nos permitió analizar la proyección hacia la eminencia media del NA. En los cortes analizados se observó la presencia de neuronas marcadas en los núcleos suparóptico, paraventricular y accesorio, lo que corrobora el hecho de que las neurohormonas (oxitocina y vasopresina) sintetizadas en el NA son conducidas vía el tracto hipotálamo-hiposifario hasta la neurohipófisis, donde son liberadas al torrente circulatorio.
En nuestro estudio estereológico el número de neuronas teñidas con tionina en el NA de los SAM-P8 y SAM-R1 fue 199 ± 18 y no se encontraron diferencias significativas entre grupos (tabla1).
DISCUSIÓN
En sistema neurosecretor del hipotálamo actúa como un área de gran importancia funcional en la regulación de diversas funciones endocrinas. El sistema neurosecretor está formado por los núcleos supraóptico y paraventricular, que se sitúan respectivamente a ambos lados del quiasma óptico y del tercer ventrículo cerebral. Las neuronas de estas formaciones sintetizan las neurohormonas oxitocina y vasopresina, que una vez sintetizadas son conducidas vía el tracto hipotálamo-hipofisario hasta la neurohipófisis, donde con determinados estímulos son liberadas al torrente circulatorio para activar las células en los órganos diana18-20. Además, estos núcleos presentan proyecciones locales a otros centros cerebrales y allí estas neurohormonas ejercen funciones neurorreguladoras. El sistema neurosecretor se ha relacionado con los procesos de envejecimiento, dado que su actividad funcional tiene un importante papel regulador de las funciones endocrinas (teoría neuroendocrina del envejecimiento).
En la rata se han descrito diversas variaciones morfológicas en la distribución de los núcleos neurosecretores hipotalámicos24-26, pero en el ratón no se las ha encontrado y sólo unos pocos estudios han señalado ciertas distribuciones peculiares de neuronas neurosecretoras en el hipotálamo anterior20. En este estudio examinamos las características morfológicas y la distribución de las neuronas neurosecretoras en el SAM tanto de envejecimiento acelerado (P8) como en el retardado (R1), que se caracterizan por un rápido envejecimiento y en el caso de la cepa SAM-P8 con un deterioro cognitivo asociado. Estas características los hacen un modelo animal muy utilizado para el análisis de las bases fisiopatológicas del envejecimiento que son similares a la encontradas en ratones muy viejos (más de 3 años) de otras cepas27.
El hallazgo más característico de este estudio ha sido encontrar en el hipotálamo del SAM-P8 y el SAM-R1 un gran desarrollo de un agregado de neuronas que no aparecen en otras cepas de ratones, que se denomina NA y consta de 2 centenares de neuronas neurosecretoras, fundamentalmente encargadas de la síntesis de vasopresina (87%), y un pequeño porcentaje (13%) que sintetiza oxitocina28. Este núcleo cerebral no apareció en las otras cepas analizadas Swiss y AKR/J. El NA fue descrito por vez primera en el ratón común, pero como una pequeña agrupación de células de menor tamaño que el NA de la cepa SAM20. El NA tampoco aparece descrito en el ratón C57BL/J6 que sirve de atlas generalizado para el cerebro del ratón y aparecen células dispersas formando el núcleo neurosecretor accesorio (Acc)29.
El NA estaba presente tanto en los ratones jóvenes como en los viejos independientemente del sexo (machos y hembras). En todos los animales estudiados el NA presentaba un gran desarrollo y no se encontraron diferencias en el número de neuronas. Estos hallazgos indican que el NA es una formación constante en el hipotálamo de los ratones SAM. Por el contrario el NA no está presente en el resto de las cepas analizadas (Swiss y AKR/J). Nuestros resultados también muestran un desarrollo del núcleo supraóptico y el paraventricular, que aparecen con las mismas características que los mismos núcleos en otras cepas de ratones, lo que confirma que el SNS del ratón SAM presenta como rasgo distintivo la presencia de un bien desarrollado NA.
El análisis de las secciones inmunoteñidas para oxitocina y vasopresina mostró las presencia de neuronas neurosecretoras en los núcleos supraóptico y paraventricular. En el núcleo supraquiasmático, que es el control central de los ritmos circadianos, algunas neuronas sintetizan vasopresina, aunque no pertenecen al sistema neurosecretor por no presentar proyecciones nerviosas a la neurohipófisis. En un artículo anterior presentamos las características morfofuncionales de las neuronas vasopresinérgicas del núcleo supraquiasmático y el ritmo tau de estos ratones21.
El NA está formado por la agrupación de grandes neuronas (magnocelular) que sintetizan en su mayoría (87%) vasopresina y sólo un pequeño porcentaje de ellas sintetizan oxitocina. Estas neuronas se caracterizan por poseer un árbol dendrítico muy desarrollado que se dirige hacia las paredes del tercer ventrículo cerebral. Un hecho interesante es el hallazgo de la peculiar distribución de estas dendritas, que forman una especie de red de malla alrededor del vaso sanguíneo que generalmente atraviesa este núcleo. Asimismo se puede observar terminales dendríticos que hacen prominencia en la superficie del tercer ventrículo. Esta peculiar distribución de las dendritas en estas neuronas indica que pudieran tener algún papel de receptores (osmorreceptores) de la calidad del líquido cefalorraquídeo.
Los axones de las neuronas del núcleo accesorio se proyectan centralmente hacia la eminencia media. El marcaje de estos axones con el trazador retrógrado DiI depositado en la región ventral de la neurohipófisis (la eminencia media) reveló que las neuronas del NA proyectan a esta región al igual que lo hacen las neuronas del núcleo supraóptico y el paraventricular. Este hallazgo contribuye a proponer la idea de que el NA proyecta a la neurohipófisis y forma parte, por lo tanto, del sistema neurosecretor magnocelular de estos ratones.
El hecho de que el NA contiene neuronas oxitocinérgicas y vasopresinérgicas que proyectan a la eminencia media, junto con sus particulares relaciones con el tercer ventrículo cerebral y los vasos hipotalámicos, indica que pudiera tener algún papel como centro informador del contenido ventricular en una cepa de ratones que acumula depósitos de amiloide incluso en el líquido cefalorraquídeo (LCR).
Una agrupación neuronal de características semejantes se ha descrito en la rata con el nombre de nucleus circularis30. Posteriormente se propuso que el nucleus circularis actuaba como un centro osmorreceptor para informar al hipotálamo de la cualidad del LCR31,32. Por estas razones no es descartable el hecho de que la función del NA sea actuar como un osmorreceptor interno. De hecho, la alta vascularización de este núcleo y su posición estratégica en el centro del sistema neurosecretor del hipotálamo pudieran ser la base de dicha regulación.
En el cerdo se ha descrito otro núcleo con características topográficas semejantes al NA aquí descrito, que se denomina «núcleo que contiene neuronas oxitocinérgicas y vasopresinérgicas» (VON). Se ha visto que el VON incrementa el número de neuronas a medida que el animal progresa en la vida posnatal hasta la pubertad, y no se han descrito diferencias en el número de neuronas entre machos y hembras33. Los análisis cuantitativos realizados por nosotros en ratas y ratones han mostrado que las poblaciones de neuronas neurosecretoras en el hipotálamo de estos múridos son estables durante la vida prenatal tardía y la posnatal hasta el envejecimiento34,35. En otros centros hipotalámicos se ha descrito la presencia de diferencias cuantitativas a lo largo del ciclo vital de los animales entre machos y hembras36,37. Se ha señalado que estos núcleos neurosecretores dispersos por el hipotálamo de los mamíferos corresponden a neuroblastos posmitóticos que no logran alcanzar las localizaciones específicas tras el proceso de migración desde las zonas ventriculares (zonas proliferativas) a su destino final38.
Basándonos en los resultados por nosotros obtenidos, se puede postular que la presencia de este núcleo neurosecretor bien desarrollado y constante en la cepa SAM representa la base morfológica de un incremento de la síntesis y liberación de neurohormonas, especialmente vasopresina, dado que son las células vasopresinérgicas las que forman la mayor parte de las neuronas del NA. Este aumento de los valores de neurohormonas pudiera responder a diferentes agresores (deshidratación e hipovolemia) que están reducidos en el envejecimiento.
Los resultados obtenidos en esta cepa de ratones de envejecimiento acelerado se relacionan con la observación en humanos del hecho de que las neuronas neurosecretoras del hipotálamo se caracterizan por un incremento de su actividad en la etapa de envejecimiento y en ciertos trastornos neuropatológicos, incluida la enfermedad de Alzheimer39. La observación de que en estas circunstancias el sistema neurosecretor se activa, probablemente como un mecanismo compensador a ciertas pérdidas periféricas de receptores, unido a la relación íntima de estas neurohormonas con estados depresivos han abierto una nueva línea de trabajo que trata de relacionar el hipotálamo en general, y el sistema neurosecretor en particular, con el envejecimiento y las enfermedades neurodegenerativas40. Consideramos que poseer un modelo animal que, además de cursar con un envejecimiento acelerado, presenta alteraciones cognitivas asociadas a este proceso facilitará el conocimiento de las bases neurobiológicas de estos padecimientos y, en consecuencia, la aproximación terapéutica a estas alteraciones.
Correspondencia: D. Crespo.
Biogerontología. Departamento de Anatomía y Biología Celular. Facultad de Medicina. Universidad de Cantabria.
Cardenal Herrera Oria, s/n. 39011 Santander. España.
Correo electrónico: crespod@unican.es
Recibido el 23-11-05; aceptado el 07-12-05.