Los efectos beneficiosos del ejercicio físico, tanto en el tratamiento como en la prevención de distintas enfermedades, han sido ampliamente establecidos. La demencia más frecuente, la enfermedad de Alzheimer (EA) es un trastorno donde el ejercicio ha demostrado causar notables mejoras fisiopatológicas y cognitivas. En el presente trabajo estudiamos el efecto del ejercicio físico sobre el estrés oxidativo y la cognición en el modelo murino doble transgénico (2×Tg) para la EA, APP/PSN1, basado fundamentalmente en la deposición cerebral de placas de β-amiloide.
Material y métodosDieciocho ratones de 10 meses de edad fueron divididos en 4 grupos experimentales: 2×Tg entrenado (2×Tg-E) (n=5), 2×Tg reposo (2×Tg-R) (n=5), control entrenado (Control-E) (n=4) y control reposo (Control-R) (n=4). El entrenamiento de 12 semanas, fue forzado en tapiz rodante (3 días a la semana) combinado con carrera espontánea. Los animales fueron evaluados mediante test físicos y cognitivos antes y después del entrenamiento. Se analizaron los parámetros del daño oxidativo y las enzimas antioxidantes a nivel cortical y sistémico.
ResultadosLos ratones 2×Tg-R mostraron una disminución con el tiempo en la fuerza de agarre y el VO2máx, que se previno con el entrenamiento. El grupo 2×Tg-E demostró mejor memoria que el 2×Tg-R. Los grupos entrenados evidenciaron mayor capacidad exploratoria y menor ansiedad que los que mantuvieron reposo. El daño oxidativo sistémico se mostró ligeramente disminuido en los 2×Tg, aunque no encontramos diferencias en cuanto a lipoperoxidación, ni en la defensa antioxidante, a nivel cerebral entre los distintos grupos.
ConclusionesEl ejercicio físico produce mejoras en la fuerza de agarre, VO2máx, cognición y memoria de los ratones 2×Tg. Estas mejoras no están relacionadas con modificaciones significativas en la defensa antioxidante o un menor daño oxidativo causado por el ejercicio.
The beneficial effects of physical exercise, in both the treatment and the prevention of several diseases, have been extensively demonstrated. The most common dementia, Alzheimer′s disease (AD), is a disorder in which exercise induces significant improvement at pathophysiopathological and cognitive levels. In the present work, we studied the relationship between physical exercise, oxidative stress, and cognition in the double transgenic mice model (2×Tg) for AD, APP/PSN1. This model is mainly based on the cerebral deposition of amyloid β plaques.
Material and methodsEighteen ten-month-old mice were divided into four experimental groups: exercised 2×Tg (2×Tg-E) (n=5), rested 2×Tg (2×Tg-R) (n=5), exercised controls (control-E) (n=4) and rested controls (control-R) (n=4). We trained the animals for twelve weeks with a combination of forced exercise (treadmill running three days/week) and spontaneous wheel running. The animals were evaluated with physical and cognitive tests before and after the training period. We analyzed systemic and cortical oxidative damage and the induction of antioxidant enzymes.
ResultsThe 2×Tg-R mice showed a decrease in their grip strength and VO2max as they grew older which was prevented by training. The 2×Tg-E group showed better memory than the 2×Tg-R animals. All the trained groups demonstrated greater exploratory capacity and less anxiety than the sedentary animals. Systemic oxidative damage was slightly decreased in the 2×Tg, although we found no difference in the lipoperoxidation and in the induction of the antioxidant defense in cortex between groups.
ConclusionsPhysical exercise leads to improvements in the grip strength, VO2max, cognition, and memory in 2×Tg mice. These improvements are not significantly related to changes in the antioxidant defenses or a reduction in the oxidative damage brought about by exercise.
La enfermedad de Alzheimer (EA) es una de las enfermedades neurodegenerativas con mayor prevalencia en la edad adulta y cuyas bases moleculares y etiología no están completamente establecidas1. Está clínicamente caracterizada por una progresiva pérdida de memoria y un marcado deterioro de la función cognitiva1. Entre las características neuropatológicas de la EA destaca la presencia de ovillos fibrilares intracelulares y la deposición de placas seniles, constituidas en gran parte por β-amiloide (βA)1. Esto provoca una consecuente pérdida sináptica y neuronal especialmente acentuada en ventrículos e hipocampo1.
Actualmente no existe un tratamiento farmacológico exitoso para la EA, por lo que la investigación sobre posibles terapias paliativas y preventivas derivadas de estilos de vida saludables ha cobrado especial relevancia2. El ejercicio aeróbico es una de las intervenciones más estudiadas debido a sus evidentes y significativos beneficios a nivel cerebral3. Entre estos beneficios destaca: el incremento en la síntesis de factores neurotróficos como el brain derived neurotrophic factor (BDNF), vascular endothelial growth factor (VEGF) e insulin like growth factor (IGF-I); la inducción de la defensa antioxidante y la consecuente protección frente al estrés oxidativo; la estimulación en la degradación de la proteína precursora de βA (PPβA) a través del proteasoma; el aumento del flujo sanguíneo cerebral; el incremento del metabolismo cerebral a través de lactato y, finalmente, la inducción de la neurogénesis a nivel hipocampal4.
La importancia del estrés oxidativo en la etiología de la EA ha sido objeto de estudio desde hace décadas. El sistema nervioso central es especialmente vulnerable al estrés oxidativo por poseer una alta tasa de consumo de oxígeno, abundante contenido lipídico (rico en ácidos grasos poliinsaturados), alto contenido en hierro y ácido ascórbico y relativa escasez de enzimas antioxidantes comparado con otros tejidos5.
La producción de especies reactivas del oxígeno (ERO) en el cerebro afectado de Alzheimer ocurre por diversos mecanismos: la activación de la NADPH oxidasa (NOX) de la microglía tanto por el βA6 como por la PPβA7, la hipoxia local de ciertas partes del cerebro8, así como el bloqueo de los grupos hemo de la cadena de transporte electrónico mitocondrial por el βA9.
Aunque existe un gran número de estudios en pacientes de EA en los que se ha demostrado que el ejercicio físico aeróbico mejora a nivel cognitivo10, es ineludible utilizar modelos animales con el fin de esclarecer los mecanismos moleculares activados por el ejercicio a nivel cerebral y que, en última instancia, darán lugar a beneficios clínicos y fisiopatológicos11.
En el presente estudio utilizamos ratones doble transgénicos para la EA12 con el fin de analizar el efecto del ejercicio físico sobre el estrés oxidativo y la cognición, ambos alterados en este modelo como consecuencia de su particular neurofisiopatología. El animal 2×Tg para la EA presenta un aumento en la deposición de placas de βA producidas por la sobre-expresión de la proteína madre transmembrana, PPβA, y de la enzima que la escinde, la presenilina1 (PSN1), dando lugar así al agregado de βA. Este agregado termina formando placas insolubles a nivel cortical e hipocampal alrededor de los 9 meses de edad. Por tanto, este ratón 2×Tg, APP/PSN1, resulta un modelo de estudio muy interesante en diferentes áreas terapéuticas, entre ellas el ejercicio. A través de test cognitivos y comportamentales se pueden estudiar las mejoras como consecuencia del ejercicio, en el aprendizaje y la memoria, en la potenciación a largo plazo13, así como en la actividad exploratoria y la ansiedad14 en estos animales 2×Tg. Del mismo modo diversos investigadores se han interesado en el estudio de la neurogénesis hipocampal15, y en la disminución de la deposición de placas de βA inducidas por el ejercicio en este modelo16.
El objetivo principal del presente estudio fue evaluar el efecto de un protocolo de ejercicio físico aeróbico combinado (espontáneo y forzado en tapiz rodante), sobre distintas habilidades cognitivas y comportamentales. Asimismo, evaluamos la posible implicación del estrés oxidativo en dichos efectos.
Material y métodosAnimales de experimentaciónDiez ratones 2×Tg para el modelo B6C3-Tg (APPswe, PSEN1dE9) 85DBo/J de la EA y 8 ratones de la misma colonia sin transgenes modificados, de 10 meses de edad, fueron utilizados en este estudio. Los ratones fueron divididos de forma aleatoria en 4 grupos experimentales: control reposo (Control-R) (n=4); control sometido a ejercicio (Control-E) (n=4); 2×Tg reposo (2×Tg-R) (n=5) y 2×Tg sometido a ejercicio (2×Tg-E) (n=5).
Nuestro modelo 2×Tg muestra un fenotipo parcial de EA incluyendo la sobreproducción de ßA-40 y ßA-42, así como deposición de esta última isoforma en hipocampo y corteza cerebral a partir de los 7-9 meses, pérdida sináptica causada por neuritas distróficas a partir de los 9 meses y disfunciones cognitivas y comportamentales a partir de los 7 meses de edad (http://www.jax.org). Todos los animales fueron estabulados individualmente y mantenidos en el animalario del Servicio Central de soporte a la Investigación Experimental (SCIE) de la Facultad de Farmacia bajo condiciones de temperatura constante (23±1˚C), humedad relativa del 60% y ciclos de luz/oscuridad de 12:12h. Fueron alimentados con dieta estándar (PANLAB S.L.) y provistos de agua ad libitum. Todos los procedimientos experimentales utilizados en este estudio fueron aprobados por el Comité de Ética para la Investigación de la Facultad de Medicina, Universidad de Valencia.
Diseño experimental y protocolo de entrenamiento físicoLos animales fueron sometidos a tests de aptitud física y tests cognitivos/comportamentales al inicio del estudio. Posteriormente, los grupos ejercicio entrenaron durante 12 semanas. El protocolo de entrenamiento fue una combinación entre carrera espontánea y forzada. El ejercicio espontáneo se realizó mediante la instalación de ruedas giratorias en las jaulas de los ratones que, a través de un sensor magnético, recogían la información de tiempos y distancias de carrera diaria. El ejercicio forzado se desarrolló en un tapiz rodante (Columbus Instruments. Excer-3r Treadmill Model). Los animales tuvieron una semana de familiarización al nuevo ambiente y adaptación al ejercicio tras la cual se implementó un protocolo incremental en intensidad y duración llegando hasta 60min por día a 20m×min, 3 días a la semana. Al finalizar las 12 semanas de entrenamiento todos los ratones fueron nuevamente evaluados mediante los mismos tests y seguidamente fueron sacrificados.
Tests físicos y cognitivos/comportamentalesTest de potencia aeróbica máximaSe desarrolló una modificación al protocolo original de Davidson et al.17,18. El test en tapiz rodante consistió en 6min de calentamiento a una velocidad de 6m×min−1. Tras el calentamiento la velocidad del tapiz fue incrementándose en 2m×min−1 cada 2min, hasta que el animal fue incapaz de seguir corriendo (extenuación). La extenuación se estableció cuando el ratón, por 3 veces consecutivas, manifestó una incapacidad para continuar con su ritmo de carrera, manteniéndose en la rejilla de descarga durante más de 2s. Se considera la máxima velocidad de carrera como la capacidad aeróbica máxima del animal19, definiéndose la velocidad aeróbica máxima como la velocidad de carrera a la que es alcanzado el consumo máximo de oxígeno (VO2máx)20.
Test de fuerza de agarreSe empleó un medidor de fuerza de agarre (modelo GS3®, Bioseb) para medir esta variable en las patas delanteras de los ratones. Los animales son sujetados por la cola, por el investigador disponiendo las patas delanteras sobre la barra de tracción conectada al sensor dinamométrico. Son lentamente separados de la barra hasta que su fuerza no es suficiente para permanecer agarrados. Esta fuerza de agarre máxima es registrada para cada animal y medida en Newtons.
Test de reconocimiento de objetosEste test emplea la tendencia innata de los animales a escoger objetos nuevos frente a los ya conocidos21. Evalúa el comportamiento espontáneo y la memoria. El material fue desarrollado según describe Hammond22, instalándose en una habitación insonorizada y de luminosidad invariable. El reconocimiento de objetos fue evaluado de acuerdo a un protocolo adaptado, inicialmente establecido por Ennaceur23. El día del test, cada animal se sitúa en la caja y se le permite explorar durante 5min. Cinco minutos después, en la primera fase (F1) se presentan 2 objetos idénticos dentro de la caja, centrados pero separados entre sí para que el animal los explore durante 5min. Transcurridos 60min de la anterior, en la segunda fase (F2), uno de los objetos presentados en la F1 fue sustituido por un nuevo objeto distinto para que el animal lo explore de nuevo durante 5min. Finalmente, transcurridas 24 h de la F2, en la última fase del test (F3), el objeto que aún se mantenía de la F1 es sustituido por un objeto completamente nuevo para que el animal lo explore nuevamente durante 5min. Cada fase del test es grabada para el análisis y cálculo del ratio entre el contacto o aproximación del ratón a cada nuevo objeto con respecto al ya conocido.
Test de las esquinasEste test se emplea para evaluar la capacidad exploratoria de los roedores. Los ratones se mantuvieron en una caja conocida, similar a donde se estabulaban, que se introdujo en una caja blanca más grande. Durante 30s se cuantifica el número de esquinas exploradas, así como de exploraciones verticales y el tiempo al que hace la primera exploración.
Test de campo abiertoEste test permite evaluar parámetros comportamentales a través del estudio de la ansiedad, actividad exploratoria, tigmotaxia, defecaciones y agorafobia24. Se desarrolló en una caja blanca de 50×50×25cm siguiendo el protocolo de PANLAB/HARVARD-APPARATUS. Cada ratón fue introducido en la caja donde se grabó durante 5min para el posterior análisis y cuantificación de los siguientes parámetros: tiempo transcurrido en el cuadro central, tiempo en alcanzar la periferia, número de exploraciones verticales, duración de los lavados, así como el número de defecaciones.
Estudio del estrés oxidativoMalondialdehídoLa determinación de lipoperóxidos en forma de malondialdehído (MDA) fue realizada en plasma y corteza cerebral siguiendo el método descrito por Wong et al.25. Este método está basado en la hidrólisis de los lipoperóxidos y la subsiguiente formación del aducto ácido tiobarbitúrico (TBA) y MDA (TBA-MDA2). Este aducto es detectado por HPLC en fase reversa y cuantificado a 532nm. El modelo instrumental utilizado fue «Ultimate 3000. DIONEK» y la técnica cromatográfica fue llevada a cabo en condiciones isocráticas siendo la fase móvil una mezcla de KH2PO4 50mM (pH: 6,8) y acetonitrilo (70:30).
Cociente glutatión oxidado y reducidoEl cociente glutatión oxidado (GSSG) y glutatión reducido (GSH) fue analizado siguiendo el método previamente descrito por nuestro grupo de investigación26.
SDS-PAGE y Western BlotAlícuotas de los lisados de corteza cerebral (50μg) fueron separadas en geles para electroforesis de sodio dodecil sulfato-poliacrilamida. Las proteínas fueron transferidas a membranas de polifluoruro de vinilo que fueron bloqueadas durante 1h con leche desnatada (5%) y se incubaron toda la noche a 4°C con su respectivo anticuerpo primario diluido en el mismo medio de bloqueo: anti cobre/zinc superóxido dismutasa (anti-Cu/ZnSOD; 1:5.000. Assay Designs) y anti glutatión peroxidasa (anti-Gpx; 1:750. Abcam). Las membranas fueron después incubadas con el anticuerpo secundario (anti-rabbit IgG; 1:2.000. Cell Signaling) durante una hora a temperatura ambiente. Una de las muestras de cada membrana fue incubada solo con el anticuerpo secundario para garantizar la especificidad. Las proteínas específicas fueron visualizadas utilizando el procedimiento de quimioluminiscencia tal cómo especifica el fabricante (Amersham Biosciences). Las señales auto-radiográficas fueron cuantificadas utilizando un escáner densitométrico (BioRad, Hercules). Los niveles de α-tubulina (1:1.000, Santa Cruz Biotechnology) fueron determinados en todos los experimentos como marcador de control de carga.
Sacrificio y conservación de muestrasLos animales fueron sacrificados 24h después de la última sesión de ejercicio siendo anestesiados por vía inhalatoria con sevoflurano (SEVOrane®). Por laparotomía amplia se accedió a la vena cava inferior para la extracción de sangre. Parte de esta sangre se dispuso en un tubo heparinizado y se centrifugó a 1.500×g, 15min a temperatura ambiente. Se recogió el plasma y se conservó a -20°C para su posterior análisis. Se dispusieron 40μl de sangre del tubo heparinizado a los que se les añadió el mismo volumen de ácido perclórico al 12%, ácido batofenantrolindisulfónico (BPDS) 2mM. Tras agitar enérgicamente se centrifugó a 15.000×g, 15min a 4°C. Se recogió el sobrenadante conservándolo a -20°C para la posterior determinación de glutatión reducido (GSH). El mismo procedimiento se siguió para la determinación de glutatión oxidado (GSSG), sustituyendo los reactivos mezclados con la sangre por ácido perclórico al 12%, BPDS 2mM, N-etilmaleimida 40mM. El resto de la sangre se depositó en un tubo con EDTA para después centrifugarlo a 1.500×g, 15min a temperatura ambiente y conservar el plasma resultante a −20°C para el posterior determinación de MDA.
También se extrajo y se conservó el cerebro de los animales, conservándose congelado tras FreezeClamping a −80°C. Para las determinaciones mediante Western Blot, los tejidos fueron lisados en frío con tampón de lisis (Tris: 76,5mM; pH: 6,8; SDS: 2%; Glicerol; 10%; suplementado con 2mM de ortovanadato de sodio e inhibidor de proteasas [Sigma-Aldrich]). Los homogenados fueron sonicados en hielo durante 3s e incubados 10min a 4°C y posteriormente centrifugados a 1.500×g, 15min a 4°C, recogiéndose finalmente el sobrenadante. La concentración de proteínas de los extractos fue cuantificada por duplicado utilizando el método de Lowry27 y un estándar de BSA.
Análisis estadísticoLos resultados se expresan como media ± desviación estándar (DE). Para todos los parámetros bioquímicos, el análisis estadístico se realizó mediante análisis de varianza seguido por el test post hoc de dos factores de Bonferroni. Un análisis de varianza de medidas repetidas seguido por el test post hoc de Newman-Keuls fueron utilizadas para determinar los efectos del protocolo de ejercicio sobre las diferentes pruebas. Se estableció un valor de p<0,05 para considerar significativas las diferencias obtenidas.
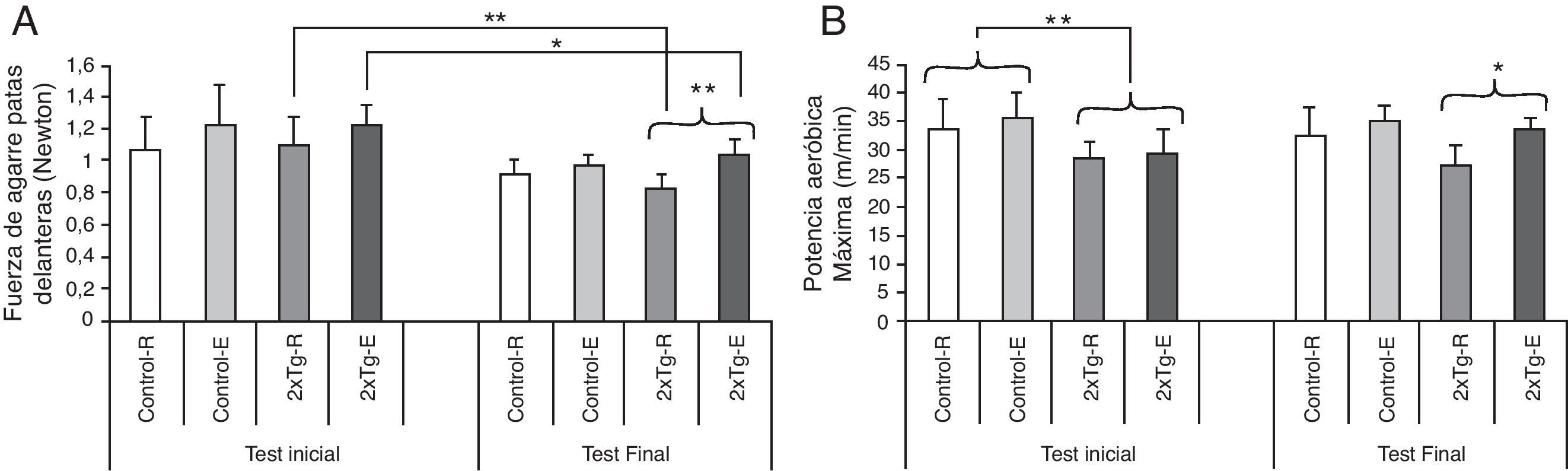
ResultadosEfecto del entrenamiento físico sobre la potencia aeróbica máxima y la fuerza de agarreSe estudió la carrera espontánea de los grupos ejercitados a través del tiempo y distancia recorrida, revelándose un mayor tiempo de carrera por parte de los 2×Tg-E cuando los comparamos con los WT-E en la quinta semana de ejercicio. Esta diferencia se mantuvo hasta la undécima semana. El tiempo de carrera espontánea en el caso de los 2×Tg-E, en la quinta semana de ejercicio, fue de 4,78± 1,19h diarias, frente a los animales WT-E que corrieron 1,00±0,59h al día (p<0,001). En la undécima semana los valores de tiempo de carrera de los 2×Tg-E fueron de 2,11±1,02h diarias, mientras que los WT-E se mantuvieron corriendo de forma voluntaria 0,58±0,49h (p<0,05). Similares resultados se evidencian analizando la distancia recorrida (datos no mostrados). En el test de fuerza de agarre de las patas delanteras se observa que los 2×Tg pierden fuerza con el tiempo. No obstante, esta pérdida de fuerza fue significativamente menor en el grupo 2×Tg-E frente a su homólogo en reposo (fig. 1A). El estudio del VO2máx reveló que los ratones 2×Tg comenzaron el protocolo de entrenamiento con una menor potencia aeróbica máxima que los controles. Tras las 12 semanas de estudio, el grupo 2×Tg-R mostró menor potencia aeróbica máxima que el grupo 2×Tg-E que se mantuvo al nivel de los controles (fig. 1B).
Adaptaciones físicas producidas por el entrenamiento. A) Test de fuerza de agarre de las patas delanteras. *p<0,05: 2×Tg-E final vs 2×Tg-E inicial; **p<0,01: 2×Tg-R final vs 2×Tg-R inicial y 2×Tg-E vs 2×Tg-R en test final. B) Test de potencia aeróbica máxima. *p<0,05: 2×Tg-E vs 2×Tg-R en test final; **p<0,01: 2×Tg vs Control en test inicial. Valores expresados como media ±DE (n=5 grupos 2×Tg; n=4 grupos Control). Control-R y Control-E, grupo no transgénico en reposo y entrenado respectivamente; 2×Tg-R y 2×Tg-E, grupo doble transgénico en reposo y entrenado respectivamente.
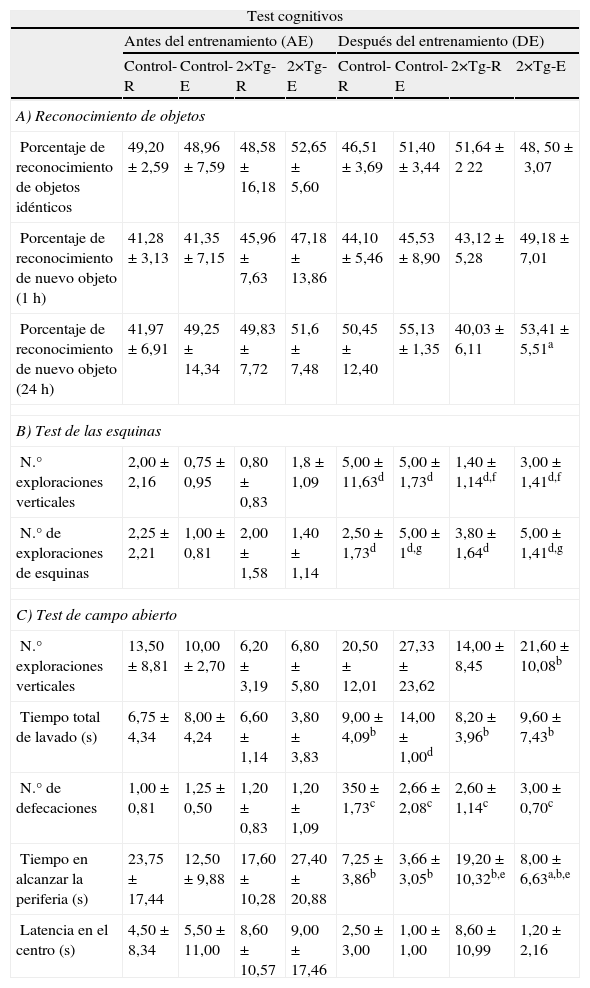
En el test de reconocimiento de objetos no se observaron cambios en la memoria a corto plazo (1h), sin embargo en la memoria a largo plazo (24h) los animales 2×Tg-E mostraron una mejora significativa con respecto a los 2×Tg-R (tabla 1A).
Test cognitivos
| Test cognitivos | ||||||||
| Antes del entrenamiento (AE) | Después del entrenamiento (DE) | |||||||
| Control-R | Control-E | 2×Tg-R | 2×Tg-E | Control-R | Control-E | 2×Tg-R | 2×Tg-E | |
| A) Reconocimiento de objetos | ||||||||
| Porcentaje de reconocimiento de objetos idénticos | 49,20±2,59 | 48,96±7,59 | 48,58±16,18 | 52,65±5,60 | 46,51±3,69 | 51,40±3,44 | 51,64±2 22 | 48, 50±3,07 |
| Porcentaje de reconocimiento de nuevo objeto (1h) | 41,28±3,13 | 41,35±7,15 | 45,96±7,63 | 47,18±13,86 | 44,10±5,46 | 45,53±8,90 | 43,12±5,28 | 49,18±7,01 |
| Porcentaje de reconocimiento de nuevo objeto (24h) | 41,97±6,91 | 49,25±14,34 | 49,83±7,72 | 51,6±7,48 | 50,45±12,40 | 55,13±1,35 | 40,03±6,11 | 53,41±5,51a |
| B) Test de las esquinas | ||||||||
| N.° exploraciones verticales | 2,00±2,16 | 0,75±0,95 | 0,80±0,83 | 1,8±1,09 | 5,00±11,63d | 5,00±1,73d | 1,40±1,14d,f | 3,00±1,41d,f |
| N.° de exploraciones de esquinas | 2,25±2,21 | 1,00±0,81 | 2,00±1,58 | 1,40±1,14 | 2,50±1,73d | 5,00±1d,g | 3,80±1,64d | 5,00±1,41d,g |
| C) Test de campo abierto | ||||||||
| N.° exploraciones verticales | 13,50±8,81 | 10,00±2,70 | 6,20±3,19 | 6,80±5,80 | 20,50±12,01 | 27,33±23,62 | 14,00±8,45 | 21,60±10,08b |
| Tiempo total de lavado (s) | 6,75±4,34 | 8,00±4,24 | 6,60±1,14 | 3,80±3,83 | 9,00±4,09b | 14,00±1,00d | 8,20±3,96b | 9,60±7,43b |
| N.° de defecaciones | 1,00±0,81 | 1,25±0,50 | 1,20±0,83 | 1,20±1,09 | 350±1,73c | 2,66±2,08c | 2,60±1,14c | 3,00±0,70c |
| Tiempo en alcanzar la periferia (s) | 23,75±17,44 | 12,50±9,88 | 17,60±10,28 | 27,40±20,88 | 7,25±3,86b | 3,66±3,05b | 19,20±10,32b,e | 8,00±6,63a,b,e |
| Latencia en el centro (s) | 4,50±8,34 | 5,50±11,00 | 8,60±10,57 | 9,00±17,46 | 2,50±3,00 | 1,00±1,00 | 8,60±10,99 | 1,20±2,16 |
AE: antes del entrenamiento; DE: después del entrenamiento; Control-R y Control-E, no transgénicos mantenidos en reposo y sometidos a ejercicio respectivamente; 2×Tg-R y 2×Tg-E, doble transgénicos mantenidos en reposo y sometidos a ejercicio respectivamente. Valores expresados como media ±DE (n=5 grupos 2×Tg; n=4 grupos control).
Estadística: ap<0,05 con respecto a 2×Tg-R en test DE; bp<0,05; cp<0,01; dp<0,001 con respecto a los valores de test AE; ep<0,05; fp<0,01 con respecto a Control en test DE; gp<0,05 con respecto a grupos reposo en test DE.
En el test de las esquinas, el número de exploraciones verticales incrementó tras el período de ejercicio en el grupo control-E. Asimismo, los ratones 2×Tg mostraron menor número de exploraciones en comparación con los controles. La exploración de las esquinas aumentó en ambos grupos sometidos a ejercicio frente a los mantenidos en reposo (tabla 1B).
En el estudio del test de campo abierto se muestran diversas variables comportamentales. Contabilizando el tiempo que el ratón se mantuvo inmóvil en el centro de la caja no se encontraron diferencias entre los distintos grupos experimentales. El grupo 2×Tg-R necesitó un mayor tiempo para alcanzar la periferia en comparación con su homólogo entrenado en el test final. Tras el período de entrenamiento, las exploraciones verticales aumentaron en todos los grupos, aunque de una forma más significativa en el grupo 2×Tg-E. En el test final, el tiempo de lavado fue mayor en todos los grupos y el número de defecaciones incrementó en ambos grupos mantenidos en reposo (tabla 1C).
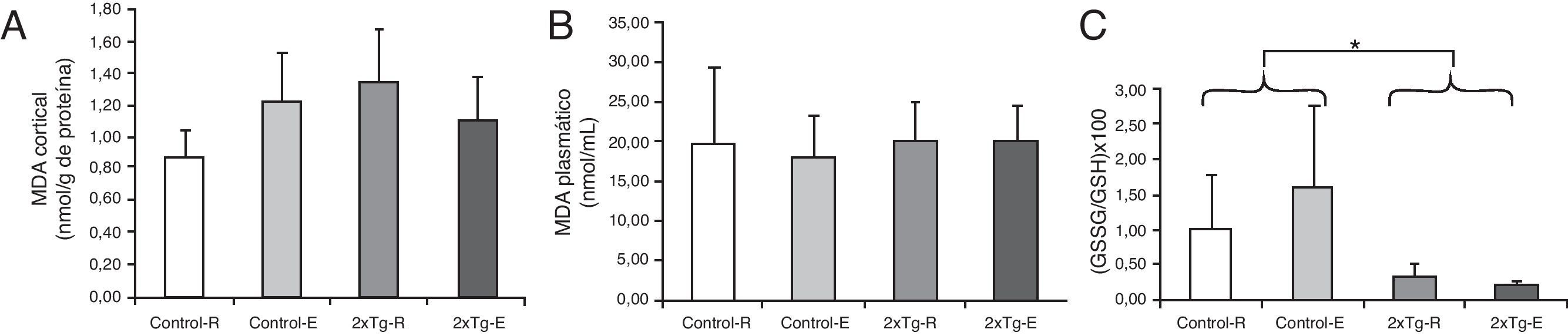
El daño oxidativo sistémico es menor en los ratones 2xTgLos niveles de MDA medidos en corteza cerebral y en plasma no mostraron diferencias significativas entre los distintos grupos experimentales (fig. 2A y B, respectivamente). Sin embargo, el cociente glutatión oxidado/reducido (GSSG/GSH) medido en sangre total fue mayor en los grupos controles que en los 2×Tg (fig. 2C).
Daño causado por estrés oxidativo. A) Niveles corticales de MDA. B) Niveles plasmáticos de MDA. C) Cociente (GSSG/GSH)×100. *p<0,05: 2×Tg vs Control. Valores expresados como media ±DE (n=5 grupos 2×Tg; n=4 grupos Control). Control-R y Control-E, grupo no transgénico en reposo y entrenado respectivamente; 2×Tg-R y 2×Tg-E, grupo doble transgénico en reposo y entrenado respectivamente.
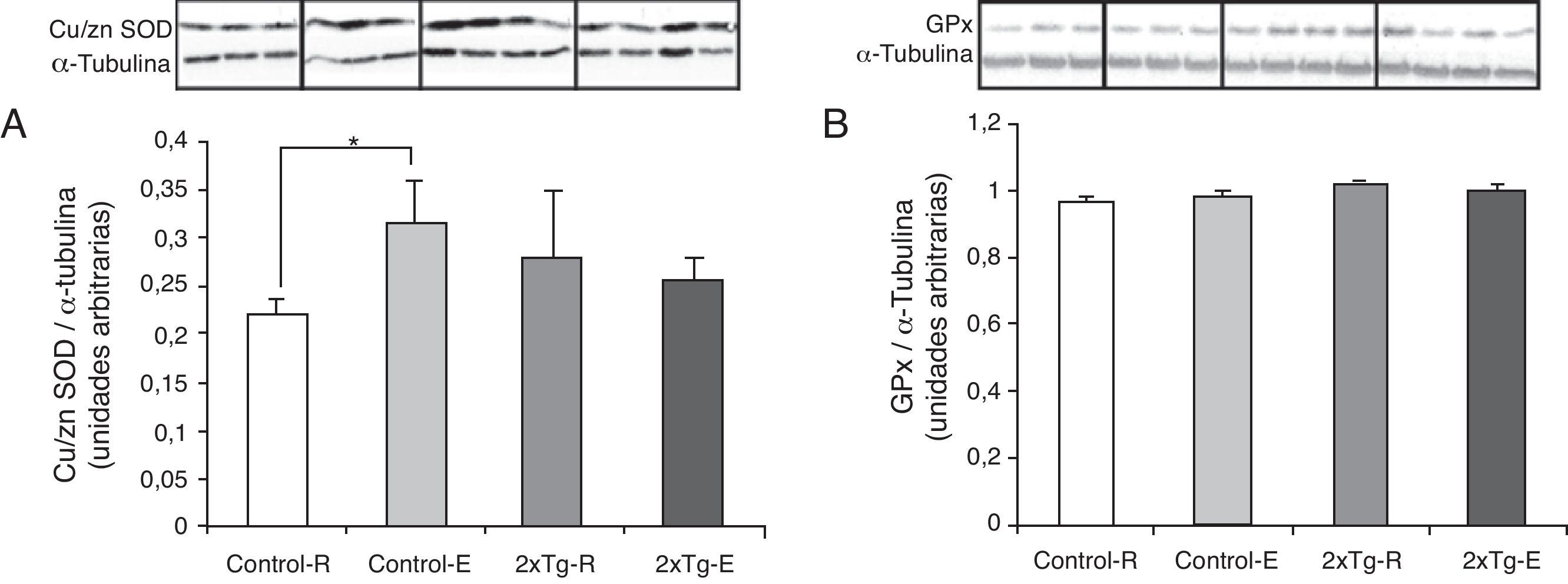
Los niveles de la enzima antioxidante Cu/ZnSOD, implicada en la dismutación del radical superóxido, fueron mayores en el grupo Control-E cuando se compararon con el Control-R. No se observan diferencias entre los grupos 2×Tg (fig. 3A). Los niveles de la enzima antioxidante GPx, implicada en la detoxificación de peróxido de hidrógeno, no se modificaron en ninguno de los grupos experimentales (fig. 3B).
Defensa antioxidante cortical. A) Niveles de Cu/Zn SOD. *p<0,05: Control-E vs Control-R. B) Niveles de GPx. Valores expresados como media ±DE (n=5 grupos 2×Tg; n=4 grupos Control). Control-R y Control-E, grupo no transgénico en reposo y entrenado respectivamente; 2×Tg-R y 2×Tg-E, grupo doble transgénico en reposo y entrenado respectivamente.
El VO2máx ha demostrado ser uno de los más relevantes predictores de muerte tanto en sujetos sanos como en sujetos con enfermedades cardiovasculares. Un aumento de un 1 MET (3,5 ml×min−1×kg−1) en el VO2máx supone un 12% de mejora en la supervivencia en humanos, por lo que su determinación ha adquirido una importante relevancia en el ámbito de la medicina28. El ejercicio mantuvo la fuerza y el VO2máx en los 2×Tg mientras los sedentarios sufrieron un declive en estas capacidades con el tiempo, sin demostrarse diferencias entre genotipo tal como describe Lalonde29. El hecho de que el VO2máx no aumente en los animales Control-E, como consecuencia del entrenamiento, puede ser explicado por la alternancia en las sesiones de ejercicio físico forzado (3 veces por semana). Trabajos previos de nuestro grupo de investigación desarrollados en ratas, demuestran que es necesario mantener una frecuencia de entrenamiento de 5 días a la semana para inducir incrementos en el VO2máx significativos18. El aumento en la fuerza de agarre demostrado por los animales 2×Tg tras el entrenamiento lo interpretamos como muy relevante por su implicación en la sarcopenia y en el riesgo de caídas cuya incidencia aumenta en el envejecimiento. De hecho, se considera que no existe una pérdida con la edad tan evidente como la pérdida de masa magra. Esta pérdida se asocia con una menor independencia del individuo y con la fragilidad, un síndrome geriátrico recientemente descrito. Buchman et al., en 2008, correlacionaron la fragilidad con la predisposición a EA30.
Los niveles de memoria han sido evaluados en distintos modelos murinos para la EA31, aunque sin alcanzar un consenso correlacional entre los modelos basados en la hipótesis del βA y la pérdida de memoria. La causa de esta indeterminación surge de las diferencias en las edades con las que se usa cada modelo y el momento de inicio y progresión de la afección32. Basándonos en nuestro modelo APP/PSN1, encontramos que en las edades de 6, 7, 9 y 15 meses los niveles de retención de los transgénicos son normales cuando se comparan con los controles33. Otros trabajos describen normalidad en la memoria a los 11 meses seguido de una involución de esta capacidad a los 1534; o anormal retención a los 9 meses13 e incluso desde los 4 meses de edad35. En nuestro estudio encontramos que los ratones 2×Tg (de 12 meses) muestran peor memoria a largo plazo que los controles. No obstante, los resultados sugieren que, gracias al ejercicio, se restituyeron estos déficits de memoria en los 2×Tg hasta alcanzar niveles similares a los controles. Resultados previos de otros grupos de investigación han mostrado efectos similares en 2×Tg de 9 meses13 y 24 meses14.
El ejercicio desencadenó una mayor actividad exploratoria tanto en los ratones controles como 2×Tg siendo ligeramente superior en los primeros; se demostró una mayor neofobia en los 2×Tg-R, ya descrita por Lalonde36, que revirtió con el ejercicio; así como también se evidenció un incremento en la ansiedad en ambos grupos reposo, medida a través del control de esfínteres37.
La mayor actividad mostrada por los 2×Tg a través de la carrera espontánea responde al comportamiento estereotipado mostrado por distintos modelos de EA como el triple transgénico para PPβA, PSN1 y Tau38 o el transgénico simple para PPβA39. Además, se describe una correlación inversa entre esta estereotipia manifestada a través de la carrera y los comportamientos estereotipados clásicos sugiriendo que el ejercicio espontáneo los sustituye a la vez que se correlaciona positivamente con la eliminación de placas de βA39.
La relación entre estrés oxidativo y EA ha sido ampliamente estudiada por nuestro grupo de investigación40. Sin embargo, no encontramos cambios en la peroxidación lipídica debidos a genotipo, tanto a nivel cerebral como en plasma. El daño oxidativo no se vio tampoco modificado por el ejercicio. A nivel sistémico la disminución en el cociente GSSG/GSH indica un menor estrés oxidativo en sangre en los 2×Tg frente a los controles. Estos resultados, sin duda paradójicos, en relación al estrés oxidativo podrían ser explicados por un aumento en la inducción de la enzimas antioxidantes en los 2×Tg. Sin embargo, cuando estudiamos la defensa antioxidante no encontramos ninguna diferencia entre los 2 genotipos, ni como consecuencia del ejercicio espontáneo. Únicamente los ratones del grupo Control-E mostraron un aumento en los niveles de Cu-Zn SOD. Este resultado refuerza la idea de que el ejercicio físico induce la defensa antioxidante endógena no solo en el músculo esquelético41 sino también en otros tejidos como el cerebro42. La hormesis es el fenómeno por el cual bajas dosis de tóxicos u otros estresores dañinos para el organismo, activan una respuesta adaptativa a estrés que lleva a una resistencia del organismo a dosis crónicas del mismo agente43. De esta forma, consideramos que el ejercicio supuso un estrés adicional que se vio contrarrestado por la inducción adaptativa de la enzima antioxidante Cu-ZnSOD44. Consideramos que la disminución en el estrés oxidativo sistémico en los ratones 2×Tg podría ser motivada por la edad de los animales, sin embargo necesitamos desarrollar nuevos estudios para explicar estos paradójicos resultados.
Concluimos que el ejercicio físico produce mejoras en la fuerza de agarre, VO2máx, cognición y memoria de los ratones 2×Tg para APP/PSN1. Estas mejoras no están relacionadas con modificaciones en la defensa antioxidante o un menor daño oxidativo causadas por el ejercicio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido financiado por las subvenciones SAF2009-08334; BFU2007-65803/BFI del Ministerio español de Educación y Ciencia (MEC); ISCIII2006-RED13-027 de la «Red Temática de Investigación Cooperativa en Envejecimiento y fragilidad (RETICEF)», PROMETEO2010 / 074, y por la UE COSTB35. Este estudio ha sido cofinanciado por fondos FEDER de la Unión Europea. El trabajo también fue apoyado por una beca FPU del Ministerio español de Educación y Ciencia (MEC) concedida a Helios Pareja Galeano (2010-2014).