La reparación del manguito rotador se acompaña de una elevada tasa de rerrotura. Nuestro objetivo es determinar si el empleo de rhBMP-2 vehiculizada en un transportador híbrido mejora el proceso de reparación en lesiones crónicas del manguito.
Material y métodosEstudio experimental en 62 ratas. A las 4 semanas de la lesión se llevó a cabo una sutura transósea y la asignación aleatoria a uno de los 5 grupos de estudio: 1) grupo control: solo sutura; 2) grupo doble-control: se aplicó además un transportador de alginato-quitina; 3) grupo control-alginato: se añadió rhBMP-2 al alginato; 4) grupo control-quitina: se añadió rhBMP-2 a la quitina, y 5) grupo doble-muestra: se añadió rhBMP-2 a ambos componentes. A los 4 meses se evaluaron los resultados mediante estudios biomecánicos e histológicos.
ResultadosEn todos los casos se observó una brecha osteotendinosa macroscópicamente a las 4 semanas. La tasa de rerrotura fue del 7,5%, ocurriendo el 20% de ellas en el grupo control-alginato. En la evaluación histológica los mejores resultados se obtuvieron en el grupo doble muestra: 4,5 (3,3-5). La carga máxima soportada fue mayor en el grupo doble muestra 62,9N (59,8-69,4) presentando además una menor rigidez 12,7 (9,7-15,9).
ConclusionesEl empleo de la rhBMP-2 vehiculizada en un transportador híbrido de alginato-quitina parece mejorar las características histológicas de la reparación e incrementar las propiedades biomecánicas del tendón en el contexto de una lesión crónica del manguito rotador.
Rotator cuff repairs have shown a high level of re-ruptures. It is hypothesised that the use of rhBMP-2 in a carrier could improve the biomechanical and histological properties of the repair.
Material and methodsControlled experimental study conducted on 40 rats with section and repair of the supraspinatus tendon and randomisation to one of five groups: Group 1 (control) only suture; Group 2 (double control), suture and alginate-chitin carrier; Group 3 (alginate-control), the rhBMP-2 was added to the alginate; Group 4 (chitin-control) application of the rhBMP-2 to the chitin, and Group 5 (double sample): The two components of the carrier (alginate and chitin) have rhBMP-2. A biomechanical and histological analysis was performed at 4 weeks.
ResultsA gap was observed in all cases 4 weeks after supraspinatus detachment. The re-rupture rate was 7.5%, with 20% of them in the control-alginate Group. Histologically the best results were obtained in the double sample group: 4.5 (3.3-5.0). Double sample were also able to support higher loads to failure: 62.9N (59.8 to 69.4) with lower rigidity 12.7 (9.7 to 15.9).
ConclusionsThe use of alginate-chitin carrier with rhBMP-2 improves the biomechanical and histological properties of the repair site in a chronic rotator cuff tear.
El dolor de hombro es la tercera causa más frecuente de demanda de atención médica especializada1. Las roturas del manguito afectan aproximadamente al 30% de la población mayor de 60 años y hasta casi el 60% de los mayores de 80. Solo en Estados Unidos se realizan unas 450.000 operaciones al año, con unos costes médicos directos que alcanzan los 7 billones de doláres2. Aunque algunos estudios abogan por el tratamiento conservador de las roturas completas3, el tratamiento más empleado es la reparación quirúrgica. Sin embargo, a pesar de los buenos resultados clínicos, se recogen porcentajes de rerrotura tras su reparación que oscilan entre un 16 y un 94% según las series4-10, y aunque los resultados clínicos tras la rerrotura son superiores a la no sutura de un tendón dañado, estos se acompañan de una disminución de la fuerza y un menor balance articular si lo comparamos con un tendón sano11.
Con el fin de disminuir la tasa de fracaso de esta reparación se han desarrollado mejoras técnicas que pretenden incrementar la fortaleza mecánica de la sutura y que están en relación tanto con el implante como con la configuración de la sutura. Existen anclajes metálicos, de materiales reabsorbibles, poli¿meros de termoplástico, compuestos únicamente de suturas, suturas transóseas, y todas ellas con diferentes tipos de configuración: simple, tipo Masson-Allen modificado, configuraciones en «doble hilera» (teóricamente superiores biomecánicamente, pero que no han demostrado aún proporcionar resultados funcionales superiores)12. Lo cierto es que a pesar de estas mejoras, tanto en los implantes como en la propia técnica, el porcentaje de fracaso de la sutura continúa siendo elevado, lo que nos lleva a buscar otro tipo de estrategias que mejoren dicha reparación. Es aquí donde la ingeniería de tejidos podría jugar un papel esencial.
Son muchos los estudios experimentales que han empleado factores de crecimiento en el proceso de reparación de lesiones del manguito. La familia de las proteínas morfogenéticas óseas (BMP) son los factores de crecimiento con capacidades osteoinductivas más potentes, y hay varios estudios experimentales que sugieren beneficios de estos en el tratamiento de las lesiones del manguito rotador mejorando las propiedades biomecánicas y favoreciendo la diferenciación tendinosa13-16 en otros, sin embargo, este papel no es tan claro17. Así mismo, son muchos los biomateriales que se han probado in vitro, en animales de experimentación o en humanos, con la finalidad de promover la reparación de las lesiones. Los transportadores no solo se emplean como materiales pasivos, permitiendo al tejido circundante crecer sobre él actuando como andamiaje para el mismo, sino que también juegan un papel activo como transportadores para factores de crecimiento o células18. El resumen de esto es que la elección del biomaterial resulta crítica para el éxito o fracaso del desarrollo de los procedimientos de ingeniería tisular. Este trabajo emplea la combinación de alginato y quitina como transportador de factores de crecimiento. Ambos transportadores han sido ampliamente empleados en procedimientos de ingeniería de tejidos18-21. Se trata de 2 materiales biocompatibles y biodegradables cuya principal ventaja como transportador híbrido es su superioridad mecánica con respecto a cualquiera de los 2 transportadores aislados. Además, a diferencia de los transportadores de alginato o de quitina aislados, el transportador híbrido puede preparase con soluciones de ph neutro, ofreciendo la ventaja adicional de incorporar de forma uniforme proteínas o fármacos en el seno de su matriz sin o con una mínima desnaturalización22.
Nuestra hipótesis por tanto es la siguiente:
La aplicación de rhBMP-2 vehiculizada en el transportador adecuado, en el contexto de una lesión crónica del manguito rotador, puede contribuir a la mejora histológica y biomecánica en el proceso de reparación tras la intervención quirúrgica.
Material y métodosPara la realización de este estudio se emplearon un total de 62 ratas macho tipo Sprague-Dawley de 8 meses de edad con pesos comprendidos entre 480 y 850g. El estudio fue aprobado por el Comité Ético de Experimentación Animal de nuestro centro y se siguieron todas las normas de la legislación internacional para la experimentación animal (86/609/CEE).
Obtención de los rhBMP-2 y transportadoresLa rhBMP-2 fue suministrada por Noricum (lote B02B05) como en procedimientos previos12.
Con relación a los transportadores empleados, las muestras implantadas presentan el siguiente código:
- -
Alginato más quitina: doble control (DC).
- -
Alginato-rhBMP-2 más quitina: control de quitina (CQ).
- -
Alginato más quitina-rhBMP-2: control de alginato (CA).
- -
Alginato-rhBMP-2 más quitina-rhBMP-2: doble muestra (DM).
El alginato se preparó (Alginic Acid, A28309 Sigma Aldrich) al 2% en ácido acético al 1%. Se dejó agitando 2h a temperatura ambiente y se filtró por 0,22μm en esterilidad preparando proporciones de 200μl de volumen final en campana de flujo laminar vertical.
La muestra CQ se preparó con alginato 160μl y 40μl de proteína rhBMP-2 (1mg/ml). Se dejó en agitación a 4°C o/n (over night). Al día siguiente se mezcló con 3mg aproximadamente de quitina (Chitin, C3641 de Sigma Aldrich) en polvo estéril por radiación gamma. Mediante pipeteo constante se mezcló nuevamente para posteriormente realizar el filme en condiciones estériles. El solvente se dejó secar 24h (técnica de evaporación de solvente).
La muestra CA se preparó igual, pero el alginato no llevaba la proteína rhBMP-2, sino que esta se añadió a 3mg de quitina. La quitina con proteína (40μl) se llevó a agitación o/n a 4°C. El alginato fue preparado al día siguiente y se mezcló con la quitina y proteína preparando filmes en las mismas condiciones.
La muestra DC se preparó el mismo día de los filmes, mezclando 200μl de alginato al 2% con 3mg de quitina para posteriormente realizar el filme. Se dejó secar 24h hasta el día siguiente.
La muestra DM contiene proteína en los 2 transportadores; 140μl de alginato al 2% y 40μl de rhBMP-2. Se llevó a agitar a 4°C o/n junto con otro tubo de ensayo que contenía los 3mg de quitina y 40μl de proteína. Al día siguiente se mezclaron los contenidos de ambos tubos de ensayo y se preparó el filme.
Los filmes se implantaron tras sumergirlos en cloruro cálcico al 0,2M y filtrado previo en condiciones estériles.
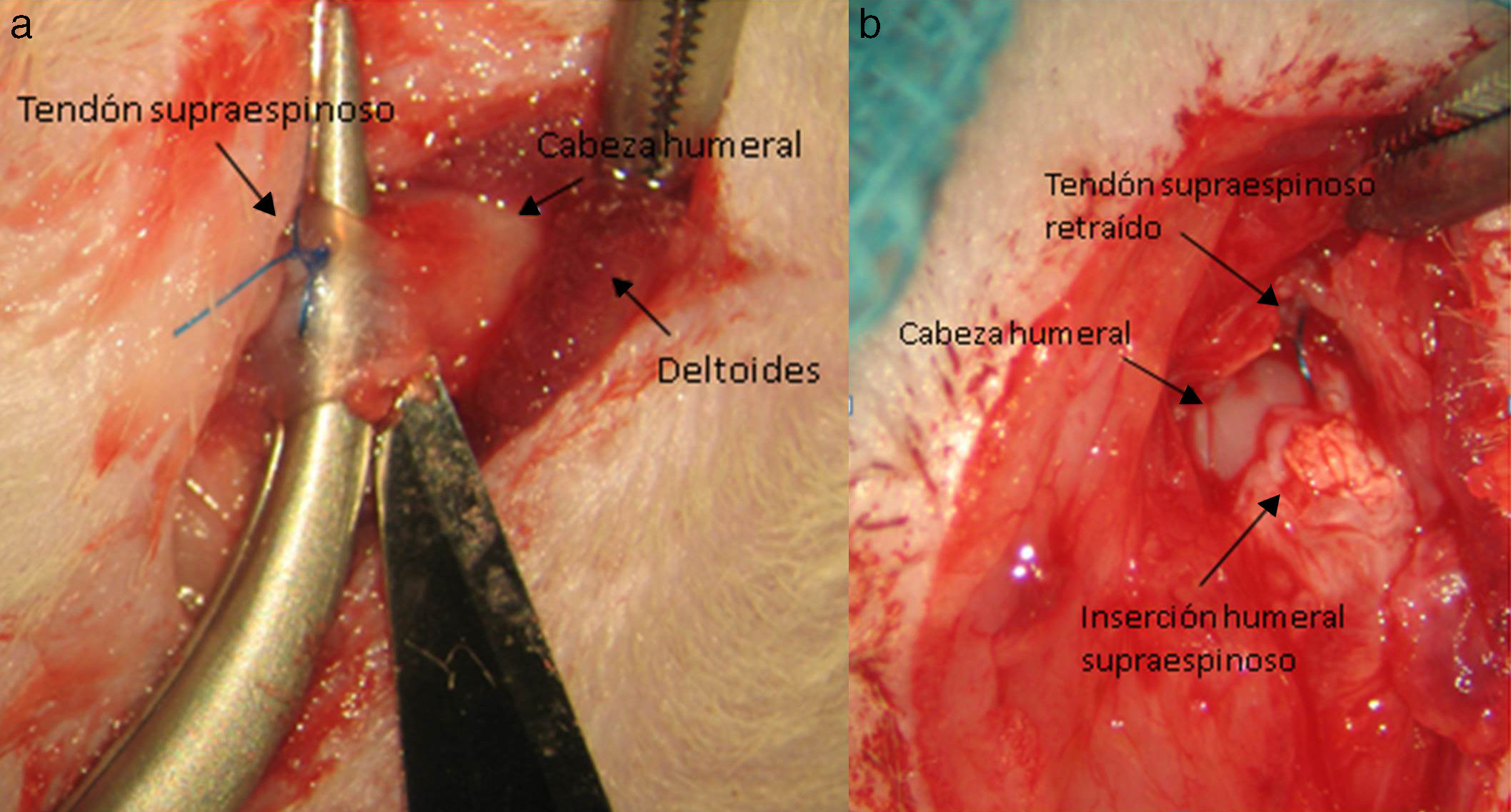
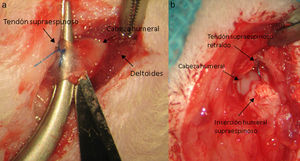
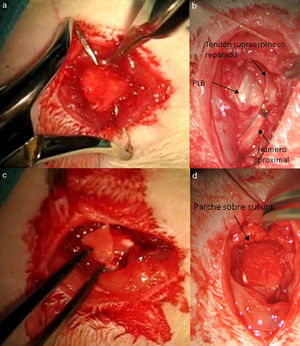
Técnica quirúrgicaLos animales intervenidos fueron sometidos a una inducción anestésica con medetomidina 0,3mg/kg (Domtor®, Pfizer, Madrid, España) y fentanilo 0,3mg/kg (Fentanest®, CERN Pharm, Barcelona, España), ambos intraperitoneales. El mantenimiento se realizó con isoflorano al 2% (Isoflo®; Esteve, Barcelona, España). Se administró una primera dosis de antibioterapia al iniciar la anestesia (enrofloxacino 5mg/kg/24h s.c.) y al finalizar la cirugía se administró una dosis de antiinflamatorio (meloxicam 0,2mg/kg/24h s.c.) y analgésico (buprenorfina 0,1mg/kg/12h s.c). Con el animal en decúbito supino fijando el miembro a intervenir en abducción y rotación interna se procede a la incisión quirúrgica de la piel de la zona anterior del hombro mediante el empleo de microscopio microquirúrgico Leica MC 1 (Leica Microsystems, Schweiz). A continuación se diseca el plano subcutáneo hasta llegar al músculo deltoides, que se abre mediante una incisión en «T» desinsertando los vientres anterior y medio, quedando expuesto el tendón supraespinoso; este se marca con Prolene® 5-0 (Ethicon, Johnson and Johnson, EE.UU.) y a continuación se secciona con la punta de un bisturí del n.o 11 perpendicular a su eje mayor y a una distancia de 4mm de su inserción, resecando el muñón tendinoso resultante hasta el troquíter y desbridando, con el bisturí, los restos del mismo en su inserción, provocando su retracción (fig. 1). Durante la técnica quirúrgica se tuvo especial cuidado en mantener intactos el resto de tendones del manguito y las estructuras de la articulación escapulohumeral. Finalmente se reinsertó el deltoides al acromion, clavícula y trapecio con Poliglactin 910 (Vicryl® 5-0) y se cerró la piel con puntos simples de sutura.
Durante los 3 primeros días los animales recibieron tratamiento antibiótico, antiinflamatorio y analgésico según dosis previas. Durante todo el postoperatorio se les permitió movilidad libre dentro de las limitaciones propias de la estabulación. La superficie de cada jaula era de 800 cm2 y 14cm de altura, y la temperatura se mantuvo entre los 20–24°C con una humedad relativa del 65% y periodos de exposición a la luz de 12h. Los animales eran alimentados con una dieta estándar (Panlab SL) y agua según necesidad.
Se procedió a la aleatorización de los animales de experimentación mediante programa informático (Excel, Microsoft, Redmond, VA, EE.UU.).
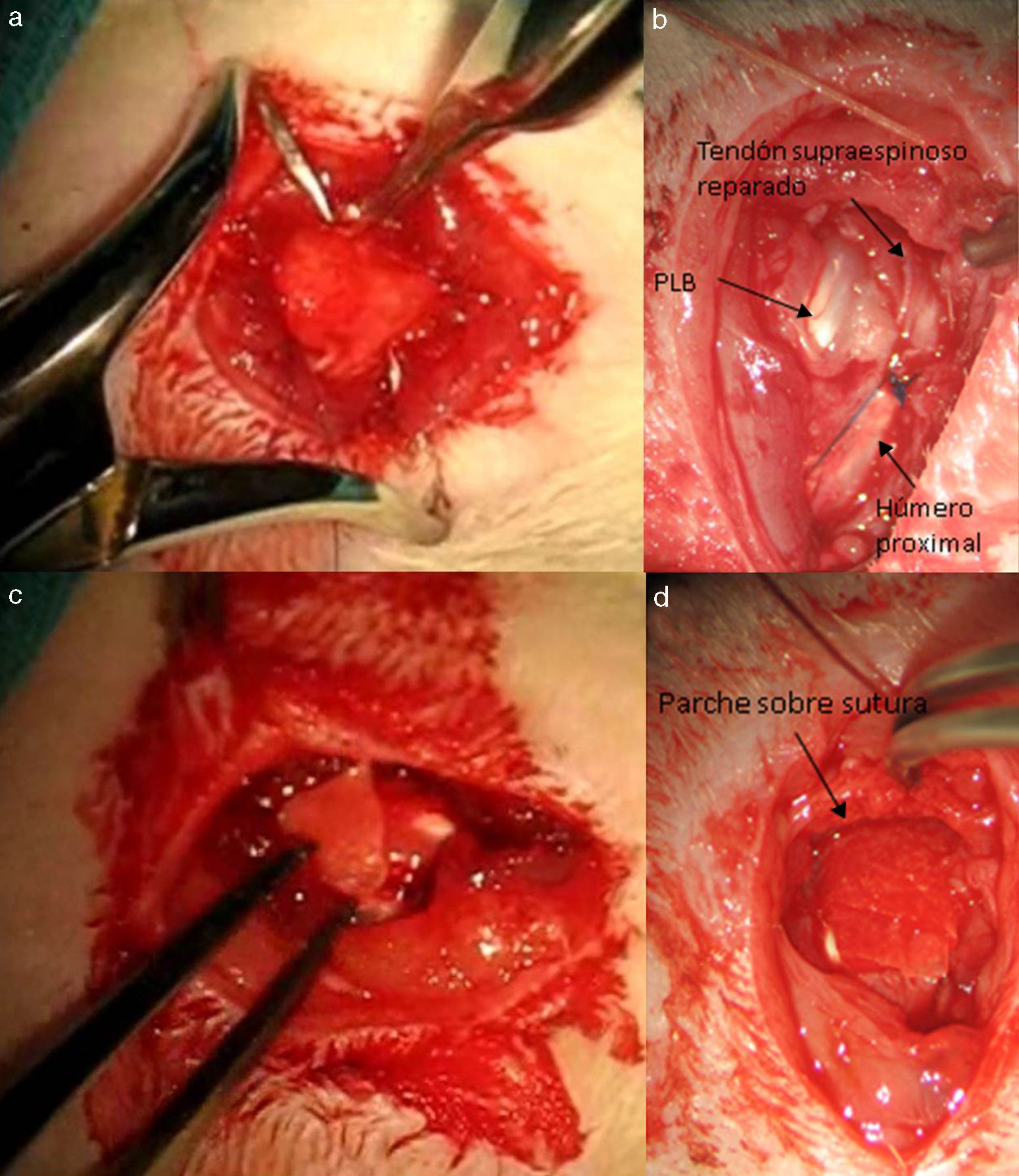
Transcurridas 16 semanas del proceso anterior, ya generado el modelo de lesión crónica, como ha sido constatado en estudios previos23,24 se procede a la reparación tendinosa mediante sutura transósea con Prolene® 6/0 (Ethicon, Johnson and Johnson, EE.UU.) (fig. 2) de forma aislada o con el empleo adicional de un transportador de quitina/alginato sin/con rhBMP-2.
Las ratas fueron divididas en 5 grupos en función del tipo de reparación tendinosa que se realizó:
Grupo I: grupo control C. Para la realización de este grupo de estudio se incluyeron un total de 10 ratas. Tras la sección se procedió a la reparación del tendón mediante sutura transósea con Prolene® sin aportarse otros tipos de materiales.
Grupo II: grupo doble control DC. Para la realización de este grupo de estudio se incluyeron un total de 10 ratas. Tras la sección tendinosa se procedió a la reparación del mismo a las 4 semanas mediante la misma sutura que en el grupo anterior, aportándose además un parche de alginato y quitina. Dicho parche se suturó con puntos sueltos alrededor del tendón mediante material no reabsorbible polipropileno 7/0 (Prolene® 7/0 Ethicon, New Jersey, EE.UU.). Los resultados se evaluaron de la misma forma que el grupo anterior con el mismo número de muestras.
Grupo III: grupo control alginato CA. En este grupo de estudio se incluyeron 10 ratas con una reparación tendinosa empleándose la sutura descrita previamente y un parche de quitina con BMP-2 y alginato sin BMP-2. El análisis de los resultados se corresponde al descrito en los grupos previos.
Grupo IV: grupo control quitina CQ. Para este grupo de estudio se intervinieron 10 ratas con sutura del tendón supraespinoso la cuarta semana de la sección del mismo. Se aportó además un parche con quitina sin BMP-2 y alginato con BMP-2.
Grupo V: grupo doble muestra DM. Para esta parte del estudio se suturaron 10 tendones del supraespinoso previamente seccionados. En el mismo acto quirúrgico se aportó un parche con quitina con BMP-2 y alginato con BMP-2 para analizar los resultados tanto histológicos (n=5) como biomecánicos (n=5).
Al finalizar el periodo de observación, los animales fueron sacrificados y consecutivamente se procedió a la extracción de las piezas mediante amputación interescapulotorácica. Las muestras se conservaron a –20°C hasta la realización del estudio biomecánico previo al cual se procedió a su descongelación a temperatura ambiente.
Evaluación macroscópicaSe determinó la existencia de la lesión crónica durante la primera fase del procedimiento (ausencia de continuidad tendinosa y presencia de una brecha entre el tendón marcado y su inserción en el troquíter), y la presencia de reparación tendinosa (continuidad macroscópica del tendón lesionado), rerrotura (falta de continuidad) y atrofia muscular tras el sacrificio del animal de experimentación.
Estudio biomecánico e histológicoLa preparación de las muestras para su estudio biomecánico consistió en embutir la extremidad sobre una resina tipo epoxi (Araldit Rápido-Ceys®) dentro de unos tubos de plástico que se sujetaron por mordazas de la máquina de tracción, permitiendo realizar un ensayo de tracción uniaxial. Para aumentar la fuerza de rozamiento entre la extremidad y la resina se envuelve la escápula y el húmero con una goma elástica y se depositan unas gotas de pegamento sobre el contacto goma-extremidad. Es importante que el pegamento no llegue a la zona de la articulación. Una vez que la resina se haya enfriado y haya adquirido cierta resistencia, hacemos lo mismo en el extremo de la escápula. Para mantener la humedad durante todo este tiempo, se envuelve la articulación con una gasa húmeda y además se deja puesto un humificador para mantener esta también en el ambiente (fig. 3). Las muestras se introdujeron formando un ángulo de 90° (posición fisiológica). Los tendones del manguito rotador se pusieron a prueba en paralelo al eje longitudinal del tendón supraespinoso en su posición fisiológica. La velocidad de tracción durante las pruebas ascendió a 1,8mm/min. Las muestras se sometieron a ciclos de cargas de hasta 10 Newtons (N) para ratas de 451-600g y 5N para ratas con pesos de 300 a 450g; se descargaron hasta llegar al punto inicial y se repitió la carga de nuevo varios ciclos hasta llegar al punto de fallo.
Todos los ensayos biomecánicos se realizaron utilizando una máquina de tracción (Instron 5866®) que registraba los valores de carga máxima en N y de deformación en mm; secundariamente se calculó la rigidez del tendón ensayado. Las definiciones de los valores registrados fueron: carga máxima: fuerza necesaria para la rotura del tejido de forma permanente; deformación o deformidad: desplazamiento utilizado para modificar la forma inicial del tendón; rigidez: la rigidez del tendón reparado se define como la pendiente de la carga máxima dividida por el desplazamiento en el punto de fallo o carga máxima.
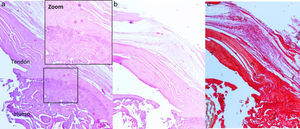
Para el estudio histológico, tras ser fijadas las muestras en una solución de formaldehído al 4%, descalcificadas con una solución de EDTA, embebidas en parafina y cortadas con microtomo, se realizaron tinciones con hematoxilina eosina, tricrómico de Masson y rojo sirio. La evaluación de las piezas fue realizada por un patólogo que desconocía el grupo experimental al que pertenecía la muestra. Para realizar la valoración de las tinciones histológicas, tanto en los casos de lesión crónica como en los casos de reparación, se utilizó una escala de valoración semicuantitativa basada en las empleadas en estudios previos25,26, con la cual se evaluaron los siguientes parámetros:
- 1.
Matriz extracelular de colágeno: orientación de las fibras que discurren de forma paralela o bien edema y desorganización de las fibras.
- 2.
Zona de transición de tendón a hueso: trabeculado de transición normal entre hueso y tendón, presencia de haces de colágeno con orientación menos uniforme o ausencia de zona de transición.
- 3.
Inflamación de la bursa: presencia o ausencia de infiltrado inflamatorio en la bursa que rodea a la matriz tendinosa: linfocitos, mastocitos, macrófagos, etc.
- 4.
Proliferación vascular: presencia de arteriolas que discurren de forma paralela a las fibras de colágeno, vascularización irregular o presencia de vasos de pared delgada que discurren de forma desorganizada, incluso perpendiculares a las fibras de colágeno.
- 5.
Celularidad: presencia de tenocitos (células alargadas con un pequeño núcleo), presencia de células con núcleo redondeado y aumento de la celularidad.
- 6.
Degeneración grasa: presencia o ausencia de adipocitos.
- 7.
Metaplasia condroide: ausencia de condrocitos o presencia de condrocitos dentro de la matriz tendinosa.
Se estableció una escala general o score de 4 puntos, cuantificando cada parámetro previamente descrito mediante 4 valores que correspondían a: 0 normalidad, 1 leve, 2 moderado, 3 severo. Por lo tanto, el tejido normal puntúa 0 y el peor resultado suma 15 puntos. Los parámetros que se evaluaron se resumen en la tabla 1.
Parámetros de la escala general de evaluación histológica
| Matriz | Inflamación de la bursa | |
|---|---|---|
| 0 | Fibras de colágeno paralelas | No |
| 1 | Fibras más difusas y con bucles | Sí |
| 2 | Presencia de ondulación de forma regular | Infiltrado inflamatorio en el tendón |
| 3 | Fibras irregulares y presencia de sustancias metacromáticas |
| Vascularidad | Transición | |
|---|---|---|
| 0 | Arteriolas paralelas a las fibras de colágeno | Apariencia de zonas naturales en la transición hueso-tendón |
| 1 | Patrón vascular irregular | Zonas con lagunas en la zona de transición |
| 2 | Aumento de vasos con paredes delgadas | Lagunas y ausencia de transición |
| 3 | Vasos perpendiculares a las fibras y de aspecto nodular |
| Celularidad | Metaplasia condroide | |
|---|---|---|
| 0 | Células alargadas y de núcleo delgado | Ausencia |
| 1 | Células alargadas con núcleos redondeados | Presencia |
| 2 | Aumento de celularidad | |
| 3 | Zonas sin células |
Cada parámetro se cuantifica como: 0 normal; 1 leve; 2 moderado, y 3 severo. El tejido normal puntúa 0 puntos y el peor resultado 15 puntos.
Se realizó durante el diseño del estudio un cálculo del poder estadístico empleando datos publicados previamente que detectaran diferencias de al menos un 25% en la carga necesaria hasta el fracaso o fallo de la reparación. De esta manera se determinó que eran precisos 10 especímenes por grupo para el estudio biomecánico, lo que proporcionaría una potencia estadística cercana al 80% con un error tipo I de 0,005.
El análisis de datos se inició con un estudio de la normalidad de las distribuciones. Para ello, debido al tamaño poblacional, se realizó el test de Saphiro-Wilk, comprobando así que no cumplía los requisitos de una distribución normal. Posteriormente, teniendo en cuenta las características y los datos obtenidos del estudio de la normalidad, para la comparación intergrupal se realizó el test no paramétrico Kruskal-Wallis. Se fijó el nivel de significación estadística en p<0,05.
ResultadosDoce animales fallecieron a consecuencia de complicaciones anestésicas y durante el postoperatorio inmediato, por lo que fueron repuestos para completar el número experimental predeterminado para la realización del estudio.
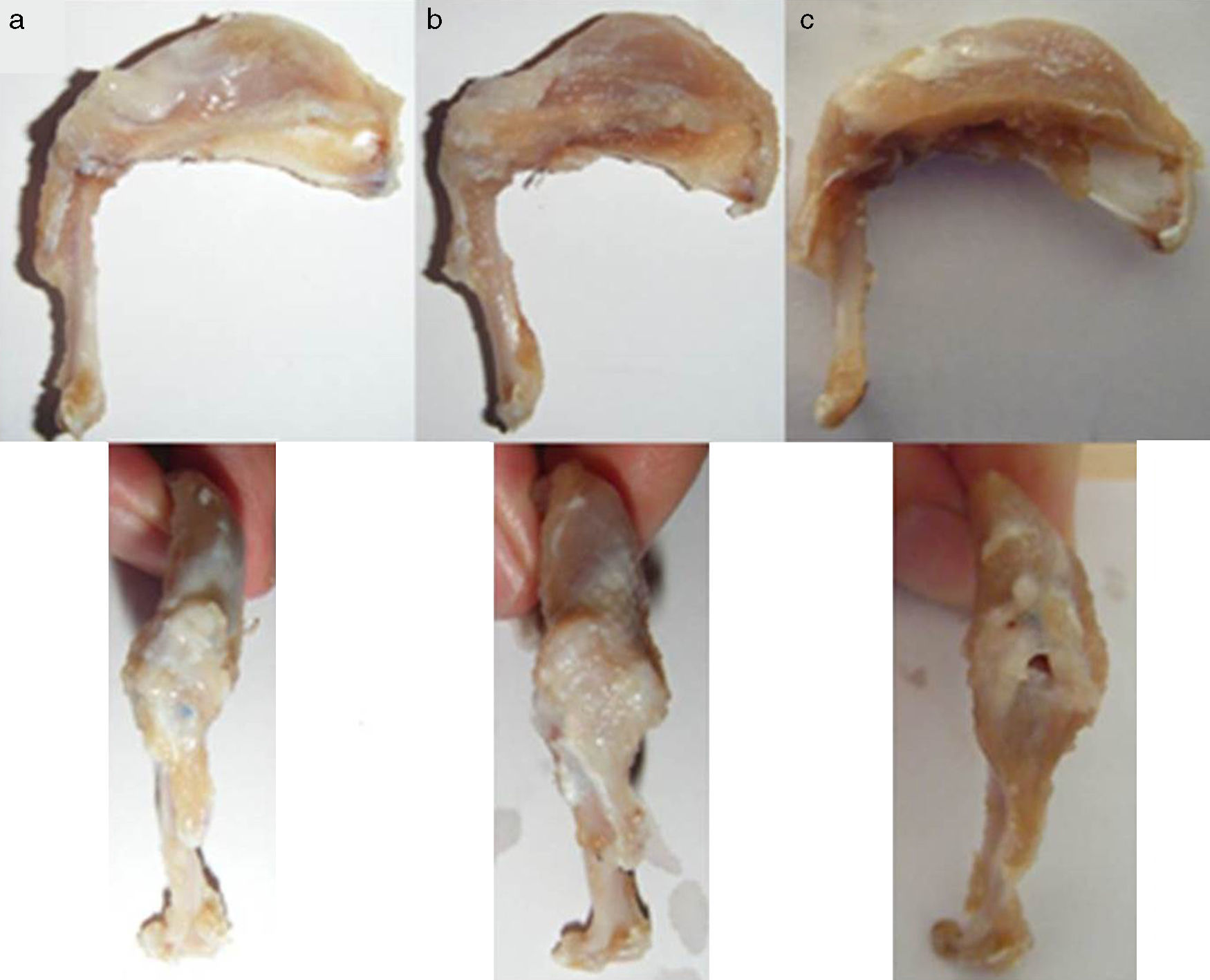
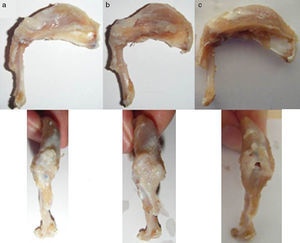
Resultados macroscópicosTras el primer tiempo del procedimiento quirúrgico se objetivó en la evaluación macroscópica la presencia de una rotura del tendón en su inserción en el troquíter con retracción del tendón en el 100% de los casos (fig. 4). Al reparar dicha lesión se consiguió restaurar la inserción tendinosa en el troquíter en todos los casos, sin embargo, en 3 de ellos esta sutura se encontraba con excesiva tensión. En la evaluación macroscópica final, después del sacrificio de los animales, se objetivó la continuidad del tendón en todos los animales salvo en 3 casos, en los que existía una rerrotura y que coincidían con los 3 casos en los que la sutura quedó a tensión. Así mismo, en 6 casos hallamos algún tipo de calcificación macroscópica (fig. 5).
En la tabla 2 se resumen las características macroscópicas de las piezas de estudio.
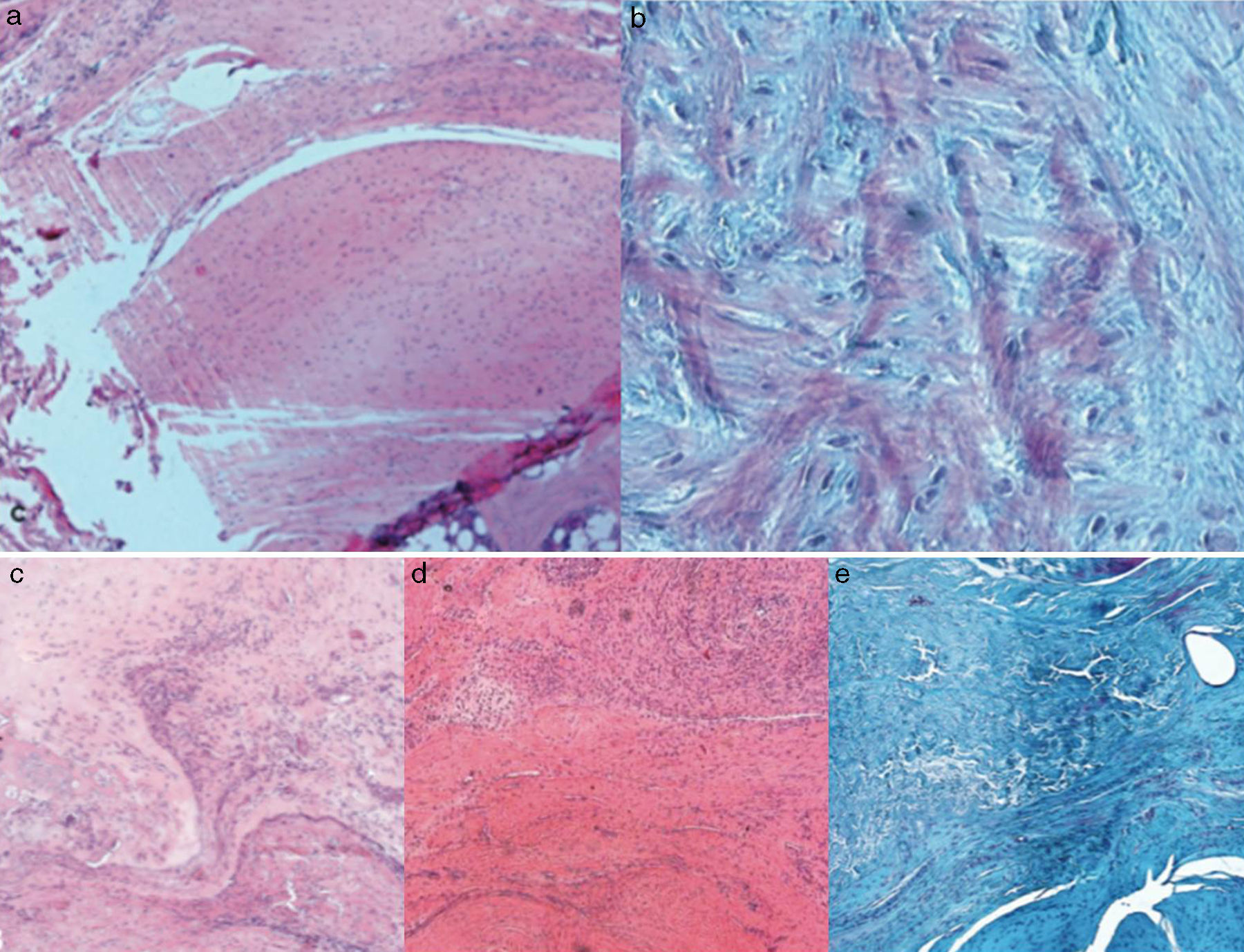
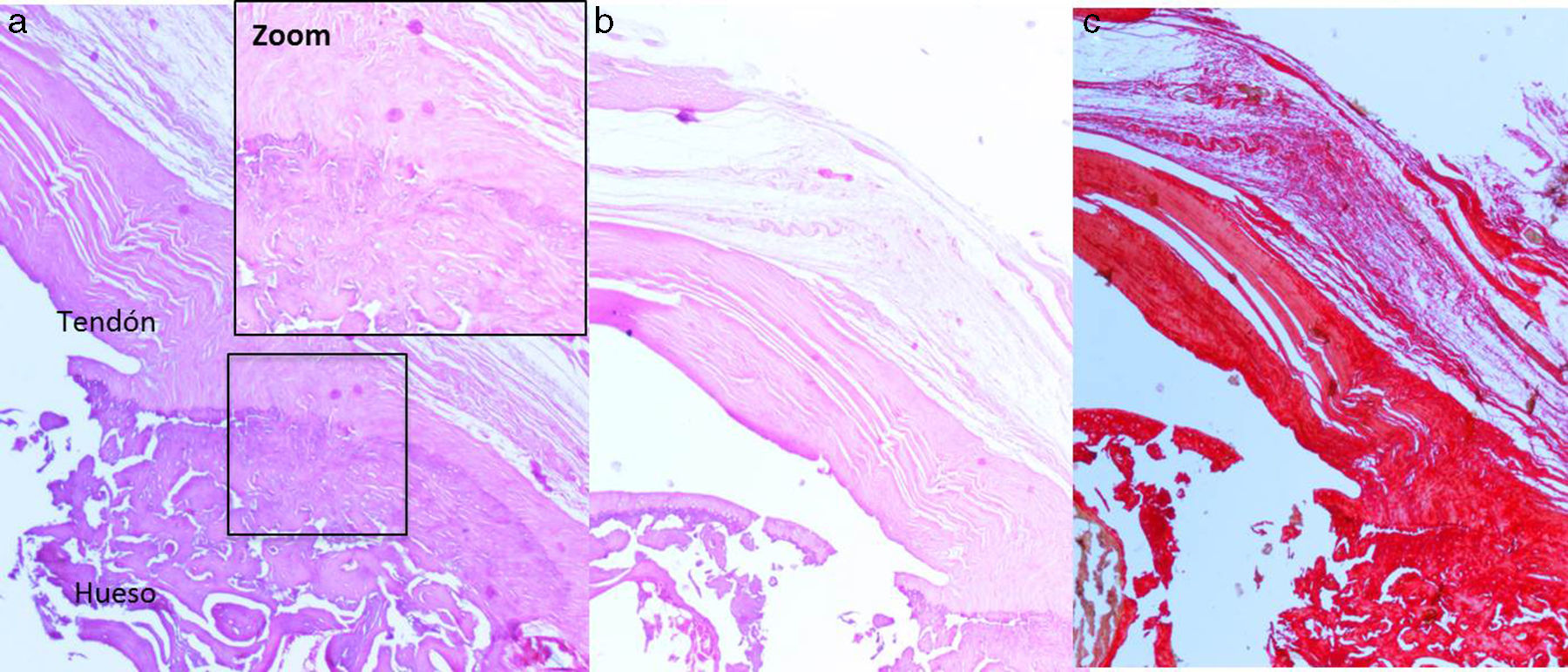
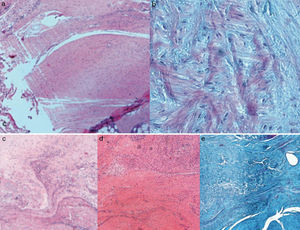
Resultados histológicosEn el grupo I se observa metaplasia condroide y desorganización de las fibras de colágeno como consecuencia de la degeneración tendinosa así como un incremento de la vascularización. En el grupo II predomina la desorganización de las fibras de colágeno, la aparición de fibroblastos y la ausencia de una correcta transición hueso-tendón con ausencia de zonas fibrocartilaginosas, como sucede de forma natural en el tendón. En los grupos III y IV, a diferencia de los 2 anteriores, las fibras aparecen más ordenadas y la vascularización es menor (fig. 6). Finalmente, en el grupo V el componente inflamatorio es considerablemente menor y la transición tendinosa entre el hueso y el tendón presenta un aspecto muy similar al encontrado en condiciones fisiológicas.
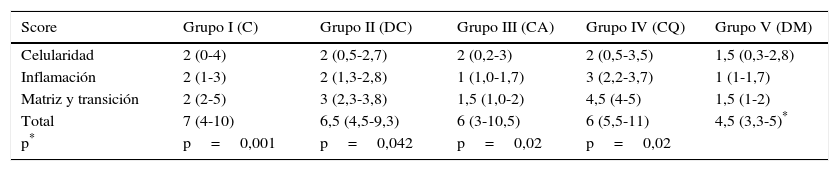
La puntuación histológica alcanzada por los grupos con transportador con o sin rhBMP-2 (grupos II, III, IV, V) resulta significativamente superior (p<0,05) a la alcanzada por el grupo con solo sutura (grupo I). A su vez, comparando la puntuación total alcanzada por los grupos que contienen rhBMP-2, en la escala de valoración histológica hemos hallado de manera estadísticamente significativa una menor puntuación del grupo V en relación con los grupos III y IV respectivamente. Los resultados se encuentran resumidos en la tabla 3.
Puntuación obtenida por los diferentes grupos en la escala de evaluación histológica
| Score | Grupo I (C) | Grupo II (DC) | Grupo III (CA) | Grupo IV (CQ) | Grupo V (DM) |
|---|---|---|---|---|---|
| Celularidad | 2 (0-4) | 2 (0,5-2,7) | 2 (0,2-3) | 2 (0,5-3,5) | 1,5 (0,3-2,8) |
| Inflamación | 2 (1-3) | 2 (1,3-2,8) | 1 (1,0-1,7) | 3 (2,2-3,7) | 1 (1-1,7) |
| Matriz y transición | 2 (2-5) | 3 (2,3-3,8) | 1,5 (1,0-2) | 4,5 (4-5) | 1,5 (1-2) |
| Total | 7 (4-10) | 6,5 (4,5-9,3) | 6 (3-10,5) | 6 (5,5-11) | 4,5 (3,3-5)* |
| p* | p=0,001 | p=0,042 | p=0,02 | p=0,02 |
Valor de mediana (25-75 percentiles). A mayor puntuación, peor resultado.
C: control; CA: control alginato; CQ: control quitina; DC: doble control; DM: doble muestra.
p*: valor de significación estadística al comparar el grupo V con el resto de grupos.
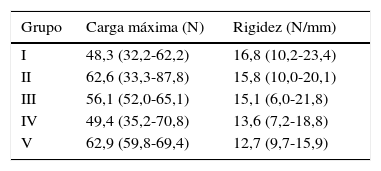
Al realizar la comparación entre los 5 grupos se observó que los hombros del grupo V ofrecían menor rigidez que los hombros de los demás grupos, siendo las diferencias estadísticamente significativas solo en relación con los grupos I y II (p=0,029, p=0,003). La carga máxima media hasta el fracaso fue de 48,3N para el grupo I, 62,6N para el grupo II, 56N para el grupo III, 49,4N para el grupo IV y 62,9N para el grupo V. En la tabla 4 se recogen los resultados de dicha evaluación.
Valores obtenidos por los diferentes grupos en la evaluación biomecánica
| Grupo | Carga máxima (N) | Rigidez (N/mm) |
|---|---|---|
| I | 48,3 (32,2-62,2) | 16,8 (10,2-23,4) |
| II | 62,6 (33,3-87,8) | 15,8 (10,0-20,1) |
| III | 56,1 (52,0-65,1) | 15,1 (6,0-21,8) |
| IV | 49,4 (35,2-70,8) | 13,6 (7,2-18,8) |
| V | 62,9 (59,8-69,4) | 12,7 (9,7-15,9) |
Valor de mediana (25-75 percentiles).
El principal objetivo de la cirugía del manguito rotador es la reparación de la rotura tendinosa con el fin de restablecer la continuidad entre el músculo y el hueso, de modo que se pueda recuperar la fuerza y la función.
Los desgarros agudos del manguito deben repararse de forma urgente, si es posible dentro de las primeras 3 semanas. Desafortunadamente, esta situación no es la que nos encontramos en nuestra práctica clínica diaria. Lo habitual es que acudan a nuestra consulta pacientes con roturas crónicas donde el manguito se encuentra retraído, fibroso, con degeneración de los bordes tendinosos y atrofia muscular asociada. Este es el tipo de rotura que se acompaña de una elevada tasa de «fracaso» tras su reparación. Por todo esto, el modelo experimental que hemos empleado de lesión crónica es un modelo que se aproxima bastante al escenario real con el que nos encontramos a diario.
La mayoría de los trabajos publicados en modelos animales utilizaban lesiones agudas en sus estudios27,28, sin tener en cuenta que la respuesta reparativa depende de si la lesión tiene una evolución aguda o crónica, ya que en las lesiones crónicas la característica predominante es la degeneración tendinosa, y la calidad tendinosa influye en la respuesta reparativa. Algunos autores, como Gimbel et al.29, en modelos de lesión crónica han observado una regeneración natural del tendón. En nuestro estudio, no hemos evidenciado regeneración tendinosa alguna. Los resultados macroscópicos constataban la presencia de un agujero o brecha en la zona donde debía estar presente el tendón supraespinoso, no existiendo por lo tanto una recuperación natural del tendón en el momento de la reintervención, lo que confirma la validez del modelo empleado. La ausencia de esta actividad de regeneración espontánea podría estar en relación con la edad de los animales empleados. Hay estudios30 que emplean animales jóvenes en el modelo de lesión; nosotros hemos empleado animales más maduros (8 meses de edad) en los que la respuesta reparativa se encuentra ya de por sí considerablemente disminuida, reproduciendo más exactamente lo acontecido en el humano.
Nuestra hipótesis de partida era que el empleo del transportador seleccionado en combinación con rhBMP-2 mejoraba el proceso de reparación, tanto histólogica como biomecánicamente.
Los resultados histológicos indicaron una mejoría en la calidad tendinosa de los hombros que tenían transportador, incluso sin rhBMP-2, con respecto a los del grupo I reparados únicamente con Prolene®. Esto podría estar relacionado con 2 hechos. Por un lado creemos que el transportador puede proporcionar resistencia a las enzimas responsables de la degeneración tendinosa disminuyendo de alguna manera el proceso inflamatorio, y por otro lado, el transportador refuerza la sutura tendinosa proporcionando un apoyo biomecánico adicional a la sutura. En este sentido, la combinación del alginato con la quitina resulta esencial. Hay muchos materiales que pueden emplearse en los procesos de ingeniería tisular pero pocos que reúnan las características idóneas. Debe tratarse de un material biodegradable, pero capaz de proporcionar un soporte mecánico adecuado hasta que el tejido tendinoso se regenere.
El transportador que hemos empleado aquí une un material extremadamente biocompatible, como es el alginato, con otro, la quitina, que ha demostrado una excelente capacidad de adhesión celular en estudios previos20. Esta capacidad parece estar en relación con la naturaleza catiónica del biomaterial que permite interacciones electrostáticas con aniones como glicosaminoglicanos, proteoglicanos, etc.21. Dichas interacciones sirven como mecanismo para la retención y el reclutamiento de células, factores de crecimiento y citoquinas, lo que convierte a este transportador en un material híbrido ideal en los procesos de ingeniería tisular31. Otra ventaja adicional es que los fibroblastos embebidos en este transportador producen principalmente colágeno tipo I, que es el colágeno mayoritario en el tendón y ligamento sanos frente al colágeno tipo III, que es el mayoritario en los tendones y ligamentos lesionados y que además es biomecánicamente inferior al tipo I.
Por otro lado, los resultados obtenidos por el grupo V (grupo doble muestra) resultan ser superiores. Es decir, cuando añadimos la proteína morfogenética ósea (rhBMP-2) asociada a los 2 biomateriales (quitina y alginato) que constituyen nuestro transportador híbrido, la calidad de la reparación es mejor, de manera estadísticamente significativa, que en el resto de los grupos. Biomecánicamente, la rigidez de los tendones que tienen rhBMP-2 resulta inferior a la del resto de los grupos (aunque de manera significativa solo con respecto a los grupos que no contienen rhBMP-2). Esto se justifica por la presencia de una mayor elasticidad en los tendones que contienen rhBMP-2. Al incrementarse la deformación por la mayor elasticidad, el resultado del cociente carga/deformidad que es a lo que corresponde la rigidez disminuye. Entre 2 materiales con igual carga máxima en el punto de rotura es más frágil el que presente menor deformidad antes de romperse y, por lo tanto, el que menos energía haya absorbido antes de la rotura. Por lo que contrariamente pueda parecer, al evaluar los resultados, los tendones reparados con el transportador y rhBMP-2 resultaban más resistentes.
La acción in vitro de la BMP-2 sobre células tendinosas pertenecientes al manguito rotador ha sido analizada en estudios previos32. La aplicación de la BMP-2 incrementa la producción de colágeno tipo I de manera significativa, aunque no su expresión.
Varios autores apoyan estos resultados. Pelled et al.33 analizaron la histología y biomecánica del tendón de Aquiles de ratones tratados con cirugía y compuestos BMP-2 y la proteína intracelular SMAD8. El análisis histológico reveló una mejor distribución celular y una mayor recuperación funcional del grupo tratado con ambos compuestos. De igual manera, Kim et al.34 consiguen mejorar la reparación a nivel de la unión óseo-tendinosa introduciendo BMP-2 vehiculizada en colágeno en el sitio de inserción de los anclajes destinados a la reparación del tendón patelar de conejos. Con la adición de la proteína, no solo se conseguía mejorar las características histológicas de la reparación, sino que además se incrementaba considerablemente la fortaleza mecánica de la misma. Chen et al.35, mediante el empleo de células procedentes de periostio junto con BMP-2 vehiculizadas en un hidrogel (polietilenglicol diacrilato), comprueban que a las 8 semanas se incrementa la formación de fibrocartílago y hueso en la unión óseo-tendinosa en lesiones del manguito rotador en conejos. Con técnicas de inmunohistoquímica se evidencia la presencia de agrecanos y colágeno tipo II. Finalmente, comprueban en los estudios biomecánicos un incremento de la carga que es capaz de soportar el tendón antes de su fallo a dicho nivel. La única duda que nos queda en este estudio es cuánto atribuir a cada uno de los elementos empleados en la ingeniería de tejidos, ¿se debe la mejora al empleo de la BMP-2, de las células, o a la combinación de ambos elementos? En este sentido, la contribución de las células al proceso reparador, aunque no es el objeto de nuestro estudio, sigue siendo motivo de controversia. Mientras que hay autores que han podido constatar cómo su empleo mejoraba la carga máxima que es capaz de soportar el tendón36, para otros37 la utilización de células troncales derivadas de lipoaspirado no recrea la organización celular de la entesis ni mejora las propiedades biomecánicas de la misma.
En nuestro estudio, obtuvimos una mejor regeneración tendinosa en todos los grupos con transportador comparado con solo sutura, y cuando el transportador se asocia a rhBMP-2 estos resultados mejoran. Parece que a mayor concentración de rhBMP-2, mejores características del tejido de regeneración. No se detectaron diferencias entre el grupo control alginato y control quitina lo que sugiere la ausencia de diferencias bioquímicas en relación con la unión de la proteína morfogenética a uno u otro componente del transportador híbrido. La mayor tasa de rerroturas encontradas en el grupo control alginato se atribuyen a la presencia en este grupo de un mayor número de suturas a tensión con relación a una mayor retracción del tendón al crear el modelo de lesión crónica, y no a las características del transportador en sí.
Por lo tanto, según los resultados que hemos obtenido, podríamos concluir que el empleo de rhBMP-2 vehiculizada en un transportador híbrido de alginato y quitina parece tener un efecto beneficioso en la reparación tendinosa a nivel de la interfaz tendón-hueso, y dichos cambios parecen influir en la mejora de las propiedades biomecánicas del tendón. No obstante, debido a la cantidad de factores que intervienen en la respuesta reparativa, son necesarios más estudios que optimicen aspectos como la dosis idónea de rhBMP-2 y la durabilidad de los resultados obtenidos.
Nivel de evidenciaNivel de evidencia I
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo ha sido financiado a través de una beca concedida por la Fundación SECOT para la investigación Básica, 2013.
AutoríaYL y CA han contribuido por igual a la realización del manuscrito.
Conflicto de interesesLos autores declaran no presentar conflicto de intereses.