INVESTIGACIÓN
Respuesta biológica frente a partículas de polietileno y titanio. Estudio experimental en ratas utilizando técnicas inmunohistoquímicas
Biological response to polyethylene and titanium particles. Experimental study in rats using immunohistochemical techniques
SEGURA MATA, J. C.*; ALBAREDA ALBAREDA, J.*; CASTIELLA MURUZÁBAL, T.**; SORIA NAVARRO, J.**, y SERAL ÍÑIGO, F.*
* Servicio de Cirugía Ortopédica y Traumatología. ** Servicio de Anatomía Patológica. Hospital Clínico Universitario Lozano Blesa. Universidad de Zaragoza. Zaragoza.
Correspondencia:
Dr. J. C. SEGURA MATA.
Avda. Roma, 18.
43005 Tarragona.
Premio Fundación SECOT 1997 de Investigación Básica.
RESUMEN: Se diseña un modelo experimental in vivo para estudiar mediante técnicas inmunohistoquímicas la respuesta del hueso de la rata tras la inyección intraósea percutánea de partículas de polietileno (PE) y titanio (Ti), así como las posibles repercusiones de estas partículas en otros órganos. Ambos tipos de partículas han sido bien toleradas por el hueso de la rata, no produciéndose granulomatosis agresiva ni respuesta inflamatoria mediada por células. Frente a las partículas de polietileno se ha producido una movilización de células del sistema mieloide, ocasionando una mielitis inespecífica mientras que frente a las de titanio ha predominado la fibrosis y la neoformación ósea. No han existido diferencias significativas en cuanto al marcaje inmunohistoquímico, discutiéndose los factores que han podido influir en el tipo de respuesta biológica. Se han encontrado partículas de biomateriales en los pulmones con reacción inflamatoria asociada. Estos resultados apoyan la influencia de otros factores, además de la presencia de partículas, para que se produzca una respuesta biológica que conduzca a la osteolisis y al aflojamiento protésico. El contacto de las partículas con el espacio articular puede ser un factor determinante. Las partículas migradas pueden causar alteraciones en otros órganos.
PALABRAS CLAVE: Hueso. Biocompatibilidad. Polietileno. Titanio.
ABSTRACT: An experimental model in vivo was designed to study, using immunohistochemical techniques, the response of rat bone to percutaneous intraosseous injection of polyethylene (PE) and titanium (T) particles and the possible effect of these particles on organs. Both types of particle were well tolerated by bone in the rats and did not produce aggressive granulomatosis or a cell-mediated inflammatory response. Polyethylene particles elicited cellular mobilization by the myeloid system, producing non-specific myelitis. Titanium elicited fibrosis and bone neoformation. There were no significant differences in immunohistochemical marking. The factors that could have influenced biological response are discussed. Particles of the biomaterials were found in lungs and produced an associated inflammatory reaction. These results suggest that factors other than the presence of particles contribute to eliciting a response leading to osteolysis and prosthetic loosening. Contact between particles and the articular space may be a determinant factor. Particles that migrate produce disturbances in other organs.
KEY WORDS: Bone. Biocompatibility. Polyethylene. Titanium.
La sustitución protésica articular constituye uno de los mayores logros de la cirugía ortopédica, pero conlleva la aparición de nuevas complicaciones relacionadas con las partículas que se generan con el desgaste de los materiales implantados. Así, se ha demostrado la diseminación linfática y pulmonar de estas partículas en diversos trabajos,4,6,18,20,28,40 desconociéndose su repercusión. Hasta 199212 se habían publicado 28 casos de tumores malignos relacionados con artroplastias de cadera o rodilla, y aunque esta incidencia parece ser similar a la de la población general,32 se ha planteado5 que el acúmulo de partículas de desgaste en los ganglios linfáticos pueda ocasionar una estimulación crónica del sistema linfoide que aumente el riesgo de neoplasias linforreticulares. La aparición de pseudotumores en relación con estas partículas, fundamentalmente adenopatías y formaciones quísticas, tampoco es infrecuente.25,35,38 Prácticamente no existen trabajos experimentales in vivo21 que hayan estudiado las posibles repercusiones que la migración de las partículas de desgaste puedan ocasionar en otros órganos.
El aflojamiento aséptico por osteolisis de las artroplastias también parece relacionarse con las partículas de desgaste, principalmente de polietileno. Cabría pensar en un sinergismo entre partículas diferentes que no se ha demostrado.31 Se ha observado una reacción celular periprotésica que sugiere una respuesta inflamatoria frente a las partículas,1,2,37,39 habiéndose detectado en estos tejidos cifras elevadas de sustancias que estimulan la reabsorción ósea (PGE2, IL-1, TNF-ß y otros).10,14
Se ha descrito hipersensibilidad frente a metales y cemento,8,9,26,27,33 pero el mecanismo que inicia la respuesta y el papel de las partículas sigue siendo controvertido. Los trabajos de experimentación con partículas ofrecen resultados heterogéneos.13,15-17,21-24,41 Las técnicas de cultivo celular han permitido avanzar en el conocimiento de los mediadores inflamatorios, pero tienen los inconvenientes de las técnicas in vitro3,7,11,19,34,36,42
El objetivo fue diseñar un modelo experimental in vivo que nos permitiera comparar la respuesta biológica del hueso frente a distintas partículas de desgaste, estudiar su evolución, determinar si existe sinergismo y establecer si se produce difusión sistémica de estas partículas, y en caso afirmativo su repercusión.
Material y Método
Preparación de las partículas
-- Partículas de titanio, suministradas por Kronos International Inc., de dióxido de titanio puro (TiO2), de las empleadas en los componentes de titanio de las prótesis articulares.
-- Partículas de polietileno de ultra-alto peso molecular (Hostalen GUR, de Hoechst) empleadas en implantes clínicos.
El tamaño de las partículas se determinó mediante un microscopio electrónico de barrido (JEOL JSM 6400) con sistema de microanálisis por rayos X (eXL-10) de Link Analytical, encontrándose un tamaño homogéneo de las partículas de titanio (una micra de media) y más heterogéneo para las de polietileno (entre 2 y 100 micras). Como material disolvente de las partículas se utilizó el ácido hialurónico al 1% (Biolon). Previa esterilización se prepararon las dioluciones de 100 mg de partículas en 6 ml de ácido hialurónico al 1%.
Procedimiento experimental
Se emplearon las dos extremidades inferiores de 24 ratas Wistar adultas (entre 9 y 12 meses de edad), sin distinción de sexo (12 machos y 12 hembras), con un peso medio de 545 y 315 g, respectivamente. Las técnicas experimentales se realizaron en el Servicio de Biomedicina y Biomateriales de la Universidad de Zaragoza.
Se consideraron cuatro grupos de seis animales (12 tibias por grupo). Grupo 1, partículas de polietileno; Grupo 2, partículas de titanio; Grupo 3, partículas de polietileno y titanio a partes iguales, y Gru-
po 4, donde sólo se administró el disolvente (ácido hialurónico). Bajo anestesia general y en condiciones de asepsia y antisepsia practicamos una inyección intraósea única de forma percutánea con un trócar de punción lumbar de 0,6 mm de diámetro tras comprobar la situación mediante aspirado. Se dividió cada grupo en tres (cuatro tibias cada uno) según el tiempo transcurrido hasta el sacrificio: a) sacrificio al tercer día; b) al mes, y c) a los 2 meses. El sacrificio se practicó previa anestesia general en campana de éter mediante la inyección intracardíaca de cloruro potásico.
En condiciones de asepsia y antisepsia se extrajeron en bloque los dos tercios proximales de la tibia, incluyendo la articulación de la rodilla, y previa toma de muestras para cultivo microbiológico se introdujeron en frascos de formaldehído. Si alguna de las muestras de cultivo resultaba positiva se procedía a excluir esa tibia del estudio. Durante la necropsia también se recogían muestras de pulmón, hígado, bazo, riñones y de los ganglios linfáticos inguinales y paraaórticos.
Procedimientos histológicos
Las muestras fueron manipuladas por un anatomopatólogo especializado en patología ósea (TC) y otro especializado en técnicas de inmunohistoquímica (JS), desconociendo el grupo al que pertenecía cada muestra. Tras inclusión en parafina se realizaron cortes de 6 µm de espesor que se tiñeron con hematoxilina-eosina (H-E) y tricrómico de Gomori. Además se empleó luz polarizada para la visión de par-
tículas birrefringentes. La muestras del resto de órganos se procesaron y tiñeron con H-E.
Procedimiento inmunohistoquímico
Para el estudio de la reacción biológica se seleccionaron los siguientes anticuerpos monoclonales primarios frente a antígenos de rata: a) CD-4, clon W3/25, anticuerpo frente a células T CD-4 colaboradores (Serotec); b) CD-8, clon MRCOX-8, anticuerpo frente a células T CD-8 supresoras-citotóxicas (Serotec); c) CD-14, clon ED9, anticuerpo frente a antígenos leucocitarios de la serie mieloide (Serotec); d) CD-45, clon MRCOX-1, anticuerpo monoclonal frente a población linfoide; e) CD-68, clon KP1, anticuerpo monoclonal frente a macrófagos (Dako), y f) Ki-67, clon MiB-1, anticuerpo monoclonal frente al antígeno nuclear Ki-67, que se expresa en las poblaciones celulares que están en fase proliferativa (Inmunotech).
En el desarrollo de la técnica inmunohistoquímica se utilizó el método de la avidina-biotina-peroxidasa (ABC) de Vector y como cromógeno la diaminobencidina (Sigma). Para el descubrimiento antigénico fue necesario en ocasiones procesar las preparaciones en un horno microondas de tres a cinco pases cada 5 minutos a 750 watios.
Análisis morfométrico
Consistió en la búsqueda de partículas de desgaste y de las células asociadas, así como la existencia o no de fenómenos de fagocitosis o remodelación ósea (osteoformación u osteolisis) mediante la cuantificación objetiva de las células por inmunohistoquímica. La variabilidad de la densidad celular a nivel de la médula ósea obligó a utilizar un método semicuantitativo. Se seleccionó de forma aleatoria un campo a 400 aumentos en la metáfisis tibial. Se consideró respuesta negativa () cuando el porcentaje de células inmunomarcadas era menor del 5%, de + entre el 6-25%, ++ entre el 26-50% y +++ más del 50% de las células.
El análisis estadístico inferencial de la relación existente entre el inmunomarcaje y los distintos grupos se realizó mediante el test de Chi cuadrado, exacto de Fisher, con un nivel de significación en todos los casos de p ¾ 0,05.
Resultados
Efecto del polietileno
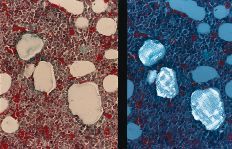
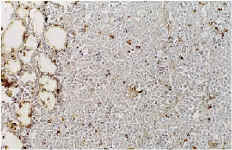
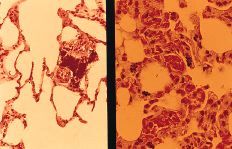
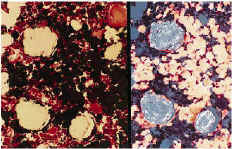
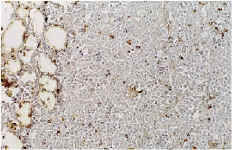
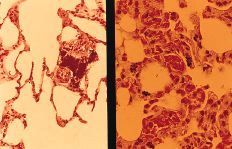
A nivel del hueso se observa en todos los casos la presencia de partículas birrefringentes a nivel metafisario rodeadas de un aumento de celularidad de la médula ósea (Fig. 1), sin encontrarse células gigantes en relación con las partículas ni fenómenos de fagocitosis. En algunas zonas se observa la formación de trabéculas nuevas de osteoide alrededor de las partículas (Fig. 2). Inmunohistoquímicamente, el marcador de la serie mieloide ha sido el predominante, con mínima expresión de los marcadores histiocitarios (Fig. 3) y linfocitarios, sin existir diferencias significativas entre los subgrupos cronológicos considerados (Tabla 1). Únicamente en el pulmón se encontraron partículas birrefringentes, que se observaban rodeadas de células gigantes y una corona de linfocitos (Fig. 4).
Tabla 1. Resultados estadísticos. No existen diferencias significativas entre los grupos de partículas y subgrupos cronológicos considerados. | |||||||||||
| Chip | IB | IC | IIA | IIB | IIC | IIIA | IIIB | IIIC | IVA | IVB | IVC |
| IA | 0,5 | 0 | 1,5 | - | - | 0,5 | - | - | 0,5 | - | - |
| 0,992 | 1 | 0,9131 | - | - | 0,9921 | - | - | 0,9921 | - | - | |
| IB | - | 1 | - | 0,5 | - | - | 2,5 | - | - | 0 | - |
| - | 0,9626 | - | 0,9921 | - | - | 0,7765 | - | - | 1 | - | |
| IC | - | - | - | - | 0,5 | - | - | 1,5 | - | - | 0,5 |
| - | - | - | - | 0,9921 | - | - | 0,9131 | - | - | 0,9921 | |
| IIA | - | - | - | 1,0000 | 1,33 | 1,33 | - | - | 1,33 | - | - |
| - | - | - | 0,9626 | 0,9315 | 0,9315 | - | - | 0,9315 | - | - | |
| IIB | - | - | - | - | 0,33 | - | 2 | - | - | 0,33 | - |
| - | - | - | - | 0,997 | - | 0,8491 | - | - | 0,9970 | - | |
| IIC | - | - | - | - | - | - | - | 2,5 | - | - | 0,0000 |
| - | - | - | - | - | - | - | 0,7765 | - | - | 1,0000 | |
| IIIA | - | - | - | - | - | - | 2,5 | 2,5 | 0,0000 | - | - |
| - | - | - | - | - | - | 0,7765 | 0,7765 | 1,0000 | - | - | |
| IIIB | - | - | - | - | - | - | - | 0,0000 | - | 1,33 | - |
| - | - | - | - | - | - | - | 1,0000 | - | 0,9315 | - | |
| IIIC | - | - | - | - | - | - | - | - | - | - | 1,3300 |
| - | - | - | - | - | - | - | - | - | - | 0,9315 | |
| IVA | - | - | - | - | - | - | - | - | - | 0 | 0 |
| - | - | - | - | - | - | - | - | - | 1 | 1 | |
| IVB | - | - | - | - | - | - | - | - | - | - | 0 |
| - | - | - | - | - | - | - | - | - | - | 1 | |
| I: Grupo polietileno. II: Titanio. III: Polietileno y titanio. IV: Control. A: Sacrificio al tercer día. B: Al mes. C: A los 2 meses. | |||||||||||
Figura 1. Tricrómico de Gomori (*400), luz convencional y a la derecha con luz polarizada. Partículas de polietileno en el hueso ocasionando un aumento de la celularidad a expensas de células del sistema mieloide. Ausencia de células gigantes e infiltrado inflamatorio frente a las partículas.
Figura 2. H-E (*200). Partículas de polietileno con formación de tra béculas nuevas de osteoide alrededor. No respuesta inflamatoria asociada.
Figura 3. Marcador CD-68 (*400). Falta de expresión del antígeno macrofágico en relación con las partículas de polietileno.
Figura 4. Muestra pulmonar. Hematoxilina-eosina (*200), luz convencional y a la derecha con luz polarizada. Partícula de polietileno en el pulmón rodeada de células gigantes y linfocitos.
Efecto del titanio
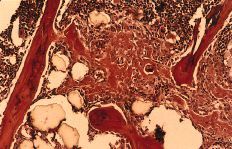
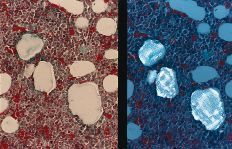
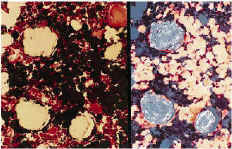
A nivel metafisario se observan partículas inmersas en un tejido fibroso que ocasiona una disminución de la celularidad medular. Bajo luz polarizada se observan núcleos celulares en relación con las partículas de titanio que demostraría la fagocitosis de estas partículas (Fig. 5). Alrededor de los acúmu los importantes de partículas existen signos de osteoformación que no tienen relación con el proceso reparativo del orificio cortical practicado con el trócar (Fig. 6). Inmunohistoquímicamente no se encontraron diferencias respecto al grupo del polietileno (Tabla 1). A nivel pulmonar se observan partículas de titanio en el interior de células macrofágicas (Fig. 7).
Figura 5. Tricrómico de Gomori (*200), luz convencional y a la derecha con luz polarizada. Partículas negras de titanio ocasionando fibrosis. Bajo luz polarizada se observan núcleos celulares en relación con las partículas de titanio (posible fagocitosis).
Figura 6. Tricrómico de Gomori (*100), luz convencional y a la derecha con luz polarizada. Partículas y acúmulos de titanio con fibrosis asociada y fenómenos osteoformativos alrededor.
Figura 7. Muestra pulmonar. H-E. A la izquierda, *200; a la derecha, *400. Partículas de titanio en los pulmones, en el interior de los macrófagos alveolares.
Efecto conjunto del polietileno y titanio
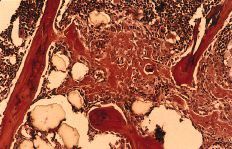
A nivel metafisario se observan acúmulos de ambos tipos de partículas, ocasionando respectivamente una respuesta similar a los dos grupos de inyección única (Fig. 8). Desde el punto de vista inmunohistoquímico no se encuentran diferencias entre este grupo y el resto considerados (Tabla 1).
Figura 8. H-E (*200), luz convencional y a la derecha con luz polarizada. Partículas de polietileno y titanio en el hueso sin respuesta inflamatoria aparente. Núcleos celulares en relación al titanio bajo luz polarizada.
Efecto de la solución control
No se observan partículas en la medular ósea, existiendo un discreto aumento de la celularidad a expensas inmunohistoquímicamente de células de la serie mieloide.
Discusión
En el diseño experimental se decidió seleccionar partículas de PE y Ti, ya que a las primeras se las considera las principales responsables de los aflojamientos protésicos por osteolisis mientras que al Ti se le considera el prototipo de la biocompatibilidad. Estas diferencias se plantearon en un modelo experimental mostrando que diversas partículas, y sobre todo las de polietileno, eran capaces de frenar e impedir el crecimiento óseo, aunque no las de titanio.17 Gonzales y cols.11 también han encontrado in vitro una menor reacción inflamatoria frente a las partículas de titanio.
El modelo experimental se consideró válido, fiable y reproducible, ya que en todos los casos se han observado acúmulos de partículas en la metáfisis tibial de la rata. La gran variabilidad celular existente en la medular metafisaria impidió la aplicación de métodos informáticos cuantitativos, por lo que se utilizó un método semicuantitativo.
En cuanto a los órganos biopsiados no se encontró en ningún caso hipertrofia de los ganglios linfáticos, aunque dadas las limitaciones del modelo no elimina la posibilidad de migración de las partículas por el sistema linfático como se ha demostrado en la práctica clínica.4,6,18,20,28,40
Se han encontrado partículas de PE y Ti en los pulmones, ocasionando una respuesta inflamatoria. Estos hallazgos refuerzan la importancia que puede tener la migración de las partículas de desgaste a otras localizaciones y las repercusiones que pueden ocasionar. En la práctica clínica debería desarrollarse un método sistematizado de detección de partículas para poder establecer sus repercusiones a largo plazo.12 Este mismo autor advierte del riesgo del par de fricción metal-metal por la liberación de gran número de constituyentes iónicos.
A nivel del hueso no se han encontrado diferencias significativas ni entre los grupos de partículas (PE y Ti) ni con el grupo control. Tampoco se ha producido sinergismo entre ambos tipos de partículas ni se han encontrado diferencias entre los grupos cronológicos. Desde el punto de vista de histología descriptiva sí se detectaron diferencias. Con el Ti se observaron fenómenos de fagocitosis sin acompañarse de reabsorción ósea y predomina la fibrosis, mientras que frente al polietileno no hay tal fagocitosis y predomina un aumento de la celularidad. Sobre todo, alrededor del Ti se observa osteoformación, que en mucha menor medida también se ve con el PE. Lo que más ha llamado la atención ha sido la falta de expresividad del anticuerpo CD-68 (marcador macrofágico) frente a las partículas de polietileno. En el caso del titanio, al existir fenómenos de fagocitosis la coloración negra de las partículas ha podido enmascarar el inmunomarcaje de estas células.
Los factores que han podido influir en la falta de respuesta inflamatoria frente a las partículas son múltiples: a) el tipo y tamaño de las partículas. Se decidió utilizar un PE de peso molecular ultra-alto por ser el que se utiliza en la clínica, mientras que otros autores emplearon el de alto peso molecular.13,15-17,21-24 Aunque Li y Wrigth30 han propuesto el 415GUR de la casa Hoeschst, fabricado a partir del polvo 4150HP, éste se presenta en forma de barras y no en forma de partículas implantables. Para poder comparar objetivamente los resultados es imprescindible un acuerdo entre la comunidad científica en cuanto al tipo de partícula que se debe utilizar.29 En nuestro modelo la falta de respuesta macrofágica frente al PE se ha podido deber a la elevada carga electrostática de las partículas, que dificultaría la adherencia celular,42 así como al tamaño relativamente grande y la concentración utilizadas. Sin embargo, Howie y cols.22 utilizaron tamaños y concentraciones similares y consiguieron reproducir una respuesta biológica. En nuestro modelo las partículas de PE encontradas en el pulmón sí activaron a los macrófagos y linfocitos, por lo que las partículas sí son capaces de producir respuesta inflamatoria. Deben existir otros factores que expliquen la falta de respuesta del hueso frente a ellas. Otros autores41 también han encontrado falta de respuesta frente al PE, considerando que deben existir factores mecánicos adicionales (como el micromovimiento o la influencia de la presión del líquido articular) para que se produzca la cascada biológica que conduce a la osteolisis; b) la inyección única ha podido influir, ya que no se reproduce la liberación continua de partículas que sucede en la práctica. Sin embargo, otros modelos de inyección única13,15 encontraron que una dosis única de PE inyectadas en la médula ósea de la tibia del conejo ocasionaba una reacción similar a la observada en los aflojamientos protésicos, aunque no con partículas de Ti y de Cr-Co, y c) el contacto con el espacio articular, ausente en este modelo por la falta de respuesta frente a las partículas, hablaría en favor de su influencia en el tipo de respuesta que se produce frente a las partículas. Un factor biológico que apoyaría esta hipótesis es la posibilidad de que las células responsables de la osteolisis periprotésica deriven de la cápsula articular como apuntaron Athanasou y cols.3 Además, las partículas a nivel intraóseo también están aisladas de la influencia de otros factores mecánicos como el micromovimiento o la presión del líquido articular, que pueden ser determinantes en el tipo de respuesta biológica. Con todo, otros modelos de inyección intraósea contradicen nuestros hallazgos.13,15
En nuestra opinión, deben existir otros factores además de la presencia de partículas de desgaste de biomateriales para que se produzca una respuesta biológica que conduzca a la osteolisis y al aflojamiento protésico. El contacto con el espacio articular puede ser un factor determinante. No debemos olvidar la capacidad de migración de estas partículas y la posibilidad de ocasionar alteraciones en otros órganos.
Agradecimientos
A la Universidad de Zaragoza por la concesión de la beca 214-27, que ha hecho posible la realización de este trabajo.
Bibliografía
1.Amstutz, HC; Campbell, P; Kossousky, N, y Clarke, IC: Mechanism and clinical significance of wear debris induced osteolysis. Clin Orthop, 276: 7-18, 1992.
2.Appel, AM; Sowder, WG; Siverhus, SW; Hopson, CN, y Herman, JH: Prosthesis associated pseudomembrane induced bone resortion. Br J Rheumatol, 29: 32-36, 1990.
3.Athanasou, NA; Quinn, J, y Bulstrode, CJK: Resorption of bone by inflammatory cells derived from the joint capsule of hip arthroplasties. J Bone Joint Surg, 74B: 57-62, 1992.
4.Benz, EB; Sherburne, B; Hayek, JE; Falchuk, KH; Sledge, CB, y Spector, M: Lymphadenopathy associated with total joint prostheses. A report of two cases and a review of the literature. J Bone Joint Surg, 78A: 588-593, 1996.
5.Bullough, PG: Bullough and Vigorita''s Orthopaedic Pathology. Mosby-Wolfe, 1997.
6.Case, C; Langkamer, VG; James, C; Palmer, MR; Kemp, AJ; Heap, PF, y Solomon, L: Widespread dissemination of metal debris from implants. J Bone Joint Surg, 76B: 701-712, 1994.
7.Charissoux, JL; Najid, A; Cook, J; Setton, D, y Rigaud, M: Development of in vitro biocompatibility assays for surgical material. Clin Orthop, 326: 259-269, 1996.
8.Evans, EM; Freeman, MAR; Miller, AJ, y Vernon Roberts, B: Metal sensitivity as a cause of bone necrosis and loosening of prostheses in total joint replacements. J Bone Joint Surg, 56B: 626-629, 1974.
9.Gil Albarova, J; Laclériga, A; Barrios, C, y Cañadell, J: Lymphocyte response to polymethylmethacrylate in loose total hip prostheses. J Bone Joint Surg, 74B: 825-830, 1992.
10.Goldring, SR; Schiller, AL; Roelke, M; Rourke, CM; O''Neill, DA, y Harris, WH: The synovial like membrane in loose total hip replacements and its proposed role in bone lysis. J Bone Joint Surg, 65A: 575-584, 1983.
11.Gonzales, JB; Purdon, MA, y Horowitz, SM: In vitro studies on the role of titanium in aseptic loosening. Clin Orthop, 330: 244-250, 1996.
12.Goodfellow, J: Malignancy and joint replacement. J Bone Joint Surg, 74B: 645, 1992.
13.Goodman, SB; Fornasier, VL, y Kei, J: The effects of bulk versus particulate ultra high molecular weight polyethylene on bone. J Arthroplasty, suppl 3: S41-S46, 1988.
14.Goodman, SB; Chin, RC; Chiou, SS; Schurman, DJ; Woolson, ST, y Masada, MP: A clinical pathologic biochemical study of the membrane surronding loosened and non-loosened total hip arthroplasties. Clin Orthop, 244: 182-187, 1989.
15.Goodman, SB; Fornasier, VL; Lee, J, y Kei, J: The effects of bulk versus particulate titanium and cobalt chrome alloy implanted into the rabbit tibia. J Biomed Mat Res, 24: 1539-1549, 1990.
16.Goodman, S; Wang, JS; Reguia, D, y Aspenberg, P: T-lymphocytes are not necessary for particulate polyethylene-induced macrophage recruitment. Histologic studies of the rat tibia. Acta Orthop Scand, 65: 157-160, 1994.
17.Goodman, S; Aspenberg, P; Song, Y; Regula, D, y Lidgren, L: Polyethylene and titanium alloy particles reduce bone formation. Dose-dependence in bone harvest chamber experiments in rabbits. Acta Orthop Scand, 67: 599-605, 1996.
18.Gray, MH; Talbert, ML; Talbert, WM; Bansal, M, y Hsu, A: Changes seen in lymph nodes draining the sites of lagge joint prostheses. Am J Surg Pathol, 13: 1050-1056, 1989.
19.Haynes, DR; Rogers, SD, y Hay, S: The differences in toxocity and release of bone-resorbing mediators induced by titanium and cobalt-chromium-alloy wear particles. J Bone Joint Surg, 75A: 825-834, 1993.
20.Hicks, DG; Judkins, AR; Sicker, JZ; Rosier, RN; Puzas, JE, y O''Keefe, RJ: Granular histiocytosis of pelvic lymph nodes following total hip arthroplasty. The presence of wear debris, citokine production and inmunologically activated macrophages. J Bone Joint Surg, 78A: 482-496, 1996.
21.Howie, DW, y Vernon-Roberts, B: The synovial response to intra-articular cobalt-chrome wear particles. Clin Orthop, 232: 244-254, 1988.
22.Howie, DW; Vernon-Roberts, B; Oakeshott, R, y Manthey, B: A rat model of resorption of bone at the cement bone interface in the presence of polyethylene wear particles. J Bone Joint Surg, 70A: 257-263, 1988.
23.Howie, DW; Manthey, B; Hay, S, y Vernon-Roberts, B: The synovial response to intra-articular injection in rats of polyethylene wear particles. Clin Orthop, 292: 352-357, 1993.
24.Howie, DW; Haynes, DR; Rogers, SD; McGee, MA, y Pearcy, MJ: The response to particulate debris. Orthop Clin North Am, 24: 571-582, 1993.
25.Jacobs, JJ; Urban, RM; Wall, J; Black, J; Reid, JD, y Veneman, L: Unusual foreigm-body reaction to a failed total knee replacement: Simulation of a sarcoma clinically and a sarcoid histologically. J Bone Joint Surg, 77A: 444-451, 1995.
26.Jones, DA; Lucas, K; O''Driscoll, M; Price, CHG, y Wibberley, B: Cobalt toxicity after McKee hip arthroplasty. J Bone Joint Surg, 57B: 289-296, 1975.
27.Lalor, PA; Freeman, MAR, y Revell, PA: Sensitivity to titanium. J Bone Joint Surg, 73B: 25-28, 1991.
28.Langkamer, VG; Case, C; Heap, P; Taylor, A; Collins, C; Pearse, M, y Solomon, L: Systemic distribution of wear debris after hip replacement. A cause for concern? J Bone Joint Surg, 74B: 831-839, 1992.
29.Leigh, HD; Taylor, P; Swaney, A, y Black, J: Research and development report: Production of fine particulate ultra high molecular weight polyethylene for biological response studies. J Appl Biomat, 3: 77-80, 1992.
30.Li, S, y Wright, T: Letters to the editor. J Orthop Res, 13: 152, 1995.
31.Maloney, WJ; Smith, RL; Castro, F, y Schurman, DJ: Fibroblast response to metallic debris in vitro. Enzyme induction, cell proliferation and toxicity. J Bone Joint Surg, 75A: 835-844, 1993.
32.Mathiesen, EB; Ahlbom, A; Bermann, G, y Lidgren, JU: Total hip replacement and cancer. J Bone Joint Surg, 77B: 345-350, 1995.
33.Merrit, K, y Rodrigo, JJ: Inmune response to synthetic materials. Sensitizatation of patients receiving orthopaedic implants. Clin Orthop, 326: 71-79, 1996.
34.Murray, DW, y Rushton, N: Macrophages stimulate bone resorption when they phagocytose particles. J Bone Joint Surg, 72B: 988-992, 1990.
35.Nolan, JF, y Bucknill, TM: Aggresive granulomatosis from polyethylene failure in an uncemented knee replacement. J Bone Joint Surg, 74B: 23-24, 1992.
36.Sabokbar, A; Fujikawa, Y; Brett, J; Murray, DW, y Athanasou, NA: Increased osteoclastic differentiation by PMMA particle-associated macrophages. Inhibitory effect by interleukin 4 and leukemia inhibitory factor. Acta Orthop Scand, 67: 593-598, 1996.
37.Schmalzried, TP; Jasty, M, y Harris, WH: Periprosthetic bone loss in total hip arthroplasty. Polyethylene wear debris and the concept of the effective joint space. J Bone Joint Surg, 74A: 849-863, 1992.
38.Segura, JC; Palanca, D; Bueno, A; Seral, B; Castiella, T, y Seral, F: Baker''s pseudocyst in the prosthetic knee affected with aggressive granulomatosis caused by polyethylene wear. Chir Organi Mov, LXXXI: 421-426, 1996.
39.Shanbhag, AS; Jacobs, JJ; Glant, TT; Gilbert, JL; Black, J, y Galante, J: Composition and morphology of wear debris in failed uncemented total hip replacement. J Bone Joint Surg, 76B: 60-67, 1994.
40.Shea, KG; Bloebaum, RD; Avent, JM; Birk, GT, y Samuelson, KM: Analysis of lymph nodes for polyethylene particles in patients who have had a primary joint replacement. J Bone Joint Surg, 78A: 497-504, 1996.
41.Van der vis, HM; Marti, RK; Tigchelaar, W, y Schüller, HM: Benign cellular responses in rats to different wear particles in intraarticular and intramedullary environments. J Bone Joint Surg, 79B: 837-843, 1997.
42.Wooley, PH; Nasser, S, y Fitzgerald, RH: The inmune response to implant materials in humans. Clin Orthop, 326: 63-70, 1996.