Cuando se produce una sección nerviosa con separación significativa de los cabos es necesario utilizar una prótesis, a modo de puente, para suturarlos. La mejor prótesis es un segmento de nervio autógeno, pero presenta importantes inconvenientes. Nuestro objetivo es comparar la eficacia de la sutura simple con la tubulización para el implante de una prótesis de nervio isogénico descelularizado.
Material y métodoSe utilizan 4 grupos de ratas Wistar. Grupo 0: animales donantes de nervio ciático. Grupo 1: recibió el implante con sutura término-terminal. Grupo 2: recibió el implante dentro de un tubo de ¿-caprolactona. Grupo 3: lo recibió en un tubo de poliláctico-co-glicólico. Se evaluó la función motora (índice ciático) y la extensión de la regeneración (estudio histológico) a las 3 semanas del implante.
ResultadosLa regeneración ha sido irregular en los 3 grupos experimentales. En todos hay implantes en los que las fibras nerviosas regeneran la longitud máxima estudiada (15mm) y otros en los que la regeneración es muy escasa. La longitud media de regeneración es mayor en el grupo de sutura directa (G1), aunque la velocidad es similar en los 3. El grupo 1 muestra el mayor porcentaje de regeneración, aunque la variabilidad de los resultados impide que esta diferencia alcance significación estadística. No hemos hallado diferencias significativas entre los dos grupos con tubos de diferentes polímeros.
ConclusiónPara implantar prótesis de nervios isogénicos descelularizados es más eficaz, en nuestras condiciones experimentales, la sutura término-terminal que los tubos de polímeros biocompatibles.
When a nerve section with a significant gap occurs, it is necessary to use a prosthesis to suture it. To date an autologous nerve segment graft appears to be the best treatment; but it has several important disadvantages. Our goal is to study the effectiveness of an isogenic acellular nerve prosthesis comparing a simple suture with tubulisation.
Material and methodFour groups of Wistar rats were used. The animals in Group 0 served as donors of nerve segments to graft. Group 1 received the implant with an end-to-end suture. In group 2, the implant was sutured inside an ¿-caprolactone tube. Group 3 received it in a polylactic-co-glycolic acid tube. We evaluated the motor function (sciatic index and step test in motion), and the regeneration length by histological study of regeneration, after a maximum of 3 weeks.
ResultsRegeneration was uneven in the three groups. In all groups, there were implants with regenerated nerve fibres at the maximum studied length (15mm) and others where regeneration was scarce. The mean regeneration length was greater in the direct end-to-end suture group (G1), although the regeneration speed was similar in the three groups. Group 1 showed the highest percentage of regeneration, but the variability of results prevents this difference reaching statistical significance. We found no significant differences between the two groups with polymer tubes.
ConclusionFor the implantation of isogenic acellular nerve prosthesis, under our experimental conditions, the direct end-to-end suture was more effective than when it isprotected with biopolymer tubes.
Las lesiones de los nervios periféricos representan una causa mayor de morbilidad y discapacidad en los pacientes afectos y genera altos costes económicos en una perspectiva global. En Suecia, la incidencia de lesiones es de 13,9/100.000 habitantes por año1. En Estados Unidos, 20 millones de americanos sufren lesiones de nervio periférico, con un coste anual de 150.000 millones de dólares2, por lo que estudios que aborden este tema no solo tendrán un gran interés sanitario, sino también importantes repercusiones socioeconómicas.
Cuando se secciona un nervio periférico sin pérdida de tejido y sin una separación excesiva de los cabos proximal y distal, la regeneración nerviosa puede conseguirse mediante una sutura simple término-terminal. Se considera aceptable una recuperación de la capacidad funcional de un nervio de entre el 30 y el 90%2. Sin embargo, lo más frecuente es que los cabos proximal y distal estén separados, bien por pérdida traumática de tejido nervioso o por la retracción de los cabos del nervio seccionado3. Cuando no pueden ser aproximados para suturarlos sin someterlos a una tensión excesiva, que impediría la regeneración, es necesario colocar un «puente biológico» que una los cabos proximal y distal del nervio y posibilite su reparación.
Hasta el momento, la mejor manera de reparar estas lesiones es el implante de segmentos de nervio autógeno3. Generalmente se sacrifica un nervio sensitivo del mismo paciente para regenerar un nervio motor. Estudios recientes4 indican que la eficiencia en la reparación de nervios mixtos es similar tanto para los nervios sensitivos como para los motores o mixtos. Los trasplantes autógenos presentan una serie de inconvenientes, tales como el aumento del tiempo y de la dificultad de la intervención quirúrgica, la escasez de nervio disponible, la desigualdad entre el tamaño del nervio implantado y el del nervio receptor, el dolor, la pérdida de sensibilidad o la formación de escaras o de neuromas5.
Para evitar estos inconvenientes se ha utilizado, como alternativa al nervio autógeno, una gran variedad de sustancias tanto sintéticas como biológicas. Entre las sustancias sintéticas, la silicona ha sido uno de los primeros materiales utilizados. Aunque los tubos de silicona no se consideran actualmente los más adecuados para la reparación de los nervios lesionados, siguen siendo un referente en los estudios experimentales6. Los polímeros sintéticos, tales como el ácido poliláctico, el ácido poliláctico-co-glicólico (PLCG), la ¿-caprolactona (¿-CPL) o mezclas de ellos han sido muy utilizados para fabricar estructuras tubulares que favorezcan la regeneración nerviosa7. Estos polímeros tienen unas cualidades mecánicas adecuadas para permitir su implante y son biocompatibles, por lo que permiten la regeneración nerviosa a su través. También se han descrito nuevos biomateriales, tales como los nanotubos de carbono8, que pueden servir como andamiaje para la regeneración de los nervios.
Así mismo, se han utilizado numerosas sustancias biológicas para elaborar prótesis implantables en neurectomías como son: tendón9, vasos sanguíneos10, músculo11 o láminas de fibrina12.
Según los principios de la ingeniería tisular, además de seleccionar los diferentes tipos de soportes, se ha de considerar el contenido de los tubos, incluidas las células y la matriz extracelular, así como las moléculas de señalización que pudieran ser de utilidad en la regeneración de los nervios13.
Para rellenar el interior de los tubos se ha utilizado una amplia gama de sustancias, tales como: filamentos de colágeno, para imitar la textura de los nervios14, geles de hidroxiacetil metacrilato, hidrogeles de alginato, quitosán15, etc. Los tipos celulares más utilizados en los implantes han sido las células madre mesenquimales16,17 y las células de Schwann. También se ha llevado a cabo, con resultados positivos, el implante, en neurectomías del nervio ciático, de células madre embrionarias18.
Desde un punto de vista estructural, lo más parecido al nervio autógeno es el implante de nervio alogénico, que en el caso de pacientes humanos puede proceder de donantes de órganos. Las ventajas serían, entre otras, la disponibilidad prácticamente ilimitada de nervio, la ausencia de lesión de un nervio sano, la reducción del tiempo y la dificultad de la intervención. El mayor inconveniente es la posibilidad de reacciones inmunogénicas17 que acabarían por destruir los nervios implantados.
Otra aproximación ha sido el intento de eliminar, mediante la descelularización, la capacidad antigénica de los segmentos nerviosos que se van a implantar19. La descelularización consiste en la extracción de las células y de la mayor parte de los componentes de la mielina. La descelularización con detergentes extrae, entre otras proteínas, las principales moléculas antigénicas, como son las de los complejos principales de histocompatibilidad, evitando así el rechazo inmunológico del implante20. De este modo se obtienen tubos de lámina basal que pueden ser ocupados por los axones en regeneración y por las células de Schwann emigrantes5, resultando implantes de nervios acelulares equivalentes a los implantes autógenos en cuanto a la regeneración obtenida21. También se han suplementado con células madre mesenquimales, con resultados peores que los implantes autógenos22.
El modo de unión de la prótesis y el nervio receptor (sutura, entubulación adhesivo biocompatible) tiene una considerable importancia23. En la clínica humana se han utilizado tres tipos de prótesis comercialmente disponibles: tubos de colágeno tipoi (NeuraGen®), tubos de poli-glicólico (Neurotube®) y nervio alogénico descelularizado Avance® (AxoGen® Inc., Alachua, FL) según el método de Hudson et al.21. Con NeuraGen® se han obtenido buenos resultados en defectos de nervio de la mano entre 0,5 y 3cm24. En un modelo experimental de rata, Whitlock et al.25 obtuvieron los mejores resultados con los implantes isogénicos (equivalentes a los autógenos), seguidos por los nervios alogénicos descelularizados (Avance®) y, en tercer lugar, los tubos de colágeno (NeuraGen®).
ObjetivosNuestro objetivo es comparar, en la reparación de una neurectomía experimental, la eficacia de la sutura simple frente a la de la entubulación en el implante de un segmento de nervio isogénico acelular.
Material y métodoSujetos y descelularización de segmentos nerviososSe han utilizado 4 grupos de ratas Wistar adultas jóvenes, machos y hembras. Cada uno de estos grupos contó, al menos, con 4 animales. En total se utilizaron 39 animales. Los animales han sido tratados y estabulados con arreglo a la normativa vigente de la Comunidad Europea (2010/636/EU) y del Estado Español (RD 52/2013).
Los animales del grupo 0 (G0, n=15) se utilizaron para obtener lo segmentos de los nervios acelulares isogénicos que fueron implantados. A los animales de este grupo se les tomó una porción de aproximadamente 1,2cm de los nervios ciáticos derecho e izquierdo. Estos nervios ciáticos fueron utilizados para fabricar los implantes descelularizados.
Al resto de los animales —grupo1 (G1, n=7), grupo2 (G2, n=9) y grupo3 (G3, n=8)— se les practicó una neurectomía de unos 7mm de longitud en el nervio ciático derecho. Las secciones del nervio ciático se realizan en todos los casos en un punto situado a una distancia de 70mm respecto de la punta del tercer dedo de la pata, a fin de asegurar en todos los animales una distancia equivalente para la regeneración axonal; a nivel distal, coincidirá con unos milímetros antes de la bifurcación en sus dos ramas principales. Se implantó un segmento de nervio ciático descelularizado. En los animales del grupo1 el implante se fijó mediante sutura directa con los cabos proximal y distal del nervio neurectomizado. En el grupo2 los animales recibieron el implante en la neurectomía con un tubo de ¿-CPL que contenía un fragmento de nervio descelularizado en su interior. Los animales del grupo3 recibieron un implante similar a los del grupo2, con la diferencia de que en el grupo3 el tubo estaba construido con un polímero de PLCG.
Una vez extraído el nervio ciático de una rata, se somete al protocolo de descelularización. Hemos utilizado el método propuesto por Sondell et al.5. El proceso comienza con la inmersión de los segmentos de nervio en agua destilada a 25°C durante 7h. A continuación se introduce el nervio en una solución de Triton X-100 al 3% durante una noche en agitación continua para después mantenerlo 24h en desoxicolato sódico al 4% en agitación continua y suave. Pasado ese tiempo se repite el proceso. Una vez terminado, se realiza un lavado final en agua destilada durante 7h y se almacenan a 4°C durante un periodo no superior a 7días5.
Elaboración de tubos guíaPara elaborar los tubos guía hemos disuelto los polímeros sintéticos al 20% en ácido acético glacial. Las disoluciones se reparten en alícuotas de 2ml.
Cada alícuota se extiende sobre un portaobjetos y se mantiene 10días a temperatura ambiente, cubierta pero permitiendo circular el aire. Pasado ese tiempo, se le da forma tubular de 2cm de largo y 2mm de diámetro y, si es necesario almacenarlos, se introducen en medios de conservación habituales, como por ejemplo, en el de la Universidad de Wisconsin, a 4°C.
Para hacer las prótesis mixtas se introduce el segmento de nervio descelularizado en el tubo mediante succión o, de forma directa, con ayuda de material quirúrgico fino, y se cortan a una longitud de unos 1,5cm. Estas prótesis se implantaron en la neurectomía.
La toma del segmento nervioso a injertar se realizó simulando una posible situación clínica, una vez muerto el animal, para lo cual los animales del grupo0 fueron eutanasiados mediante la inyección intraperitoneal de una dosis doble de la utilizada para anestesiarlas. Se inició el procedimiento de la toma de nervios ciáticos mediante el abordaje posterolateral de cadera. Los nervios ciáticos se expusieron desde su salida por debajo del músculo piramidal hasta un nivel lo más distal posible para visualizar siempre la bifurcación en sus ramas terminales, tibial y peronea. De cada uno de los nervios ciáticos se extrajo un segmento de unos 15mm de longitud para elaborar un segmento descelularizado, como ya se ha descrito.
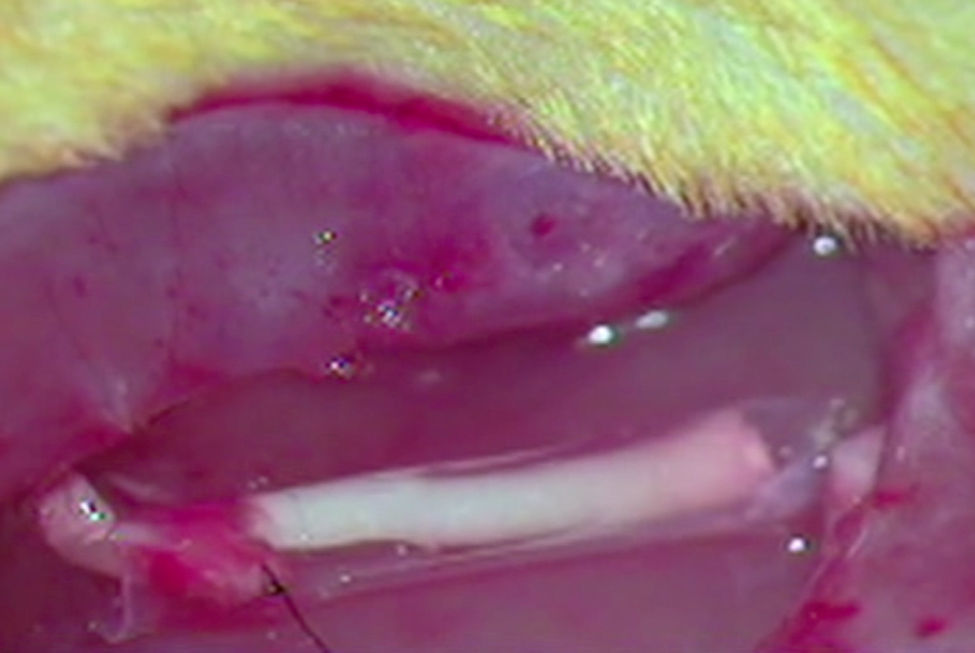
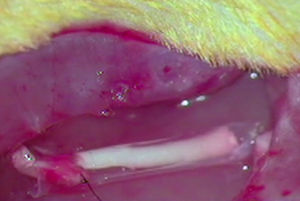
ImplanteLos animales del resto de grupos G1, G2 y G3, que recibieron el implante de un segmento acelular en una neurectomía, fueron en primer lugar anestesiados por vía intraperitoneal con una mezcla de ketamina (Imalgene® 1000, Merial) 75mg/kg de peso y xilacina (Rompun®, Bayer) 10mg/kg de peso. A continuación se les rasuró el área quirúrgica y se desinfectó con Betadine®. Se expuso el nervio ciático como ya hemos descrito y se practicó una neurectomía de unos 7mm de longitud que con la retracción propia de las secciones nerviosas alcanzó unos 10mm de longitud. En la neurectomía se implantó, como se ha mencionado, un segmento nervioso acelular de otra rata mediante sutura simple (G1) mediante un tubo de ¿-CPL (G2) o mediante un tubo de ácido PLCG (G3) Para la sutura de los nervios utilizamos dos puntos de Prolene 9/0 en cada extremo del mismo. Las prótesis tubulares fueron suturadas al epineuro (fig. 1).
Estudio funcionalEl estudio de la función motora, mediante el índice funcional ciático (IFC), se llevó a cabo tras unas 3semanas de supervivencia de los animales después de recibir el implante. El IFC es un parámetro útil para evaluar el progreso de la recuperación funcional mediante el estudio de la deambulación. Hemos utilizado un túnel de madera para que fuese recorrido por cada rata, dejando marcada su huella en un papel de 0,15mm de grosor, tras pasar por una almohadilla con tinta de tampón.
A los valores obtenidos se les aplicó la fórmula propuesta por Bain, como se ha hace referencia en el estudio de Vleggeert-Lankamp26. Los resultados conseguidos expresan la pérdida funcional en términos de porcentaje: el valor 0 es el que representa la función normal o ausencia de disfunción, y el valor −100 es el que representa la pérdida total de la función.
Estudio histológicoTras el estudio funcional los animales se procesaron para su estudio histológico con microscopia de luz y electrónica. Para ello, los animales fueron anestesiados como ya se ha descrito y perfundidos por vía intracardíaca con paraformaldehído al 1% y glutaraldehído al 1% en tampón fosfato 0,1M, pH7,4. Se repitió el abordaje de la cirugía, disecando el segmento de nervio ciático para extraer en bloque la porción que incluye la prótesis mixta o el nervio acelular y los cabos proximal y distal del nervio. Se tallaron y se cortaron en porciones transversales de aproximadamente 0,5cm de grosor comenzando por el cabo proximal antes de la unión con la prótesis implantada y terminando en la región más alejada del cabo distal. Estas porciones se refijaron con tetróxido de osmio al 1% en tampón fosfato 0,1M, pH7,4 durante una noche y se incluyeron en resina de baja viscosidad.
Para el estudio con microscopia de luz, las piezas se cortaron en secciones de 1μm de espesor y se tiñeron con azul de toluidina. Las muestras se fotografiaron con la cámara AxioCam HRc del microscopio biológico Axiophot, Zeiss, utilizando el programa Axiovision Rel 4.8.
Para la microscopia electrónica se utilizaron cortes ultrafinos (20-30nm) que fueron contrastados con citrato de plomo y se estudiaron y fotografiaron en un microscopio electrónico Jeol JEM-1200.
La longitud alcanzada por la regeneración se estimó mediante el estudio con microscopia de luz y electrónica de la presencia de fibras nerviosas mielínicas en las distintas secciones en las que hemos dividido el nervio con el implante.
Análisis estadísticoLos datos numéricos obtenidos se analizaron con el test de ANOVA de una vía seguido de los tests post hoc de Bonferroni y Tukey, así como el test de Wilcoxon para los datos no paramétricos. Por su parte, los datos cualitativos fueron analizados utilizando el test de χ2 y el exacto de Fisher. Consideramos el límite de la significación estadística en p<0,05. Para estos estudios hemos utilizado el programa IBM SPSS Statistics 23 para Windows.
ResultadosAl comparar las huellas de ambas patas traseras tomadas de los animales experimentales, en una proporción no desdeñable muestran una imagen relativamente normal, siendo bastante simétricas las huellas de la extremidad no operada y las de la operada.
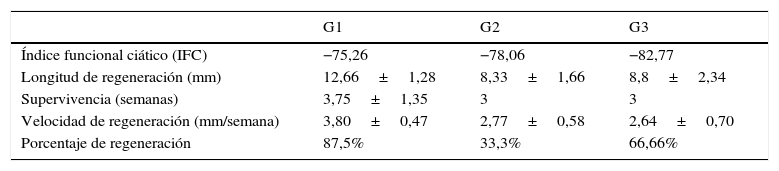
El IFC se midió en todos los animales del experimento, pero solo comparamos el IFC de las ratas en las que se comprobó que la regeneración alcanzó la medida crítica de 15mm. Los valores del IFC se muestran en la tabla 1. La media del IFC del conjunto de todos los animales operados fue, en nuestro estudio, de −78,7±3,8. A pesar de tomar como referencia para el cálculo del IFC los animales que alcanzaron una regeneración completa, los resultados obtenidos distan mucho del valor que indica una funcionalidad ciática normal (valor0). No existió una correlación directa entre la longitud de la regeneración nerviosa alcanzada a través de la prótesis y el IFC, de forma que, por ejemplo, en el G1, un animal con regeneración de 12mm obtuvo un IFC de −98,21, mientras que un animal del grupo 3, sin regeneración, mostró un IFC de −71,57.
Parámetros relevantes de la regeneración a través de implantes acelulares isogénicos con sutura simple (G1), entubulación con ¿-CPL (G2) y entubulación con PLCG (G3). Excepto el IFC y el porcentaje de regeneración, los valores de la tabla son la media ±desviación típica
| G1 | G2 | G3 | |
|---|---|---|---|
| Índice funcional ciático (IFC) | −75,26 | −78,06 | −82,77 |
| Longitud de regeneración (mm) | 12,66±1,28 | 8,33±1,66 | 8,8±2,34 |
| Supervivencia (semanas) | 3,75±1,35 | 3 | 3 |
| Velocidad de regeneración (mm/semana) | 3,80±0,47 | 2,77±0,58 | 2,64±0,70 |
| Porcentaje de regeneración | 87,5% | 33,3% | 66,66% |
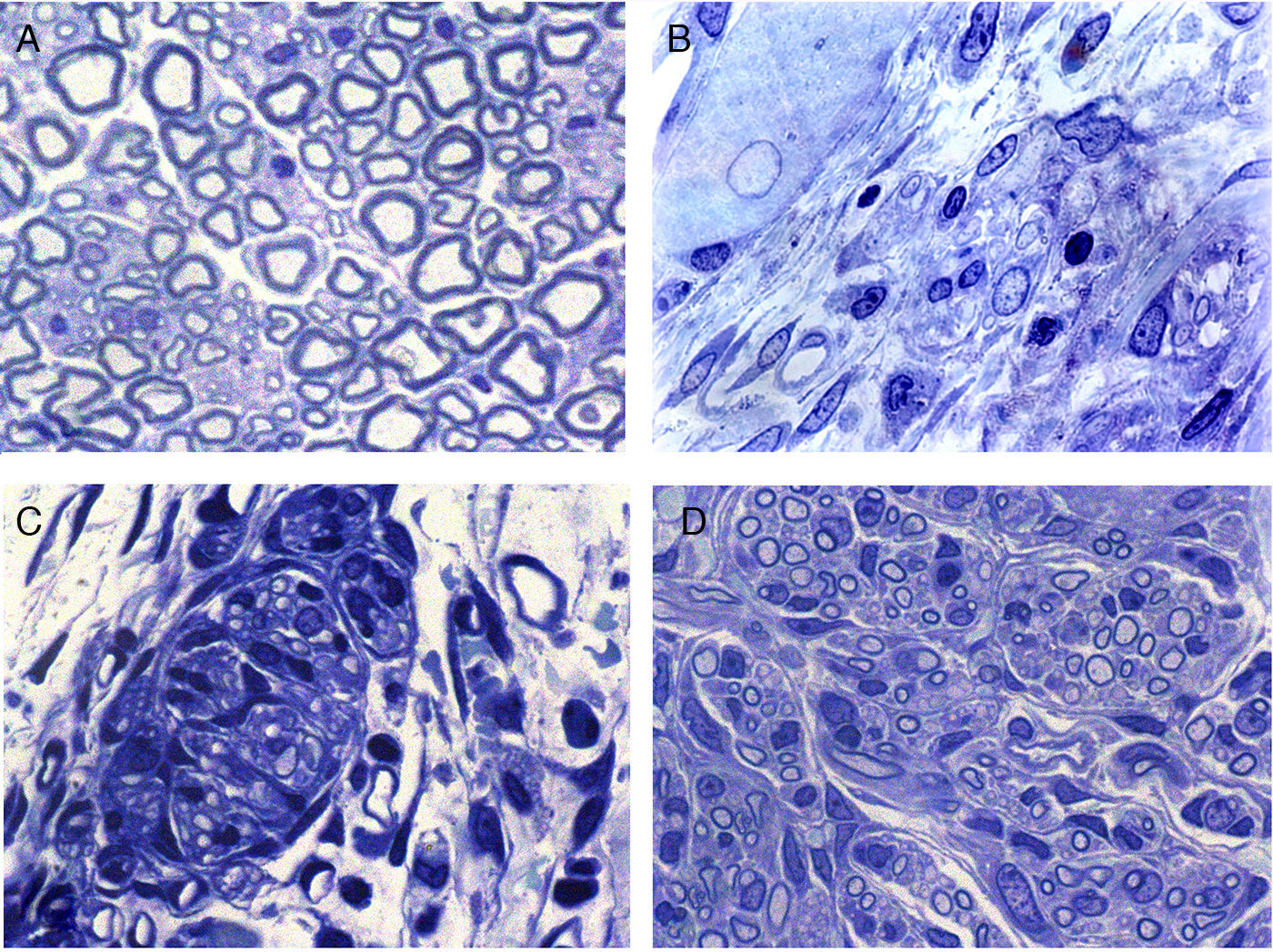
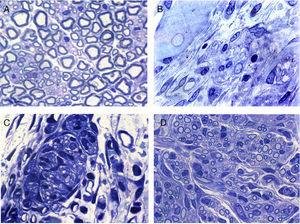
La regeneración comienza, en la zona proximal del nervio seccionado, mediante el retornamiento de las fibras nerviosas junto con las células de Schwann. En esta zona, en principio, se distingue un tejido conjuntivo relativamente laxo que contiene, entre otros tipos celulares, unos elementos de forma muy alargada y apariencia fibroblástica con cisternas de retículo endoplásmico rugoso relativamente abundantes (figs. 2 y 3). En el espacio extracelular (endoneural) se hallan abundantes fibras de colágeno. Las imágenes sugieren que el tejido conjuntivo se organiza partiendo de estas células fibroblastoides y posteriormente penetran en él las células de Schwann y las fibras nerviosas asociadas (figs. 2B y 3). Las fibras nerviosas con las células de Schwann, al penetrar en el tejido conjuntivo neoformado, forman grupos que hemos denominado «unidades de regeneración». En la región de regeneración, es decir, en el frente de crecimiento del nervio neoformado, las unidades de regeneración son escasas y dispersas. A medida que avanza la regeneración, estas unidades se hacen más abundantes, con lo que disminuye el tejido conjuntivo laxo y, por tanto, el espacio que hay en el endoneuro (fig. 2C,D), disminuye el espacio endoneural y el aspecto del nervio regenerado va progresivamente pareciéndose más cada vez a la estructura del nervio normal.
Secciones transversales de nervio ciático normal (A) y regenerado a través de una prótesis acelular (B, C y D). La zona de comienzo de la regeneración contiene células y fibras del tejido conectivo, con algunas fibras nerviosas (B). La regeneración parece realizarse por grupos formados por células de Schwann y axones que forman unidades de regeneración (C). Estos grupos de células y fibras aumentan de tamaño y llenan el espacio endoneural, con lo que adquieren aspecto similar al de los nervios normales.
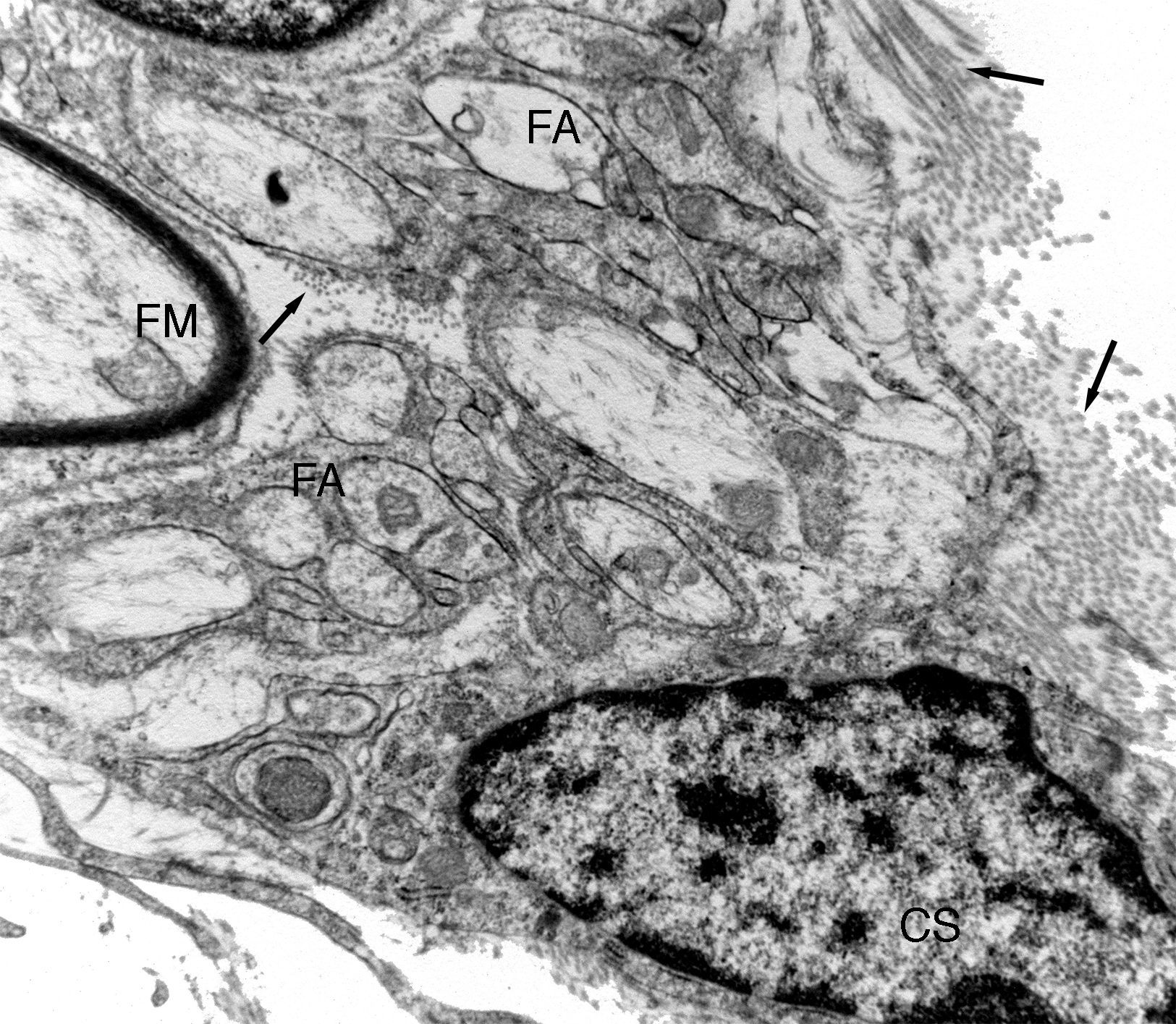
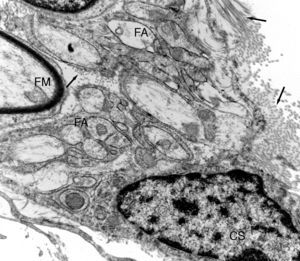
Imagen ultraestructural de una de las unidades de regeneración dentro de una prótesis de nervio isogénico acelular. Se distingue una fibra mielínica (FM) y numerosas fibras amielínicas (FA). Puede observarse una pequeña zona de una célula de Schwann (CS). En el espacio endoneural se distinguen fibras de colágeno (fechas).
Con microscopia electrónica se observa claramente que muchas de esas fibras regeneradas son amielínicas, las cuales por su pequeño diámetro (fig. 3) son difíciles de distinguir con microscopia de luz. Parte de las fibras amielínicas serán posteriormente mielinizadas y otra parte permanecerán como fibras amielínicas. En el tejido conectivo laxo que formará el endoneuro se distinguen numerosas células alargadas con prolongaciones finas y muy extendidas de aspecto fibroblástico. En algunas zonas se distinguen acumulaciones de fibras de colágeno que forman haces más o menos paralelos.
Los resultados histológicos obtenidos muestran, del mismo modo que los estudios funcionales, que la regeneración ha sido irregular en los 3 grupos, de forma que en todos los grupos hay implantes en los que las fibras nerviosas regeneran la longitud máxima estudiada (15mm) y otros en los que la regeneración es muy escasa, incluso en algunos casos no regenera nada.
El parámetro principal que hemos medido es la longitud que alcanza la regeneración en cada uno de los animales de los grupos experimentales. Los valores obtenidos oscilan entre0 (ninguna regeneración) y 15mm, la máxima distancia que hemos estudiado. La regeneración media por grupo se muestra en la tabla 1. La mayor longitud de regeneración media (12,66±1,28) se ha hallado en el grupo con sutura directa (G1), seguido por la tubulización con PLCG (G3=8,8±2,35), y por último el grupo G2 (tubulización con ¿-CPL), cuya longitud de reinervación media fue de 8,33±1,66 (tabla 1). A pesar de las importantes diferencias que existen entre las medias de los 3 grupos experimentales, estas diferencias no son estadísticamente significativas, probablemente debido a la mencionada gran variabilidad de los casos. La supervivencia en cada grupo también se refleja en la tabla 1, oscilando alrededor de las 3semanas. Hemos calculado la velocidad de regeneración a través de la prótesis, teniendo en cuenta únicamente los implantes con regeneración. La velocidad de regeneración es mayor en los implantes con sutura directa G1 que en los que pusimos un tubo de polímero (tabla 1), pero las diferencias halladas no son estadísticamente significativas. Un dato interesante es el porcentaje de implantes que han conseguido reparar la lesión del nervio con cada uno de los 3 métodos (tabla 1).
El método que mayor porcentaje de reparación ha mostrado ha sido el G1, sutura directa, con un 87,5% de implantes en los que existió regeneración en mayor o menor grado, seguido de los tubos de PLCG (G3), con el 66,66%, y los tubos de ¿-CPL (G2), con el que regeneraron el 33,3% de los implantes (tabla 1). Ninguna de las diferencias encontradas fue estadísticamente significativa.
DiscusiónComo ya hemos señalado, en la sección o rotura de un nervio periférico con una separación de los cabos proximal y distal demasiado grande para poder hacer una sutura término-terminal es necesario utilizar una prótesis, a modo de puente, que permita unir, sin tensión, los dos cabos de la neurectomía3. La reparación de la lesión del nervio periférico con el trasplante de nervio autógeno es todavía considera como el gold standard para rellenar los vacíos nerviosos, cuando no es posible la coaptación de los extremos sin tensión.
Hasta ahora, el injerto de nervio autógeno ofrece la mejor composición celular, molecular y estructural para soportar la regeneración axonal5. Sin embargo, este procedimiento presenta, principalmente, 2 importantes desventajas: comorbilidad asociada a la resección del nervio donante y disponibilidad limitada de nervios autógenos donantes.
El tejido nervioso alogénico (aloinjertos) es uno de los sustitutos más prometedores frente al autoinjerto nervioso. Los injertos de cadáver están disponibles en abundancia y ofrecen ventajas en cuanto a tamaño, longitud y especificidad motora o sensorial, y contienen tanto células de Schwann donantes viables como la microestructura endoneural que proporciona el mismo nivel de apoyo regenerativo que los autoinjertos nerviosos con adecuada inmunosupresión26. Desafortunadamente, la aplicación clínica de los aloinjertos frescos está limitada por la concomitante necesidad de inmunosupresión sistémica, lo que predispone a los receptores a infecciones oportunistas, neoplasias y toxicidad secundaria20. El procesamiento de los aloinjertos para eliminar los componentes celulares ofrece un medio atractivo de eludir estas limitaciones al reducir la inmunogenicidad del injerto, que puede ser un segmento de nervio u otro órgano o tejido diferente. Existe un escaso consenso en cuanto a qué técnica de procesamiento es mejor para preservar la capacidad de regeneración natural y maximizar la recuperación funcional27.
A pesar de las diferencias inherentes, todas las técnicas de procesamiento tienen como objetivo: 1)reducir la inmunogenicidad del injerto mediante la eliminación de los constituyentes celulares y 2)mejorar la capacidad de regeneración a través de la preservación de la matriz extracelular nativa21. La finalidad de la descelularización de un nervio periférico es, por un lado, eliminar las células de Schwann, la mielina y las células de tejido conjuntivo y, por otro lado, se persigue mantener intactos los tubos de lámina basal del tejido en tratamiento. Su procesamiento químico mediante detergentes es un método alternativo a la congelación o la radiación gamma para la preparación de aloinjertos acelulares. En implantes de nervio ciático de rata se ha observado que la capacidad de los injertos nerviosos para apoyar la regeneración neural es significativamente mayor tras exponer repetidamente dichos injertos nerviosos a soluciones de agua desionizada, sulfobetaína-10 (SB-10) y Tritón X-200/sulfobetaína-16 (SB-16)20.
Los tratamientos químicos podrían comprometer el andamiaje de la matriz extracelular haciéndolo más susceptible a la degradación enzimática in vivo, lo que llevaría a una disminución de su efecto biológico. Es poco probable que cualquier combinación de métodos elimine el 100% de todos los componentes de las células de un tejido u órgano; sin embargo, parece evidente que los métodos que eliminan la mayor parte de estos componentes, ofrecen un material biológico seguro para ser implantado28. El único aloinjerto comercial de nervio descelularizado disponible en el mercado es Avance® (AxoGen® Inc., Alachua, FL). A pesar de la creciente popularidad, la investigación clínica actual sugiere que los injertos nerviosos así procesados siguen siendo inferiores a los autoinjertos frescos en su capacidad para apoyar la regeneración nerviosa25.
El reciente éxito de los injertos nerviosos acelulares en estudios de investigación y los informes clínicos sugieren un inminente cambio de paradigma en la gestión clínica de los defectos críticos irreparables del nervio periférico. En la práctica clínica actual, los injertos de nervio acelulares disponibles comercialmente han sustituido en gran medida a los conductos nerviosos como la alternativa preferida a los autoinjertos nerviosos para el tratamiento quirúrgico de las lesiones de escasa longitud o diámetro pequeño. La base de este cambio radica en la capacidad de regeneración superior del procesado de los aloinjertos acelulares en comparación con los conductos nerviosos disponibles29. La presencia de la matriz extracelular nativa y la conservación de la lámina basal de las células de Schwann en los injertos acelulares apoyan la regeneración axonal y la orientación con éxito de los axones en comparación con los conductos vacíos30.
En nuestro estudio hemos optado por el modelo más sencillo de implante, es decir, nervio isogénico descelularizado. En este modelo hemos analizado el efecto de la sutura simple o la tubulización con 2 tipos de polímero considerando diversos parámetros. Al tratarse de una cepa de ratas isogénicas (Wistar), la respuesta inmunitaria es prácticamente inexistente y consideramos que los efectos sobre el implante, tanto físicos como biológicos, deben ser atribuibles al proceso de descelularización y a la técnica de unión del implante al nervio receptor.
El análisis de la marcha es una medida del movimiento distal coordinado del animal que requiere funciones motoras y sensoriales intactas. Después de la lesión del nervio se pierde la selectividad de la inervación de las fibras nerviosas sobre los músculos porque los patrones de activación de los músculos se alteran durante la locomoción11. Como el esfuerzo máximo no es necesario para caminar, no existe correlación entre los parámetros de la deambulación y las fuerzas musculares máximas. Según Varejao y comprobado en estudios experimentales de nuestro grupo de trabajo11, el IFC representa el método más fiable del análisis de la recuperación funcional, lo cual permite la integración entre los sistemas sensitivo y motor. Parece ser además el método más versátil, ya que es de bajo coste y de fácil aplicación en comparación con otros métodos propuestos, características que probablemente expliquen su aplicación más amplia. Nuestros resultados en esta prueba no indican ninguna influencia de la metodología utilizada en la valoración funcional de la recuperación. Consideramos que el periodo de tiempo que permitimos sobrevivir a los animales (alrededor de 3semanas) es demasiado corto para evidenciar signos de recuperación.
La media de la longitud de regeneración de los animales que recibieron un implante muestra valores del doble o del triple cuando el implante se hace mediante sutura directa que cuando se implanta mediante un tubo de polímero biocompatible. Sin embargo, la variabilidad de los resultados de los implantes hace que las diferencias no sean estadísticamente significativas19. Debemos considerar igualmente que la curva de aprendizaje de los 2 cirujanos que hicieron estos experimentos ha sido diferente, lo que introduce una mayor variabilidad de los resultados. Por el contrario, la velocidad de regeneración parece ser muy similar entre los diferentes grupos experimentales, no existiendo diferencias significativas entre ellas. Considerando ambos parámetros —longitud media y velocidad de regeneración—, podríamos considerar que la sutura directa, al ser más fácil, permite mayor número de aciertos, mientras que la tubulización, al ser técnicamente más compleja, produciría un mayor número de fallos. Una vez comenzada la regeneración, la velocidad con que progresa sería más o menos la misma en todos los casos. Esta explicación sería apoyada por los porcentajes de regeneración que se consiguen con los diferentes métodos, ya que son mucho mayores en las suturas directas que en las entubulaciones, ya sean con PLCG o con ¿-CPL17.
ConclusionesNuestros resultados indican que el nervio descelularizado con detergentes es una alternativa a la reparación con injertos de nervio autógeno. Los segmentos de nervio isogénico descelularizados, bajo nuestras condiciones experimentales, se unen más eficazmente al nervio receptor mediante sutura directa que dentro de los tubos de biopolímeros.
Nivel de evidenciaNivel de evidencia II.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores que firman este manuscrito declaran la inexistencia de conflicto de intereses.
A la Fundación SECOT.
A la ayuda técnica de Luis Santiago Bucero, María Teresa Rodríguez Martín y Rogelio Martínez Díez