La aplicación de la tecnología del ADN recombinante a la investigación médica ha supuesto un cambio sustancial en el entendimiento de la genética y la fisiopatología humana, y ha abierto un nuevo frente en la lucha contra las enfermedades. Lo que hoy entendemos por terapia génica no es más que una aplicación de esa tecnología.
La terapia génica es la introducción de material genético en el interior de un órgano o tejido con la intención de producir un efecto biológico que permita prevenir o tratar una enfermedad1-3.
En 1990 Anderson, Blaese y Culvert lograron transferir el gen de la adenosina desaminasa (ADA) a los linfocitos T de niños inmunodeficientes4,5. Posteriormente, el número de pacientes incluidos en ensayos clínicos de terapia génica se ha incrementado significativamente, sobrepasando en la actualidad los 500 ensayos clínicos6. En un principio la terapia génica fue enfocada hacia el tratamiento de enfermedades monogénicas heredadas para suplir la carencia de un determinado gen. Sin embargo, pronto se advirtió el enorme espectro de enfermedades susceptibles de ser tratadas mediante la transferencia génica, incluyendo enfermedades tanto de carácter hereditario como adquiridas. El descifrado de la secuencia completa del genoma humano ha impulsado los estudios relacionados con la transferencia de genes con fines terapéuticos.
Recientemente hemos asistido a tres acontecimientos que han puesto a la terapia génica en el centro de la atención de la comunidad científica. En el año 2000 falleció un joven de 18 años que había sido incluido en un ensayo clínico de terapia génica tras recibir un adenovirus que expresaba el gen de la OTC (ornitiltranscarbamilasa), un defecto enzimático hepático del metabolismo de la urea7. La muerte de este paciente se produjo 48 horas más tarde por un fallo multiorgánico. Poco más tarde, el grupo de Fischer, en París, logró transferir mediante un vector retrovírico el gen de la subunidad γC a células hematopoyéticas de pacientes con inmunodeficiencia combinada severa (niños SCID) normalizando su sistema linfoide en 9 de los 10 niños tratados, constituyendo el primer éxito terapéutico de la terapia génica8. Tres años más tarde dos de los pacientes tratados desarrollaron leucemia aguda, consecuencia de la integración del vector retrovírico en el genoma de estos pacientes en la proximidad del promotor del proto-oncogen LMO29.
OBJETIVOS DE LA TERAPIA GÉNICA
La finalidad de los procedimientos de transferencia génica puede ser muy diversa. Se muestran algunos ejemplos:
1. Introducir genes endógenos o exógenos que aporten o potencien nuevas funciones con un efecto beneficioso para el organismo o célula diana (genes suicidas).
2. Restaurar o complementar una función biológica defectuosa por carencia o modificación de un determinado gen o conjunto de genes (antioncogenes).
3. Silenciar o inhibir determinados genes que, por mutaciones puntuales o por desregulación de su control, dan lugar a proteínas con efectos nocivos para el organismo (oncogenes).
4. Modificar la actividad de factores de transcripción mediante el bloqueo o la competición por sus dominios de unión a ácidos nucleicos.
5. Introducir genes o moléculas que permitan el seguimiento (o monitorización) de las células modificadas en el interior del organismo.
6. Expresar proteínas antigénicas para inmunizar con procedimientos de vacunación génica (moléculas de coestímulo y antígenos tumorales).
ASPECTOS FUNDAMENTALES DE LA TERAPIA GÉNICA
Transferencia del material genético a las células diana
Una de las claves del éxito terapéutico de las diversas estrategias de la terapia génica no sólo radica en la selección de la secuencia génica adecuada y que se quiere transferir, sino también en el desarrollo de un vector conveniente que sea capaz de transportar los genes al sitio correcto y de la manera más segura y eficaz posible.
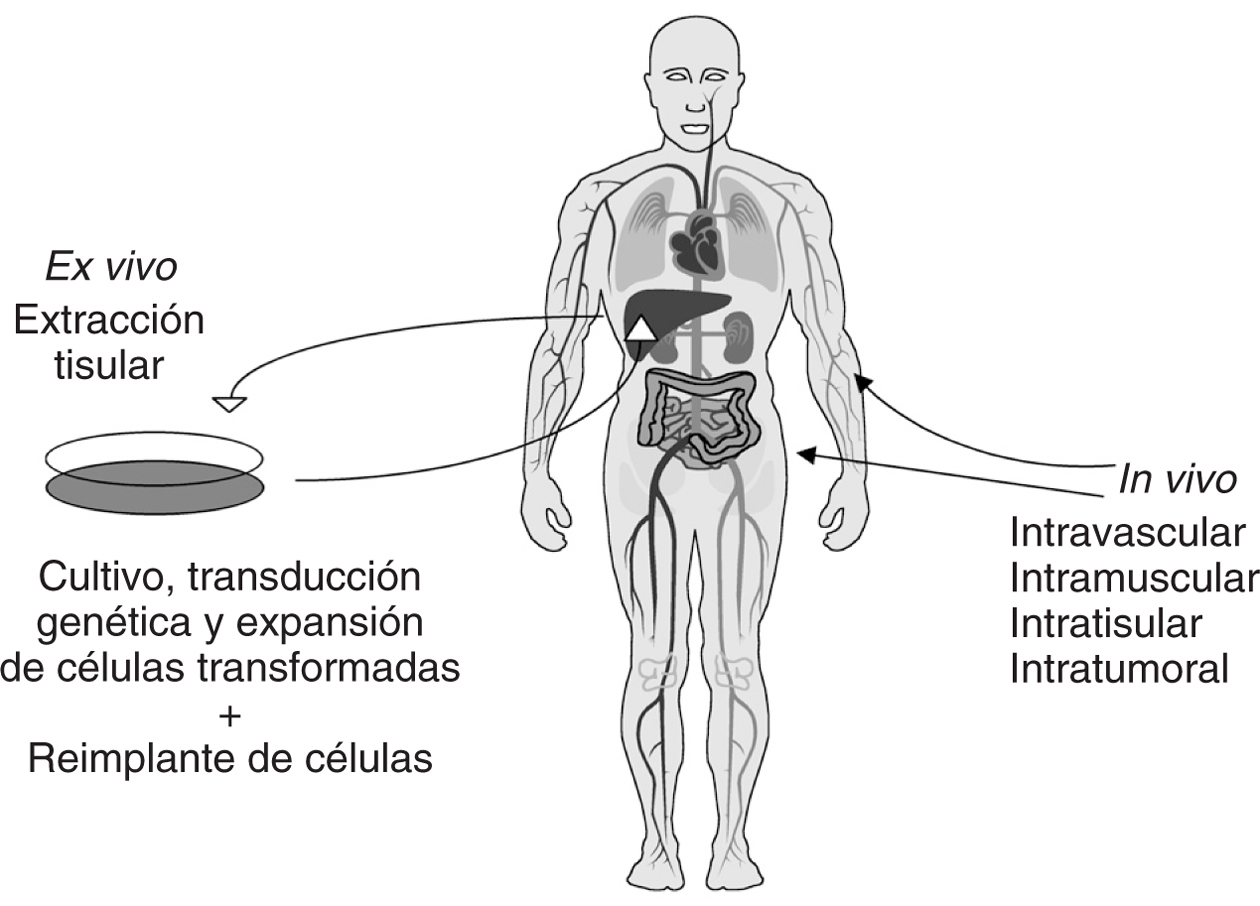
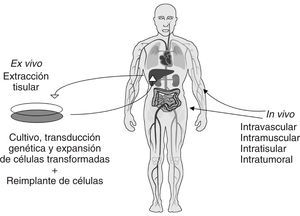
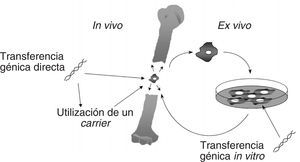
Desde el punto de vista metodológico la terapia génica puede ser de dos tipos: ex vivo o in vivo (fig. 1). La terapia génica ex vivo requiere de la extracción del organismo de las células diana y la consiguiente reintroducción de dichas células, después de ser transfectadas y seleccionadas. Se entiende por transfección al proceso de transferencia génica y expresión del transgén realizado con éxito. Por otro lado, la terapia génica in vivo consiste en la transferencia de material génico directamente al organismo empleando la vía intravenosa, intratisular, intratumoral, etc. La transferencia de material genético puede realizarse tanto a células germinales como somáticas. Sin embargo, por razones éticas, nos centraremos exclusivamente en la terapia génica de tipo somática.
Figura 1. Terapia génica somática ex vivo e in vivo. La terapia génica ex vivo requiere la extracción de las células del huésped que se desean modificar genéticamente, el establecimiento de un cultivo y la posterior transferencia génica del gen de interés. Se pueden emplear vectores de todo tipo para transferir los genes, víricos (adenovirus y retrovirus, generalmente) o no víricos, utilizando liposomas, electroporación o precipitación con calcio y fosfato. Una vez que las células diana han sido transducidas se puede realizar una selección de las células y administrarlas al huésped por diversas vías.
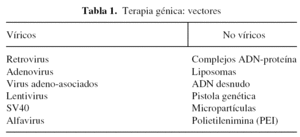
Una vez seleccionado el gen que queremos transferir al organismo (un factor de crecimiento, una citoquina) debemos introducirlo o clonarlo en lo que denominamos vectores, que son los transportadores o vehículos para los genes (tabla 1). Los vectores pueden ser de dos tipos: víricos y no víricos o físicos. Unos y otros pueden utilizarse tanto en procedimientos ex vivo como in vivo.
El vector ideal es el que es capaz de transferir el material genético a las células deseadas de una manera segura y específica, sin que resulte tóxico para el huésped ni tampoco inmunogénico. También es necesario que pueda producirse en cantidades adecuadas para su utilización con una técnica de laboratorio relativamente sencilla. En la actualidad no existe un vector con tales características, aunque el intenso desarrollo producido en la tecnología de vectores en los últimos años indica que nos acercamos.
Vectores no víricos
Existen numerosos métodos de transferencia génica basados en vectores no víricos y la mayoría de ellos comparten una serie de características especiales10: simplicidad y facilidad de preparación, capacidad para clonar en su interior genes de gran tamaño, baja inmunogenicidad, escasa toxicidad y elevada seguridad.
En general, la eficacia de la transferencia génica alcanzada con los vectores no víricos suele ser baja y poco específica, especialmente en lo que respecta a las estrategias in vivo. Entre los vectores no víricos más empleados en la terapia génica encontramos el ADN desnudo (plásmidos), los complejos de ADN con liposomas, la pistola génica, polímeros catiónicos asociados a ADN (poliplejos), los complejos ADN-proteína, la electroporación, ultrasonido, etc. A pesar de la baja eficacia de transferencia génica que ofrecen los vectores no víricos éstos han dado buenos resultados en ensayos de vacunación.
ADN desnudo
Se trata de secuencias de ADN sin otro componente añadido, por lo que requieren del empleo de diversos procedimientos para facilitar su entrada al interior de las células11. Uno de ellos es la electroporación, técnica que consiste en la aplicación de un choque eléctrico a las células diana para permeabilizar sus membranas celulares y permitir el paso de moléculas de ADN al interior. Otra de las técnicas empleadas es la precipitación empleando una solución de calcio-fosfato que permite formar agregados entre el ADN y los complejos de calcio-fosfato, que tras depositarse en las membranas celulares son internalizados. También se ha demostrado que el ADN desnudo puede administrarse directamente en los tejidos, como en el caso de la transferencia génica al músculo esquelético o al miocardio.
En los últimos años se ha venido investigando en la transferencia de ADN plasmídico a los hepatocitos a través de procedimientos que modifican la hemodinámica hepática, produciendo sobrecarga de volumen o incrementando de forma transitoria la presión intrahepática mediante la compresión de las venas suprahepáticas, que ha permitido transducir con éxito el hígado en modelos murinos12. Esta técnica, denominada «transducción hidrodinámica hepática por vía sistémica», presenta serias limitaciones para su reproducción en el campo clínico.
Liposomas
Son estructuras vesiculares conformadas por una capa doble de fosfolípidos que contienen un espacio acuoso en su interior. Los lípidos pueden ser neutros o de carga positiva y/o negativa13. Los fosfolípidos forman estructuras cerradas que en su interior contienen ADN o ARN y penetran en el interior de las células, ya sea a través de vesículas de endocitosis (los neutros) o por fusión con las membranas celulares (catiónicos y aniónicos). Pueden aplicarse tanto en procedimientos in vitro como in vivo, por ejemplo, por vía sistémica. Una estrategia especial diseñada con el objeto de mejorar la eficacia de los vectores liposomales in vivo es el desarrollo de los «virosomas», que intercalan proteínas o péptidos de origen vírico en la capa lipídica para facilitar el proceso de fusión del liposoma con las membranas celulares de manera específica.
Complejos ADN-proteína
Constituyen un método sofisticado para la transferencia de ADN in vivo. En el campo de la hepatología el uso de estos complejos tiene especial interés, ya que la existencia en los hepatocitos de receptores exclusivos que no se encuentran en otros tipos celulares lo convierte en un órgano ideal para la captación de moléculas de ADN a través de su asociación con el ligando específico de alguno de esos receptores, como es el caso del receptor de la asialoglucoproteína. Wu et al14 fueron los primeros en emplear complejos con residuos de asialoglucoproteína y demostrar que eran efectivos en la transferencia de genes a los hepatocitos in vivo. Una estrategia similar ha sido empleada utilizando el receptor de la transferrina, también aplicable para dirigir la transducción hacia ciertos tumores. El factor limitante en todos aquellos casos en los que se emplean complejos ADN-proteína es la internalización de los mismos en vesículas de endocitosis que se funden con los lisosomas y terminan por degradar el ADN.
Bombardeo de partículas
Es el sistema de transferencia génica conocido como «pistola génica» o sistema balístico15. Fue utilizado en un principio para la transferencia génica en vegetales y la producción de maíz transgénico. Básicamente consiste en la obtención de partículas metálicas como el oro o el tungsteno que adsorben en su superficie material genético, principalmente ADN, conformando unos «microproyectiles» que son impulsados a alta velocidad, 600 metros/segundo, mediante gas a presión (helio), atravesando las membranas citoplasmáticas para introducirse en el interior de las células. Esta estrategia ha resultado eficaz en la transferencia de genes antitumorales (IL-12) a tumores, mediante su aplicación directa sobre la superficie del tumor16.
Vectores víricos
Son los más eficaces y también los más empleados17. Su diseño se realiza mediante la supresión de regiones implicadas en el proceso de replicación vírica y la incorporación, en su lugar, del material genético de nuestro interés, dejando en el vector las secuencias víricas necesarias para la expresión génica. Así se obtienen vectores víricos defectivos, llamados de esta manera porque son capaces de infectar las células, pero no de replicarse en ellas. Los vectores no replicativos son los que se utilizan con más frecuencia, aunque existe un firme y creciente interés en el desarrollo de virus con capacidad replicativa selectiva, es decir, que puedan replicarse exclusivamente ante determinadas circunstancias, como es el caso de los vectores que codifican sólo en tumores con expresión defectuosa del gen supresor de tumores p5318 o Rb.
Adenovirus
Los adenovirus recombinantes han sido y siguen siendo uno de los vectores víricos más empleados en la terapia génica, por lo que se cuenta con un amplio conocimiento de su estructura y funcionalidad19. Existen 6 subgéneros (A-B-C-D-E-F) y alrededor de 47 serotipos diferentes, de los cuales los tipos 2 y 5 son los más empleados.
El adenovirus posee un ciclo de replicación que se divide en dos fases: una temprana y otra tardía. En la fase temprana se expresan las proteínas necesarias para la transcripción y la replicación vírica, mientras que en la fase tardía, se expresan las proteínas que conformarán la cubierta del adenovirus.
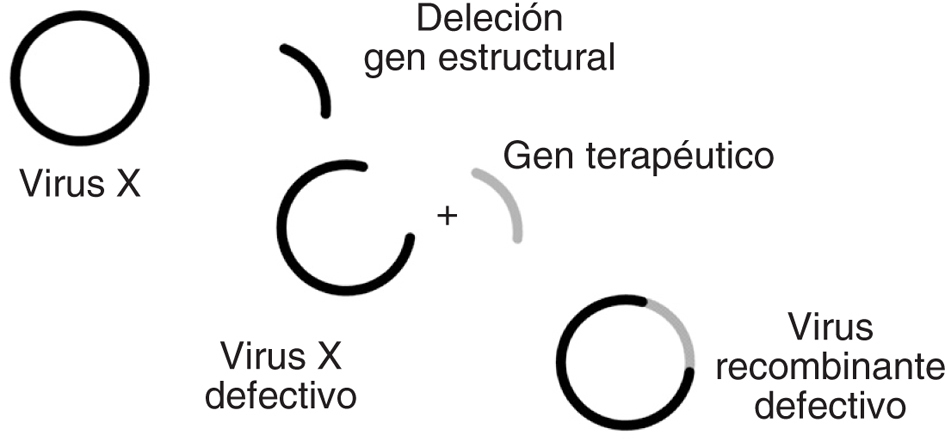
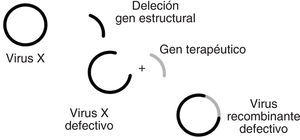
Básicamente, los vectores adenovíricos se construyen mediante la deleción o eliminación de los genes que componen la región E1, lo que los convierte en virus defectivos al no poder replicarse en las células que infecten de manera independiente (E1 es un transactivador del resto de los genes del adenovirus). Se obtienen así los denominados adenovirus recombinantes defectivos (fig. 2).
Figura 2. Vectores víricos recombinantes defectivos. Así se denominan los vectores basados en virus a los cuales se les deleciona o elimina una porción de su genoma, habitualmente aquellas regiones que codifican proteínas inmunogénicas o regiones que resultan indispensables para la replicación vírica. De esta manera se forman los vectores recombinantes defectivos, porque ya no pueden replicarse en el huésped. Este concepto es válido para la mayoría de los vectores basados en virus que se emplean frecuentemente en la terapia génica (adenovirus, retrovirus, herpes virus, etc.).
Para producir o purificar estos virus en cantidad es indispensable contar con células que permitan la replicación del adenovirus en su interior. A estas células se las llama empaquetadoras y expresan de forma constitutiva la proteína E1, delecionada en la construcción de los adenovirus recombinantes. Las más populares son las células 293, derivadas de tejido renal embrionario.
Contrariamente a los retrovirus, los adenovirus no integran su material genético en el genoma del huésped y se mantienen en forma episomal, siendo su expresión transitoria. Los adenovirus recombinantes humanos son muy útiles para realizar procedimientos de transferencia génica, pues pueden infectar una amplia variedad de células. Si bien esta variabilidad de infección es una ventaja, también puede resultar un inconveniente cuando se requiere infectar un determinado tipo celular. Los adenovirus penetran en el interior de las células que infectan a través de un mecanismo de endocitosis mediado por receptores, que se inicia cuando la fibra proteica de la cápside del adenovirus se une al receptor de superficie. Se han identificado dos proteínas encargadas de cumplir la función de unir el virus a la célula y permitir su entrada: en primer lugar, el receptor de Coxsackie y el de adenovirus denominado CAR (coxsakie adenovirus receptor), y en segundo lugar, la cadena pesada del CMH (complejo mayor de histocompatibilidad) de tipo I. La interacción fibra-receptor se acompaña de otro evento en el que la base pentona interactúa con las integrinas αvβ3 y αvβ5 que se localizan en la superficie celular. Los adenovirus tienen un especial interés en Hepatología por su tropismo natural por los hepatocitos y por su capacidad para infectarlos, a pesar de tratarse de células en estado de reposo.
Numerosas publicaciones han descrito la corrección parcial o completa, mediante vectores adenovíricos, de patologías como la hemofilia, deficiencias en la conjugación de la bilirrubina, tirosinemia de tipo I y III, así como déficit del receptor de LDL en diversos modelos animales. También han sido empleados en procedimientos de transferencia génica in vivo y ex vivo en Traumatología. Sin embargo, desde que comenzaron a usarse se ha observado que la expresión de estos vectores era transitoria y que, en el huésped, se desencadenaba una importante respuesta inmunitaria de tipo humoral y celular, tanto contra las proteínas víricas como contra el transgén, lo que provoca finalmente la eliminación de las células infectadas. Esta es la causa de la expresión transitoria de los vectores adenovíricos de primera generación.
El desarrollo de respuesta inmunitaria es uno de los impedimentos más importantes que existen actualmente para el empleo de los adenovirus en la terapia génica. Se han desarrollado adenovirus de segunda y tercera generación (eliminación de las regiones E2 y E4, respectivamente), que parecen mejorar la duración de la expresión. Sin embargo, el desarrollo de adenovirus en los que todo el material genético vírico es eliminado (gutless), excepto las señales de empaquetamiento terminales, da lugar a la expresión sostenida de estos vectores, como se ha observado en el ámbito hepático en modelos experimentales con ratones hasta varios meses después de su administración intravenosa. Esto abre una esperanzadora vía a su empleo en la terapia génica de los pacientes cuando se requiere una expresión sostenida del gen terapéutico.
Retrovirus
Junto con los adenovirus los vectores retrovíricos han sido muy utilizados en terapia génica20. Los retrovirus han sido particularmente empleados para la transferencia génica en estudios ex vivo. Se trata de virus de cadena simple que llevan la información genética en forma de ARN. Los retrovirus infectan las células por un mecanismo mediado por receptor, y tras la infección se integran en el genoma de la célula huésped. Además, para que tenga lugar la infección es necesario que la célula esté en estado de división. Básicamente, los retrovirus se obtienen mediante la deleción o eliminación de los genes víricos endógenos gag, pol y env y su reemplazo por el gen de interés para convertirlos en defectivos. Para su producción se emplean células empaquetadoras basadas en fibroblastos que complementan las proteínas necesarias para la encapsidación. Los títulos que se obtienen en los procesos de purificación son en general bajos. El riesgo de mutagénesis insercional que, si bien es mínimo, implica la posibilidad de que la integración tenga lugar en un sitio de alto riesgo, como puede ser la localización de un oncogén y la necesidad de que la célula a infectar se encuentre en estado de división, que suponen las limitaciones más destacadas para el uso de retrovirus recombinantes en la terapia génica. En los últimos años se han desarrollado retrovirus recombinantes basados en la estructura de lentivirus, que tienen la ventaja de poder infectar las células, aunque no se encuentren en estado de división21.
Virus adenoasociados
No son patogénicos para el hombre y se diferencian de los adenovirus y los retrovirus en que no desencadenan una respuesta inmunitaria considerable, no producen enfermedad por sí mismos, pueden infectar células tanto en reposo como en división y se integran en el genoma del huésped con un cierto tropismo por un lugar específico del cromosoma 19.
Los parvovirus poseen, además, un grado de tropismo por el hígado tras su administración sistémica, y se han utilizado con el fin de transducir, de manera sostenida, los hígados de ratones con el factor IX humano. Otro campo en el que han despertado una interesante expectativa es en el de la transferencia génica al músculo esquelético, donde la expresión es muy duradera y puede dar lugar a la producción de concentraciones considerables de la proteína codificada por el transgén que transporten22. Se ha señalado23 que el empleo de medidas que dañen el ADN de las células, como el uso de ectopósido o de radiación gamma, puede incrementar la eficiencia en la expresión génica tras la transducción de las células por el virus adenoasociado.
Virus herpes
Los vectores derivados del virus del herpes simple se han empleado, generalmente, para la transferencia de genes al sistema nervioso gracias a su conocido tropismo neuronal24. No obstante, también han demostrado ser eficaces en la transducción de los hepatocitos de ratón in vivo, como se ha observado con la secreción del factor IX, que logró alcanzar cifras terapéuticas. Los virus herpes poseen un complejo genoma de 150 kb, que dificulta en cierta medida su manipulación.
Material genético
El material genético que se desea introducir en el interior de una célula o tejido diana puede estar constituido por genes o por moléculas subgenómicas. Los genes son secuencias de ADN que incluyen todos los elementos necesarios para la síntesis de una determinada proteína. Las moléculas subgenómicas son fragmentos de ADN y ARN que no actúan a través de la síntesis de una proteína, sino que obran por sí mismas interfiriendo en el funcionamiento de otros ácidos nucleicos, principalmente en el ámbito del ARN mensajero.
Genes
De manera simplificada, una vez identificada la población celular de la cual se quiere extraer nuestro gen de interés, se procede a extraer el ARN mensajero. Más tarde, mediante una técnica conocida como RT-PCR y con el uso de una transcriptasa reversa se obtiene el cADN (ADN clonado). Posteriormente se completa la otra cadena del ADN mediante la amplificación con reacción en cadena de la polimerasa (PCR). Para que esa secuencia de ADN sea funcional es necesario que se acompañen, al menos, de dos nuevas estructuras: el promotor, responsable de que se inicie la transcripción en el sitio correcto, y la señal de poliadenilación, que le indica al ARN polimerasa dónde debe finalizar la transcripción y dónde debe añadir las secuencias de adenina características del extremo 3' de los ARN mensajeros (fig. 3). Este cADN puede tener su origen en genes naturales, es decir, en aquellos preparados a partir de genes que están presentes en las células, o en genes quiméricos producto de la ingeniería genética.
Figura 3. Elementos básicos de un vector de terapia génica. Para que un gen terapéutico o reportero se exprese y pueda ejercer su función, es necesario que se encuentre incorporado en lo que se denomina «cassette de expresión». Esta construcción está constituida básicamente por una secuencia promotora que permite el inicio de la transcripción, puede ser un promotor universal (como el citomegalovirus) o específico (como AFP o CEA); el gen o los genes de interés y una señal de poliadenilación final, que estabiliza el ARN mensajero. Este cassette de expresión puede clonarse en un vector vírico o emplearse directamente como ADN desnudo.
Partículas subgenómicas
Las partículas subgenómicas inhiben la síntesis proteica mediante el bloqueo de la transcripción de genes o mediante la interacción con el ARN. Cabe citar como ejemplos las ribozimas, las moléculas antisentido y las moléculas señuelo.
Las ribozimas son moléculas de ARN diseñadas para unirse de manera específica a otros ARN diana mediante un mecanismo de hibridación molecular y destruirlos. La característica más relevante es su capacidad catalítica, que les permite destruir más de una molécula de ARN.
Las moléculas antisentido son aquellas de ADN o ARN, generalmente cortas (oligonucleótidos), que pueden unirse específicamente a secuencias de ADN o ARN y bloquear la transcripción, la replicación del ADN o el ARN, o la traducción del ARN mensajero.
Las moléculas señuelo reproducen la secuencia de ADN o ARN a la que se unen determinadas proteínas reguladoras, como los factores de transcripción, y consiguen sustituir dichos ácidos nucleicos secuestrando las proteínas reguladoras e impidiendo su efecto biológico.
PRINCIPALES PATOLOGIAS DEL SISTEMA MUSCULOESQUELÉTICO SUSCEPTIBLES DE TRATAMIENTO CON TERAPIA GÉNICA25-27
1. Reparación de fracturas óseas.
2. Reparación de lesiones del cartílago articular.
3. Fusión ósea en columna vertebral.
4. Reparación de lesiones tendinosas o ligamentarias.
5. Tumores musculoesqueléticos.
FACTORES DE CRECIMIENTO OSEO
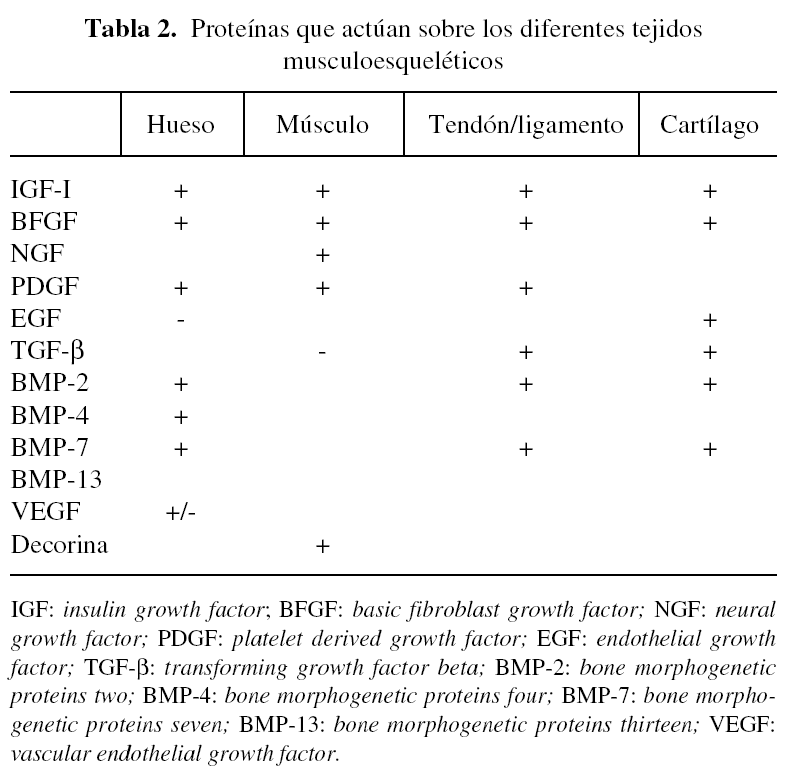
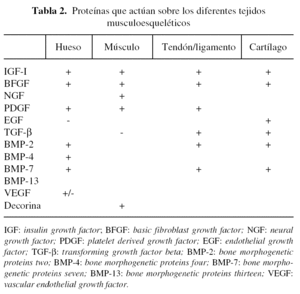
Se han identificado una serie de proteínas (tabla 2) que participan en mayor o menor medida en los procesos de reparación ósea. Uno de los más destacados es el TGF-β (transforming growth factor beta)28,29, proteína dimérica de 25 kDa que fue aislada originalmente de las plaquetas. Existen tres isoformas de TGF-β, siendo TGF-β1 la más abundante. Si bien la mayoría de las células del organismo expresan TGF-β, los niveles más importantes se encuentran en las plaquetas y en el hueso. Se ha observado que la concentración de TGF-β es unas 100 veces mayor en el hueso en comparación con otros tejidos y que los osteoblastos presentan una alta densidad de receptores para el TGF-β. El TGF-β1 es una citoquina con múltiples funciones e interviene en procesos de inmunomodulación, inflamación y en la reparación de tejidos.
Otros de los factores bien estudiados son las BMP (bone morphogenetic proteins)30-33. Las BMP constituyen una familia de moléculas relacionadas de las que se han identificado unas 47, que pertenecen a la superfamilia del TGF-β. No sólo intervienen en los procesos de formación y reparación del hueso, sino que también participan en otros numerosos procesos biológicos que se llevan a cabo en el esqueleto, corazón, riñón, cerebro, gónadas, hígado y piel. Las BMP se unen a receptores específicos de membrana y activan una cascada de señales bioquímicas que regulan la transcripción de genes implicados en diversas funciones fisiológicas, entre las que se incluyen procesos de proliferación y diferenciación celulares. Algunos miembros de la familia de BMP, como las BMP-2, BMP-4, BMP-7, BMP-9, intervienen de manera crítica en el desarrollo musculoesquelético. Incluso algunas de ellas (BMP-2 y BMP-7) están siendo ensayadas en el área clínica34,35. Las BMP han sido empleadas para inducir la formación de hueso y para reparar defectos óseos significativos en diversos modelos experimentales que se detallarán más adelante.
El proceso de formación ósea es complejo y en él intervienen otros factores que actúan de manera interrelacionada. Entre ellos están los factores angiogénicos, en especial el VEGF (vascular endothelial growth factor), que al parecer desempeña un papel importante en el crecimiento óseo a través del proceso o vía de osificación endocondral36.
REPARACION DE FRACTURAS
La regeneración ósea es un proceso necesario para la curación de defectos o pérdidas extensas de hueso ocasionadas por diversas patologías como traumatismos, tumores o fracturas. El método más empleado en la actualidad, tanto para facilitar la curación de fracturas como para el «relleno» de defectos óseos, es el autoinjerto de hueso, habitualmente procedente de cresta ilíaca. Sin embargo, este es un procedimiento limitado por la cantidad de hueso que se puede obtener, así como también por los efectos secundarios que frecuentemente se producen en el sitio del explante óseo. El autoinjerto óseo es el único que provee los tres componentes indispensables para la formación de hueso: componente celular, matriz y factores estimulantes de la formación ósea. Otra fuente de hueso es el tejido óseo alogénico, cuyo empleo también se acompaña de inconvenientes como son el desarrollo de procesos infecciosos e inflamatorios y la posibilidad de transmitir infecciones víricas. Por su parte, el empleo de sustitutos de hueso, en forma de matriz ósea desmineralizada, no parece ser suficiente para permitir la formación adecuada del mismo.
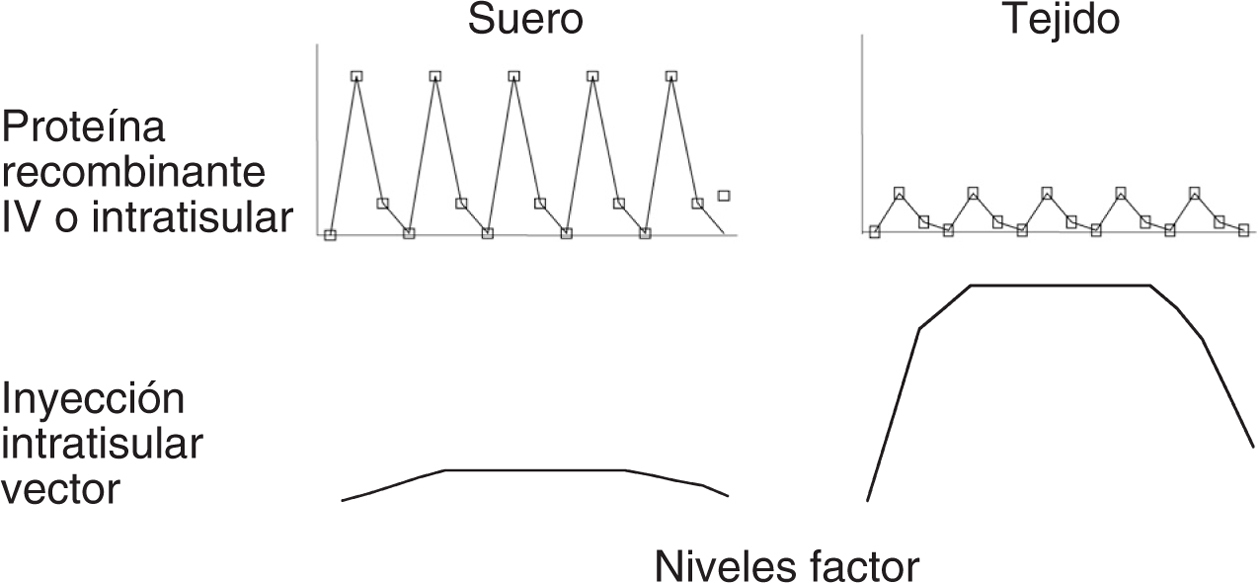
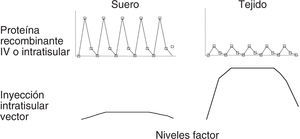
El hallazgo y la caracterización de distintos factores de crecimiento óseo han posibilitado su utilización para favorecer la regeneración ósea37,38. Dada la corta vida media de estos factores es necesario emplearlos a dosis muy elevadas y administrarlos de manera repetida. Es por tanto necesario un sistema que permita una producción adecuada de estos factores de crecimiento, que sea sostenida y, si es posible, que esté dirigida al sitio de actuación. Es en este contexto donde la terapia génica puede resultar una herramienta particularmente útil26 (fig. 4).
Figura 4. Bases farmacocinéticas de la terapia génica. El empleo de proteínas recombinantes en Traumatología se ve limitado no solamente por su elevado coste de producción, sino también por la escasa vida media de estos factores que obliga a su administración repetida. Incluso es necesario emplear dosis muy elevadas y por la vía sistémica para alcanzar un efecto terapéutico. Esto trae aparejado la llegada no deseada de la molécula a sitios distantes de la lesión que se quiere tratar. El empleo de estrategias de terapia génica con vectores hace posible que tras la administración se produzca una liberación local en el sitio de la inyección con mínimo escape sistémico.
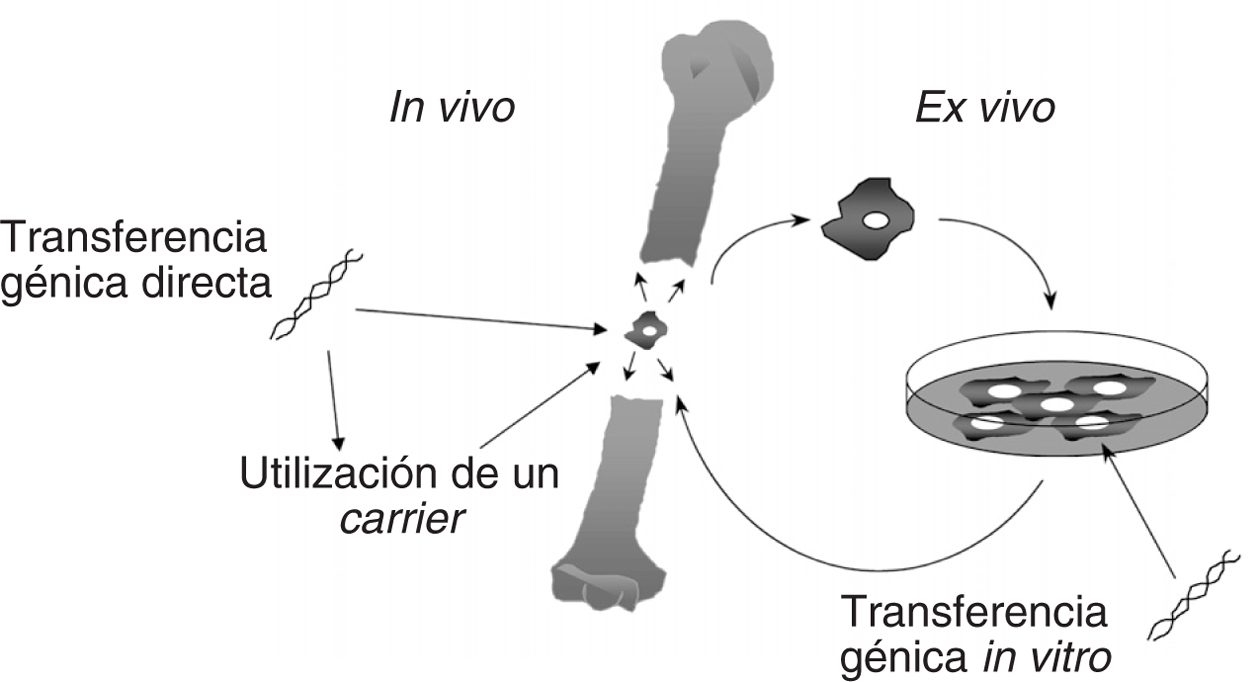
Las estrategias de terapia génica ex vivo (fig. 5) ofrecen la ventaja de poder seleccionar un tipo celular determinado, células musculares, células stem, fibroblastos, transferirles el gen de interés, una de las BMP, por ejemplo; seleccionar las células positivas y reintroducirlas en el huésped en el lugar requerido para que produzcan estos factores, y de esta manera estimular o facilitar la formación ósea. Las células que se presentan como mejores candidatos para desempeñar este papel parecen ser las provenientes de la médula ósea, ya que han demostrado ser eficaces en la formación de hueso en diversos modelos experimentales.
Figura 5. Vías de administración de genes terapéuticos en Traumatología. De manera similar que para otras enfermedades, la terapia génica en Traumatología puede realizarse ex vivo, extrayendo células de médula ósea o condrocitos, por ejemplo, para transferirles el gen terapéutico (una BMP u otro factor de crecimiento: una citoquina) y reintroducirlas en el sitio donde deben actuar y sintetizar la proteína. Por otro lado, es posible acceder directamente a la lesión e inyectar un vector vírico o no vírico que lleve en su interior nuestro gen de interés para que actúe también en el sitio donde se encuentra el defecto.
Entre los estudios más destacados en este campo se encuentra el publicado por Lieberman et al39, en un modelo en ratas con un defecto óseo femoral. Estos investigadores demuestran que transduciendo una línea de células provenientes del estroma de la médula ósea con un vector adenovírico que codifica para hBMP-2, e implantando las células en el defecto junto con una matriz ósea desmineralizada es posible conseguir la reparación ósea en un número significativo de animales.
En otro estudio realizado en un modelo de conejos con un defecto craneal se transdujeron células periósticas, de las que formaban parte células progenitoras de hueso y cartílago, con un retrovirus que expresaba BMP-7. Estas células fueron administradas junto a una matriz de ácido poliglicólico permitiendo reparar el defecto a los tres meses40.
Lee et al41 emplearon células provenientes de músculo transducidas con un adenovirus que codifica para hBMP-2 en un modelo de ratones inmunodeficientes SCID con un defecto craneal. Observaron que tras 4 semanas se obtenía reparación de cerca del 95% del defecto óseo. Uno de los elementos importantes en este trabajo fue la demostración de que una parte de las células musculares se diferenciaron a osteoblastos.
Las estrategias de transferencia génica in vivo permitían entregar directamente el gen terapéutico al sitio de la lesión, evitando la extracción y la manipulación de células fuera del organismo. Baltzer et al42 demostraron en un defecto en el fémur de conejos que la administración directa de un adenovirus que codifica para hBMP-2 en el defecto óseo facilita la regeneración de hueso. Los resultados fueron significativos desde el punto de vista histológico, radiológico y biomecánico.
Se han ensayado otras maneras de transferir genes con capacidad para inducir la formación ósea. La administración de ADN desnudo impregnado en matriz degradable fue aplicado en un modelo de rata con un defecto óseo femoral. Tras la implantación de la matriz junto con ADN codificante para BMP-4 y PTH 1-34, se regeneró el tejido óseo con mayor rapidez que cuando se empleaban estos genes por separado, observando que el efecto es dependiente de la magnitud con la que los fibroblastos captan y expresan el ADN en el área tratada43.
Como se ha comentado previamente, la angiogénesis es un elemento que acompaña al proceso de reparación ósea. El VEGF desempeña un papel destacado en el proceso de formación ósea mediado y actuando de manera sinérgica con la BMP-4. Peng et al36 establecieron un modelo en ratones C57BL/6 con un defecto óseo craneal para estudiar el efecto terapéutico de la administración de células stem provenientes de músculo y transducidas con un vector retrovírico que expresa BMP-4 y VEGF. Observaron que la co-expresión de ambos factores favorecía el proceso de reparación ósea.
Es conveniente resaltar que si bien los experimentos arriba reseñados tienen un valor importante desde el punto de vista preclínico, no representan la realidad clínica en la que es frecuente encontrar pacientes diabéticos, ancianos, etc., afectados por patologías vasculares, metabólicas o con lesiones óseas pobremente vascularizadas e incluso infectadas, que complican los procesos de reparación ósea y/o cartilaginosa.
REPARACION DE LESIONES DEL CARTILAGO ARTICULAR
El cartílago articular es un tejido vulnerable que está desprovisto de mecanismos efectivos de reparación. El daño del cartílago articular puede ser consecuencia de un daño agudo ocasionado por un traumatismo crónico, secundario a procesos inflamatorios y/o degenerativos de larga duración.
De particular importancia es el hecho de que las lesiones del cartílago que no penetran hasta el hueso subcondral no conducen a una reparación espontánea44,45. Se ha observado que cuando se produce una lesión que afecta al tejido subcondral se favorece la migración e infiltración de células progenitoras provenientes de la médula; sin embargo, en el mejor de los casos este proceso de reparación es insuficiente y el tejido formado es de mala calidad. En la actualidad no existe un tratamiento médico o quirúrgico eficaz que permita regenerar el cartílago articular.
Una opción terapéutica para pacientes jóvenes con patologías del cartílago articular en fase experimental es la extración de tejido del cartílago articular del paciente, la separación de los condrocitos, su cultivo y expansión in vitro y su reimplantación quirúrgica. Numerosos pacientes han sido tratados con este procedimiento que por el momento se limita a la reparación del cartílago en la articulación de la rodilla46.
Los avances obtenidos en biología molecular han identificado una serie de genes implicados en el proceso de reparación, mantenimiento o anabolismo metabólico del cartílago. Entre ellos se encuentran BMP-7, IGF-1 (insulin growth factor-1), TGF-β, FGF (fibroblast growth factor), HGF (hepatocyte growth factor), factores de transcripción como SOX-9 y moléculas involucradas en la inhibición de la apoptosis como Bcl-226. También se han identificado otras moléculas que ejercen un efecto beneficioso inhibiendo la degradación del cartílago, como son IL-4, IL-10 y TNFsR. La transferencia génica de factores que facilitan el crecimiento o que impiden su degradación o destrucción son alternativas terapéuticas muy atractivas.
Una de las técnicas que se han desarrollado recientemente y con cierto grado de éxito es la administración combinada de una plataforma tisular compuesta por una matriz de ácido poliglicólico, mezcladas con células progenitoras de condrocitos derivadas del periostio y transducidas con un vector retrovírico que expresa hBMP-7. Esta mezcla de matriz y células modificadas genéticamente para producir un factor de crecimiento de cartílago fue administrada directamente sobre un defecto rotuliano, de 3 mm2, en la rodilla de conejos47. La evaluación del efecto biológico fue realizada a las 4, 8 y 12 semanas. Mientras que la administración de matriz o de matriz con células progenitoras sin el gen terapéutico fue incapaz de reparar el defecto, la administración combinada de estos elementos permitió regenerar el cartílago macroscópica e histológicamente47.
Aprovechando la accesibilidad del tejido sinovial, y gracias a la facilidad con la que es posible infectar este tejido, se han ensayado diversas aproximaciones terapéuticas en modelos experimentales para intentar que los sinoviocitos produzcan factores que difundan a la articulación y lleguen al cartílago para hacer su efecto. Una de ellas consiste en la inyección intrasinovial de un adenovirus que expresa IGF-1 en la rodilla de conejos. Con esta estrategia se incrementó la síntesis de matriz48. Sin embargo, este efecto se acompaña de la formación de cartílago ectópico en la articulación48. Resulta crítico, por tanto, desarrollar vectores con expresión específica en el cartílago articular.
Mi et al49 examinaron los efectos de la administración intraarticular de un adenovirus que expresaba TGF-β1 humana en rodillas sanas y con artrítis en conejos49, pero a pesar de tener propiedades antiinflamatorias, la transferencia génica de TGFβ-1 mediada por adenovirus no fue capaz de estimular la reparación de cartílago dañado, es más, se indujo la degradación de cartílago.
Estos resultados contrastan con los obtenidos in vitro, en los que se observaba que TGFβ-1 era capaz de estimular la síntesis de matriz y de inhibir los efectos supresivos de IL-1β sobre su metabolismo. Resulta importante resaltar, al menos en este modelo estudiado, que la transferencia de TGFβ-1 intraarticular conlleva un elevado riesgo de efectos adversos que hacen que no sea una estrategia aplicable para patologías en las que es necesario reparar cartílago dañado, como la artritis reumatoide o la artrosis.
Queda claro que la transferencia génica directa al tejido sinovial no parece apropiada, así como tampoco parece ser eficaz la transducción del tejido cartilaginoso dada la dificultad que tienen los diferentes vectores para atravesar fácilmente la matriz densa en la que se encuentran los condrocitos. Sin embargo, se han publicado estudios en los que se ha logrado transducir in vivo condrocitos empleando vectores basados en liposomas50.
Dada la dificultad para lograr una transducción adecuada in vivo, se han explorado otras alternativas. Un ejemplo es la utilización de cultivos de condrocitos, los cuales se pueden transducir ex vivo y reimplantar en el huésped para regenerar cartílago. Las células progenitoras de condrocitos provenientes de médula ósea (adipocitos, periostio) parecen ser más apropiadas para realizar esta función dada su plasticidad. En el caso de los progenitores de la médula ósea parece ser que son las células mesenquimales (MSC) (mesenchymal stem cells) las que mayor potencial tienen. Se han podido diferenciar in vitro condrocitos a partir de MSC en presencia de factores como TGF-β y dexametasona en el medio de cultivo51 y se ha demostrado que la administración directa de estas células fue capaz de regenerar defectos importantes de cartílago en un modelo desarrollado en conejos52. También se observó que las MSC tienen capacidad para adherirse a la superficie de cartílago tanto in vitro como in vivo53. Sin embargo, la experiencia en este campo es bastante limitada.
ARTRODESIS DE LA COLUMNA VERTEBRAL
La fusión de los cuerpos vertebrales es uno de los procedimientos quirúrgicos más frecuentes en cirugía ortopédica. Sin embargo, por diversos motivos la fusión de los cuerpos vertebrales no es satisfactoria en un porcentaje no desdeñable de casos.
El empleo de BMP en forma de proteína recombinante, unidos a un carrier de colágeno, se ha utilizado en diversos modelos animales para incrementar la formación de hueso y facilitar las uniones vertebrales. Las elevadas dosis de proteína, su corta vida media, la necesidad de unos niveles sostenidos y de carriers, hacen prácticamente imposible su empleo generalizado para esta técnica.
La terapia génica se constituye como un recurso alternativo que podría cubrir estas necesidades14. Se han ensayado diversas estrategias entre las que se encuentra el empleo de un vector adenovírico que codifica para BMP-2. Este vector ha sido utilizado en un modelo de rata inmunodeficiente aplicándolo de manera percutánea en la región paraespinal lumbosacra. El estudio con tomografía axial computarizada (TAC) a diferentes tiempos demostró la formación de hueso, hecho confirmado posteriormente mediante estudio histológico en el que se confirmó la osificación endocondral. No hubo evidencia de formación ósea en sitios distantes a la administración54,55.
Wang et al56 demostraron la artrodesis entre las apófisis transversas de L4-L5 administrando células provenientes de médula ósea de rata infectadas con un adenovirus que codifica para BMP-2 a las 4 semanas. Boden et al57 vieron que la administración de células provenientes de médula ósea transfectadas con un plásmido que codifica para LMP-1 (LIM mineralization protein), un factor de transcripción que promueve la expresión endógena de BMP, en un modelo animal alcanzó la fusión de apófisis transversas lumbares en la mayoría de los animales tratados.
Los resultados comentados previamente sugieren que la terapia génica puede ser una herramienta más que contribuya a facilitar la formación ósea en las fusiones vertebrales.
REPARACION DE LIGAMENTOS
Aunque existe variabilidad entre los diferentes ligamentos, tras una lesión la mayoría cura con dificultad14. El TGF-β1 es uno de los factores de crecimiento que incrementa la producción de colágeno. Existen otros, PDGF, EGF, HGF, BMP-2, IL-1, que facilitan la síntesis de colágeno a través, entre otros mecanismos, de la migración de fibroblastos58.
Hildebrand et al59 demostraron la factibilidad del procedimiento de administración directa de un vector adenovírico que expresa el gen reportero lacZ en ligamentos de la rodilla de conejos. También se ha ensayado con otros vectores para transferir genes, como, por ejemplo, vectores no víricos basados en liposomas, en conjugación con el virus hemaglutinante de Japón o HVJ60. Helm et al61 emplearon un adenovirus que expresaba la BMP-13 humana en un modelo de ratón atímico mediante la inyección intramuscular directa del vector, con el fin de estudiar la capacidad del sistema para inducir la formación de tejido de tipo tendinoso o ligamentario de manera ectópica. Los tejidos analizados con microscopia óptica y electrónica mostraron que de manera precoz se producía una infiltración de células progenitoras que posteriormente se diferenciaban a fibroblastos. Estos fibroblastos fueron capaces de producir matriz de colágeno extracelular, aunque también se observó la presencia de pequeños focos conteniendo tejido óseo y cartílago.
En el campo de la terapia génica ex vivo se ha experimentado con la administración de MSC autólogas resuspendidas en un vehículo compuesto por un gel de colágeno en el tendón de Aquiles en conejos. Transcurridas varias semanas después de la administración de las células se observó una mejoría significativa en estructura de las fibras de colágeno62.
TERAPIA GÉNICA ANTITUMORAL
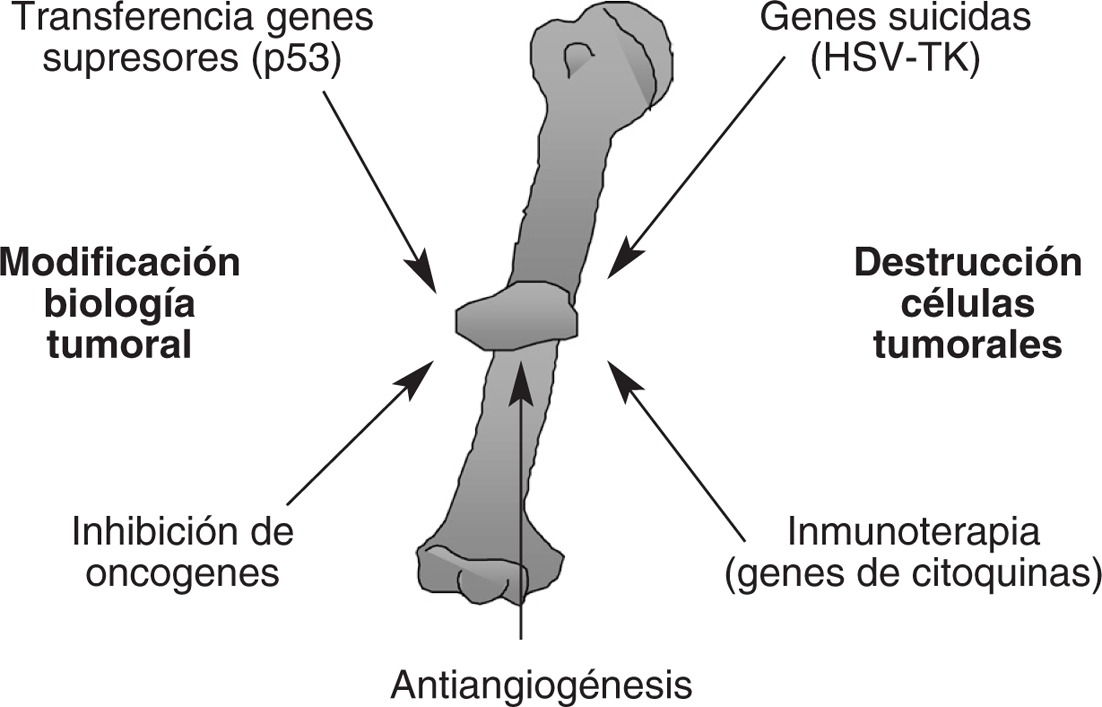
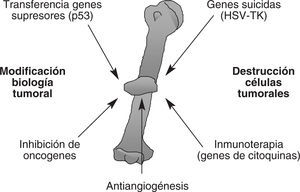
En la terapia génica del cáncer pueden utilizarse distintas estrategias basadas en la transferencia de genes con diversas acciones biológicas. Entre las distintas modalidades terapéuticas encontramos (fig. 6):
Figura 6. Terapia génica del cáncer. Existen múltiples sistemas a través de los cuales se puede detener el crecimiento de los tumores o incluso hacerlos regresar en modelos experimentales. El empleo de combinación de estas estrategias puede resultar sinérgica en la erradicación de tumores.
1. Transferencia de genes a las células tumorales que inducen una sensibilización ante fármacos que no son tóxicos para las otras células del organismo (genes suicidas).
2. Inhibición de la actividad de oncogenes involucrados en el desarrollo de tumores (mediante la transferencia de secuencias antisentido o robozimas).
3. Restablecimiento de la función de genes supresores de tumores.
4. Potenciación de la respuesta inmunitaria antitumoral a través de la transferencia de genes que codifican para citoquinas, quimiocinas, moléculas de coestímulo, terapia celular adoptiva de linfocitos antitumorales o de células presentadoras de antígenos modificadas genéticamente ex vivo, o bien distintas combinaciones de las mencionadas estrategias (inmunoterapia génica).
El osteosarcoma es un tumor muy agresivo que requiere la búsqueda de tratamientos alternativos. Tanto en experimentos in vitro como in vivo se ha estudiado el efecto antitumoral del sistema terapéutico timidina kinasa/ganciclovir (TK/GCV) sobre osteosarcoma. En los experimentos in vitro se ha observado efecto citopático, así como efecto bystander o vecindad, que consiste en la eliminación de las células tumorales vecinas que no han sido transducidas directamente con TK, pero que son eliminadas de igual manera tras administrar ganciclovir63. Mientras que en los modelos realizados in vivo fue posible obtener reducciones de la masa tumoral y reducir el desarrollo de metástasis63.
Los modelos metastásicos de osteosarcoma son claros ejemplos en los que se puede evaluar la eficacia terapéutica de la inmunoterapia génica. La IL-12 es una citoquina con importantes funciones inmunorreguladoras y ha sido extensamente utilizada como proteína recombinante o mediante transferencia génica en el tratamiento de diversos modelos tumorales experimentales64. Jia et al65 estudiaron los efectos de la administración aerosolizada de PEI (polyethylenimine) junto con un plásmido que codifica para la citoquina inmunoestimuladora IL-12 en un modelo murino de metástasis pulmonares de osteosarcoma. Observaron que el PEI es un buen sistema para vehiculizar el ADN en el pulmón, una estrategia que reduce el número y tamaño de las metástasis pulmonares de osteosarcoma65.
Tanto el desarrollo de respuesta inmunitaria específica y el empleo de otras estrategias como el sistema TK/GCV, o la terapia antiangiogénica, solos o en combinación, abren una puerta prometedora en el tratamiento de los tumores óseos.
CONSIDERACIONES FINALES
En los últimos años se ha abierto la posibilidad de transferir material genético funcionante a las células, introduciendo cambios fundamentales en la biología de las patologías más frecuentes en Traumatología. Como consecuencia de las limitadas opciones terapéuticas que existen para pacientes con pérdidas óseas sustanciales, lesiones del cartílago articular o tumores óseos, la terapia génica se ha convertido en una de las áreas de investigación con mayor desarrollo. Entre los objetivos pretendidos por la terapia génica están incrementar la eficacia de los vectores en la transducción celular, desarrollar promotores específicos de tejido que permitan reducir los efectos tóxicos asociados a la expresión génica en tejidos no deseados, aplicar sistemas que permitan que la expresión del gen terapéutico pueda ser regulable e identificar el gen o la combinación de genes más apropiada para permitir la reparación tisular.
Conflicto de intereses. Los autores no hemos recibido ayuda económica alguna para la realización de este trabajo. Tampoco hemos firmado ningún acuerdo por el que vayamos a recibir beneficios u honorarios por parte de alguna entidad comercial. Por otra parte, ninguna entidad comercial ha pagado ni pagará a fundaciones, instituciones educativas u