En los últimos años han aparecido polietilenos altamente entrecruzados para intentar disminuir el desgaste, tal como se ha demostrado en simuladores de rodilla. El objetivo es evaluar mediante el recuento de partículas de polietileno en líquido sinovial, si se confirma un menor desgaste en pacientes con prótesis de polietileno altamente entrecruzado.
Material y métodoEstudio prospectivo aleatorizado, en el que durante la implantación de una prótesis de rodilla se asignó a un grupo de pacientes la colocación de un polietileno convencional (grupo A), y a otro grupo un polietileno altamente entrecruzado (X3® de Stryker Orthopaedics) (grupo B). A los 12 meses tras la cirugía se practicó una artrocentesis de rodilla y se hizo un recuento de partículas de polietileno en el líquido sinovial mediante microscopio electrónico de barrido. Se han analizado 14 muestras en cada grupo.
ResultadosAmbos grupos son comparables en todas las variables estudiadas. No hemos hallado diferencias significativas en la concentración de partículas de polietileno/ml (1,49±0,85 millones grupo A vs. 1,42±0,91 millones grupo B; p=0,60) ni en el número total de partículas aisladas entre ambos grupos. Tampoco hemos hallado diferencias en el tamaño ni la morfología de partículas entre ambos grupos.
Discusión y conclusionesAunque diversos trabajos in vitro han hallado una reducción muy significativa del desgaste del polietileno altamente entrecruzado, no se ha hallado que en las prótesis de rodilla implantadas en pacientes este desgaste se vea reducido. La gran variabilidad del número de partículas entre individuos sugiere que el desgaste de polietileno in vivo depende de muchos factores y probablemente el tipo de polietileno no sea el más determinante.
In recent years cross-linked polyethylenes have been developed in an attempt to reduce the wear, as has been demonstrated in knee simulators. The aim is to assess, by counting particles of polyethylene in synovial fluid, whether the reduction in wear is confirmed in patients with a highly crosslinked polyethylene prosthesis.
Material and methodsA prospective randomised study was designed. During the implantation of a knee prosthesis, one group of patients was assigned the use of a conventional polyethylene (group A), and the other group a highly crosslinked polyethylene (X3®, Stryker Orthopaedics) (group B). At 12 months after surgery a knee arthrocentesis was performed, and the number of polyethylene particles was counted in a scanning electron microscopy. Fourteen samples from each group were studied.
ResultsBoth groups were comparable in all study variables. We found no significant differences in the concentration of polyethylene particles/ml (1.49±0.85 million in group A vs 1.42±0.91 million in group B, P=.60) or the total number of isolated particles. We found no differences either in size or morphology of particles between both groups.
Discussion and conclusionsAlthough several in vitro studies in vitro using different types of highly crosslinked polyethylene found a significant reduction, we did not find that that wear was reduced in the knees of these patients. The great variability in the number of particles between individuals suggests that polyethylene wear in vivo depends on many factors, so perhaps the type of polyethylene is not the most significant factor.
La osteólisis es una de las principales causas de fracaso en la artroplastia total de rodilla. Así, a partir de los 5 años la osteólisis secundaria al desgaste de polietileno y el aflojamiento aséptico son la primera causa de revisión1,2.
En el caso de la artroplastia de rodilla el mecanismo predominante de desgaste es el de fatiga. Ello produce partículas de mayor tamaño a las producidas en el caso de las artroplastias de cadera, en las que el desgaste se produce por abrasión y adhesión3. El tamaño de las partículas es importante, ya que las de menor tamaño tienen mayor actividad biológica y producen mayor osteólisis3. Las partículas >10μm son poco pro-inflamatorias por no ser fagocitables4.
La osteólisis es el resultado de una respuesta a cuerpo extraño, inducida por las partículas procedentes del desgaste del polietileno5. Esas partículas son fagocitadas por macrófagos y células gigantes, que se activan y liberan citocinas. Las interleucinas IL-1β, IL-6 y el factor de necrosis tumoral alfa producen inflamación y estimulan a los osteoclastos y el osteoclasto activado es la célula responsable de la osteólisis6–8; pero además las citocinas disminuyen la formación de hueso por parte de los osteoblastos9.
Con el objetivo de disminuir la liberación de partículas de polietileno en las últimas décadas se han introducido diferentes mejoras por parte de la industria: mejoras en los procesos de esterilización del polietileno, utilizando radiaciones gamma en un medio sin oxígeno10, nuevos pares de fricción, y polietilenos altamente entrecruzados11,12. Entre estos polietilenos altamente entrecruzados encontramos el X3® (Stryker Orthopaedics, Mahwah, NJ)
El polietileno altamente entrecruzado se utiliza desde hace más de 10 años en la artroplastia total de cadera, donde ha demostrado mejores resultados in vivo en cuanto a desgaste que el polietileno convencional13–15. Sin embargo, los estudios realizados en artroplastia de rodilla, y en los que se basa su uso actual en esta articulación, están realizados in vitro sobre un simulador16,17. En un estudio, Wang encuentra una reducción del desgaste del polietileno del 68 y del 64% en artroplastias tipo con retención del cruzado posterior (CR) y prótesis totales de rodilla (PTR) posteroestabilizadas (PS) respectivamente, al comparar el polietileno X3® con el polietileno convencional16.
No obstante, sabemos que los estudios en simuladores e in vitro no siempre reproducen de una manera fiel las condiciones que se producen en la clínica.
La hipótesis del presente estudio es que la utilización del polietileno altamente entrecruzado X3® reduce el número de partículas de polietileno procedentes del desgaste, en comparación con el polietileno convencional en un contexto in vivo.
El objetivo principal del estudio es comparar el número de las partículas de polietileno aisladas en líquido sinovial tras artroplastia total de rodilla primaria, según se utilice un polietileno convencional o el altamente entrecruzado.
El objetivo secundario es comparar los tamaños y morfología de las partículas de ambos grupos.
Material y métodosSe diseñó el presente estudio prospectivo y aleatorizado. El protocolo del estudio ha sido aprobado por el Comité Ético local. Los pacientes facilitaron el consentimiento informado para su inclusión en el estudio, incluyendo la extracción de líquido sinovial mediante artrocentesis a los 12 meses.
En todos los casos se ha implantado la PTR Triathlon® (Stryker Orthopaedics, Kalamazoo, MI, EE. UU.) cementada de tipo PS, habiéndose llevado a cabo la cirugía por el mismo cirujano.
La aleatorización se efectuó mediante la asignación intraoperatoria por sobre cerrado, asignándose el 50% de pacientes al grupo A (polietileno convencional) y el 50% de pacientes al grupo B (polietileno altamente entrecruzado o X3®). El polietileno convencional es polietileno de alto peso molecular GUR 1020 irradiado con 30 KGy (irradiación gamma) en nitrógeno. El polietileno X3® es polietileno de alto peso molecular altamente entrecruzado, que se somete a tres ciclos de irradiación a 30 KGy en aire seguida de recocido en aire a 130°C durante 8 horas. La esterilización tras los tres ciclos se realiza con gas-plasma.
Se consideraron criterios de inclusión en el presente estudio la implantación de una PTR primaria posteroestabilizada, en pacientes con edad comprendida entre 60 y 85 años.
Se consideraron criterios de exclusión el diagnóstico diferente al de gonartrosis primaria (postraumática, artropatía inflamatoria), la presencia de deformidad preoperatoria severa (>12° de varo o valgo en el eje femorotibial), la presencia de una alineación postoperatoria con varo o valgo >4°, la retirada voluntaria del estudio y la imposibilidad para obtener 3 cc de líquido sinovial en la visita de control de los 12 meses.
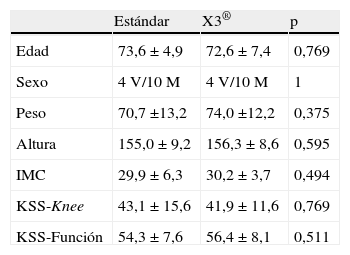
Las variables consideradas en la evaluación preoperatoria fueron: edad, sexo, peso, talla, índice de masa corporal (IMC), ángulo femorotibial (AFT) medido en proyección radiológica telemétrica, y los valores de rodilla y función de la escala KSS (Knee Society Score)18.
La edad media de los pacientes fue de 73,1±6,2 años, tratándose de 8 varones y 20 mujeres. La puntuación preoperatoria en la escala KSS fue de 42,6±13,6 puntos en la subescala de rodilla y 55,4±7,8 puntos en la de función.
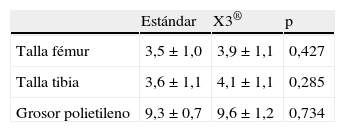
Las variables del implante consideradas fueron: talla del componente femoral, talla del componente tibial y grosor del polietileno. Las tallas más usadas de los componentes femoral y tibial fueron las tallas 3 y 4. El polietileno empleado fue el más delgado, de 9mm en el 82% de los casos.
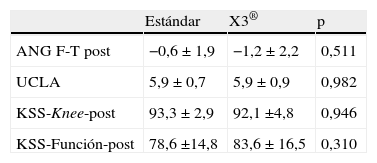
Los pacientes siguieron los controles habituales en el postoperatorio y en la evaluación de los 12 meses tras la cirugía se consideraron las siguientes variables: valores de rodilla y función de la escala KSS, AFT postoperatorio medido en proyección radiológica telemétrica, resultado del cuestionario de actividad física según la escala de UCLA19. Los valores de la escala KSS a los 12 meses fueron de 92,4±3,8 puntos en la subescala de rodilla y 80,9±16,3 en la de función. El AFT postoperatorio medio fue de 0,9°±1,9°. El 57% de los pacientes estuvieron en la categoría 6 de la escala de UCLA, el 21% en la categoría 7, el 14% en la categoría 5 y el 7% en la categoría 4.
A todos los pacientes se les practicó una artrocentesis en condiciones de esterilidad en la visita de los 12 meses, habiéndose evacuado por el mismo explorador la cantidad máxima de líquido sinovial. En todos los casos el volumen mínimo fue de 3ml. El volumen medio obtenido en esta artrocentesis fue de 12,4±6,9ml.
Las muestras de líquido sinovial, una vez identificadas, eran conservadas en un tubo estéril en congelador a −20°C hasta el procesamiento de las muestras en las siguientes semanas.
Las muestras posteriormente se procesaron según la técnica descrita por Minoda et al.20, que básicamente consiste en una digestión de la muestra mediante hidróxido de sodio a 65°C durante 12 horas para destruir los restos tisulares. A continuación se aplicó a un gradiente continuo de sacarosa en un tubo de 14ml y ultracentrifugada a 28.000rpm durante tres horas a 4°C. Seguidamente, se tomó el nivel más superior de tubo y se aplicó a un gradiente de isopropanol-agua (en un tubo de 40ml, que también se ultracentrifugó a 28.000rpm durante una hora a temperatura ambiente para agrupar las partículas. Finalmente, se tomó la línea de la interfase que se filtró a través de un filtro de policarbonato de 0,1μm, donde quedaron retenidas las partículas de polietileno. El filtro se colocó en una placa de Petri.
En el servicio de microscopía electrónica de barrido, el filtro se montó sobre una lámina de latón con cinta bioadhesiva conductora y plata coloidal; se recubrió con una lámina de oro de 40nm, y se analizó con el microscopio. El microscopio utilizado fue un microscopio electrónico de barrido ambiental (ESEM) Quanta 200 (FEI,Co). En el microscopio electrónico cada muestra era analizada en 10 campos aleatorios a 10.000 aumentos. Dicho análisis fue efectuado por una persona especializada. En aquellos casos de duda sobre la composición de una partícula, era analizada con el sistema de microanálisis por separación de energías de rayos-X (EDAX Genesi y díodo de polvorización catódica Polaron E5000), mediante el que pudimos saber si se trataba realmente de una partícula de polietileno o bien si era una partícula contaminante.
En cada campo de gran aumento se analizó el número de partículas, la medida de las mismas y su morfología.
Análisis estadísticoSe llevó a cabo mediante el paquete estadístico SPSS 15.0 para Windows. Las variables cuantitativas se compararon con la prueba U de Mann-Whitney y las variables categóricas se compararon con la prueba Chi-cuadrado o el test exacto de Fisher, según conviniese. Se estableció el nivel de significación estadística en p<0,05.
ResultadosAmbos grupos son comparables en todas las variables preoperatorias tanto antropométricas como radiológicas como de puntuación de KSS (tabla 1). Tampoco existen diferencias significativas en las tallas de implantes o grosor de polietileno (tabla 2). Ambos grupos han resultado también comparables en las variables postoperatorias: AFT, escala de UCLA y puntuación en la escala KSS (tabla 3).
El volumen de líquido sinovial obtenido en la artrocentesis ha sido de 11,7±7,2ml en el grupo A (polietileno convencional) y de 13,1±5,7ml en el grupo B (polietileno X3®) (p=0,635).
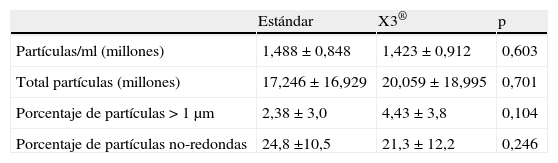
La concentración media de partículas de polietileno/ml ha sido de 1,46×106±0,88×106. El número total de partículas de polietileno por muestra ha sido de 18,63×106±17,93×106. No hemos hallado diferencias ni en la concentración de partículas de polietileno/ml ni en el número total de partículas aisladas entre las muestras del grupo A y B (tabla 4).
Resultados del estudio de las muestras de líquido sinovial en el microscopio electrónico
| Estándar | X3® | p | |
| Partículas/ml (millones) | 1,488±0,848 | 1,423±0,912 | 0,603 |
| Total partículas (millones) | 17,246±16,929 | 20,059±18,995 | 0,701 |
| Porcentaje de partículas>1μm | 2,38±3,0 | 4,43±3,8 | 0,104 |
| Porcentaje de partículas no-redondas | 24,8 ±10,5 | 21,3±12,2 | 0,246 |
El tamaño de las partículas de polietileno aisladas es muy variable, entre 0,1μm y 30μm, pero el 96,57% de las mismas eran iguales o menores de 1μm de diámetro. Comparando el porcentaje de partículas mayores de 1μm entre ambos grupos, observamos una tendencia a un mayor porcentaje de partículas mayores en el grupo B, aunque la diferencia (p=0,104) no alcanza el nivel de significación estadística (tabla 4).
Estudiando la morfología de las partículas, hallamos que el 76,5% de las mismas las consideramos redondas. No existe diferencia en el porcentaje de partículas no redondas entre ambos grupos (tabla 4).
DiscusiónEl principal hallazgo del trabajo ha sido la ausencia de diferencia en el número de partículas de polietileno en líquido sinovial entre el grupo de prótesis de rodilla con polietileno convencional y el grupo con polietileno altamente entrecruzado. Existen pocos trabajos en la literatura sobre el estudio de partículas de polietileno en líquido sinovial en pacientes y, hasta donde nosotros sabemos, solamente uno había comparado dos grupos con tipos de polietileno diferentes, pero se trataba de un estudio retrospectivo, con pocos casos analizados21.
El número de partículas aisladas en el trabajo, de unos 18,7 millones por muestra, se compara positivamente respecto a otras series con PTR metal-polietileno (57 millones), pero negativamente respecto a PTR con par de fricción cerámica-polietileno (7,1 millones)22.
Previamente diversos estudios han comparado el desgaste de polietileno in vitro entre un polietileno altamente entrecruzado y uno convencional en un simulador de rodilla al que se aplicaban varios millones de ciclos: Poppola halla una reducción entre el 72-85% del desgaste con el polietileno altamente entrecruzado de NexGen® (Zimmer, Warsaw, Ind, EE. UU.)23. Otros trabajos in vitro con el polietileno altamente entrecruzado X3® de Stryker también han hallado reducciones del desgaste superiores al 60%16,24.
Apenas existen trabajos que hayan analizado el desgaste del polietileno altamente entrecruzado in vivo: en un estudio en PTR hallaron una reducción del desgaste analizando las partículas en líquido sinovial, pero estos resultados se basaban en solamente 7 casos (tres en un grupo y 4 en el otro)21. En cambio, en un estudio en prótesis de cadera revisadas, los implantes extraídos del polietileno altamente entrecruzado mostraban un desgaste similar al del polietileno convencional25.
En este estudio se han hallado únicamente una reducción del 4,37% de partículas/ml de líquido sinovial, que no es estadísticamente significativo. Además, se ha observado una alta variabilidad entre individuos, lo que sugiere que in vivo además del tipo de polietileno influyen muchos otros factores en el desgaste: el peso y actividad del paciente, la alineación de los componentes en los tres planos del espacio, el tamaño de los componentes protésicos que condiciona su superficie, la tensión ligamentosa y muchos otros.
Las reacciones biológicas adversas que provocan la osteólisis no dependen solamente de los valores del desgaste, sino también de la concentración y tamaño de las partículas26. En cuanto al tamaño de las partículas, la primera generación de polietilenos altamente entrecruzados generaba partículas de menor tamaño, que se había relacionado con un aumento de la capacidad de generar osteólisis27. No obstante, en otros estudios con polietileno altamente entrecruzado contemporáneo no se hallaron diferencias en el tamaño de las partículas respecto al polietileno convencional28,29, ni aunque la superficie de fricción fuera cerámica en lugar de metálica30. En el presente estudio tampoco hemos hallado diferencias significativas en el tamaño de las partículas entre ambos grupos, aunque hemos observado una tendencia a mayor porcentaje de partículas mayores de 1 micra en el grupo de polietileno altamente entrecruzado.
Aunque existe evidencia de que las partículas elongadas son más proinflamatorias que las redondas4, nosotros no hemos hallado tampoco diferencias significativas en la morfología de las partículas de polietileno entre ambos grupos.
Aunque se ha especulado sobre la posible fragilidad del poste del componente PS por su mayor fragilidad31, desde el punto de vista clínico algunos trabajos han mostrado que la utilización de polietileno altamente entrecruzado en prótesis de rodilla es seguro a corto y medio plazo, pero no aporta ventajas en cuanto a resultados clínicos o radiológicos32,33.
El presente trabajo tiene diversas limitaciones como son el número reducido de casos, el difícil control de algunas variables que pueden influir en el desgaste del polietileno tanto o más que el tipo del mismo, como son la tensión de los ligamentos, que resulta imposible de medir in vivo. Por último, en el procesamiento del líquido sinovial se han empleado filtros con poros de 0,1μm siguiendo la técnica descrita por Minoda20, por lo que partículas menores a este tamaño no son retenidas por el filtro, aunque estudios previos demuestran que la mayoría de partículas de desgaste en PTR se hallan entre 0,1 y 1μm34,35 y las partículas que provocan mayor osteólisis son las que miden entre 0,3 y 1μm36, por lo que las partículas no retenidas por el filtro empleado apenas serían causantes de osteólisis.
Otra limitación del estudio es el seguimiento, limitado a 12 meses. Aunque hemos tomado la misma cifra que otros estudios previos que comparaban diferentes PTR22,37, no podemos descartar que la ausencia de diferencias se modifique a medida que el polietileno envejece, tal como han demostrado algunos trabajos in vitro31,38.
Como conclusiones podemos decir, que en el escenario in vivo no se ha hallado una reducción en el número de partículas de polietileno a los 12 meses con la utilización del polietileno altamente entrecruzado. La gran variabilidad observada entre individuos sugiere que el desgaste de polietileno es multifactorial y probablemente el tipo de polietileno no es el principal factor que influye en el mismo.
Nivel de evidenciaNivel de evidencia I.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEl presente trabajo ha sido financiado mediante una beca concedida por la Fundación SECOT en la convocatoria de 2009.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Fundación SECOT por la beca concedida en la convocatoria de 2009 para la elaboración del presente estudio; a Gabriel Gil del Institut Municipal d’Investigació de Barcelona (IMIM) por su colaboración en el procesamiento de las muestras, y a Sergi Mojal (IMIM) por su colaboración para el estudio estadístico.