Modulación de la respuesta inmunológica en la sepsis quirúrgica*
Modulation of immunological response in surgical sepsis
GARCÍA-ÁLVAREZ GARCÍA, F.*; NAVARRO ZORRAQUINO, M.**; LOZANO MANTECÓN, R.**; LARRAD MUR, L.***; SALINAS PAYER, J. C.**; CASTILLO, J.****, y SERAL ÍÑIGO, F.*
*.Servicio de Traumatología y Cirugía Ortopédica. Hospital Lozano Blesa. Zaragoza. **.Departamento de Cirugía. Universidad de Zaragoza. ***.Servicio de Inmunología. ****.Servicio de Microbiología. Hospital Lozano Blesa. Zaragoza.
Correspondencia:
Dr. F. GARCÍA-ÁLVAREZ.
Zumalacárregui, 4, 4.°.
50006 Zaragoza.
*.Premio Mapfre 1998.
RESUMEN: El propósito de este estudio es valorar el efecto del metamizol y de la S-adenosilmetionina (SAMe) sobre los linfocitos T y las citoquinas en un modelo experimental de sepsis quirúrgica. El primero es un inhibidor de la ciclooxigenasa y la segunda es una precursora del glutatión, protectora contra los radicales libres. Se emplearon 30 ratas divididas en tres grupos. En el grupo control se procedió a la laparotomía, ligadura y punción del ciego bajo anestesia como modelo experimental de sepsis. En el segundo y tercer grupo las ratas sufrieron la misma intervención y recibieron, respectivamente, metamizol (229 mg/kg) o SAMe (14 mg/kg) por vía intramuscular en el primer (1PO) y segundo (2PO) días de postoperatorio. Una semana antes de la cirugía (PRE) en el 1PO y en el 3PO se determinaron en sangre periférica los niveles de IL-1, IL-2, IL-4, IL-6, IL-10 y TNF (ELISA y anticuerpos monoclonares) y porcentajes de marcadores celulares CD4 y CD8 (citometría de flujo y anticuerpos monoclonales). Las ratas que recibieron metamizol mostraron un descenso de los niveles de IL-4 (p < 0,05) IL-6 (p< 0,01) y cambios similares al grupo control respecto a las células. Con SAMe no mostraron variaciones de CD4 ni de niveles de IL-1, pero sí un aumento significativo de CD8 en el 3PO, mostrando diferencias respecto al grupo control (p < 0,01). Concluimos, por ello, que el metamizol descendió los niveles en sangre periférica de la IL-4 y la IL-6, citoquinas proinflamatorias, y la SAMe inhibió el descenso de las células inmunocompetentes y el aumento de IL-1. Ambas sustancias muestran en este modelo experimental efectos complementarios, útiles al evitar alteraciones inmunológicas de la sepsis que contribuyen a graves complicaciones como la inmunodepresión y el fracaso multiorgánico.
PALABRAS CLAVE: Cirugía. Sepsis. Infección. Citoquinas. Células inmunocompetentes. S-adenosilmetionina. Metamizol.
ABSTRACT: A study was made of the effect of metamizole and S-adenosymethionine (SAMe) on T lymphocytes and cytokines in an experimental model of surgical sepsis. Metamizole is a ciclo-oxygenase inhibitor and SAMe is a precursor of glutathion, which protects against free radicals. Thirty rats were distributed into three groups. The rats in the control group underwent laparotomy, cecal ligation and perforation under anesthesia to create the experimental model of sepsis. In the second and third groups, rats underwent the same intervention and received, respectively, metamizole (229 mg/kg) or SAMe (14 mg/kg) by intramuscular injection on the first (1PO) and second (2PO) postoperative days. IL-1, IL-2, IL-4, IL-6, IL-10 and TNF (ELISA and antimonoclonal antibodies) and the percentages of CD4 and CD8 cell markers (flow cytometry and monoclonal antibodies) were determined in peripheral blood 1 week before surgery (PRE) and 1PO and 3PO. The rats that received metamizole showed a decrease in the levels of IL-4 (p < 0.05) and IL-6 (p < 0.01), and cellular changes similar to those observed in the control group. With SAMe, no variations in CD4 or IL-1 levels were observed, but there was a significant increase in CD8 on 3PO compared with the control group (p < 0.001). The findings suggest that metamizole reduced the blood levels of the proinflammatory cytokines IL-4 and I-6 and that SAMe inhibited the decline in immunocompetent cells and increase in IL-1. These substances had complemmentary effects in this experimental model, indicating that they could be useful for preventing the immunological disturbances that accompany sepsis, which contribute to severe complications like immunodepression and multi-organ failure.
KEY WORDS: Surgery. Sepsis. Infection. Cytokines. Immunocompetent cells. S-adenosylmethionine. Metamizole.
El trauma debilita la respuesta inmunológica y predispone al huésped a la sepsis.43 Se constata con frecuencia que a procesos infecciosos o a grandes traumatismos les sucede la aparición de shock séptico y del fracaso multiorgánico (FMO),23 siendo la mortalidad de estas complicaciones del 50 al 70%. 27,41 De hecho, el fracaso multiorgánico ha alcanzado proporciones epidémicas en la mayoría de las unidades de cuidados intensivos (UCI) y se está convirtiendo rápidamente en la causa más frecuente de muerte en las UCI quirúrgicas (50-80%).13,49 Destaca, además, que la supervivencia tras un fracaso multiorgánico no ha mejorado significativamente en las dos últimas décadas.13
Ante una cirugía o traumatismo accidental se desencadena una cascada de respuestas destinadas a la defensa y curación del organismo, entre las que se encuentran: coagulación, fibrinolisis, activación del sistema del complemento y respuesta inmunológica, cobrando esta última una importancia cada vez mayor en la literatura.31 Puede ser, sin embargo, que ante un gran traumatismo se produzca una desmesurada activación de estos sistemas que a su vez origine un daño al propio organismo. Si además se asocia una bacteriemia o una endotoxinemia, este fenómeno se desencadena con mayor virulencia. Cabe destacar también que el origen de la sepsis puede radicar en el propio intestino, aun con un epitelio intestinal intacto, y ésta es con frecuencia la vía de colonización de prótesis de diversos tipos en ausencia de una fuente clara de organismos infectantes.65 Las alteraciones que pueden llegar a originarse en la microcirculación causan daños como el distrés respiratorio del adulto, el fracaso renal agudo y, en general, el fracaso multiorgánico.7,18
Material y Método
Se emplearon ratas macho Wistar-Furth endogámicas (Panlab®) de 300 a 350 g (entre 20 y 25 semana). Todas las intervenciones y extracciones de muestras se realizaron en condiciones de máxima higiene en la Unidad Mixta de Investigación de la Universidad de Zaragoza. Las ratas se mantuvieron en jaulas individuales desde la llegada de los animales al citado centro hasta el momento del sacrificio o del óbito espontáneo. Los animales pasaron una semana en el lugar del experimento, previa a la primera extracción de sangre, a fin de lograr su aclimatación. Todos los animales permanecieron libres de parásitos y fueron mantenidos según las normas estándar de conservación (GLP) y con acceso al agua y a la alimentación ad libitum (Panlab A-4). La experimentación desarrollada cumple las directrices éticas sobre experimentación animal, habiendo sido aprobada por el comité de experimentación animal.
Las ratas se dividieron en tres grupos de 10 animales cada uno. El grupo A (control) se sometió a anestesia con una mezcla de ketamina (0,6 mg/kg), diazepina (1 mg/kg) y atropina (0,025 mg/kg) por vía i.m.; se realizó laparotomía media (2 cm), ligadura con seda de 3/0 en la base del ciego (sin comprometer el tránsito intestinal y sin lesionar la vasculación de la zona) y punción del ciego mediante aguja 25G, comprimiendo el ciego posteriormente para que salieran heces. Finalmente, tras reintroducir el ciego, se cerró la laparotomía en dos planos con sutura atraumática de ácido poliglicólico de 4/0. Se les administró una dosis i.m. de agua bidestilada los días primero y segundo tras la intervención a modo de placebo. El modelo empleado fue inicialmente desarrollado por Baker3 y posteriormente modificado por Salinas et al,53 y actúa como foco persistente de sepsis durante todo el estudio.25,53 El grupo B (metamizol): se sometió a los animales al mismo procedimiento anterior y además se les administró una do-sis i.m. de metamizol (Nototil®, Europharma®) de 229 mg/kg los días primero y segundo tras realizar la intervención. El grupo C (SAMe): se sometió a los animales al mismo procedimiento del grupo A y además se les administró una dosis i.m. de 14,28 mg/kg de SAMe (S-AMET®, Europharma®) los días primero y segundo tras realizar la intervención. En todos los grupos se practicó la autopsia tras el fallecimiento o una vez alcanzado el séptimo día tras la intervención.
Determinación de niveles de citoquinas y de subpoblaciones de linfocitos T en sangre
Una semana antes de la intervención, como situación más próxima a la basal (PRE) y los días primero (1PO) y tercero (3PO) postintervención, se extrajo sangre periférica para la determinación de porcentaje de linfocitos T cooperadores (células CD4) y linfocitos T supresores/citotóxicos (CD8), y para medir los niveles de IL-1, IL-2, IL-4, IL-6, IL-10 y TNF. La determinación de las células CD4 y CD8 se realizó por medio de citometría de flujo usando anticuerpos monoclonales (AcMo) dirigidos contra los receptores antigénicos correspondientes. La técnica consiste en el marcaje de las células por medio de la incubación de 100 µl de sangre total heparinizada con 10 µl del anticuerpo monoclonal correspondiente por espacio de 10 minutos a temperatura ambiente y protegida de la luz. Después del marcaje se lisan las células fijándose posteriormente para poder ser observadas y cuantificadas por el citómetro (Epics Profile XL MCL). No existen valores de referencia disponibles, por lo que las cifras preoperatorias fueron usadas como valores control. Para la determinación de los niveles de IL-1, IL-2, IL-4, IL-6, IL-10 y TNF en sangre periférica se emplearon técnicas de inmunoanálisis en fase sólida (ELISA) con microplaca. Los estándares y las muestras de suero problema reaccionan con anticuerpos fijados a la microplaca (fase sólida). Después se añade un anticuerpo anticitoquina conjugado con peroxidasa y finalmente se realiza un revelado con tetrametilbencidina. La reacción se frena con ácido sulfúrico y se realiza la lectura a 450-490 nm, lo que proporciona una absorbancia que permite valorar hasta 1,5 unidades de densidad óptica. La casa Genzyme® (Genzyme, Cambridge, Massachusetts) suministró los equipos de citoquinas específicos para la rata. Las sensibilidades fueron de 15 pg/ml para IL-1, IL-2, IL-10 y TNF y de 5 pg/ml para IL-4 e IL-6.
Muestras bacteriológicas
En el momento de la autopsia de las ratas fallecidas sacrificadas al séptimo día se obtuvieron en condiciones de asepsia muestras del exudado peritoneal que fueron remitidas al Laboratorio de Microbiología. Con el caldo de cultivo para microorganismos aerobios Bacter 6A de Becton-Dickinson se sembraron 0,1 ml de la muestra en cada uno de los siguientes medios de cultivo:
-- Agar-chocolate con Isovitalex de Becton-Dickinson®.
-- Agar-sangre de Becton-Dickinson®.
-- Agar-McConkey de Becton-Dickinson®.
Una vez sembrados fueron incubados durante 18-24 horas a temperatura de 37° C en atmósfera con una presión parcial de CO2 del 10% para la placa de agar-chocolate y en aerobiosis para los otros medios usados. Además, los frascos para microorganismos aerobios (Bacter 6A®) y anaerobios (Bacter 7A®) se incubaron durante 24 horas a una temperatura de 37° C, efectuando posteriormente resiembras en los mismos medios y condiciones de cultivo citadas para aerobios y en placa de agar-sangre de Schaedler en atmósfera de anaerobiosis. Con las colonias desarrolladas en estos medios de cultivo se procedió a realizar la identificación de género y especie mediante el estudio de sus propiedades metabólicas y características bioquímicas, empleando para ello sistemas miniaturizados comercializados (Sistema API®, BioMerieux® y PASCO®, Difco®).
Análisis estadístico
Se realizó un análisis descriptivo de cada una de las variables, donde se incluyeron la curtosis y la asimetría para la determinación de la normalidad de la muestra. Dado que esta muestra no sigue una distribución normal, se emplean pruebas comparativas no paramétricas: la de Wilcoxon para el estudio de las variaciones en cada grupo de cada una de las variables y la «U» de Mann-Whitney para establecer comparaciones entre los grupos. Para el estudio de las correlaciones se empleó el coeficiente de correlación de Pearson (r) (para valores entre 0,4 y 0,7 la correlación se consideró moderada, entre 0,7 y 0,9 se consideró alta y entre 0,9 y 1 como muy alta), utilizándose como test de significación estadística en el estudio de las correlaciones la prueba no paramétrica de Spearman, considerando datos estadísticamente significativos aquellos con una p < 0,05.
Resultados
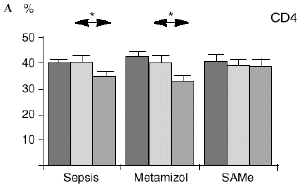
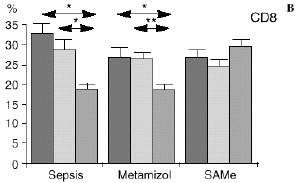
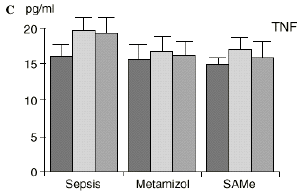
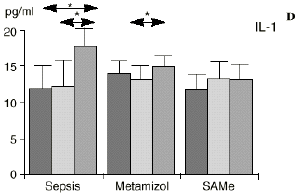
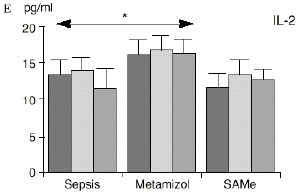
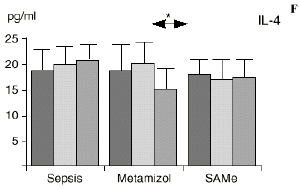
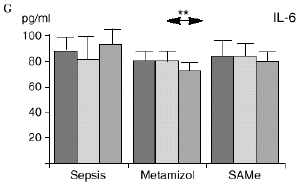
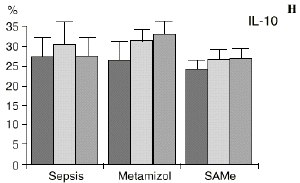
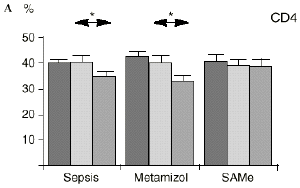
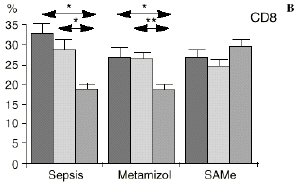
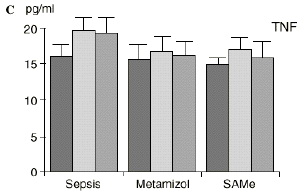
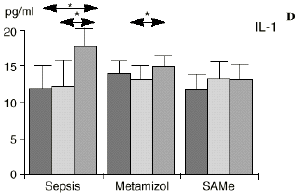
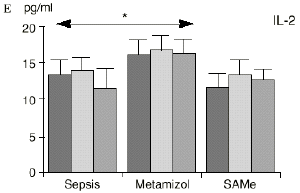
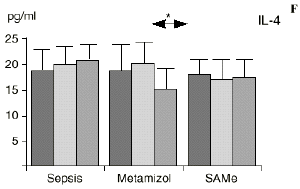
En el grupo A (control) apareció un descenso significativo del porcentaje de CD4 y CD8 (p < 0,05) en sangre periférica en el 3PO. Aunque se observaron aumentos de los niveles de IL-1, IL-4, IL-6 y TNF, sólo la IL-1 mostró un aumento significativo respecto a los valores preoperatorios (p < 0,05). Por su parte, la IL-2 y la IL-10 disminuyeron ligeramente en el 3PO. Se encontró una correlación inversa entre los niveles de IL-1 y los de IL-4 en el PRE (r = 0,71; p < 0,05) y en el 1PO (r = 0,67; p < 0,05) y en el 1PO, y otra entre IL-4 y TNF en el PRE (r = 0,67; p < 0,05) (Fig. 1). En todos los grupos apareció una correlación inversa en el preoperatorio entre la IL-10 y la IL-6 (r = 0,58; p < 0,05), y entre la IL-10 y la IL-4 en el preoperatorio (r = 0,61; p 0,05), y en el 1PO (r = 0,66; p < 0,05).
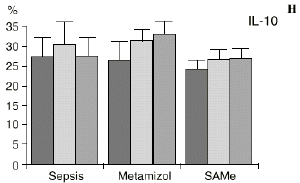
Figura 1. Evolución de las poblaciones linfocitarias (CD4 y CD8) y de las diversas citoquinas (TNF, IL-1, IL-2, IL-4, IL-6 e IL-10) en los tres grupos y comparación entre ellos. * p < 0,05. ** p < 0,01.
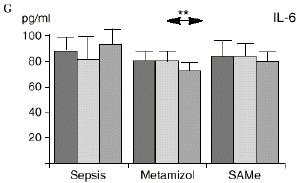
En el grupo B (metamizol) las variaciones en el porcentaje de subpoblaciones linfocitarias (Figs. 1 y 2) fueron similares a las del grupo control de sepsis. El aumento de IL-1 en este grupo fue, sin embargo, menos al del grupo control. En el tercer día postoperatorio la IL-2 no disminuyó en el grupo tratado con metamizol, mostrando un nivel más alto que el del grupo control (p < 0,05). La IL-4 y la IL-6, por su parte, manifestaron descensos significativos respecto al grupo control (p < 0,05). Un aumento moderado de IL-10 no significativo estadísticamente, apareció en el 1PO y en el 3PO en el grupo tratado con metamizol (Fig. 1).
En el grupo C (SAMe) no se observaron cambios en el porcentaje de células CD4. Sin embargo, el porcentaje de células CD8 aumentó, mostrando una diferencia significativa (p < 0,01) respecto al grupo control en el 3PO. Respecto a las citoquinas cabe destacar que en este grupo éstas no mostraron cambios significativos (Fig. 1).
En el grupo A (control) fallecieron tres animales por sepsis antes de las 48 horas, en cambio en los otros grupos no se dieron fallecimientos provocados por la sepsis. En dicho grupo control hubo también una mayor incidencia frente a los otros dos de casos de ascitis contaminadas por Enterococcus faecalis (grupo A --control--, 5; grupo B --metamizol--, 0, y grupo C --SAMe--, 2) y por Escherichia coli (grupo A --control--, 6; grupo B --metamizol--, 3, y grupo C --SAMe--, 0).
Discusión
Los traumatismos y la sepsis deterioran la respuesta inmunológica, especialmente la celular, generando elevados índices de complicaciones sépticas en los pacientes intervenidos quirúrgicamente.6 Además queda constatado que durante la sepsis se establece una correlación entre los niveles de determinadas citoquinas y la mortalidad, de tal manera que aquellos pacientes que desembocan en un final fatal han presentado durante el proceso niveles mayores y durante más tiempo que aquellos otros cuya evolución es favorable.14 En los pacientes que progresan hacia el fallo multiorgánico y la muerte a través del shock séptico, una disregulación en la producción y liberación de citoquinas puede ser la causa de la persistencia de una respuesta inflamatoria sistémica en ausencia de la continuidad de una fuente identificable de infección.14,54
De entre los metabolitos del ácido araquidónico producidos en la respuesta inflamatoria destaca la PGE2, que es el eicosanoide predominante en situaciones inflamatorias en el ser humano62 y que por tanto está presente tanto en la sepsis como tras un traumatismo.34 El metamizol es un fármaco de la familia de los AINEs de amplio uso en la clínica humana por sus propiedades analgésicas. Al igual que otros componentes de este grupo farmacológico, inhibe la síntesis de prostaglandinas a partir del ácido araquidónico.12,21,35 El metamizol posee además mayor potencia que el ácido acetilsalicílico para inhibir la PGF2* y la PGE2.33,35
Otro punto importante en la respuesta inflamatoria es la producción de radicales libres y el daño que éstos generan sobre el propio organismo. Los radicales libres son capaces de dañar, reversible o irreversiblemente, compuestos de todas las clases bioquímicas incluyendo ácidos nucleicos, proteínas, lípidos, etc.51 El glutatión, un tripéptido de origen endógeno, puede proteger a las células contra la toxicidad mediada por los radicales libres que son liberados como parte de la respuesta inflamatoria y ante estímulos de diversas citoquinas.38 La SAMe es un metabolito celular endógeno que participa activamente en el metabolismo de los aminoácidos sulfurados y del glutatión. La SAMe incrementa el contenido de glutatión del hepatocito y evita la disminución de glutatión inducido por el TNF.63 La SAMe no había sido evaluada anteriormente en la sepsis, así como tampoco su acción sobre la respuesta inmunológica de mediación celular y citoquínica.
En este experimento la sepsis induce un descenso del porcentaje de células CD4 y CD8 de manera similar a lo hallado por otros autores.34,50,57 También la agresión quirúrgica28,66 y la anestesia44 pueden haber contribuido a la disminución de las subpoblaciones linfocitarias T en nuestro modelo experimental. El metamizol parece no influir sobre las poblaciones linfocitarias en la sepsis. Por el contrario, el grupo tratado con SAMe no manifestó el descenso significativo de linfocitos T cooperadores que apareció en los otros dos grupos. Los estados sépticos se han relacionado con alteraciones en el metabolismo de la SAMe48,56 La enzima encargada de la producción de SAMe a partir de metionina (la SAM-sintetasa) se inhibe en algunos modelos experimentales durante la sepsis.48 Esta inhibición enzimática parece ser «dosis-dependiente» respecto al óxido nítrico y revertir al administrarse un agente reductor como es el glutatión, que además es metabolito de la SAMe.48 Kinscherf y cols.32 observan que las personas con niveles de glutatión intracelular de 20-30 nmol/mg tienen mayor número de células CD4 que aquellas otras con menor concentración. Otros metabolitos sulfurados de la SAMe como son la cistina, la cisteína y la taurina también se han relacionado con las células T. El déficit de *-cistationasa (enzima de la vía de la transulfuración derivada del metabolismo de la SAMe) genera un déficit de cisteína y por tanto un déficit de sus metabolitos glutatión, cistina y taurina. La disminución de esta enzima ha sido observada como consecuencia del estrés quirúrgico en pacientes traumatológicos (en los que aparece un descenso de cistina y cisteína, que se recupera tras reducir las fracturas) y en el cáncer.64 El aporte adicional de cisteína afecta al nivel intracelular de glutatión, a la proliferación de las células T y a la activación del factor de transcripción NF-kappa B.15 Además cabría resaltar que el glutatión ha sido relacionado42 con la actividad citotóxica de los linfocitos T, que se inhibe con la depleción de los niveles de glutatión, recuperándose al aumentar esos niveles. Por su parte, Iwata y cols.30 descubrieron que la ausencia de aminoácidos sulfurados en el cultivo celular frena la mitosis de estas células en fase G1. De este modo, la ausencia de glutatión provocada en la sepsis por una inhibición de la SAM-sintetasa,48 por un aumento de consumo para la neutralización de los radicales libres y por el fallo hepático secundario a la sepsis2 puede ser un factor importante que justifique la disminución linfocitaria aparecida en el grupo de sepsis y también el efecto de la SAMe sobre los linfocitos T manifestado en el presente trabajo.
La taurolidina, un derivado de la taurina, ha demostrado un efecto protector contra el shok endotóxico en animales de experimentación.5 Existe una relación entre el descenso de la respuesta de los linfocitos T ante la estimulación mitogénica en pacientes ancianos y una pérdida de capacidad para incrementar las concentraciones de calcio intracelular en respuesta al estímulo.40 La taurina40 estimula la entrada de Ca2+ en las células, de lo cual dependen el metabolismo de los nucleótidos. Además, la taurina aumenta de manera significativa la respuesta de los linfocitos T y B en ratones jóvenes y viejos ante los mitógenos.46
Si bien no hemos encontrado en la bibliografía anteriores trabajos respecto al efecto de la SAMe sobre las subpoblaciones linfocitarias, parece ser que la acción protectora de la SAMe sobre la disminución de linfocitos T ocasionada por la sepsis queda justificada por las acciones combinadas de los metabolitos a los que da lugar la SAMe, como son el glutatión y los aminoácidos sulfurados. El hecho de que los linfocitos citotóxicos (CD8) sean los principales responsables de la muerte y eliminación de células extrañas, confiere especial importancia a los datos hallados en este trabajo respecto al efecto protector de la SAMe sobre las células CD8.
En contraste con la brusca subida en plasma de los niveles de TNF observado después de la inyección de endotoxina,22,59 tras la ligadura y punción del ciego las concentraciones de TNF resultan más tardías y más bajas en la circulación.16,17,24 La sepsis en el ser humano probablemente no siga el modelo experimental de bolos de endotoxina, sino que más bien sea un estímulo séptico sostenido, lo que explicaría la relativa estabilidad de las concentraciones de TNF en aquellos pacientes de peor evolución en la sepsis.14 Por ello consideramos que el modelo experimental de sepsis que hemos desarrollado se acercaría más a la situación propia en la clínica humana en la cual el organismo no recibe una dosis única y puntual de endotoxina, sino que sufre un proceso de instauración de la infección que además perdura durante un tiempo, sobre todo si el paciente está expuesto a más de un foco séptico. La producción de IL-1 aparece dependiente de la del TNF, pues si se inhibe al TNF disminuye la génesis de IL-1 en un 95%,8 siendo la IL-1, por ello, de aparición más tardía que el TNF en todos los modelos analizados22.54. La IL-1 no sufre inhibición por tolerancia al lipopolisacárido, presentando mayores niveles al ser reestimulada por la endotoxina, ocurriendo lo mismo con la IL-6, el óxido nítrico y la PGE2.54 Este distinto comportamiento del TNF y la IL-1 parece justificado por las diferencias existentes entre ambos mediadores celulares respecto a la transcripción del ARNm y la liberación de citoquinas.67 La IL-4 influye sobre la IL-1 y el TNF, frenando su producción.39 Quizá la aparición en nuestro estudio de una correlación directa significativa (p< 0,05) entre la IL-4 y los linfocitos CD4 a las 24 horas de inducir la sepsis esté en consonancia con el vínculo establecido en la bibliografía1 entre la IL-4 y los linfocitos CD4, principales productores de esta citoquina.
A diferencia del ascenso significativo observado en el grupo A (control), en el grupo C (SAMe) no se observaron variaciones en los niveles de IL-1. Algunos autores como Bedrosian y cols.5 obtienen una inhibición de la síntesis de IL-1 al añadir taurolidina a células mononucleares periféricas humanas estimuladas con lipopolisacárido donde el mecanismo de inhibición sería por medio de cambios en los nucleóticos cíclicos, ya que el aumento de AMPc suprime la síntesis de IL-1. La taurolidina, según estos autores, disminuye la mortalidad en ratones y la fiebre en conejos y presenta propiedades antimicrobianas. La clorotaurina reduce también los niveles de ARN mensajero inducible de la óxido nítrico sintetasa en los macrófagos.37 Rosman y cols52 administrando taurolidina en ratas con peritonitis consiguen disminuir la mortalidad y la concentración de bacterias, de endotoxina y de TNF abdominal. La acción antibacteriana de la taurolidina en las infecciones bacterianas se ha atribuido a la capacidad de reacción de grupos metilol activos de la taurinamida (parte metabólicamente activa de la taurolidina), que forman enlaces cruzados con los grupos NH2 del lipopolisacárido, reduciendo la potencia de éste y dificultando la división bacteriana, lo que puede desencadenar la lisis bacteriana.5 Estas propiedades de los derivados de la SAMe, así como los efectos anteriormente descritos sobre las células inmunocompetentes, confieren a la SAMe la posibilidad de ser antibacterianas.
Las ratas tratadas con metamizol también produjeron menores niveles de IL-1 que las del grupo control de sepsis. De hecho, algunos AINEs han demostrado inhibir la producción de IL-19. El metamizol produjo, en comparación con el grupo control, un menor descenso de IL-2, un descenso significativo de IL-4, de manera similar a la dexametasona,39 y un descenso significativo de IL-6. Estos efectos del metamizol no habían sido descritos. O''Sullivan y cols.47 detectan descensos de IL-2 tras la agresión quirúrgica o accidental, correspondientes a una menor activación de los linfocitos Th-1, productores de IL-2, en beneficio de una mayor activación de los Th-2, productores de IL-4 e IL-6. Si bien no existen datos bibliográficos directos sobre la acción del metamizol sobre la IL-2, se sabe que la prostaglandina E2 (PGE2) es liberada por monocitos y macrófagos en la sepsis y que ésta inhibe la liberación de IL-2 y aumenta la respuesta tipo Th-2.19,45,55 De hecho, la PGE2 aumenta significativamente la producción de IL-6 en linfocitos T periféricos.36,55 Estas acciones de la PGE2 pueden conseguir el equilibrio del sistema inmunológico, pero también pueden ser la causa de la inmunodepresión que aparece en pacientes con shock séptico,34 grandes traumatismos o quemaduras extensas.19,45 Los inhibidores de la ciclooxigenasa aumentan la producción de IL-2 y suprimen la producción y expresión de ARNm de la IL-4 y de la
IL-6,26,58 y el metamizol, al igual que estos AINEs, inhibe la síntesis de prostaglandinas,12,13,21 por lo que probablemente tanto el aumento de IL-2 como la bajada de IL-4 e IL-6 en el grupo de sepsis tratado con metamizol se deba a la inhibición de la PGE2. Cabe destacar la importancia del efecto sobre la IL-6, que actúa en los procesos inflamatorios activando los leucocitos polimorfonucleares, contribuyendo a la proliferación y activación de los linfocitos B29,61 y estimulando la síntesis de las proteínas reactantes de fase aguda.61 De hecho se han vinculado altos niveles de IL-610,14 con una peor evolución de los pacientes que presentaban infecciones bacterianas.
La sepsis se ha asociado a un aumento de los niveles de IL-10 en plasma,17,60 atribuyéndosele una función protectora en modelos de shock séptico.60 El metamizol parece inducir un aumento de IL-10 que no se había descrito hasta el momento. En nuestro trabajo aparece en el PRE una correlación inversa entre la IL-6 y la IL-10 y otra correlación inversa entre IL-4 e IL-10 en el PRE y en el 1PO. La aparición de estas correlaciones puede orientar hacia el papel inmunosupresor atribuido a la IL-10, y confirmaría la capacidad de inhibir la producción de citoquinas proinflamatorias por parte de los macrófagos.60 De hecho, a la IL-10 se le ha atribuido el papel de citoquina inhibidora de los estímulos de activación y proliferación que el linfocito Th-1 envía al Th-2 productor de IL-4 e IL-6),11,20 Por tanto, el incremento de la IL-10 encontrado en el grupo de sepsis tratado con metamizol podría contribuir al descenso de IL-4 e IL-6 propiciado por la referida inhibición de la PGE2.
El estudio microbiológico en este trabajo se ha desarrollado de manera complementaria con el mero objeto de comprobar la existencia de infección bacteriana en el animal de experimentación. Respecto a la mortalidad, ésta ha sido escasa. Ello se debe al empleo de un modelo experimental que no produjera una muerte fulminante, permitiendo realizar un seguimiento del animal.
Para concluir se destaca el efecto inhibidor de las citoquinas proinflamatorias por parte del metamizol y la acción protectora de la SAMe de las células inmunocompetentes frente a la sepsis. Parece ser que estas dos sustancias trabajan de manera complementaria como inmunomoduladores en la sepsis. Sin embargo, estamos de acuerdo con Baue4 en que serían necesarios múltiples agentes para modular, mejor que bloquear, una excesiva o continua respuesta inflamatoria. Dado que estas sustancias son fármacos de amplio uso en la clínica humana, de fácil dosificación, alto margen de seguridad y escasos efectos secundarios, creemos que ambas sustancias pueden complementarse, de tal modo que su aplicación en enfermos politraumatizados o con procesos sépticos podría ser una terapéutica complementaria de utilidad en la clínica quirúrgica. Sería conveniente, no obstante, realizar estudios experimentales induciendo una sepsis más grave que diera lugar a un shock séptico con el objeto de comprobar estos efectos terapéuticos.
Agradecimientos
El metamizol, la SAMe, los reactivos para citoquinas y los anticuerpos monoclonales fueron cedidos por el doctor Pablo Ortiz (Europharma, Grupo Boehringer Ingelheim, España).
Bibliografía
1. Abbas, AK; Lichtman, H, y Pober, JS: Citocinas. En: Abbas, AK; Lichtman, AH, y Pober, JS (Eds): Inmunología celular y molecular. Madrid. Interamericana-McGraw-Hill, 1995, 267-292.
2. Arias-Díaz, J; Vara, E; García, C; Villa, N; Rodríguez, JM; Ortiz, P, y Balibrea, JL: S-adenosylmethionine protects hepatocytes against the effects of cytokines. J Surg Res, 62: 79-84, 1996.
3. Baker, CC; Chaudry, IH; Gaines, HO, y Baue, AE: Evaluation of factors affecting mortality rate after sepsis in a murine cecal ligation and puncture model. Surgery, 94: 331-335, 1983.
4. Baue, AE: Multiple organ failure, multiple organ dysfunction syndrome, and systemic inflammatory response syndrome. Arch Surg, 132: 703-707, 1997.
5. Bedrosian, I; Sofía, RD; Wolff, SM, y Dinarello, CA: Taurolidine, an analogue of the amino acid taurine, suppresses interleukin 1 and tumor necrosis factor synthesis in human peripheral blood mononuclear cells. Cytokine, 3: 568-75, 1991.
6. Caínzos, M, y Potel, J: Aspectos inmunológicos de la infección en cirugía. En: Caínzos M (Ed): Infección en cirugía. Barcelona. Doyma, 1994, 227-243.
7. Carrico, CJ; Meakins, JL; Marshall, JC; Fry, D, y Maier, RV: Multiple organ failure syndrome. Arch Surg, 121: 196-208, 1985.
8. Cerami, A: Inflammatory cytokines. Clin Immunol Immunopathol, 62: S3-S10, 1992.
9. Chang, DM; Baptiste, P, y Schur, PH: The effect of antirheumatic drugs on interleukin 1 (IL-1) activity and IL-1 inhibitor production by human monocytes. J Rheumatol, 17: 1148-57, 1990.
10. Damas, P; Ledoux, D; Nys, M; Vrindts, Y; De Groote, D; Franchimont, P, y Lamy, M: Cytokine serum level during severe sepsis in human IL-6 as a marker of severity. Ann Surg, 215: 356-62, 1992.
11. De Vries, JE: Antiinflammatory properties of IL-10. Intensive Care Med, 20: 53, 1994.
12. Deby-Dupont, G: Release of thromboxane B2 during adult respiratory distress syndrome and its inhibition by non-steroidal anti-inflamatory substances in man. Arch Pharmacology, 259: 317-319, 1982.
13. Deitch, EA: Multiple organ failure: Pathophysiology and potential future therapy. Ann Surg, 216: 117-134, 1992.
14. Dofferhoff, ASM; Bom, VJJ; Vries-Hospers, HG; Van Ingen, J; Meer J, y Hazenberg, BP: Patterns of cytokines, plasma endotoxin, plasminogen activator inhibitor, and acure-phase proteins during the treatment of severe sepsis in humans. Crit Care Med, 20: 185-192, 1992.
15. Drogue, W: Cysteine and glutathione deficiency in AIDS patients: A rationale for the treatment with N-acetyl-cysteine. Pharmacology, 46: 61-65, 1993.
16. Eskandari, MK; Bolgos, G; Miller, C; Nguyen, DT; De Forge, LE, y Remick, DG: Anti-tumor necrosis factor antibody therapy fails to prevent lethality after cecal ligation and puncture or endotoxemia. J Immunol, 148: 2724-2730, 1992.
17. Evans, GF; Snyder, YM; Butler, LD, y Zuckerman SH: Differential expression of interleukin-1 and tumor necrosis factor in murine septic shock models. Circ Shock, 29: 270-290, 1989.
18. Faist, E; Baue, AE; Dittmer, H, y Heberer. G: Multiple organ failure in polytraumapatients. J Trauma, 23: 775-787, 1983.
19. Faist, E; Ertel, W; Mewes, A; Alkan, S; Walz, A, y Strasser T: Trauma-induced alterations of the lymphokine cascade. En: Faist, E; Ninnemann, J, y Green D (Eds). Immune Consequences of Trauma, Shock, and Sepsis. New York. Springer-Verlag, 1989: 79-94.
20. Fiorentino, DF; Bond, MW, y Mosmann, TR: Two types of mouse T helper cell IV; Th2 clones secrete a factor that inhibits cytokine production by Thl cells. J Exp Med, 170: 2081-2095, 1989.
21. Flórez, J; Armijo, JA, y Mediavilla, A. Analgésicos antitérmicos; antirreumáticos no esteroideos. En: Florez, J; Armijo, JA, y Mediavilla, A (Eds): Farmacología humana. Pamplona. EUNSA, 1989: 241-264.
22. Fong, Y; Tracey, KJ; Moldawer. LL, Hesse, DG, y Manogue, KR: Antibodies to cachectin/TNF reduce interleukin-1 and interteukin-6 appearance during lethal bacteremia. J Exp Med, 170: 1627-1633, 1989.
23. Fry, DE: Diagnosis and epidemiology of multiple organ failure. En: Deitch EA (Ed): Multiple Organ Failure. Stuttgart. Georg Thieme Verlag, 1990: 13-25.
24. Furutani, M; Arii, S; Monden, K; Adachi, Y; Funaki, N, y Higashitsuji H: Immunologic activarion of hepatic macrophages in septic rats; a possible mechanism of sepsis-associated liver injury. J Lab Clin Med, 123: 430-436, 1994.
25. García, JM; Torcal, J, y Salinas, JC: Modelos experimentales de infección intraabdominal en la década de los ochenta. Cir Esp, 49: 56-60, 1991.
26. González, E; De la Cruz, C; De Nicolás, R; Egido, J, y Herrero-Beaumont, G: Long-term effect of nonsteroidal anti-inflammatory drugs on the production of cytokines and other inflammatory mediators by blood cells of patients with osteoarthritis. Agents Actions, 41: 171-178, 1994.
27. Goris, RJA: Sepsis and multiple organ failure; the result of a whole body inflammation. En: Faist, E; Meakins, J, y Schildberg, F (Eds). Hostdefense Dysfunction in Trauma, Shock, and Sepsis. New York. Springer-Verlag, 1993: 161-170.
28. Hansbrough, JF; Zapata-Sirvent, RL; Bartle, EJ; Anderson, JK; Elliott, L; Mansour, MA, y Carter, WH: Alterations in splenic lymphocyte subpopulations and increased mortality from sepsis following anesthesia in mice. Anesthesiology, 63: 267-273, 1985.
29. Hirano, T: Interleukin-6 and its relation to inflammation and disease. Clinical Immunology and Immunopathology, 62: S60-S65, 1992.
30. Iwata, S; Hori, T; Sato, N; Ueda-Taniguchi, Y; Yamabe, T; Nakamura, H; Masutani, H, y Yodoi, J: Thiol-mediated redox regulation of lymphocyte proliferation. Possible involvement of adult T cell leukemia-derived factor and glutathione in transferrin receptor expression. J Immunol, 152: 5633-5642, 1994.
31. Jochum, M, y Fritz, H: Pathobiochemical mechanisms in inflammation. En: Faist, E; Ninnemann, J, y Green, D (Eds): Immune Consequences of Trauma, Shock, and Sepsis. New York. Springer-Verlag, 1989: 165-172.
32. Kinscherf, F; Fischbach, T; Mihm, S; Roth, S; Hohenhaus-Sievert, E; Weiss, C; Edler, L; Bartsch. P, y Drogue, W: Effect of glutathione depletion and oral N-acetyl-cysteine treatment on CD4+ and CD8+ cells. FASEB J, 8: 448-451, 1994.
33. Kramer, M: Pyrazolones: Hematologic side-effect and the toxicology. Adv Inflam Res, 6: 275-281, 1984.
34. Lin, RY; Astiz, ME; Saxon, JC, y Rackow, EC: Altered leukocyte immunophenotypes in septic shock. Studies of HLA-DR, CD1lb, CD14 and 1L-2R expression. Chest, 104: 847-853, 1993.
35. Lüthy C; Multhaupt, M; Oetliker, O, y Perisic, M: Differential effect of acetylsalicylic acid and dipyrone on prostaglandin production in human fibroblast cultures. Br J Pharmac, 79: 849-854, 1983.
36. Marcinkiewicz, J, y Chain, BM: Differential cytokine regulation by eicosanoids in T cells primed by contact sensitisation with TNP. Cell Immunol, 149: 303-314, 1993.
37. Marcinkiewicz, J; Grabowska, A; Bereta, J, y Stelmaszynska, T: Taurine chloramine, a product of activated neutrophils, inhibits in vitro the generation of nitric oxide and other macrophage inflammatory mediators. Leukoc Biol, 58: 667-674, 1995.
38. Martesson, J, y Meister, A: Mitochondrial damage in muscle occurs after marked depletion of glutathione and is prevented by giving gluthatione monoester. Proc Natl Acad Sci USA, 86: 471-475, 1989.
39. Mehindate, K; Al Daceak, R; Rink, L; Mecheri, S; Hebert, J, y Mourad, W: Modulation of mycoplasma arthritidis-derived superantigen-induced cytokine gene expression by dexamethasone and interleukin-4. Infect Immun, 62: 4716-4721, 1994.
40. Miller, RA; Jacobson, G; Weil, G, y Simons, ER: Diminished calcium influx in lectin-stimulated T cells from old mice. J Cell Physiol, 132: 337-342, 1987.
41. Morrison, DC; Silverstein, R, y Parmely, MJ: Novel approaches to the treatment of septic shock. En: Vincent, JL (Ed): Yearbook of Intensive Care and Emergency Medicine. New York. Springer-Verlag, 1992, 91-103.
42. Multhoff, G; Boztler, C; Allenbacher, A, y Issels R: Effects of ifosfamide on immunocompetent effector cells. Cancer Immunol Immunother, 42: 251-254, 1996.
43. Napolitano, LM, y Campbell C: Polymicrobial sepsis following trauma inhibits interleukin-10 secretion and lymphocyte proliferation. J Trauma, 39: 104-111, 1995.
44. Navarro, M; Armijo, J; Larrad, L, y Lozano, R: Different effects of two anaesthetic techniques on T-helper and T-supressor/cytotoxic cells. Eur Surg Res, 18: 35, 1986.
45. Navarro, M: El paciente quirúrgico desde el punto de vista inmunológico. En: Navarro, M (Ed): Aspectos inmunológicos de la cirugía. Zaragoza. Prensas Universitarias, 1997, 21-50.
46. Negoro, S, y Hara, H: The effect of taurine on the age-related decline of the immune response in mice: The restorative effect on the T cell proliferative response to costimulation with ionomycin and phorbol myristate acetate. Adv Exp Med Biol, 315: 229-239, 1992.
47. O''Sullivan, ST; Lederer, JA; Horgan, AF; Chin, DH; Mannick, JA, y Rodrick, ML: Major injury leads to predominance of the T helper-2 lymphocyte phenotype and diminished interleukin-12 production associated with decreased resistance to infection. Ann Surg, 222: 482-492, 1995.
48. Pajares, MA; Álvarez, L; Gil, B; Martínez, ML; Mingorance, J; Sánchez, E; Deigner, P; Ávila, M, y Mato, JM: Regulation and structure of rat liver S-adenosylmethionine synthetase, a target enzyme for studies in liver injury. En: Mato, JM, y Caballero, A (Eds): III Workshop on Methionine Metabolism; Molecular Mechanism and Clinical Implications. Madrid. CSIC, 1996, 2-10.
49. Ramos, C; Arazo, P, y Aguirre, JM: Epidemiología, fisiopatología y valoración pronóstica de la sepsis, el shock séptico y el fracaso multiorgánico. En: Actualización diagnóstico-terapéutica en las enfermedades infecciosas (III). Zaragoza. Colegio Oficial de Médicos, 1995, 7-18.
50. Richardson, RP; Rhyne, CD; Fong, Y; Hesse, DG; Tracey, KJ, y Marano MA: Peripheral blood leucocyte kinetics following in vivo lipopolisaccharide (LPS) administration to normal human subjects. Ann Surg, 210: 239-245, 1989.
51. Romero, D; Villalba, MP, y Bueno, J: Papel de la prooxidación y la antioxidación en la etiología de la hipertensión arterial. Med Clin, 97: 542-551, 1991.
52. Rosman, C; Westerveld, GJ; Van Oeveren, W; Kooi, K, y Bleichrodt, RP: Effect of intraperitoneal antimicrobials on the concentration of bacteria, endotoxin, and tumor necrosis factor in abdominal fluid and plasma in rats. Eur Surg Res, 28: 351-360, 1996.
53. Salinas, JC; Cabezalí, R; Larrad, L; Navarro, M; Gil, I; Sousa, R, y Lozano, R: The influence of blood transfusion plus sepsis on cytokine pattern in rats. Br J Surg, 82 (suppl 1): 75, 1995.
54. Seatter, SC; Bennet, T; Li, MH; Bubrick, MP, y West, MA: Macrophage endotoxin tolerance. Arch Surg, 129: 1263-1270, 1994.
55. Sottile, A; Venza, I; Venza, M; Valenti, A, y Teti, D: PGE2 induced immunoregulation mediated by cytokine production from cultures of human peripheral T lymphocytes. Immunopharmacol Immunotoxicol 18: 27-36, 1996.
56. Stramentinoli, G: Adametionine; the development of a drug. En: Mato, JM, y Caballero, A (Eds): III Workshop on Methionine Metabolism, Molecular Mechanism and Clinical Implications. Madrid. CSIC, 1996, 121-131.
57. Toft, P; Hokland, M; Hansen, TG, y Tonnesen, E.: Changes in lymphocyte subpopulations and adhesion/activation molecules following endotoxemia and major surgery. APMIS, 103: 261-266, 1995.
58. Tsuboi, I; Tanaka, H; Nakao, M; Shichijo, S, y Itoh, K: Nonsteroidal antiinflammatory drugs differentially regulate cytokine production in human up-regulation of TNF, IFN and IL-2, in contrast to downregulation of IL-6 production. Cytokine, 7: 372-379, 1995.
59. Van der Poll, T, y Lowry, SE: Tumor necrosis factor in sepsis: Mediator of multiple organ failure or essential part of host defense? Shock, 3: 1, 1995.
60. Van der Poll, T; Marchant, A, y Buurman, WA: Endogenous IL-10 protects mice from death during septic peritonitis. J Immunol, 155: 5397-5401, 1995.
61. Van Snick, J: Interleukin-6: An overview. Ann Rev Immunol, 8: 253-278, 1990.
62. Vane, J, y Botting, J: Overview, mechanisms of action of anti-inflammatory drugs. En: Vane, J; Botting, J, y Botting, R (Eds): Linproved Non-steroid Antiinflammatory Drugs. London. Kluwer AcacVemic Publishers, 1996, 1-28.
63. Vara, E; Arias-Díaz, J; García, C; Villa, N; Rodríguez, JM; Ortiz, P, y Balibrea, JL: Protective action of S-adenosyl-methionine against the toxic effects of cytokines on rat hepatocytes. En: Mato, JM, y Caballero, A, (Eds): Methionine Metabolism; Molecular Mechanisms. Madrid. CSIC, 1994: 227-232.
64. Viña, JR; Pallardó, FV; García, C; Triguero, A; Martín, JA; Boix, J; Pellín, A; Viña, J, y Sastre, J.: Metabolic implications of cystathionase activity in mammals. En: Mato, JM, y Caballero, A (Eds): III Workshop on Methionine Metabolism; Molecular Mechanism and Clinical Implications. Madrid. CSIC, 1996, 111-120.
65. Wells, CL; Maddans, MA, y Simmons, RL: Role of the macrophage in the translocation of intestinal bacteria. Arch Surg, 122: 48-53, 1987.
66. Wood, JJ; Grbic, JT; Rodrick, ML; Jordan, A, y Mannick, JA: Supression of interleukin-2 production in an animal model of thermal injury is related to prostaglandin synthesis. Arch Surg, 122: 179-184, 1987.
67. Zhong, WW; Burke, PA; Hand, AT; Walsh, MJ; Hughes, LA, y Forse, RA. Regulation of cytoquine MRNA expression on lipopolysaccharide-stimulated human macrophages. Arch Surg, 128: 158-164, 1993.