Introducción
Tanto en Traumatología como en Cirugía ortopédica y cardiovascular, la infección cobra una gran importancia por su frecuencia de aparición y la gravedad de sus consecuencias.7,19,34 Una infección del biomaterial implantado conlleva un aumento de la morbilidad, coste económico y mortalidad e impide la osteosíntesis.7,17 Las tasas de infección en este campo no han disminuido significativamente en las últimas décadas, a pesar del uso de diferentes pautas de profilaxis antibióticas, y de las variaciones en la técnica quirúrgica, en los quirófanos y en las formas de fijación de los implantes.19,34
Los microorganismos más frecuentes en cirugía son Staphylococcus aureus y Staphylococcus epidermidis.19 La capacidad que poseen ambas especies para producir «slime», componente que constituye la matriz de los «biofilms» bacterianos que se adhieren a la superficie de los implantes y protege a las bacterias de la acción de los antibióticos y de los macrófagos, pueden generar una infección difícil de erradicar de la zona infectada y tejidos adyacentes.10,15,18,23
Durante años se ha buscado un modelo experimental que simule la osteomielitis humana que se ha reproducido con éxito en conejos2,21-24,30 y en ratas.32 mediante inoculación sistémica de suspensiones bacterianas o de la bacteria en el implante. Además, se considera de interés el desarrollo de un modelo experimental con cepas formadoras de biofilm que reproduzca los problemas derivados de la colonización del implante y el difícil acceso de los antibióticos. La producción de slime, además de aumentar la adherencia bacteriana al implante,15,20 puede hacer poco fiable el cálculo de la concentración mínima inhibitoria realizada en tests in vitro con bacterias en suspensión27 del antibiótico para el tratamiento de la infección.19 Los modelos de biofilms realizados exclusivamente in vitro pueden proporcionar una información incompleta, no siempre extrapolable a la situación in vivo, teniendo en cuenta que en esta situación los cambios producidos en la zona infectada, tanto para la bacteria como para el huésped, pueden afectar al tamaño y la densidad bacteriana y matricial de los biofilms, conducir a una restricción nutricional en el lugar de la infección6 o alterar la actividad inmunológica frente a las bacterias.16,31 Desafortunadamente, los anticuerpos que pueden formarse frente a las bacterias SP no son capaces de eliminar las bacterias adheridas8 y son numerosos los factores propios del paciente que influyen en el desarrollo de la infección quirúrgica, déficits inmunológicos, diabetes, desnutrición, obesidad, infecciones concomitantes, etc.19,28 Finalmente, cobran asimismo gran importancia las características del microorganismo infectante.
Por todo ello, consideramos necesario desarrollar un modelo experimental in vivo de osteomielitis asociada a implante metálico producida por S. aureus SP, como modelo más cercano a la realidad clínica. El objetivo de este trabajo es evaluar distintos modelos animales para reproducir osteomielitis crónica, y determinar cuál de ellos muestra una mayor fiabilidad en conseguir dicha infección usando una cepa de S. aureus productora de slime.
Material y Método
Como microorganismos para producir la infección bacteriana se utilizó la variante SP, cepa 9213, de S. aureus con gran capacidad adherente, obtenida a partir de la cepa original NSP, de morfología lisa y brillante en agar rojo Congo (ARC), mediante el procedimiento descrito previamente.4 La cepa adherente fue seleccionada a partir de un crecimiento en caldo de tripticasa soja (TSB, Difco, Detroit), suplementada con el 2% de glucosa y con 4 mg/ml de micro-bolitas de gelatina de 150-210 mm de diámetro (Microcarrier Beads, Sigma, St. Louis) que sirvieron de superficie favorecedora de la adherencia. Tras sucesivos pases en este medio (renovando el medio cada 12 h) y conservando las bolitas con las bacterias adheridas, se observó que dichas bacterias formaban colonias con una morfología rugosa en ARC, correspondiente a las variantes SP. Para verificar que la cepa recuperada de los implantes y tibias en el modelo animal al final del experimento, era la misma que se introdujo en el animal en el día de la intervención, se llevó a cabo su identificación genética mediante ribotipia y PFGE.
Preparación de la suspensión bacteriana, desarrollo de biofilms sobre los implantes y cuantificación bacteriana en ellos. Para la inoculación de las suspensiones bacterianas en el momento de la infección, las bacterias se obtuvieron tras un crecimiento de 24 h en TSB, y fueron resuspendidas en PBS a 105, 106 y 107 ufc/ml, según el modelo animal utilizado. Cada rata recibió 0,1 ml de suspensión; es decir, aproximadamente 104, 105 o 106 ufc, respectivamente.
El material implantado en el animal consistió en agujas de acero de 18G (Abbocat®) seccionadas en piezas de 1,5 cm. Todas las piezas a implantar estériles en autoclave y se conservaron en tubos precintados, a 4 °C, hasta el momento de la operación en condiciones estériles. Los implantes sobre los que se desarrollaron biofilms, una vez esterilizados en autoclave, se introdujeron en tubos que contenían 2 ml de un cultivo bacteriano estacionario (de 24 h), incubándose a 37 °C durante 12 h. Los implantes quedaron así colonizados por un biofilm bacteriano y se recuperaron con pinzas en condiciones de esterilidad; tras 3 lavados con PBS para descartar las bacterias que quedaban libres, también se almacenaron a 4 °C hasta el momento de la intervención quirúrgica. Previamente a la implantación, se estimó el número de bacterias que formaban el biofilm en piezas control. Para el recuento en la serie control, los implantes ya lavados, se resuspendieron en 2 ml de PBS. Tras 30 min de sonicación a 40 Hz y 22-24 °C, para desintegrar los agregados formados en el biofilm y desprender las bacterias adheridas de las cánulas, se realizó el recuento en placas de TSA y por el método de ATP-bioluminiscencia.1 Ambos métodos condujeron a resultados similares. Cada implante contenía una media de 6,15 ± 0,12 log10 ufc en el momento de la intervención.
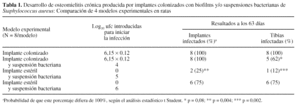
Animales. Se utilizaron 32 ratas macho, raza Wistar, con una media de peso de 375 g, en 4 grupos distintos (tabla 1):
-- Grupo con implante colonizado. Recibió solamente el implante colonizado con un biofilm bacteriano de 12 h en el momento de la operación.
-- Grupo con implante colonizado y una suspensión bacteriana de 104 ufc.
-- Grupo con implante estéril y una suspensión bacteriana de 105 ufc.
-- Grupo con implante estéril y una suspensión bacteriana de 106 ufc.
Los implantes, colonizados o estériles, se implantaron en la tibia y, en los modelos correspondientes, también se inoculó una suspensión bacteriana, cuya concentración variaba según el grupo. Se permitió el desarrollo de una infección crónica (63 días). Los animales fueron examinados individual y diariamente a lo largo del período experimental (fiebre y signos de inflamación o dolor).
Antes de sacrificar los animales se anestesiaron con una inyección intramuscular de 50% Ketamina (Ketolar®), 40% diazepan (Valium®) y 10% atropina5 extrayendo la sangre por punción cardíaca. El sacrificio se efectuó con una inyección intracardíaca de cloruro potásico. Una vez muerto el animal se recogieron muestras de tejidos para la cuantificación bacteriana.
Procedimiento quirúrgico. Los animales fueron anestesiados como se ha descrito previamente. Después de afeitar y desinfectar la piel de la zona quirúrgica circundante a la rótula, se realizó una incisión, atravesando longitudinalmente el ligamento rotuliano desde la fascia articular (con la ayuda de un bisturí). Se fresó la tibia con una aguja de 16G (1,2 ´40) desde el área proximal hasta la distal, se introdujo el implante metálico (colonizado o estéril) en la cavidad resultante, y se procedió a la inoculación de la suspensión bacteriana correspondiente. La sutura se realizó con grapas y la piel se desinfectó con polividona yodada.
Detección de la infección y tratamiento de muestras. La cronicidad se confirmó al final de la experiencia por rayos-x y análisis bacteriológico e histológico (en secciones de tejidos de 4 µm de grosor, usando la tinción Gram). Para los estudios histológicos, antes de la tinción, las muestras se pegaron y decalcificaron en EDTA-PVP (durante 26 días); después de lavar para eliminar la solución decalcificadora, las muestras se deshidrataron consecutivamente en alcohol a distintas concentraciones (70-80-96-100-100%), xilol y se incluyeron en parafina.
Para el análisis bacteriológico realizado al final del período experimental (9 semanas tras la infección), se extrajeron las tibias que contenían los implantes, las tibias contralaterales como control para determinar si la infección llegaba por vía sistémica a esta pata, hígado, bazo y sangre (en EDTA). Los implantes recuperados se introdujeron en tubos con 2 ml de PBS estéril.
Las bacterias presentes se cuantificaron por recuento en placa y ATP-bioluminiscencia1 tras una sonicación de 30 min a 40 Hz y 22-24 °C (en un baño sonicador; P-Selecta, Barcelona). La cuantificación bacteriana en la sangre y vísceras, diluidas en 10 ml de PBS y homogeneizadas con un Stomacher®, se realizó por recuento en placa tras las diluciones pertinentes en PBS estéril.
Análisis estadístico. Se aplicó un análisis estadístico t de Student para comparar los porcentajes de infección alcanzados en cada modelo animal, considerando independientemente el lugar de infección (tibia e implante) al final del período experimental.
Resultados
Al final del período experimental, no se detectó septicemia en ninguno de los modelos experimentales, puesto que el hígado, el bazo, la sangre y la tibia no intervenida resultaron estériles en todos los animales. Las bacterias recuperadas de hueso e implantes fueron en todos los casos S. aureus y tenían el mismo ribotipo y morfología colonial (SP) que la cepa inoculada, descartándose la presencia de bacterias contaminantes.
El desarrollo de infección en cada modelo experimental difería al estudiar el porcentaje de animales en los que se lograba infectar la tibia, así como en los que el implante permanecía infectado. Sólo el modelo de implante colonizado, en ausencia de suspensión bacteriana, fue capaz de alcanzar un 100% de infección en el implante y en el hueso. El modelo que incorporaba la inoculación de 104 bacterias en suspensión además de implante con el biofilm, consiguió un 100% de infecciones de los implantes, pero solamente se infectaron 5 de las 8 tibias intervenidas. Sin embargo, en los 2 modelos en los que el implante introducido era estéril, se infectaron, 6 de los 8 animales (implante y tibia) cuando la suspensión fue de 106 bacterias mientras que con una suspensión de 105 ufc, se infectaron sólo 2 implantes y 1 tibia.
Discusión
El análisis comparativo de los modelos de osteomielitis experimental utilizados muestran una capacidad distinta para infectar en el hueso y en el implante. Un implante colonizado ha sido la única manera capaz de provocar la infección en un 100% de las tibias y los implantes. La utilización de implantes colonizados con estafilococos tienen mayor probabilidad de reproducir la infección en modelos experimentales.
Algunos de los componentes (plaquetas, moléculas del huésped y restos celulares) presentes en los biofilms formados solamente in vivo pueden haber sido menos abundantes en los biofilms cuyo desarrollo ha sido iniciado in vitro. Sin embargo, éstos tienen la ventaja de ofrecer una homogeneidad en los biofilms formados que posteriormente servirán de diana para los antibióticos en los tratamientos postquirúrgicos. Gracias a esta homogeneidad, es posible establecer comparaciones entre distintos antibióticos. Por el contrario, los modelos basados en el uso de suspensiones bacterianas sólo pueden dar lugar a la formación de biofilms irregulares o afectando a diferentes zonas de infección, lo cual dificulta el establecimiento de comparaciones. Por otra parte, consideramos más apropiado el empleo de especies murinas (rata en este caso) como animales de experimentación, ya que en éstas el sistema inmunológico se asemeja al del ser humano.14,25,28
La presencia del implante en la clínica eleva sustancialmente las tasas de infección.17,18,23 Dentro de los modelos experimentales desarrollados, en el de implante asociado a una suspensión bacteriana como fuente de infección, se han empleado catéteres de silicona intramedulares en la tibia del conejo24 y tallos metálicos,2,22,32,36 pero como se ha verificado en este estudio, ninguno de ellos garantiza la infección persistente. Por otro lado, los implantes precolonizados se han empleado de manera aislada en el peritoneo,35 o bien en modelos de cirugía ortopédica asociados a una suspensión bacteriana.3,16 Sin embargo, estos últimos dificultan el análisis diferencial del efecto atribuible al biofilm formado sobre el implante debido a la suspensión bacteriana inoculada. Concretamente, los modelos que emplean la vía sanguínea,11,22 opción con menor porcentaje de logro de osteomielitis y mayor mortalidad, serían comparables en la práctica a las infecciones producidas por la aparición de focos infecciosos en distintos puntos del organismo; mientras que aquéllos que utilizan implante precolonizado, se aproximarían a la situación clínica de material contaminado por defecto de esterilización o contaminación intraoperatoria. El modelo desarrollado con mayor éxito en este trabajo, implica el uso de implantes precolonizados en ausencia de suspensión bacteriana en el momento de la intervención; este modelo ha demostrado ser efectivo para la producción de biofilms sobre los implantes (100% de implantes infectados al final del período experimental) y para la reproducción de la infección crónica (100% de tibias infectadas), por lo que puede considerarse un modelo fiable para el estudio de este tipo de infección.
Llama la atención que el modelo que incorpora la inoculación de suspensión bacteriana además del implante con el biofilm, sólo consiguiera la infección en el 62% de las tibias intervenidas. Probablemente se deba a la mayor capacidad de una suspensión bacteriana diluida (104 ufc) para estimular la respuesta inmunológica del organismo. La discrepancia de estos resultados con los obtenidos en un trabajo anterior en el que se utilizaba una estrategia mixta equivalente y se lograba un 100% de infección,16 puede deberse a la mayor concentración de bacterias encontrada en el biofilm al inicio de la infección (del orden de 108 ufc), como resultado de que su formación se realizó en TSB suplementado con glucosa, en lugar de TSB sin suplemento. La eficacia de la utilización de suspensión bacteriana únicamente (106 ufc) se halla en este estudio disminuida respecto a la publicación de Gracia y cols.16 probablemente porque se utilizó un menor número de animales.
Hay autores que defienden el empleo de un agente esclerosante como elemento determinante para conseguir una osteomielitis9,22,23,29,33 que no se ha mostrado necesario en nuestro modelo. Algunos ensayos in vitro e in vivo (cobayas) de sensibilidad a antibióticos que implican la utilización de bacterias adheridas a las superficies, emplean superficies cubiertas con fibronectina, favoreciendo la adhesión bacteriana a través de los receptores (fibronectin-binding protein) de S. aureus.12-13 La estrategia aplicada en este estudio para elegir la cepa bacteriana se basa en la utilización de una variante de S. aureus SP altamente adherente, y resistente a la fagocitosis, lo que favorece la cronicidad.15,20,26 La adhesión al implante se debe a una interacción entre el biomaterial y la cepa. Las cepas SP demuestran una mayor capacidad para mantenerse adheridas, según König y cols.20 a la hidrofobicidad. En nuestro estudio, se ha observado que la población bacteriana SP adherida al implante, permanece 2 meses después de la intervención coincidiendo con lo observado en otros estudios.5
Un modelo experimental válido debe lograr reproducir la infección en la mayor proporción posible de animales con la menor tasa de mortalidad. El modelo elegido, un implante colonizado, cumple ambos requisitos siendo una herramienta útil para el estudio de las osteomielitis generadas por S. aureus asociadas a la formación de biofilms en implantes y para la valoración de la eficacia de distintos tratamientos.