analizar el resultado clínico de los implantes meniscales de colágeno (CMI) combinados con roturas del ligamento cruzado anterior (LCA).
Pacientes y métodose realizó el seguimiento de 37 varones y 1 mujer, con edades entre 22 y 50 años, a los que se implantó artroscópicamente un CMI en el compartimento medial de la rodilla asociado a plastia de ligamento cruzado anterior, semitendinoso y recto interno en 35 casos y con aloinjerto en 3. De los pacientes, 10 presentaban una lesión del menisco lateral en la misma rodilla. El intervalo de tiempo entre la lesión del LCA y la cirugía varió entre 3 semanas y 6 meses. Se evaluó a todos los paciente con la escala IKDC, radiografías en carga y resonancia magnética. La evolución fue entre 24 y 84 meses.
Resultadosel IKDC, en 19 de los pacientes fue normal (A), en 14 casi normal (B), en 4 anormal (C) y en uno severamente anormal (D). El rango de movilidad fue normal en 26 pacientes y cercano al normal en 12. El KT-1000 fue normal en 30 pacientes, casi normal en 5, anormal en 1 y severamente anormal en 2. El estudio radiográfico en carga fue normal en 24 pacientes, casi normal en 7 y anormal en 7. Como complicaciones encontramos 8 implantes reabsorbidos a los 6 meses; 7 disestesias en territorio del nervio safeno, una rotura de plastia, una pérdida del CMI y 2 rigideces que precisaron movilización bajo anestesia.
Conclusionesel CMI es una alternativa funcional en pacientes jóvenes con lesiones meniscales graves que asocian roturas del LCA, pero requiere futuros estudios y desarrollos técnicos antes de ser generalizada.
To analyze the clinical results of collagen meniscal implants (CMIs) combined with tears of the anterior cruciate ligament (ACL).
Materials and methods37 males and 1 female were followed up, with ages ranging between 22 and 50, who were subjected to an arthroscopic implantation of a CMI in the medial compartment of the knee associated with the repair of the anterior cruciate ligament and the semitendinosus and gracilis tendons in 35 cases; in 3 cases an allograft was used. Ten of the patients presented with an injury in the lateral meniscus of the same knee. Time elapsed between injury to the ACL and surgery ranged between three weeks and six months. All patients were evaluated on the IKDC scale, as well as weight-bearing X-rays and NMRi. Follow-up was between 24 and 84 months.
ResultsThe IKDC score was normal in 19 patients (A), almost normal in 14 (B), abnormal in 4 (C) and severely abnormal in one (D). Range of motion was normal in 26 patients and near-to-normal in 12. KT-1000 was normal in 30 patients, near-to-normal in 5, abnormal in 1 and severely abnormal in 2. The weight-bearing X-ray study was normal in 24 patients, near-to-normal in 7 and abnormal in 7. As regards complications, 8 implants had reabsorbed at 6 months; there were 7 dysesthesias in the area of the saphenous nerve, one failed repair, one loss of a CMI and two instances of stiffness that required mobilization under anesthesia.
ConclusionsCMI is a functional alternative for young patients with severe meniscal lesions who also have an ACL tear. However, further study is necessary before it can be considered a generalized technique.
Los meniscos de la articulación de la rodilla son difíciles de sustituir por la función que desarrollan al ser elementos estabilizadores y absorbentes de las solicitaciones, con una función propioceptiva. Su alteración o pérdida puede llevar a la degeneración articular aunque no es fácil de valorar. Sin embargo, la meniscectomía altera la mecánica articular y conduce a la degeneración del cartílago articular que disminuye un 20–25% su módulo de elasticidad al reducir la concentración de glucosaminoglucanos que facilita la rotura de la red de fibras de colágeno1–4.
Es difícil conseguir sustitutos meniscales, pues la congruencia meniscal con las superficies articulares se consigue con el desarrollo embrionario y el crecimiento, y la morfología del menisco no es sencilla de imitar, ya que los fibrocartílagos presentan mayor radio de curvatura en sus extremos1,2.
En su aspecto biomecánico, el menisco humano se caracteriza por tener una gran capacidad de tensión-relajación, ya que queda aprisionado entre las superficies femoral y tibial, según la posición articular, sin presionar el cartílago5. Con la flexoextensión, los meniscos se adaptan a los diferentes radios de curvatura de las superficies articulares, tanto en el plano sagital como el coronal6.
Tratando de encontrar otra vía para la solución de una lesión meniscal compleja y extensa en un individuo activo, se han empleado sustitutos meniscales sintéticos, como Teflón®, Dacron® o fibras de carbono7–9, hasta que Steadman y su grupo10–15 desarrollaron y comercializaron un sustituto meniscal de colágeno tipo I (collagen meniscal scaffold, CMI), con un grosor de 8mm y una longitud de 7,5cm, procedente del tendón de Aquiles de bovino joven, al que añadieron ácido hialurónico y condroitinsulfato.
La indicación principal para un sustituto meniscal es en pacientes con una rodilla con amplia meniscectomía y dolor del compartimento femorotibial interno, estable o susceptible de ser estabilizada, mediante reconstrucción previa o simultánea del ligamento cruzado anterior, y con una buena alineación femorotibial. De existir una mala alineación deberá corregirse previamente o simultáneamente mediante osteotomía. Por último, hay que señalar que una sustitución meniscal no debe realizarse en rodillas con el cartílago articular degenerado (artritis reumatoide o lesiones condrales de grado III o IV de Outerbridge). Algunos autores fijan el tope de edad de los candidatos entre los 40 y los 50 años.
En pacientes jóvenes meniscectomizados con una rotura de ligamento cruzado anterior (LCA), los implantes meniscales de colágeno (CMI) pueden estar indicados para conseguir una actividad cotidiana y laboral normales y prevenir la degeneración del cartílago articular.
El objetivo de nuestro estudio fue analizar el resultado clínico de los implantes meniscales de colágeno combinados con roturas del LCA.
Material y métodoSe registró un total de 38 pacientes, 37 varones y 1 mujer, entre 2001 y 2005, con edades comprendidas entre 20 y 50 años (fig. 1), sin predominio de lado (20 derechas y 18 izquierdas). En 6 casos fueron lesiones meniscales agudas irreparables. El tiempo medio desde la aparición de la sintomatología hasta la intervención fue de 11 semanas (fig. 2). Los pacientes incluidos en nuestra serie fueron jóvenes con una lesión meniscal interna crónica irreparable o una meniscectomía previa dolorosa, con rotura o rerrotura del LCA, sin signos graves de artrosis. El seguimiento de los pacientes fue un un mínimo de 2 meses y un máximo de 6 años.
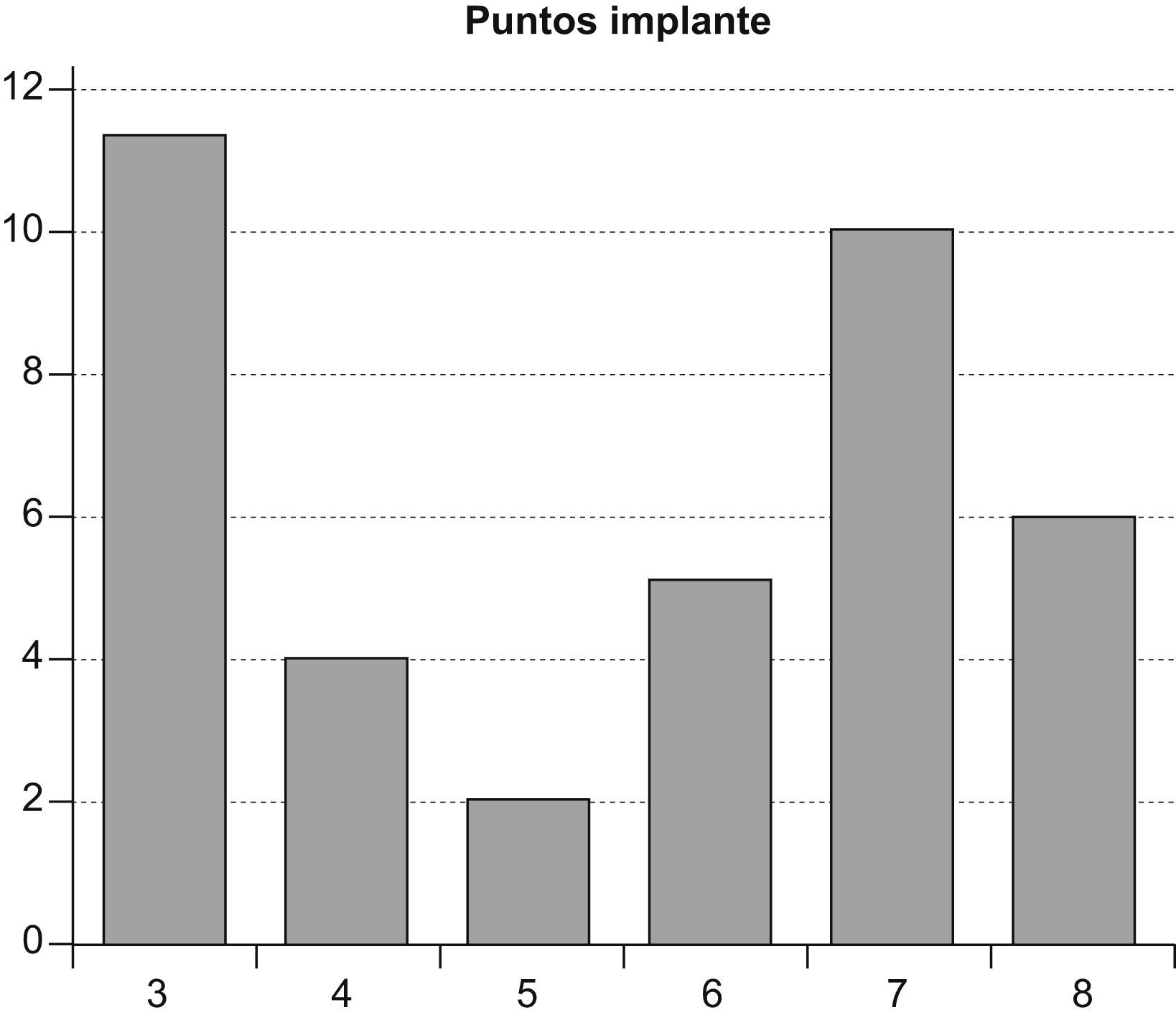
En todos los casos, excepto en 3, se asoció una plastia de LCA de semitendinoso-recto interno (ST-RI). Los 3 casos fueron rerroturas del LCA que fueron intervenidos con una plastia de injerto liofilizado. En 10 casos se relacionaban con meniscectomía parcial del menisco externo (6, derecho; 4, izquierdo). Las plastias de ST-RI se fijaron en 5 ocasiones con grapas (Richards) y en las 33 restantes con un sistema Rigid-Fix®. La longitud del implante fue entre 3 y 6,5cm (fig. 3) y el número de puntos aplicado entre 3 y 8 (fig. 4).
Técnica quirúrgicaEl paciente se colocó en decúbito supino, con isquemia en el muslo correspondiente. Las vías de abordaje fueron pararrotuliana medial y lateral. Después de preparar la plastia de ST-RI, se efectuó la meniscectomía respetando el muro meniscal y los anclajes del menisco en su porción anterior y posterior. Se midió el tamaño de la resección y se adaptó el implante, dejándolo en suero fisiológico para su hidratación.
Tras refrescar el muro meniscal se procedió a medir el tamaño de la lesión y se introdujo el implante. Luego efectuamos un abordaje retroligamentario interno, para permitir la salida de la aguja para realizar la sutura de la zona posterior del implante, con un protector para no dañar las estructuras anatómicas posteriores. No se disecaron las estructuras anatómicas y se mantuvo el separador pegado al hueso para separar las partes blandas.
Inicialmente se suturó el CMI al muro meniscal con suturas dentro-fuera mediante el sistema ReGen y en 3 pacientes con el sistema Fastfeed® (Stryker). Una vez suturado el CMI se realizó la ligamentoplastia ST con monotúnel, anclados proximalmente con Rigidfix® (Mitek) y distalmente con grapa o tornillo interferencial con hidroxiapatita (Milagro®, Mitek).
En el postoperatorio se colocó una férula de yeso en extensión durante 2 semanas, después se comenzó la fisioterapia, con una ortesis para las actividades diarias durante otras 6 semanas. Se permitió la carga parcial a partir de la sexta semana y total en la octava semana.
Para valorar los resultados seguimos el protocolo IKDC y un estudio de imagen a los 6 y los 12 meses. Se solicitó resonancia magnética (RM) antes de la intervención, a los 6 meses y al año de la cirugía.
ResultadosEn las tablas 1 y 2 se presentan los datos de la evolución de los pacientes. El índice de satisfacción en la mayoría de los pacientes fue alto. La extensión fue completa y la flexión mayor de 135° en todos los casos.
Datos de los pacientes intervenidos
| A | B | C | D | E | F | G | H | I | J | K | L | M | N | Ñ | O | P | Q | R | S | T | |
| 1 | 3 | 25 | 1 | 1 | 2 | 16 | 0 | 0 | 1 | 1 | 5 | 4 | 17 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 0 |
| 2 | 2 | 28 | 2 | 1 | 1 | 250 | 0 | 0 | 1 | 1 | 5 | 8 | 16 | 0 | 0 | 0 | 0 | 0 | 4 | 0 | 0 |
| 3 | 4 | 35 | 2 | 1 | 1 | 12 | 0 | 0 | 1 | 2 | 3,5 | 3 | 20 | 0 | 0 | 0 | 0 | 0 | 5 | 1 | – |
| 4 | 3 | 29 | 1 | 1 | 2 | 3 | 0 | 0 | 1 | 1 | 3 | 3 | 21 | 0 | 0 | 0 | 0 | 0 | 7 | 0 | 0 |
| 5 | 3 | 37 | 2 | 1 | 1 | 16 | 0 | 0 | 1 | 1 | 4 | 5 | 14 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 0 |
| 6 | 3 | 28 | 2 | 1 | 1 | 8 | 1 | 0 | 1 | 1 | 5 | 7 | 14 | 1 | 0 | 0 | 1 | 1 | 6 | 0 | 0 |
| 7 | 3 | 25 | 2 | 1 | 1 | 6 | 0 | 0 | 1 | 1 | 3 | 7 | 16 | 0 | 0 | 0 | 0 | 0 | 6 | 1 | – |
| 8 | 2 | 30 | 1 | 1 | 2 | 8 | 0 | 1 | 1 | 1 | 4 | 3 | 23 | 0 | 0 | 0 | 0 | 0 | 8 | 0 | 0 |
| 9 | 2 | 20 | 2 | 1 | 2 | 100 | 0 | 0 | 1 | 1 | 6,5 | 8 | 2 | 0 | 0 | 0 | 0 | 1 | 5 | 0 | 0 |
| 10 | 2 | 21 | 3 | 1 | 2 | 20 | 0 | 0 | 1 | 1 | 4 | 6 | 18 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 0 |
| 11 | 2 | 24 | 2 | 1 | 1 | 6 | 0 | 0 | 0 | 1 | 6,5 | 8 | 18 | 1 | 1 | 1 | 1 | 1 | 6 | 0 | – |
| 12 | 2 | 27 | 2 | 1 | 1 | 6 | 0 | 0 | 1 | 1 | 4 | 7 | 15 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 0 |
| 13 | 2 | 27 | 2 | 1 | 1 | 12 | 0 | 0 | 1 | 1 | 4 | 7 | 18 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 0 |
| 14 | 3 | 24 | 2 | 1 | 1 | 12 | 0 | 0 | 1 | 1 | 4,5 | 7 | 16 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 0 |
| 15 | 3 | 29 | 2 | 1 | 2 | 8 | 0 | 0 | 1 | 1 | 5,5 | 7 | 20 | 0 | 0 | 0 | 0 | 0 | 4 | 0 | 0 |
| 16 | 4 | 26 | 1 | 1 | 1 | 24 | 0 | 0 | 1 | 1 | 4 | 3 | 21 | 0 | 0 | 0 | 0 | 0 | 9 | 0 | 0 |
| 17 | 3 | 27 | 2 | 1 | 1 | 200 | 0 | 1 | 1 | 1 | 5 | 6 | 18 | 1 | 1 | 1 | 2 | 1 | IPT | 1 | – |
| 18 | 4 | 26 | 1 | 1 | 1 | 24 | 0 | 0 | 1 | 1 | 4 | 3 | 21 | 0 | 0 | 0 | 0 | 0 | 9 | 0 | 0 |
| 19 | 4 | 29 | 2 | 1 | 2 | 20 | 1 | 0 | 1 | 2 | 3 | 4 | 15 | 0 | 0 | 0 | 0 | 0 | 5 | 0 | 0 |
| 20 | 4 | 32 | 3 | 1 | 2 | 8 | 0 | 0 | 0 | 2 | 4 | 4 | 21 | 1 | 1 | 1 | 2 | 1 | IPT | 0 | 0 |
| 21 | 3 | 30 | 1 | 1 | 2 | 12 | 0 | 0 | 1 | 1 | 3 | 3 | 21 | 0 | 0 | 0 | 0 | 0 | 7 | 1 | – |
| 22 | 4 | 50 | 2 | 1 | 2 | 20 | 0 | 1 | 0 | 2 | 3 | 5 | 21 | 0 | 1 | 1 | 1 | 1 | 6 | 1 | – |
| 23 | 3 | 39 | 2 | 1 | 1 | 10 | 0 | 0 | 0 | 1 | 5 | 8 | 18 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 0 |
| 24 | 3 | 27 | 2 | 1 | 1 | 6 | 0 | 0 | 1 | 1 | 3 | 3 | 21 | 1 | 0 | 0 | 1 | 0 | 12 | 0 | 0 |
| 25 | 4 | 33 | 2 | 1 | 1 | 20 | 1 | 0 | 1 | 2 | 3,5 | 4 | 21 | 0 | 0 | 0 | 0 | 0 | 5 | 0 | 0 |
| 26 | 3 | 21 | 1 | 1 | 2 | 8 | 0 | 0 | 1 | 1 | 4 | 8 | 16 | 0 | 0 | 0 | 0 | 0 | 4 | 0 | 0 |
| 27 | 3 | 29 | 1 | 1 | 2 | 16 | 1 | 0 | 1 | 1 | 5 | 6 | 16 | 1 | 1 | 0 | 0 | 0 | 4 | 0 | 0 |
| 28 | 4 | 26 | 2 | 1 | 1 | 8 | 0 | 0 | 1 | 1 | 3 | 2 | 21 | 0 | 0 | 0 | 0 | 0 | 8 | 1 | – |
| 29 | 2 | 30 | 4 | 1 | 2 | 36 | 0 | 0 | 1 | 1 | 4 | 6 | 20 | 1 | 0 | 0 | 0 | 0 | 6 | 0 | 0 |
| 30 | 3 | 32 | 1 | 1 | 2 | 16 | 0 | 1 | 1 | 1 | 3 | 3 | 21 | 0 | 0 | 0 | 0 | 0 | 12 | 0 | 0 |
| 31 | 2 | 27 | 2 | 2 | 2 | 8 | 0 | 0 | 1 | 1 | 5 | 8 | 18 | 0 | 0 | 0 | 1 | 0 | 4 | 0 | 0 |
| 32 | 3 | 49 | 1 | 1 | 1 | 6 | 0 | 1 | 0 | 1 | 4 | 3 | 56 | 1 | 0 | 0 | 1 | 0 | 12 | 0 | 0 |
| 33 | 3 | 29 | 2 | 1 | 1 | 6 | 0 | 1 | 1 | 1 | 3 | 3 | 21 | 0 | 0 | 0 | 1 | 0 | 9 | 0 | 0 |
| 34 | 2 | 26 | 2 | 1 | 1 | 4 | 0 | 1 | 1 | 1 | 3 | 3 | 18 | 0 | 0 | 0 | 0 | 0 | 8 | 1 | – |
| 35 | 3 | 25 | 2 | 1 | 2 | 8 | 0 | 0 | 1 | 1 | 4,5 | 7 | 18 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 0 |
| 36 | 3 | 27 | 2 | 1 | 2 | 8 | 1 | 0 | 1 | 1 | 4,5 | 6 | 18 | 0 | 0 | 0 | 0 | 0 | 5 | 0 | 0 |
| 37 | 4 | 24 | 2 | 1 | 2 | 4 | 0 | 0 | 1 | 1 | 4,5 | 7 | 14 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 0 |
| 38 | 3 | 30 | 2 | 1 | 1 | 12 | 0 | 1 | 0 | 1 | 4,5 | 7 | 21 | 1 | 1 | 1 | 1 | 1 | IPP | 1 | – |
A: evolución (años); B: edad (años); C: mecanismo accidente (1=deporte; 2=torsión; 3=traumatismo directo; 4=tráfico); D: sexo (1=varón; 2=mujer); E: lado (1=derecho; 2=izquierdo); F: tiempo transcurrido hasta cirugía (semanas); G: lesión de menisco externo (0=no; 1=parcial); H: lesión condral (0=no; 1=cóndilo femoral interno); I: rehabilitación previa (1=sí; 0=no); J: anclaje plastia LCA (1=RigidFix®; 2=grapas); K: longitud del implante (cm); L: puntos implante; M: inmovilización (semanas); N: derrames (0=no; 1=sí); Ñ: fiebre (0=no; 1=sí); O: dolor gemelar (0=no; 1=sí); P: recirugía (0=no; 1=movilización bajo anestesia; 2=limpieza); Q: afectación de nervio safeno (0=no; 1=sí); R: alta (meses) (IPT=incapacidad temporal; IPP=incapacidad parcial); S: RM 6 meses (0=persiste CMI; 1=reabsorbido); T: RM 1 año (0=persiste CMI; 1=reabsorbido).
Valoración del IKDC
| Subjetivo | Movilidad | Síntomas | Estabilidad | Radiografía medial | Radiografía lateral | |
| 1 | B | A | A | A | A | A |
| 2 | B | A | A | A | A | A |
| 3 | C | B | B | A | B | B |
| 4 | A | A | A | A | A | A |
| 5 | B | A | B | A | A | A |
| 6 | A | A | A | A | A | A |
| 7 | A | B | B | B | A | A |
| 8 | A | A | B | A | C | B |
| 9 | A | A | B | A | A | A |
| 10 | A | B | B | A | A | A |
| 11 | B | A | A | A | A | A |
| 12 | B | B | A | B | B | B |
| 13 | B | A | A | A | A | A |
| 14 | B | B | B | A | A | A |
| 15 | A | B | B | B | A | A |
| 16 | B | B | C | C | C | A |
| 17 | C | A | B | D | C | A |
| 18 | B | A | A | A | A | A |
| 19 | B | A | A | A | A | A |
| 20 | C | B | B | D | C | B |
| 21 | A | A | A | A | A | A |
| 22 | A | A | A | A | A | A |
| 23 | A | A | A | A | A | A |
| 24 | A | B | A | A | A | A |
| 25 | A | B | B | A | B | B |
| 26 | B | A | A | B | A | A |
| 27 | B | A | A | A | A | A |
| 28 | A | A | A | A | A | A |
| 29 | A | B | B | A | A | A |
| 30 | A | A | A | A | C | A |
| 31 | A | A | A | A | B | B |
| 32 | A | A | A | A | C | A |
| 33 | B | A | B | A | B | A |
| 34 | C | A | B | A | B | A |
| 35 | A | A | A | A | B | B |
| 36 | B | A | B | A | A | B |
| 37 | A | A | B | A | A | A |
| 38 | D | B | D | B | C | C |
A: normal; B: casi normal; C: anormal; D: muy anormal.
De los 38 pacientes intervenidos, 35 se incorporaron a su trabajo en un tiempo medio de 5 meses (tabla 1). De los 3 pacientes no incorporados, uno requirió dos rescates y sigue su evolución, otro sigue refiriendo fuerte dolor y del tercero perdimos su seguimiento.
En la evaluación del IKDC, la mayoría de los casos estaban dentro de los intervalos de normalidad o casi normalidad (tabla 2; fig. 5). El IKDC subjetivo fue normal o casi normal en 33 pacientes, en que presentaton una movilidad normal o casi normal 38 casos.
La estabilidad, comparando el KT-1000 de ambas rodillas, fue normal o casi normal, es decir, de 3mm o menos, en 35 operados.
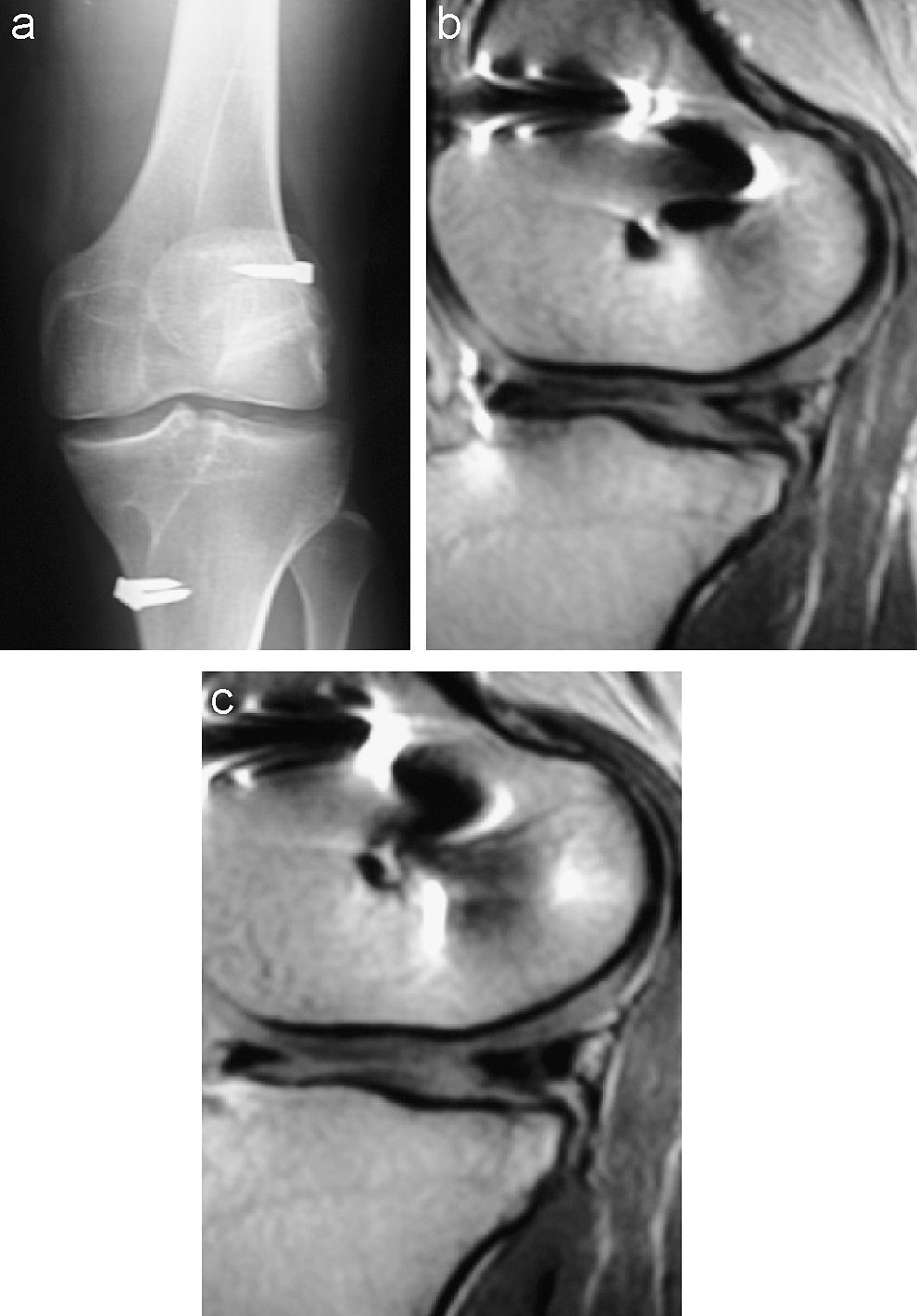
En la RM a los 6 meses de la intervención se observaron 8 reabsorciones, sin que éstas aumentaran en la revisión a los 12 meses (figs. 6–9). Las radiografías en carga, al año de la intervención, mostraron 7 casos con signos degenerativos en el compartimento medial y sólo un caso en el compartimento externo. Los demás implantes muestran un tejido seudomeniscal con una imagen parecida al menisco que ocupa el espacio articular. La mayoría de los adelgazamientos se produjeron en la interfaz entre el implante de colágeno y el menisco receptor (fig. 10).
Las complicaciones halladas fueron una rotura del CMI, una rotura de la plastia ST-RI; 7 neuropatías del nervio safeno interno con disestesias asociadas. Encontramos 7 casos de rigidez por déficit de flexión resueltos con movilización bajo anestesia, antes de los 3 meses. Efectuamos una limpieza articular por derrame con mejoría clara del paciente e indicamos 5 eco-Doppler por dolor en la pantorrilla. En 6 casos se detectó fiebre que cedió a los pocos días sin necesidad de administrar antibióticos (tabla 1).
DiscusiónEl menisco debe ser considerado una unidad funcional por lo que un sustituto meniscal será efectivo cuando permita una función adecuada y evite el deterioro articular sin producir molestias.
La evaluación de los resultados de un trasplante meniscal debe ser clínica, valorando la disminución o la desaparición del dolor, la vuelta a la actividad normal, incluida la actividad deportiva moderada, si hay o no rigidez o derrame, etc., con la imagen, radiografías simples y en carga y RM y con una segunda artroscopia exploradora al tiempo de realizado el implante. Además, se deben introducir instrumentos mecánicos que permitan valorar objetivamente la articulación.
La meniscectomía total está indicada actualmente cuando el tejido o el tipo de lesión no permiten una reparación o se requieren equipos especiales o técnicas difíciles que llevan al cirujano a decidirse por la resección parcial o total del menisco16, mientras que la meniscectomía parcial está reservada para las lesiones sintomáticas en rodillas estables, con una lesión en una zona no reparable y en individuos con una gran actividad17–19.
Los implantes meniscales buscan la regeneración del tejido meniscal, a partir de una «plantilla» o soporte15, pues es como un andamio en el que migran fibrocondrocitos que producen sustancia cartilaginosa fundamental. El soporte de colágeno se reabsorbe en perros en un 90–95% entre los 6 y los 12 meses. Stone et al11, en un estudio clínico de 10 casos realizados por artroscopia, vieron que los implantes eran estables y que no presentaban proliferación vascular ni nueva matriz condroide. El CMI puede ser adecuado pues se trata de un material biocompatible, biorreabsorbible, que soporta el crecimiento de nuevo tejido en su interior10–15. En las cuatro biopsias estudiadas, a los 6 meses del implante, Reguzzoni et al20 demuestran el reconocimiento tridimensional de la estructura del CMI observando su relleno por células no inflamatorias y vasos que terminan construyendo un modelo semejante al menisco. El nuevo tejido meniscal que se regenera es funcionalmente aceptable sin presentar efectos adversos. Por su parte, Steadman et al10 demostraron en tres biopsias la formación de fibrocartílago.
La función protectora del menisco está en relación directa con su capacidad de transmitir y distribuir la carga. Sólo un menisco con unos amarres anteriores y posteriores intactos es capaz de asumir las solicitaciones de carga que generan la actividad de la rodilla21. Un menisco, implante o aloinjerto, con anclajes laxos o insuficientes crea cambios articulares por su movilidad y por la incapacidad para la correcta transmisión de cargas, que lesionan el cartílago y aumentan la cantidad de proteoglucanos en el líquido sinovial, similar a las alteraciones que se pueden encontrar después de meniscectomía o de sección radial del menisco6. En la mayoría de nuestra casuística se han dado siempre entre 3 y 8 puntos de anclaje.
Los resultados publicados en la literatura con el CMI señalan, en general, buenos resultados, si bien se deben matizar pues no son infrecuentes los problemas. Steadman et al10 revisaron 8 casos con una evolución de 5 y 6 años; en todos los casos observaron una mejoría de la valoración de Lysholm, también la valoración subjetiva del paciente mejoró y la escala de dolor; en la RM encontraron que el cartílago articular no presenta alteraciones. Sin embargo, en nuestra revisión hemos encontrado problemas que deben ser tenidos en cuenta, como las neuritis y disistesias, la rigidez articular, el dolor en la pantorrilla y los derrames o la fiebre sin causa conocida.
La combinación de una plastia de LCA combinada con un CMI debe aportar mayor estabilidad mecánica a la articulación de la rodilla que la regulación meniscal o su resección. Una rodilla estable permite una mejor incorporación de la plastia ligamentosa. Sin embargo, hacen faltan estudios que demuestren y avalen esta hipótesis.
Mientras que Zaffagnini et al22 en otros 8 casos, con una evolución de 6 a 8 años, señalan que todos los pacientes volvieron a su trabajo a los 3 meses de la cirugía. Nosotros preferimos alargar el tiempo de incorporación entre 4 y 6 meses. Al efectuar las nuevas revisiones, 2 casos presentaron peores resultados que a los 2 años de la cirugía, y en 4 casos mostraban un dolor soportable. Con la imagen vieron que 6 casos presentaban un espacio articular preservado, sin cambios, pero lo que resulta más llamativo son las imágenes de la RM donde 5 casos presentaron una degeneración mixoide; 2, una señal normal pero con el tamaño reducido y en un caso se había reabsorbido el implante. En nuestra experiencia, hemos tenido 8 reabsorciones del implante a los 6 meses. Este 25% de reabsorciones no ha variado en los controles efectuados a los 12 meses, lo que nos hace sospechar que la causa puede ser el rechazo del material o un defecto de técnica al dejar demasiada laxitud o demasiada rigidez en el anclaje del menisco. Tal vez sea mayor que otras estadísticas22 al combinar siempre una plastia de LCA.
En nuestro estudio hemos encontrado un elevado número de afectación de la sensibilidad en el territorio inervado por el nervio safeno interno debido al abordaje posterointerno efectuado, que se ha evitado en las últimas cirugías con la sutura dentro-dentro. Las disestesias pueden haber sido provocadas por atrapamiento del punto de sutura meniscal o por sección de ramos al intentar ser muy económicos con la incisión de abordaje retroligamentario interno. Hay que señalar que la neuropatía del nervio safeno ha sido un hallazgo clínico que la mayoría de los pacientes no la apreciaron hasta la exploración clínica de la zona.
También hemos registrado casos frecuentes de fiebre posquirúrgica que pensamos debida a la reacción inmunitaria al implante, sin encontrar una relación con el resultado obtenido ni con la reabsorción del implante. No se han descrito transmisión de enfermedades de contagio o infecciosas con el CMI ni hemos tenido que retirar ninguno de los implantes por rechazo orgánico.
Sin embargo, los resultados clínicos y funcionales obtenidos, a pesar del elevado número de reabsorciones, son en una gran mayoría satisfactorios. Tal vez sean mejores al combinar la plastia de LCA y no diferenciar los resultados debidos a la estabilidad ligamentosa de la meniscal. No cerramos la puerta a mejorar la estructura del implante acudiendo a técnicas de ingeniería tisular que, como Martinek et al23, obtienen mejores resultados experimentalmente ya que aportan fibrocondrocitos autólogos.
La colocación de un sustituto meniscal requiere un equipo entrenado y coordinado, pues constituye una cirugía contrarreloj para preparar el lecho meniscal y adaptar el sustituto. Además, no es fácil calcular la longitud exacta de la lesión y evitar el desplazamiento del implante sin olvidar que el acceso al compartimento interno con un LCA roto es complejo, pues el platillo está subluxado y el compartimento medial, cerrado. En conclusión, puede ser una solución funcional adecuada que presenta inconvenientes y problemas que requieren futuros estudios y desarrollos técnicos antes de ser generalizada.
Declaración de conflicto de interesesLos autores han declarado no tener ningún conflicto de intereses.