Expresión inmunohistoquímica de glicoproteína P como factor pronóstico en sarcomas óseos
Immunohistochemical expression of glycoprotein P as a prognostic factor in bone sarcomas
HERNÁNDEZ CORTÉS, P.*; ANEIROS CACHAZA, J.**; RAMÍREZ TORTOSA, C.**; NOGALES, F.*; O''VALLE RAVASA, F.**; ANDÚJAR SÁNCHEZ, M.**; ACOSTA GONZÁLEZ, F.*, y GARCÍA DEL MORAL, R.**
* Departamento de Anatomía Patológica.
** Servicio de Cirugía Ortopédica y Traumatología.
Hospital Clínico Universitario San Cecilio. Granada.
Correspondencia:
Dr. P. HERNÁNDEZ CORTÉS.
Avda. de Andalucía, 9, 2.° D.
18014 Granada.
Recibido: Febrero de 1999.
Aceptado: Septiembre de 1999.
RESUMEN: Se presenta un estudio inmunohistoquímico de expresión de glicoproteína P en 44 tumores óseos malignos (32 osteosarcomas y 12 condrosarcomas) con el propósito de analizar la inmunorreactividad por estirpe histológico y su valor pronóstico potencial. El principio del procedimiento es la determinación de la molécula de glicoproteína P mediante un método inmunohistoquímico que emplea un cóctel de anticuerpos monoclonales específicos (JSB1 y MRK16) prediluidos y el procedimiento estándar de la fosfatasa-antifosfatasa alcalina, con incubación doble de anticuerpo secundario y ese complejo. Las muestras de tejido fueron obtenidas antes de la quimioterapia. La inmunoexpresión se clasificó en seis grados según una escala semicuantitativa de positividad celular. Hay que destacar la expresión intensa y constante de glicoproteína P en la membrana celular de los condrosarcomas (positividad del 100% y puntuación semicuantitativa de 3,83 ± 1,03). En los osteosarcomas la tinción fue menos constante (positividad del 59,37% y puntuación semicuantitativa de 2,79 ± 1,81). Los pacientes con osteosarcomas localizados de alto grado (IIB) y que expresaban glicoproteína P tenían una menor supervivencia (log rank; p < 0,05) e intervalo libre de enfermedad (log rank; p < 0,001). Los hallazgos sustentan a la expresión de glicoproteína P como factor pronóstico en el osteosarcoma.
PALABRAS CLAVE: Osteosarcoma. Condrosarcoma. Neoplasias óseas. Glicoproteína P. Resistencia a drogas. Inmunohistoquímica.
ABSTRACT: An immunohistochemical study was made of glycoprotein P expression in 44 malignant bone tumors (32 osteosarcomas and 12 chondrosarcomas) to analyze immunoreactivity by histological line and determine its prognostic value. The principle of the procedure was the determination of glycoprotein P molecule with an immunohistochemical method using a combination of prediluted specific monoclonal antibodies (JSB1 and MRK16) and the standard alkaline phosphatase-antiphosphatase procedure with double incubation of the secondary antibody and this complex. Tissue samples were obtained before chemotherapy. Immune expression was classified into six grades on a semiquantitative scale of cellular positivity. The intense and constant expression of glycoprotein P on chondrosarcoma cell membranes (100% positivity and semiquantitative score of 3.83 ± 1.03) was noteworthy. Staining was less constant in osteosarcomas (59.37% positivity and semiquantitative score of 2.79 ± 1.81). Patients with localized high-grade (IIB) osteosarcoma who expressed glycoprotein P had a lower survival rate (log rank; p < 0.05) and disease-free interval (log rank; p < 0.001). Findings support glycoprotein P expression as a prognostic factor in osteosarcoma.
KEY WORDS: Osteosarcoma. Chondrosarcoma. Bone neoplasms. Glycoprotein P. Drug resistance. Immunohistochemistry.
En la actualidad la respuesta histológica a la quimioterapia se considera el factor pronóstico más importante en el osteosarcoma convencional sin enfermedad metastásica.1,8,11,22,33 Sin embargo, no se ha identificado ningún parámetro capaz de predecirla antes del tratamiento.2
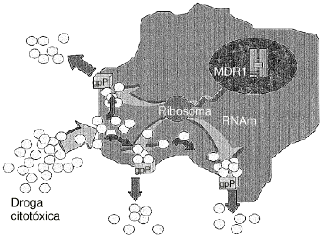
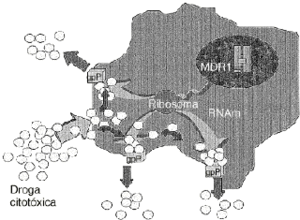
Uno de los principales problemas de la quimioterapia del cáncer es la multirresistencia a fármacos o fenotipo MDR.4,15,40 La sobreexpresión de glicoproteína P, codificada por el gen MDR1, se establece como un factor principal en la adquisición de esta multirresistencia en un amplio espectro de tipos celulares tumorales. Su mecanismo de acción está vinculado a un incremento del flujo de fármacos hacia el exterior celular, disminuyendo su acumulación en el citoplasma y de esta forma también la cantidad efectiva que reacciona con las dianas celulares15,16 (Fig. 1).
Figura 1. Mecanismo de acción de la glicoproteína P (gpP). Es una proteína codificada por el gen humano de multirresistencia a drogas (MDR1) y actúa como una bomba de membrana ATP-dependiente que expulsa fuera de la célula una gran cantidad de drogas citotóxicas, con diferente estructura química y con las que no siempre ha tenido contacto previo.
La sobreexpresión de glicoproteína P en diferentes cánceres se ha relacionado con malas respuestas a la quimioterapia e intervalos libres de enfermedad reducidos.51
Existe una expresión variable de la glicoproteína P en hueso y cartílago,25 así como en líneas celulares de osteosarcoma.6,26 Al igual que en otros tumores, la expresión en las células del sarcoma osteogénico se incrementa cuando se exponen a agentes quimioterápicos.28,34,35,46,53
Desde el trabajo de Baldini y cols. en 19953 varios grupos de investigación han pretendido establecer la expresión de glicoproteína P como un factor pronóstico en el osteosarcoma.41,42
En esta línea se presenta un estudio inmunohistoquímico de una serie de 44 tumores óseos malignos con el fin de analizar la expresión de glicoproteína P en osteosarcomas y condrosarcomas no tratados y su valor pronóstico potencial.
Material y Método
Se incluyen 44 pacientes afectos de neoplasias malignas primitivas de hueso de origen mesenquimal (32 osteosarcomas y 12 condrosarcomas) seleccionados de entre los 63 casos tratados en el Hospital Clínico San Cecilio de Granada entre los años 1978 y 1993. El diagnóstico histológico fue confirmado de manera independiente por dos patólogos con experiencia en patología ósea. Los 19 casos no considerados fueron eliminados de la serie final por desacuerdo en el diagnóstico histológico inicial (tres casos), seguimiento inferior a 36 meses sin muerte documentada (cuatro casos), ausencia de material histológico adecuado para análisis inmunohistoquímico (tres casos) y severas variaciones del protocolo terapéutico (nueve casos).
Los 44 pacientes fueron sometidos a algún tipo de resección quirúrgica. El margen, según los criterios de Enneking,12 fue intralesional en un caso (condrosarcoma), marginal en 13, amplio en 22 y radical en ocho pacientes. La quimioterapia (esquemas T4 y T7 de Rosen) fue utilizada como tratamiento adyuvante después del control local del tumor primario en 30 pacientes con osteosarcoma (no se trataron dos osteosarcomas yuxtacorticales). Sólo los cuatro condrosarcomas IIB recibieron quimioterapia en el postoperatorio.
La Tabla 1 resume las características clínicas de la serie, incluyendo el estadio clínico12 y radiológico.23
Tabla 1. | |||
| Osteosarcoma | Condrosarcoma | ||
| Localización: | |||
| -- Fémur | 16 | 2 | |
| -- Tibia | 12 | -- | |
| -- Húmero | 1 | 3 | |
| -- Pelvis | 1 | 6 | |
| -- Otros | 2 | 1 | |
| Estadio Lodwick: | |||
| -- Ia | -- | -- | |
| -- Ib | -- | -- | |
| -- Ic | 1 | 4 | |
| -- II | 12 | 6 | |
| -- III | 19 | 2 | |
| Estadio Enneking: | |||
| -- IA | 1 | 3 | |
| -- IB | 3 | 4 | |
| -- IIA | -- | -- | |
| -- IIB | 23 | 4 | |
| -- III | 5 | 1 | |
| Atipia Broders: | |||
| -- I | 1 | 6 | |
| -- II | 2 | 4 | |
| -- III | 20 | 2 | |
| -- IV | 9 | -- | |
| Subtipo histológico: | |||
| -- OS. OB | 10 | -- CS. CN | 9 |
| -- OS. CB | 6 | -- CS. SUP | 3 |
| -- OS. FB | 4 | ||
| -- OS. TG | 5 | ||
| -- HFM-L | 3 | ||
| -- PARA | 2 | ||
| -- PERI | 2 | ||
| Estadios Ennekig: grado clínico.12 Estadios Lodwick: estadio radiológico.23 OS. OB: osteosarcoma osteoblástico. OS. CB: osteosarcoma condroblástico. OS. FB: osteosarcoma fibroblástico. OS. TG: osteosarcoma teleangiectásico. HFM-L: osteosarcoma tipo histiocitoma fibroso maligno like. OS. PARA: osteosarcoma paraostal. OS. PERI: osteosarcoma periostal. CS. CN: condrosarcoma central. CS. SUP: condrosarcoma de superficie. | |||
El seguimiento mínimo fue de 36 meses y el medio de 86 (mínimo: 36 y máximo: 216 meses). Diecisiete pacientes con osteosarcoma (53,1%) y cuatro con condrosarcoma (33,3%) padecieron metástasis pulmonares en algún momento de su evolución. Quince enfermos con osteosarcoma (46,9%) y cinco con condrosarcoma (41,7%) fallecieron a consecuencia del tumor.
El material seleccionado para estudio histopatológico fue obtenido antes de la aplicación de la quimioterapia. Todas las muestras de tejido óseo fueron sometidas a descalcificación en solución de formalina-ácido nítrico a 25° C y lavado en solución de sulfato sódico al 5% e inclusión en parafina. Sobre secciones histológicas teñidas con hematoxilina y eosina se confirmó el diagnóstico histopatológico y se determinó la atipicidad y parámetros histológicos básicos (Tabla 1).
El procedimiento inmunohistoquímico para la determinación de la molécula de glicoproteína P consistió en la aplicación de un preparado, que contenía un cóctel de anticuerpos antiglicoproteína P prediluidos (JSB1, MRK16), sobre secciones histológicas en portaobjetos tratados con poli-L-lisina. Se realizó un desenmascaramiento antigénico por incubación en horno microondas (10 minutos). La técnica se basaba en el procedimiento estándar de la fosfatasa-antifosfatasa alcalina (FAAFA), con incubación doble de anticuerpo secundario y complejo FAAFA (Máster Diagnóstica. Granada, España).
Para cada muestra se realizó un control isotipo negativo, control positivo de calidad de tinción sobre secciones histológicas de suprarrenal humana y control de expresión antigénica del material, en base a la intensidad de tinción de vimentina (clona V9; dilución 1:50, Máster Diagnóstica).
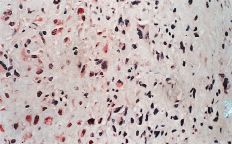
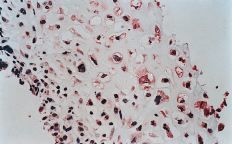
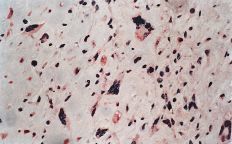
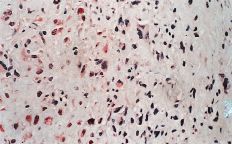
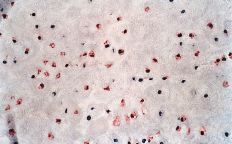
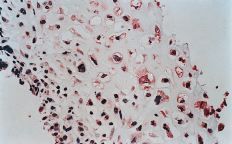
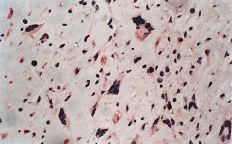
La evaluación fue llevada a cabo por dos patólogos independientes que desconocían la evolución clínica de los pacientes. La expresión de glicoproteína P se aceptó como positiva cuando era evidente una tinción con patrón de membrana y de coloración rojiza. Se realizó una valoración semicuantitativa según una escala de seis grados: 1, tinción negativa; 2, tinción positiva en menos del 10% de las células; 3, tinción positiva en 10-25% de las céluas; 4, tinción positiva entre el 25-50% de las células; 5, tinción positiva entre el 50-75% de las células, y 6, tinción en más del 75% de las células. El grado fue establecido en base a la puntuación del área más positiva de la sección histológica (Figs. 2A y B).
ABFigura 2. A: Expresión de glicoproteína P en osteosarcoma. Técnica de la fosfatasa-antifosfatasa alcalina (FAAFA). Positividad celular semicuanti-tativa de 3 (10-25% de las células) (HE, 200*). B: Expresión de glicoproteína P en condrosarcoma. Técnica de la fosfatasa-antifosfatasa alcalina (FAAFA). Positividad celular semicuantitativa de 6 (más del 75% de las células) (HE, 200*). C: Patrón de tinción en el condrosarcoma. Tinción constante de membrana. La presencia de agregados citoplasmáticos es anecdótica (HE, 200*). D: Patrón de tinción en el osteosarcoma. La tinción es menos específica de membrana. Podemos observar una coloración roja difusa en el citoplasma (HE, 200*).
Se llevó a cabo un estudio estadístico de la supervivencia e intervalo libre de enfermedad mediante los pruebas de Kaplan Maier y Log Rank. Las variables paramétricas se estudiaron por el test de análisis de la varianza. Las variables no paramétricas y semicuantitativas por los test de Mann Whitney y Kruskall Wallis. La comparación de medias se realizó según las pruebas de «t» de Student y *2. En general se asumió como máximo error el 5% (p < 0,05).
Resultados
La inmunotinción para la glicoproteína P fue diferente en los condrosarcomas con respecto a los osteosarcomas (Tabla 2). En los primeros es destacable la constancia de la positividad de tinción en la membrana celular y presencia ocasional de agregados citoplásmicos, en particular en las células con más clara diferenciación condroblástica (Fig. 2C).
C| Tabla 2. Expresión de glicoproteína P por grupos histológicos. | ||||
| Glicoproteína P | Osteosarcoma | Condrosarcoma | Test | Significación |
| Porcentaje de casos po sitivos | 59,37% | 100% | *2 | p < 0,01 |
| Puntuación semicuantitativa de positividad celular (media ± DS) | 2,79 ± 1,81 | 3,83 ± 1,03 | KW | p < 0,05 |
| Ver Material y Método en el texto para la escala de puntuación semicuantitativa. KW: test de Kruskal-Wallis. DS: desviación estándar. | ||||
En los osteosarcomas, por el contrario, la tinción no fue tan predominantemente de membrana, y ésta coexistía con una tinción citoplásmica difusa (Fig. 2D); su positividad fue más inconstante y de menor intensidad (59,4%). Estas diferencias en la expresión inmunohistoquímica fueron estadísticamente significativas como refleja la Tabla 2.
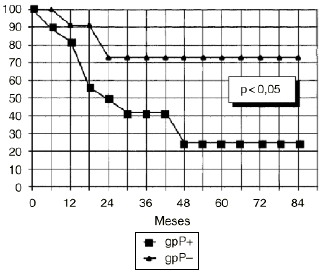
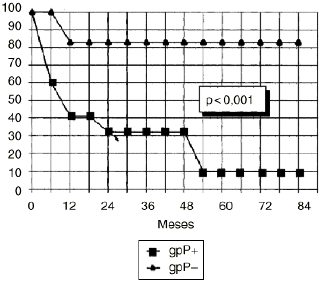
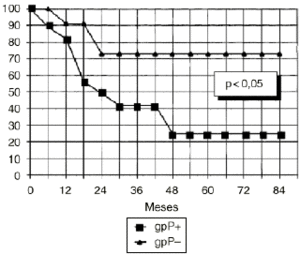
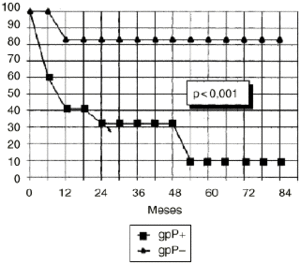
DEn el grupo de osteosarcomas localizados de alto grado (estadio IIB de Enneking) compuesto por 23 pacientes, los tumores con inmunoexpresión de glicoproteína P tuvieron una supervivencia estadísticamente inferior (Fig. 3) y un menor intervalo libre de enfermedad, también con significación estadística (Fig. 4), que los tumores que no la expresaban.
Figura 3. Curva de supervivencia en función de la expresión de glicoproteína P en osteosarcomas IIB. Análisis estadístico por el test de log rank.
Figura 4. Curva de intervalo libre de enfermedad en función de la expresión de glicoproteína P en osteosarcomas IIB. Análisis estadístico por el test de log rank.
La Tabla 3 expone las variables clínicas e histológicas con interés pronóstico en nuestra serie y el grado de significación estadística para un análisis univariante por el test de log rank.
Tabla 3. Variables clínicas e histológicas con valor pronóstico. Análisis univariante. Test de log rank. | ||
| Factor | Supervivencia | Metástasis |
| Significación | Significación | |
| Localización en tibia | p < 0,05 | p < 0,1 |
| Estadio radiológico de Lodwick | p < 0,05 | p < 0,1 |
| Estadio clínico de Enneking | p < 0,1 | p < 0,01 |
| Margen de resección | p < 0,05 | p < 0,05 |
| Esquema de quimioterapia | NS | NS |
| Osteosarcoma subtipo osteoblás tico | p < 0,001 | p < 0,001 |
| Atipicidad nuclear Broders | p < 0,1 | p < 0,05 |
| Índice mitótico *10 > 15 | p < 0,1 | p < 0,05 |
| Positividad a glicoproteína P | p < 0,05 | p < 0,001 |
| NS: no significativo. | ||
No se observó asociación entre la expresión de glicoproteína P y las variables clínicas o histológicas, a excepción de la ya comentada relación con la estirpe histológica (Tabla 4).
Tabla 4. Variables clínicas e histológicas relacionadas con la expresión de glicoproteína P en el estudio. Análisis estadistico con respecto a la positividad (*2) como variable cualitativa y con respecto a la puntuaciión semicuantitativa. | ||
| Factor | Expresión de glicoproteína P | |
| Test | Significación | |
| Estadio radiológico de Lodwick | *2 | NS |
| KW | NS | |
| Estadio químico de Enneking por tumor | *2 | NS |
| KW | NS | |
| Osteoformador o cartilaginoso | *2 | p < 0,01 |
| KW | p < 0,05 | |
| Subtipos de osteosarcoma | *2 | NS |
| KW | NS | |
| Atipicidad nuclear de Broders | *2 | NS |
| KW | NS | |
| KW: test de Kruskall-Wallis. NS: no significativo. | ||
Discusión
La presencia de inmunotinción para glicoproteína P no se correlaciona cuantitativamente con el nivel de expresión del gen mdr-1 como ocurre cuando se emplea la técnica de la reacción en cadena de la polimerasa con transcripción inversa (RT-PCR).20 Sin embargo, la determinación inmunohistoquímica es el procedimiento más empleado en los trabajos publicados al respecto. Esta técnica presenta unas ventajas evidentes, aunque no es superior a la RT-PCR. La detección de una pequeña subpoblación celular que exprese glicoproteína es clínicamente relevante a efectos de quimiorresistencia, independientemente de su valoración cuantitativa. Las técnicas inmunohistoquímicas, además, permiten diferenciar en una muestra dada la expresión del marcador por células tumorales de la que pudiera exhibir el tejido conectivo.45
Los resultados que se publican en la detección de glicoproteína P en tumores humanos son extraordinariamente variables. Ello se debe a diferencias en los procedimientos de preparación de la muestra, fijación y análisis final. Por ello un grupo de especialistas5 han propuesto una serie de normas de consenso para la determinación de glicoproteína. Entre las normas se incluye la utilización de dos o más anticuerpos primarios, práctica de controles de tinción y tejido, asesoramiento de la expresión antigénica de la muestra y valoración de la intensidad de tinción y porcentaje de células positivas. Todas ellas han sido seguidas en este estudio.
La tasa de positividad para glicoproteína P en los osteosarcomas de la presente serie (59,4%) se encuentra en la línea de los artículos revisados. Bodey y cols.6 publican un 83% de positividad en muestras de osteosarcoma en parafina y una expresión particularmente intensa en el 39% de la serie. No refieren si los tumores habían sido previamente tratados con quimioterapia, ni estudia su relación con la supervivencia. Serra y cols.42 describen una positividad del 23% en sus tumores primitivos y del 50% en los sarcomas osteogénicos metastásicos. Baldini y cols.3 refieren una positividad del 30%. Posl y cols.35 publican una positividad del 66,6% en los tumores no tratados y del 80,3% en los osteosarcomas que habían sido sometidos a quimioterapia.
Quizá el porcentaje de este trabajo contrasta con las positividades más bajas de Baldini y cols.,3 hecho que se puede explicar porque estos autores utilizaron el método de avidin-biotin-peroxidasa, menos sensible que el que nosotros utilizamos, fosfatasa alcalina antifosfatasa alcalina con doble incubación.
La tinción citoplásmica que se observó en el osteosarcoma no es específica; ya se mencionó en el apartado de material y métodos que la glicoproteína P es una proteína de membrana, y ésta debe ser la localización de la tinción. No obstante, el hecho puede explicarse por el empleo del anticuerpo JSB-1, que tiene una reacción cruzada con la enzima mitocondrial piruvato-carboxilasa,38 que sí estaría en el citoplasma.
Todos los condrosarcomas de la serie han expresado glicoproteína P. El hallazgo tiene un particular interés por la posible relación con la quimiorresistencia que habitualmente exhibe este tumor14,31 y las dificultades terapéuticas que de ello se derivan.
Hasta finales de 1997 no se había descrito la expresión en tumores de estirpe cartilaginosa, y en la actualidad sólo hay constancia del trabajo de Rosier y cols.39 y Terek y cols. en 1998.48 Ambas series tienen una composición heterogénea, pues agrupan diferentes estirpes tumorales, benignas y malignas, y una inmunoexpresión inconstante.
Probablemente la glicoproteína P sea parte del inmunofenotipo normal del hueso, cartílago y células del osteosarcoma y no sea preceptivo el contacto con agentes quimioterápicos para su expresión,35,36 pues aunque no se discute que se incremente con la exposición a drogas26,28,36 nuestro porcentaje de positividad lo ha sido sobre muestras tumorales no tratadas.
Un dato a favor de que la glicoproteína P se deba considerar como un parámetro de diferenciación tumoral y no un mero marcador de quimiosensibilidad es el hecho de su máxima expresión en las áreas celulares de más clara diferenciación condroblástica (dato descriptivo, sin que exista una asociación estadísticamente significativa con la variante condroblástica del osteosarcoma). Los trabajos de Radig y cols.37 y Oda y cols.30 así lo confirman. Scotlandi y cols.41 relacionan la expresión de glicoproteína P con osteosarcomas de fenotipo menos maligno, tanto a nivel experimental en un modelo de osteosarcoma xenotrasplantado como en la revisión de su serie clínica en la que los sarcomas osteogénicos glicoproteín positivos se presentaban más localizados y tenían un intervalo libre de enfermedad más largo.
En nuestra serie es destacable la relación de la inmunoexpresión de glicoproteína P en el pronóstico de estos tumores. En la misma tendencia que lo publicado por Serra y cols.,42,43 los sarcomas de alto grado (IIB) que expresan glicoproteína P tienen una supervivencia más corta y una mayor incidencia y precocidad de las metástasis con significación estadística. Estos datos son superponibles también a los que Baldini y cols.3 publican a finales del 1995.
A pesar de no aportar un análisis multivariante por el reducido tamaño de la muestra, somos de la opinión de que la expresión de glicoproteína P es un factor pronóstico independiente, pues no se relaciona con ninguna variable clínica o histológica influyente en la supervivencia (Tablas 3 y 4).
¿Está relacionado el mal pronóstico que parece conllevar la inmunoexpresión de glicoproteína P con el fracaso a la quimioterapia en los sarcomas de hueso? En esta serie no se analiza la relación entre la expresión inmunohistoquímica de glicoproteína P y la adecuación a la respuesta a la quimioterapia preoperatoria, pero en cualquier caso la expresión de glicoproteína parece ser un factor de mal pronóstico digno de tener en cuenta.
Ocho de los nueve pacientes que expresaban el gen mdr-1 en la serie de Imanishi y cols.19 fueron resistentes a la quimioterapia. Serra y cols.42 encuentran una relación estadísticamente significativa entre la expresión de glicoproteína y la multirresistencia a agentes quimioterápicos en el osteosarcoma. En su serie, los tumores que expresan glicoproteína P tenían un mayor índice de metástasis y un peor pronóstico. Por el contrario, para Posl y cols.35,36 este carácter inmunohistoquímico no guarda relación con el fracaso de tratamientos quimioterápicos en el osteosarcoma osteogénico y no predice la respuesta a la quimioterapia. Hay tumores glicoproteín positivos con necrosis del 100% postquimioterapia y malas respuestas al tratamiento entre los glicoproteín negativos.36,37,44 Vergier y cols.52 también señalan la expresión variable de glicoproteína P en sarcomas humanos, pero no lo considera el mecanismo principal de su resistencia a las drogas.
Si se acepta el hecho de la relación entre la inmunoexpresión de la glicoproteína P en los sarcomas de alto grado y una peor supervivencia y mayor desarrollo de metástasis a distancia3,9,17,42,46,51 se derivan importantes implicaciones terapéuticas.
Existen un gran número de sustancias capaces de revertir el fenotipo de multirresistencia a drogas (MDR) in vitro por un mecanismo de inhibición competitiva.21,27
Se han realizado ensayos clínicos con antagonistas del calcio,13,29,32 ciclosporina y análogos18,49,50 y otras sustancias como el tamoxifeno,7,13 progesterona, cefoperazona, flufenacina, quinina y otros27,46,47 para revertir el estado de multirresistencia a drogas.
Es cierto que para asegurar el bloqueo de la glicopreoteína P in vivo se requieren altas dosis de estas sustancias moduladoras, hasta niveles cercanos o incluso superiores a las dosis máximas tolerables, con el riesgo de una toxicidad inaceptable.32 Sin embargo, estudios en fase I/II, en los que se combinó quimioterapia convencional con agentes moduladores del MDR, obtuvieron sensibles beneficios en pacientes con leucemias, mielomas o sarcomas de partes blandas refractarios al tratamiento.24
Como conclusión, y de acuerdo con Stein y cols.,45 se puede establecer que la expresión de glicoproteína se va a consolidar como un factor pronóstico importante en los tumores óseos malignos, lo cual podría justificar, por una parte, su determinación sistemática y, por otra, la introducción de moduladores MDR como tratamiento suplementario en los sarcomas óseos de alto grado.
Bibliografía
1. Bacci, G; Picci, P; Ferrari, S; Ruggieri, P; Casadei, R; Tienghi, A; Brach del Prever, A; Gherlinzoni, F; Mercuri, M, y Monti, C: Primary chemotherapy and delayed surgery for nonmetastatic osteosarcoma of the extremities. Cancer, 72: 3227-3238, 1993.
2. Bacci, G; Picci, P; Pignatti, G; De Cristofaro, R; Dallari, D; Avella, M; Maufrini, M; Marangolo, M; Ferruzi, A; Mercuri, M; Ruggieri, M; Bragini, R; Capanna, R; Ferrari, S; Prasad, R, y Campanacci, M: Neoadjuvant chemotherapy for non-metastatic osteosarcoma of the extremities: The experience at the Rizzoli Institute. Clin Orthop, 270: 87-98, 1991.
3. Baldini, N; Scotlandi, K; Barbanti-Brodano, G; Manara, MC; Maurici, D; Bacci, G; Bertoni, F; Picci, P; Sotilli, S; Campanacci, M, y Serra, M: Expression of P-glycoprotein in high grade osteosarcomas in relation to clinical outcome. N Engl J Med, 333: 1380-1385, 1995.
4. Benard, J; Bourhis, J, y Riou, G: Clinical significance of multiple drug resistance in human cancers. Anticancer Res, 10: 1297-1302, 1990.
5. Beck, WT; Grogan, TM; Wilman, CL; Cordon-Cardo, C; Parham, DM; Kuttesch, JF; Andreeff, M; Bates, SE; Berard, CW; Boyett, JM; Brophy, NA; Broxterman, HJ; Chan, HSL; Dalton, WS; Dietel, M; Fojo, AT; Gascoyne, RD; Head, D; Houghton, PJ; Srivastava, DK; Lehnert, M; Leith, CP; Paietta, E; Pavelick, ZP; Rimsza, L; Roninson, IB; Sikie, BI; Twentyman, PR; Warnke, R, y Weinstein, R: Methods to detect P-glycoprotein-associated multidrug resistance in patients'' tumor: Consensus recomendation. Cancer Res, 56: 3010-3020, 1996.
6. Bodey, B; Taylor, CR; Siegel, SE, y Kaiser, HE: Immunocytochemical observation of multidrug-resistance (MDR) P170 glycoprotein expression in human osteosarcoma cells. The clinical-significance of MDR protein overexpression. Anticancer Res, 15: 2461-2468, 1995.
7. Callaghan, R, y Higgins, CF: Interaction of tamoxifen with the multidrug resistance P-glycoprotein. Br J Cancer, 71: 294-299, 1995.
8. Campanacci, M; Bertoni, F; Picci, P; Minutillo, A, y Franceschi, C: The treatment of osteosarcoma of the extremities: Twenty years experience at the Istituto Ortopedico Rizzoli. Cancer, 48: 1569-1581, 1981.
9. Chan, HS; Grogan, TM; Haddad, G; De Boer, G, y Ling, V: P-glycoprotein expression: Critical determinant in the response to osteosarcoma chemotherapy. J Natl Cancer Inst, 89 (22): 1706-1715, 1997.
10. Davis, AM; Bell, RS, y Goodwin, PJ: Prognostic factors in osteosarcoma. A critical review. J Clin Oncol, 12: 423-431, 1994.
11. Eckardt, JJ: Newest knowledge of osteosarcoma. Clin Orthop, 270: 2-3, 1991.
12. Enneking, WF: A system of staging musculoeskeletal neoplasms. Clin Orthop, 204: 9-24, 1986.
13. Figueredo, A; Arnold, A; Goodyear, M; Findlay, B; Neville, A; Normandeau, R, y Jones, A: Addition of verapamil and tamoxifen to the initial chemotherapy of small cell lung cancer. Cancer, 65: 1895-1902, 1990.
14. Forscher, C; Williamson, D; Blum, RH, y Holland, JF: Adult oncology. En: Lewis M (Eds): Musculoeskeletal Oncology. A Multidisciplinary Approach. Philadelphia. WB Saunders Company, 1992, 135-150.
15. Gottesman, MM, y Pastan, I: Resistance to multiple chemotherapeutic agents in human cancer cell. TIPS, 9: 54-58, 1988.
16. Gottesman, MM: How cancer cells evade chemotherapy: Sixteenth Richard and Hinda Rosenthal foundation award lecture. Cancer Res, 53: 747-754, 1993.
17. Grundmann, E; Roessner, A; Ueda, Y; Schneiderstock, R, y Radig, K: Current aspects of the pathology of osteosarcoma. Anticancer Res, 15: 1023-1032, 1995.
18. Herweijer, H; Sonneveld, P; Baas, F, y Nooter, K: Expression of mdr1 and mdr3 multidrug-resistance genes in human acute and chronic leukemias and association with stimulation of drug accumulation by ciclosporine. JNCI, 82: 1133-1140, 1990.
19. Imanishi, T; Abe, Y; Suto, R; Higaki, S; Ueyama, Y; Nakamura, M; Tamaoki, N; Fukuda, H, e Imai, N: Expression of the multidrug resistance gene (MDR1) and prognostic correlation in human osteogenic sarcoma. Tokai J Exp Clin Med, 19: 39-46, 1994.
20. Kandel, RA; Campbell, S; Noble-Topham, S; Bell, R, y Andrulis, IL: Correlation of P-glycoprotein detection by inmunohistochemistry with mdr-1 mRNA levels in osteosarcoma. Pilot study. Diagn Mol Pathol, 4:59-65, 1995.
21. Kunikane, H; Zalupski, MM; Ramachandran, C; Kukuruga, MA; Lucas, D; Ryan, JR, y Krishan, A: Flow cytometric analysis of P-glycoprotein expression and drug efflux in human soft tissues and bone sarcomas. Cytometry, 30: 197-203, 1997.
22. Link, MP; Goorin, AM; Horowitz, M; Meyer, WH; Belasco, J; Baker, A; Ayala, A, y Sushter, J: Adjuvant chemotherapy of high-grade osteosarcoma of the extremity: Update results of the multi-institutional osteosarcoma study. Clin Orthop, 270: 8-14, 1991.
23. Lodwick, GS; Wilson, AJ; Farrell, C; Virtama, P, y Dittrich, F: Determining growth rates of focal lesions of bone from radiographs. Radiology, 134: 577-583, 1980.
24. Lum, BL; Gosland, MP; Kaubisch, S, y Sikic, BI: Molecular targets in oncology: Implications of the multidrug resistance gene. Pharmacotherapy, 13: 88-109, 1993.
25. Mangham, DC; Cannon, A; Komiya, S; Gendron, RL; Dunussi, K; Gebhardt, MC; Mankin, HJ, y Arceci, RJ: P-glycoprotein is expressed in the mineralizing regions of the skeleton. Calcified Tissue International, 58: 186-191, 1996.
26. Maraldi, NM; Zini, N; Sabatelli, P; Valmori, A; Scotlandi, K; Serra, M, y Baldini, N: Ultrastructural features and P-glycoprotein immunolocalization in Saos-2/DX(580) multidrug-resistant human osteosarcoma Cells. J Submicr Cytol Pathol, 28: 93-100, 1996.
27. McLeod, HL: Clinical reversal of the multidrug resistance phenotype: True tumour modulation or pharmacokinetic interaction. Eur J Cancer, 30A: 2039-2041, 1994.
28. Mealey, KL; Barhoumi, R; Rogers, K, y Kochevar, DT: Doxorubicin induced expression of P-glycoprotein in a canine osteosarcoma cell line. Cancer Lett, 126: 187-192, 1998.
29. Mickisch, GH; Kössig, J; Keilhauer, G; Schlick, E; Tschada, RK, y Alken, PM: Effects of calcium antagonists in multidrug resistant primary human renal cell carcinomas. Cancer Res, 50: 3670-3674, 1990.
30. Oda, Y; Sakamoto, A; Shinohara, N; Ohga, T; Uchiumi, T; Khono, K; Tsuneyoshi, M, e Iwamoto, Y: Nuclear expression of YB-1 protein correlates with P-glycoprotein expression in human osteosarcoma. Clin Cancer Res, 4 : 2273-2277, 1998.
31. Patel, SR; Burgess, MA; Papadopuolos, NE; Linke, KA, y Benjamín, RS: Extraskeletal myxoid chondrosarcoma. Long term experience with chemotherapy. Am J Clin Oncol, 18: 161-163, 1995.
32. Philip, PA; Joel, S; Monkman, SC; Dolega-Ossowski; Tonkin, K; Carmichael, J; Idle, JR, y Harris, AL: A phase I study on the reversal of multidrug resistance (MDR) in vivo: Nifedipine plus etoposide. Br J Cance, 65: 267-270, 1992.
33. Picci, P; Sangiorgi, L; Rougraff, BT; Neff, JR; Casadei, R, y Campanacci, M: Relationship of chemotherapy-induced necrosis and surgical margins to local recurrence in osteosarcoma. J Clin Oncol, 12: 2699-2705, 1994.
34. Pinedo, HM, y Giaccone, G: P-glycoprotein a marker of cancer cell behavior. N Engl J Med, 333: 1417-1419, 1995.
35. Posl, M; Grahl, K; Amling, M; Werner, M; Ritzel, H; Stenzel, I; Hentz, M; Winkler, K, y Delling, G: P-glycoprotein expression in osteosarcomas. Pathologe, 17: 50-55, 1996.
36. Posl, M; Amling, M; Grahl, K; Hentz, M; Ritzel, H; Werner, M; Winkler, K, y Delling, G: P-glycoprotein expression in high grade central osteosarcoma and normal bone cells. An inmunohistochemical study. Gen Diagn Pathol, 142: 317-325, 1997 .
37. Radig, K; Hackel, C; Herting, J; Oda, Y; Mittler, U; Neumann, W, y Roessner, A: Expression of P-glycoprotein in high grade osteosarcoma with special emphasis on chondroblastic subtype. Gen Diagn Pathol, 142: 139-145, 1997.
38. Rao, VV; Anthony, DC, y Piwnica-Worms, D: Multidrug resistance P-glycoprotein monoclonal antibody JSB-1 crossreact with pyruvate carboxilase. J Histochem Cytochem, 43: 1187-1192, 1995.
39. Rosier, RN; O''Keefe, RJ; Teot, LA; Fox, EJ; Nester, TA; Puzas, JE; Reynolds, PR, y Hicks, DG: P-glycoprotein expression in cartilaginous tumors. J Surg Oncol, 65: 95-105, 1997.
40. Rothenberg, M, y Ling, V: Multidrug resistance: Molecular biology and clinical relevance. JNCI, 81: 907-910, 1989.
41. Scotlandi, K; Serra, M; Nicoletti, G; Vaccari, M; Manara, MC; Nini, G; Landuzzi, L; Colacci, A; Bacci, G; Bertoni, F; Picci, P; Campanacci, M, y Baldini, M: Multidrug resistance and malignancy in human osteosarcoma. Cancer Res, 56: 2434-2439, 1996.
42. Serra, M; Scotlandi, K; Manara, MC; Maurici, D; Benini, S; Sarti, M; Campanacci, M, y Baldini, N: Analysis of P-glycoprotein expression in osteosarcoma. Eur J Cancer, 31A: 1998-2002, 1995.
43. Serra, M; Maurici, D; Scotlandi, K; Barbanti-Brodano, G; Manara, MC; Benini, S; Picci, P; Bertoni, F; Bacci, G; Sottili, S, y Baldini, N. Relationship between P-glycoprotein and p53 status in high-grade osteosarcoma. Int J Oncol, 14: 301-307, 1999.
44. Shnyder, SD; Hayes, AJ; Pringle, J, y Archer, CW: P-glycoprotein and metallothionein expression and resistance to chemotherapy in osteosarcoma. Br J Cancer, 78: 757-759, 1998.
45. Stein, U; Shoemaker, RH, y Schlag, PM: MDR1 gene expression: Evaluation of its use as a molecular marker for prognosis and chemotherapy of bone and soft tissue sarcomas. Eur J Cancer, 32A : 86-92, 1996.
46. Takeshita, H; Gebhardt, MC; Springfield, DS; Kusuzaki, K, y Mankin, HJ: Experimental model for the study of drug resistance in osteosarcoma: P-glycoprotein positive, murine osteosarcoma cell lines. J Bone Joint Surg, 78A: 366-375, 1996.
47. Takeshita, H; Kusuzaki, K; Tsuji, Y; Hirata, M; Hashiguchi, S; Nakamura, S; Murata, H; Ashihara, T, y Hirisawa, Y: Avoidance of doxorubicin resistance in osteosarcoma cells using a new quinoline derivative, MS-209. Anticancer Res, 18: 739-742, 1998.
48. Terek, RM; Schwartz, GK; Devaney, K; Glantz, L; Mark, S; Healey, JH, y Albino, A: Chemotherapy and P-glycoprotein expression in chondrosarcoma. J Orthop Res, 16: 585-90, 1998.
49. Twentyman, PR; Fox, EN, y White, DJG: Cyclosporin A and its analogues as modifiers of adriamycin and vincristine resistance in a multidrug resistant human lung cancer cell line. Br J Cancer, 56: 55-57, 1987.
50. Twentyman, PR; Wright, KA, y Wallace, HM: Effects of cyclosporin A and non-immunosuppressive analogue, O-acetyl cyclosporin A, upon the growth of parent and multidrug resistant human lung cancer cells in vitro. Br J Cancer, 65: 335-30, 1992.
51. Van Kalken, CK; Pinedo, HM, y Giaccone, G: Multidrug resistance from the clinical point of view. Eur J Cancer, 27: 1481-1486, 1991.
52. Vergier, B; Cany, L; Bonnet, F; Robert, J; De Mascarel, A, y Coindre, JM: Expression of MDR1/P glycoprotein in human sarcomas. Br J Cancer, 68: 1221-1226, 1993.
53. Zini, N; Scotlandi, K; Baldini, N; Nini, G; Sabatelli, P, y Maraldi, NM: Multidrug-resistance (MDR) phenotype of human osteosarcoma cells evaluated by quantitative morphological and electron-microscopy Analyses. Biol Cell, 84: 195-204, 1995.