Las mejoras en el diagnóstico y tratamiento del cáncer han mejorado la supervivencia. Secundariamente también aumenta el número de estos pacientes que presentan una metástasis vertebral y el número con alguna morbilidad en relación con estas metástasis. Fractura vertebral, compresión radicular o lesión medular causan un deterioro de su calidad de vida. El objetivo en el tratamiento de las mismas ha de ser el control del dolor, mantenimiento función neurológica y de la estabilidad vertebral, teniendo presente que en muchos casos será un tratamiento paliativo.
El tratamiento de estas complicaciones presenta un enfoque multidisciplinario, radiólogos, radiólogos intervencionistas, oncólogos y radioterapeutas, cirujanos de raquis, pero también Unidad de Rehabilitación o Unidad de Dolor. Recientes trabajos muestran que un enfoque multidisciplinario de estos pacientes puede mejorar calidad de vida e incluso pronóstico.
En el presente trabajo se realiza una revisión y lectura de la bibliografía sobre el manejo multidisciplinario de estos pacientes.
Improvements in cancer diagnosis and treatment have improved survival. Secondarily, the number of patients who present a vertebral metastasis and the number with some morbidity in relation to these metastases also increases. Vertebral fracture, root compression or spinal cord injury cause a deterioration of their quality of life.
The objective in the treatment of the vertebral metastasis must be the control of pain, maintenance of neurological function and vertebral stability, bearing in mind that in most cases it will be a palliative treatment.
The treatment of these complications needs a multidisciplinary approach, radiologists, interventional radiologists, oncologists and radiation therapists, spine surgeons, but also rehabilitation or pain units. Recent studies show that a multidisciplinary approach of these patients can improve quality of life and even prognosis.
In the present article, a review and reading of the literature on the multidisciplinary management of these patients is carried out.
Durante los últimos años la supervivencia de los pacientes con cáncer se ha incrementado de manera dramática debido a los avances en diagnóstico y tratamiento. Secundariamente a esto estamos viviendo también un aumento en la incidencia de las metástasis1.
La metástasis vertebral es el tumor más frecuente en la columna, y la metástasis ósea más frecuente, y globalmente la tercera localización más frecuente de metástasis tras pulmón e hígado. Se estima que más de 70% de los pacientes con cáncer presentarán una metástasis vertebral y que entre 10-30% de los pacientes oncológicos requerirán un tratamiento por sus metástasis vertebrales2.
Dolor es el síntoma clínico más frecuente, pero en más de 75% de los casos pueden aparecer otros síntomas, tales como fracturas patológicas, supresión médula ósea, compresión radicular o lesión medular, esta última se presenta entre 10-20% de los pacientes con metástasis vertebrales3,4.
Todas estas complicaciones empeoran el estado general con un impacto negativo en su pronóstico y calidad de vida5.
No debemos olvidar que a día de hoy el objetivo del tratamiento de estos pacientes sigue siendo paliativo. Mantener o mejorar la calidad de vida, control del dolor, evitar o mejorar la lesión neurológica y especialmente preservar capacidad de marcha suelen ser nuestros objetivos6,7.
Actualmente el tratamiento de estas lesiones requiere de un enfoque multidisciplinario, dadas las diversas opciones de tratamiento de que disponemos. Técnicas de ablación, técnicas de aumentación, radiocirugía o estereoradioterapia, o con la mejoría de las técnicas quirúrgicas, o la combinación de varias de ellas han llevado al mejor control de estas lesiones, pero al mismo tiempo a una dificultad en la indicación de las mismas, sin existir en la literatura actual una clara recomendación o valoración de los resultados que proponen7,8, lo que ha llevado a la publicación de múltiples algoritmos de toma de decisiones en el tratamiento de estos pacientes8,9.
El objetivo de la presente revisión será examinar las diferentes estrategias de manejo en la metástasis vertebral y la evidencia sobre la necesidad de comités multidisciplinarios para la toma de decisiones en los pacientes con metástasis vertebrales.
MétodoRealizamos una búsqueda bibliográfica en PubMed, Cochrane y Embase, los términos usados fueron (spine OR spinal OR vertebral) y (metastases OR tumour OR Neoplams OR cancer) y (multidisciplinary) y (management) y/o (systematic review).
Evaluación del pacienteLos parámetros que nos han de permitir estratificar, clasificar a los pacientes y ayudarnos en la toma de decisiones son: supervivencia prevista del paciente, carga tumoral e histología, valoración radiográfica-estabilidad espinal, lesión neurológica. Esto determinará momento de la cirugía, opciones de tratamiento adyuvante, expectativas de recuperación posterior o uso medidas paliativas.
SupervivenciaDe cara a la selección de los enfermos potencialmente quirúrgicos, incluso para determinar técnica quirúrgica, la estimación de la supervivencia (SV) del paciente es un punto crítico. La estimación de la SV según parámetros clínicos se ha mostrado inexacta y poco fiable10.
Se han diseñado numerosos sistemas de puntuación para intentar calcular SV prevista de estos pacientes, en un intento de estratificar y ayudar en la toma de decisiones, pero tanto la metodología en el desarrollo de los modelos y los resultados obtenidos con los mismos no han mostrado, a lo largo del tiempo, suficiente consistencia9,10.
En una reciente revisión sistemática sobre 22 trabajos y 7.779 pacientes encontraron tras el estudio multivariable que los únicos factores asociados a mortalidad fueron etiología del tumor primario y estado general, con un nivel de evidencia alto11. En otro trabajo hasta 20% de pacientes tuvieron una SV inferior a la prevista, habiéndose sobreindicado cirugía. La ausencia de terapia adjuvante y el estado nutricional del paciente12 son otros factores asociados a una menor supervivencia.
Verlann et al.12 en un trabajo multicéntrico, con un total de 1.266 pacientes, valoraron aquellos con SV inferior a tres meses y aquellos con SV superior dos años. El mal estado general fue el factor pronóstico aislado más predictivo de SV, corta y baja carga tumoral junto con histología del primario son los factores pronósticos más robustos relacionados con SV a largo plazo.
Un factor que no valoran ninguno de los sistemas es el beneficio/riesgo potencial de los pacientes con el tratamiento, a saber, en el trabajo de Verlaan12, la mayoría de los pacientes que fallecieron antes de los tres meses fue por rápida progresión de la enfermedad (85%), esta sobreestimación puede ser dada por la poca capacidad de calibración del score o porque ningún sistema valora el impacto de la cirugía en la enfermedad (mecanismos de inmunosupresión perioperatoria, por estrés quirúrgico, hemoderivados que pueden deprimir inmunidad, etc.); así, la SV en parte se verá afectada por la agresividad quirúrgica.
Estado/carga oncológicaHistologiaLa histología de la lesión primaria nos informará del pronóstico del paciente, siendo el factor aislado más robusto predictor de la SV12,13.
EstadiajeLa presencia y la extensión de otras metástasis tienen un fuerte impacto en la toma de decisiones. Algunos de los scores valoran el número y extensión de metástasis como factor relacionado con una disminución de la SV (Tomita, Tokuhashi, etc…), sin embargo, otros trabajos no han demostrado esta relación9–13.
Valoración radiográfica. Estabilidad vertebralLas imágenes radiográficas han de ser las que nos permitan valorar la extensión de la lesión, localización, afectación de canal y evaluar inestabilidad de la lesión.
Básicamente nos encontramos dos escenarios. Debut de metástasis en un paciente con cáncer, en el que un reestadiaje será mandatorio, requiriendo habitualmente un estudio de tomografía computarizada (TC) toracoabdominal y gammagrafía ósea, o de manera alternativa un tomografía de emisión de positrones (PET)-TC, buscando otras metástasis y valorando la necesidad de biopsia para confirmar el diagnóstico6.
El otro escenario es el debut de una lesión en paciente con metástasis conocidas. Para el estudio en sí de la lesión básicamente necesitaremos una resonancia magnética (RM) y TC. El estudio radiográfico nos puede ser útil básicamente a la hora de valorar alineación en pacientes que puedan requerir cirugías amplias6,53.
La resonancia tiene una elevada sensibilidad y especificidad en la detección de metástasis (98,5 y 98,7%, respectivamente)6. También es de utilidad en el diagnóstico diferencial con fracturas osteoporóticas, frecuentes en contexto de paciente oncológico6. También nos permitirá evaluar la severidad de la compresión cordón medular6,14,22.
La TC evalúa estructura ósea y características líticas, blásticas de las lesiones, grado de afectación cortical, pedículos o cambios destructivos que afecten cortical posterior6,14. Al mismo tiempo nos permitirá cuantificar la inestabilidad de la lesión. En la evaluación de metástasis vertebrales la sensibilidad baja a 66%, mientras que la fiabilidad se acerca a 89%6.
En 2010, el Spine Oncology Study Group (SOSG) definió la inestabilidad vertebral y desarrolló un score que intenta cuantificarla. Se trata de una reunión de expertos y acuerdo entre ellos, elaborando un score que intenta cuantificar el grado de inestabilidad, el Spinal Instability Neoplastic Score (SINS)15.
Es un intento de estandarizar la evaluación de la inestabilidad dependiendo de la localización de la lesión, el tipo de afectación ósea (lítica o blástica), la presencia de dolor, la pérdida de alineación y la afectación de estructuras posteriores. Cada uno de estos factores están categorizados y puntúan de menos a mayor inestabilidad13–18.
El problema es la gran indefinición que significa el grupo de inestabilidad indeterminada, que por otro lado es el que se presenta más frecuentemente16,17, y en el que a día de hoy se desconoce cuál es la mejor opción de tratamiento6,16.
Otra de las críticas es la moderada especificidad, de 79,5%, por lo que falla en identificar todos los negativos verdaderos y tiende a sobreindicar tratamiento (dos de cada 10)18.
La radiografia presenta una escasa sensibilidad, así que más allá de su rápida disposición no debería ser usada de manera rutinaria6.
Compresión medularLa compresión medular y la lesión neurológica secundaria son unas de las complicaciones más severas en el paciente oncológico. Su valoración requiere de una adecuada valoración de su capacidad de marcha; tiempo de evolución de los síntomas y minuciosa valoración del daño neurológico y del grado de afectación por resonancia.
La lesión medular está directamente relacionada con la calidad de vida relacionada con la salud (HRQoL) en estos pacientes y también con la supervivencia, con evidencia franca a favor de mayor supervivencia en pacientes mantienen capacidad de marcha19.
Tiempo de evolución de la lesión, pérdida capacidad de marcha, alteración del control del esfínter y fuerza pares musculares (fuerza<III de la Medical Research Council) parecen ser los factores pronósticos asociados a la capacidad de recuperación funcional19,20.
La valoración clínica del grado de lesión medular se ha de realizar siguiendo las normas de clasificación neurológicas de las lesiones de la médula espinal, según los criterios de la American Spinal Injury Association (ASIA), que ha ido actualizándose21. Ha demostrado una alta sensibilidad y validez, sin embargo, debido a su complejidad posiblemente requiera de un médico rehabilitador o neurólogo habituado a la exploración de estos pacientes.
Bilsky et al. definieron y describieron un intento de cuantificación por RM del grado de compresión y extensión del tumor. Así definieron grado 0 y 1, donde no existía compresión o desplazamiento del cordón medular y grado 2, donde existía desplazamiento del cordón en diversos grados y grado 3 en el que se pierde la señal de líquido cefalorraquídeo (LCR) alrededor del cordón22.
Opciones de tratamientoControl del dolor, mantenimiento o recuperación de la función, especialmente neurológica han de ser nuestros objetivos, teniendo presente que, en muchas ocasiones, se tratará de medidas paliativas. Otro escenario es en pacientes oligometastásicos y con opciones de tratamiento sistémico eficaces. En los diferentes escenarios, la agresividad y la morbilidad del tratamiento se ha de ajustar individualmente al paciente3,6,7.
Tratamiento radioterápicoSigue siendo el eje fundamental de tratamientoLa radioterapia convencional con dosis fraccionadas de 20 o 30 Gy ha sido usada durante décadas, presenta el límite de 30 Gy que es el margen de tolerancia de la médula a la irradiación; en tumores radiosensibles (hematológicos o tumores de célula pequeña) se ha mostrado eficaz, otros tumores muestran grados variables de sensibilidad (ovario, mama o próstata) y clásicamente resultados subóptimos en otros tumores (renales, tiroides o no célula pequeña, entre otros)6,23. Tumores radiosensibles, con dolor, sin signos de fractura y con mínimo componente epidural serían los candidatos ideales (en casos de tumores muy sensibles también responden eficazmente en casos de masa peridural)6,53. También es un recurso en pacientes con corta expectativa de vida de manera paliativa para control del dolor. Hay que recordar que la radioterapia no controla el dolor secundario a inestabilidad o fractura.
La aparición de las técnicas de estereorradioterapia (radioterapia estereotáctica) han cambiado el paradigma entre tumores radiosensibles o radiorresistentes, como resultado de los avances tecnológicos en la guía por imágenes y las técnicas de administración del tratamiento que permiten la administración de grandes dosis a tumores con márgenes reducidos con altos gradientes fuera del objetivo. La radioterapia corporal estereotáctica (SBRT) permite aumento de dosis y mayor seguridad23. Tumores considerados radiorresistentes, como los renales, ahora se pueden beneficiar de este tratamiento, incluso reirradiar pacientes previamente tratados con radioterapia convencional6.
Recientemente, un estudio de Sahgal et al. ha reportado la superioridad de la SBRT según esquema de 12 Gy/2 fracciones vs. el tratamiento convencional de 20 Gy/5 fracciones para el control del dolor a los tres y seis meses sin incremento de la toxicidad en pacientes con metástasis vertebrales oligo y polimetástasicos24.
La variabilidad en la delimitación del objetivo a tratar ya no debe ser motivo de controversia tras las publicaciones de consenso de expertos internacionales para la delimitación, tanto en escenarios de SBRT tras la cirugía de separación como en tratamientos exclusivos con SBRT24.
La valoración del grado de compresión es importante de cara a determinar la eficacia de SBRT en el manejo de la metástasis. Así, Bilsky 0 o 1 donde no existe desplazamiento cordón pueden tratarse perfectamente mediante SBRT, mientras que en casos 2 o 3 generalmente requieran de una cirugía previa para descomprimir y dar espacio entre cordón y restos de metástasis antes de SBRT22,26, conocido como técnica de separación22–25.
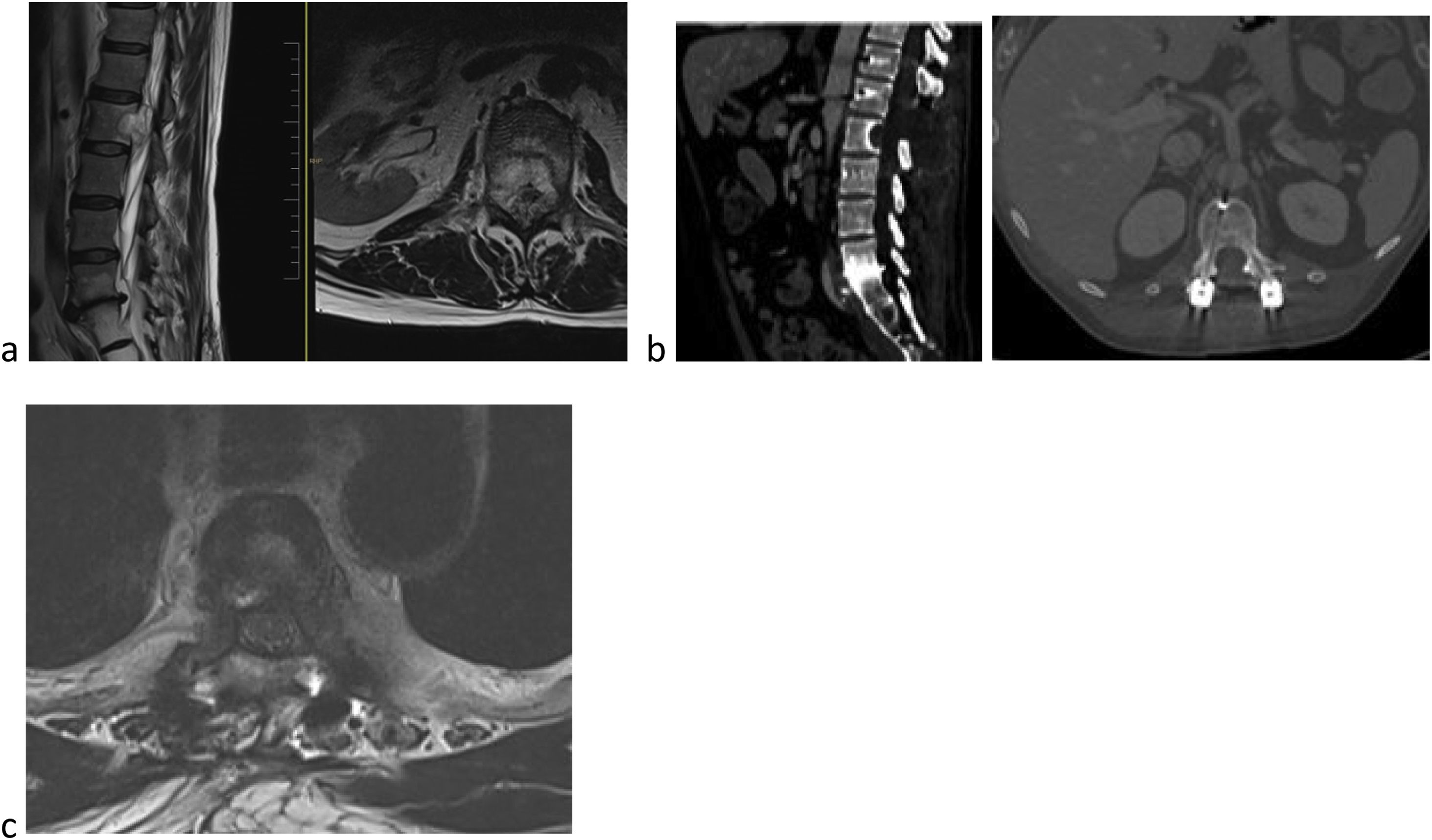
La indicacion ideal para SBRT sería un paciente con ocupación parcial del canal; histología radiorresistente, no inestabilidad mecánica y SV esperada superior a seis meses (fig. 1).
Varón de 59 años de edad. Metástasis cuerpo de L2 Tokuhashi 13, SINS 6 y Bilsky 2. a) Se trata de un paciente con buen estado general (BEG) y supervivencia previsible superior a los 12 meses. b) Se decide tratamiento mediante exéresis parcial y cirugía de separación y posterior SBRT. c) Para optimizar preparación SBRT se decide instrumentación con fibra de carbono.
La mejoría de técnicas anestésicas, control neurofisiológico y la mejora de técnicas quirúrgicas nos han permitido realizar intervenciones más seguras y agresivas, así como otras miniinvasivas con mejoría de nuestros resultados y disminución de la morbilidad8.
Habitualmente la cirugía irá destinada a aportar estabilidad o ha descomprimir el cordón medular, para lograr mejorar el dolor, mantener capacidad de marcha y lograr control local8,27.
Los resultados en cuanto a control del dolor, mejoría estabilidad son ampliamente reportados en la literatura y van más allá del interés de este artículo7,8,27,28.
La tasa de complicaciones es de 20/30%27–29, directamente relacionada con la agresividad de la cirugía, por lo que siempre se ha de balancear el riesgo del tratamiento quirúrgico vs. beneficio cuando decidimos la táctica/técnica quirúrgica a realizar.
Clásicamente las opciones quirúrgicas de que disponemos son: descompresión paliativa, estabilización mecánica, debulking y vertebrectomía (piecemeal o en bloque), o más recientemente, la combinación de estas técnicas para la cirugía de separación y posterior SBRT25,26. Necesitamos más evidencia para definir el papel e indicación de las diferentes opciones quirúrgicas7,30.
La aparición y desarrollo de técnicas de cirugía mínimamente invasiva de la columna (MISS) intenta cambiar este paradigma.
En una revisión sistemática de nueve artículos en los que comparan técnicas MISS con abiertas de manera retrospectiva (183 vs. 161 pacientes). Se trata de series cortas, no randomizadas y con sesgo de selección de casos y en la que solo pueden concluir, con baja evidencia, que las técnicas MISS pueden ser una alternativa a las técnicas abiertas, con resultados similares en cuanto a control del dolor y control local, sin demostrar otras diferencias por la heterogeneidad de las técnicas MISS comparadas, las supuestas mejoras en tiempos quirúrgicos, pérdida hemática o menor ingreso no son homogéneas en los nueve trabajos revisados31.
Lu et al.32 sí que realizan un metaanálisis de solo seis trabajos, pero solo logran hallar diferencias en pérdida hemática y transfusión en favor de las técnicas MISS, no hallando diferencias en cuanto a dolor, resultado neurológico o tiempo quirúrgico y complicaciones.
Otras técnicas miniinvasivas como las técnicas de aumentación (cifo o vertebroplastia) se han mostrado eficaces en el control del dolor por lesiones líticas y fracturas8,32,33. Otras técnicas como la ablación por radiofrecuencia, aisladas, o combinadas con las de aumentación están mostrando resultados esperanzadores con mejoría del dolor, disminución de riesgos quirúrgicos, reducción en la incidencia de fracturas y mejoría de la calidad de vida34.
Tratamientos no quirúrgicosDolor.La analgesia oral es considerada la primera línea tratamiento en el dolor óseo por parte de la Organización Mundial de la Salud (OMS). La morfina o derivados es la opción más común en el tratamiento del dolor severo en estos pacientes, pero los efectos secundarios limitan en ocasiones su uso8.
La definición del cuarto escalón de la OMS y la disponibilidad de la técnica de intratecales o eperidurales han ido ganando popularidad, dado que han demostrado mejor control del dolor, con menores dosis. La mejoría de la técnica también ha disminuido sus desventajas como riesgos de infección, costo o durabilidad, con bombas externas programables o implantes subcutáneos35,36.
RehabilitaciónLa rehabilitación es un factor crucial en el cuidado de pacientes con metástasis vertebrales, tanto para su correcta evaluación19–21 como para su recuperación funcional si aparece lesión neurológica37, demostrando una ventaja en la prevención de complicaciones, mejoría de la funcionalidad, disminución del dolor y mejoría de la calidad de vida37.
DiscusiónEl manejo de las metástasis vertebrales involucra a diferentes especialidades como oncólogos, oncólogos radioterapeutas, radiólogos y radiólogos intervencionistas, rehabilitadores, unidades de dolor, paliativos y, por supuesto, cirujanos de columna. La valoración y el manejo de las mismas requieren en ocasiones de una compleja toma de decisiones, donde la rapidez en la toma de decisiones, en las exploraciones o intervenciones necesarias es de vital importancia para mejorar el pronóstico y la calidad de vida de estos pacientes38.
En muchos centros el manejo de estos enfermos está fragmentado, donde los pacientes son referidos a una serie de especialistas, con escasa continuidad en el cuidado del paciente y el consiguiente estrés psicológico por parte de los pacientes38.
En otros campos de la cirugía del raquis, como pueden ser la deformidad del adulto o cirugías de alto riesgo, se ha demostrado eficaz y con disminución de complicaciones si la toma de decisiones quirúrgicas se realiza en grupos multidisciplinarios39.
En una reciente revisión sistemática de la literatura, Farhadi et al. realizan una revisión sistemática de la literatura de los trabajos que incluyen grupos multidisciplinares en la toma de decisiones quirúrgicas de patología raquis. Muestran una reducción de 51% en las complicaciones los primeros 30 días en la cirugía de escoliosis del adulto y entre 0-14% en las complicaciones en otras patologías de raquis. Concluyen que estos grupos multidisciplinares tienen impacto en el manejo de estos pacientes, mejoran la comunicación entre especialidades, estandarizan tratamiento y mejoran cuidado del paciente, si bien advierten que de momento faltan trabajos para demostrar que mejoran los resultados40.
Dentro del campo de los tumores espinales, su manejo y tratamiento significa un reto por la complejidad inherente a la columna, requiriendo de grandes recursos y tiempo, y donde los comités multidisciplinarios han demostrado su eficacia41.
Mann et al.41 presentan su experiencia en su comité multidisciplinario de tumores espinales de 2006 a 2021, donde 40% son metástasis, y concluyen que es fundamental para acceder a aportaciones multidisciplinarias, aumentar la confianza en las decisiones para ambos pacientes y médicos y cirujanos, ayudando con la orquestación de la atención y mejorar la calidad de la atención para los pacientes con tumores de columna vertebral.
En el campo de la oncología, la presencia de estos comités multidisciplinarios tiene mucho más recorrido. Desde que en 1995 Calman-Hine mostraron una correlación positiva entre el manejo pluridisciplinario y la óptima toma de decisiones en los pacientes con cáncer, los grupos y reuniones o comités multidisciplinarios se han ido convirtiendo en el estándar en el manejo de pacientes con cáncer42.
El manejo en comités multidisciplinarios de los pacientes con cáncer se ha implementado y convertido en el estándar los últimos años43,44.
Esto ha permitido mejorar el estadiaje preoperatorio de estos pacientes, acorta el tiempo entre diagnóstico y tratamiento, hace más probable el tratamiento neo y adjuvante; entre 4-50% de los pacientes sufren modificaciones en su diagnóstico y pronóstico tras el paso por comité y globalmente ha mejorado supervivencia y ha mejorado la adherencia a las guías de tratamiento.
La toma de decisiones en el tratamiento de las metástasis óseas clásicamente no era valorada en ningún comité y era el oncólogo el que consultaba a la Unidad de Raquis cuando aparecía alguna complicación. Igual que las opciones de tratamiento oncológico han cambiado y ampliado mucho en los últimos años, el manejo de las metástasis y las diferentes opciones de tratamiento también se ha complicado mucho. Como hemos visto previamente, la toma de decisiones involucra la evaluación del estado general, la agresividad del tumor, el estado neurológico, pero también los tratamientos previos recibidos y las posibles opciones de tratamiento sistémico que pueda tener. Al mismo tiempo se ha de evaluar el impacto que este tratamiento sistémico pueda tener en la metástasis a tratar. Por otro lado también se ha de evaluar conjuntamente el impacto que el retraso en iniciar el tratamiento sistémico pueda tener en la SV global, teniendo presente que en la mayoría de nuestros casos el manejo será, como hemos dicho anteriormente, paliativo. Todo esto hace idónea la valoración de estos pacientes en comités multidisciplinarios, más si consideramos el amplio abanico de presentaciones clínicas o tumores primarios, algunos poco frecuentes con lo que es difícil tener experiencia si no se centraliza la toma de decisiones y manejo41,45,51.
La aplicación de comités multidisciplinarios para manejo y tratamiento de las metástasis vertebrales ha demostrado una mejora en la rapidez e inicio de tratamiento, una mayor prevención de «eventos espinales» y disminución de las cirugías de emergencia por compresión medular41,46,47.
Para ello, en este grupo japonés son los radiólogos los que notifican todas las metástasis vertebrales y se presentan en comité aquellas con un SINS>7, así refieren evitar o mejorar el retraso médico que se da en muchos casos cuando son los oncólogos los que han de notificar las complicaciones espinales y no siempre valoran adecuadamente las señales de riesgo48.
El objetivo de un comité para metástasis vertebrales sería mejorar el diagnóstico y valoración de las mismas, anticiparse y prevenir las complicaciones asociadas a ellas y un rápido y más eficaz tratamiento en casos de presentarse, permitiendo una intervención coordinada, rápida y adaptada con el objetivo de mantener calidad de vida del paciente45,51.
Los comités también han demostrado cambiar los tratamientos paliativos y alargar la supervivencia en casos terminales. También se ha demostrado que un fallo en la implementación de mejores prácticas clínicas, asociado a la no implantación o acceso a comités ha resultado en 50.000 a 100.000 muertes evitables en Europa49–51.
Aún queda mucho trabajo por recorrer, como acabar de convencer a los oncólogos de la necesidad e importancia del control de las metástasis óseas, vertebrales en particular. Una queja típica por parte del equipo de cirujanos es la demora en consultarnos. La metástasis ósea clásicamente no se creía asociada al pronóstico, por lo que muchos pacientes nos eran referidos, solo cuando presentaban una complicación.
Hay trabajos que muestran el retraso en la consulta con el equipo quirúrgico, un predictor independiente de peor pronóstico52, así como motivo de cirugías de mayor agresividad.
Existen posiblemente muchas razones que expliquen este retraso, uno de ellos se debe a los criterios aceptados y usados para control evolución de los pacientes con cáncer. Estos están reflejados en el Response Evaluation Criteria in Solid Tumors (RECIST) 1.153 que se refiere a un set/grupo de reglas publicadas para valorar la extensión del tumor intentando dar un valor objetivo sobre la respuesta de un tumor a la terapia, y así catalogar al tumor como remisión, respuesta parcial, estable o enfermedad en progresión. Las metástasis se dividen en lesiones objetivo (aquellas medibles) y no objetivo (aquellas no medibles), donde se incluyen las metástasis vertebrales. Para considerar enfermedad como progresiva las lesiones no objetivo solo se consideran si su empeoramiento es suficientemente dramático que no importe el estado de las lesiones objetivos53, por lo tanto habitualmente la lesiones no objetivo no se valoran en los estudios sobre respuesta del cáncer salvo importante progresión.
Nuestro grupoLas reuniones han de tener una periodicidad regular que en nuestro caso es semanal. Debe haber un médico que coordine la reunión. Presentar caso y los radiólogos interpretar imágenes, los objetivos son: confirmar diagnóstico, determinar estado general y pronóstico vital previsto, indicación de radioterapia vs. cirugía o combinado y en estos casos planificar tiempo entre cirugía y SBRT, así como ajustar momento de exploraciones complementarias necesarias, timing/demora en administrar tratamiento sistémico, indicación radiológica intervencionista, requerimientos de ortesis o rehabilitación54.
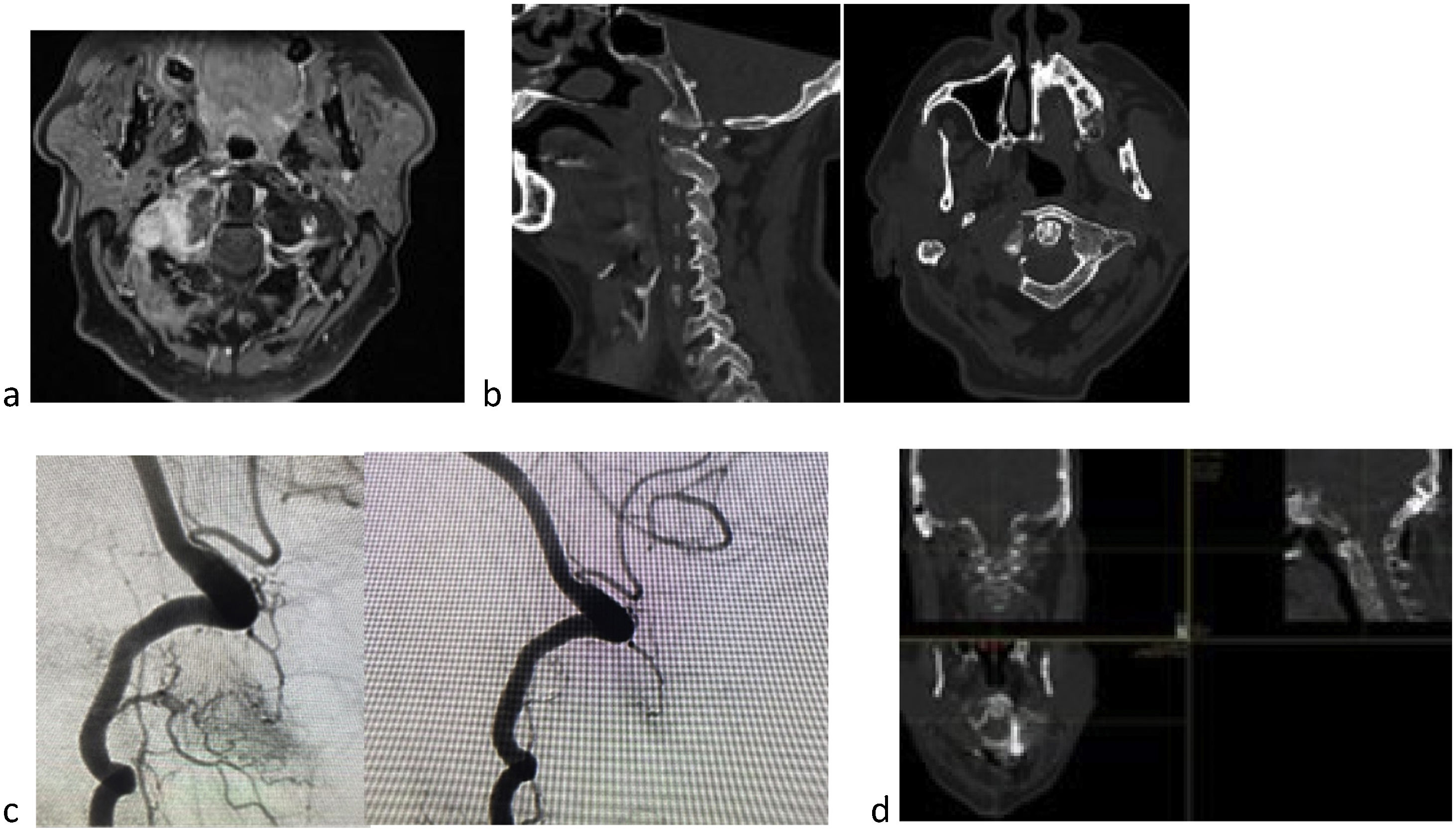
El comité lo componen varios miembros de la Unidad de Raquis, uno de ellos como presidente del comité y coordinador de la reunión, miembros de radiología, expertos en aparato locomotor y resonancia sistema nervioso, dos miembros de radioterapia, varios miembros de oncología médica, los más frecuentes de genitourinario, oncohematología y mama, y dependiendo del tumor primario algún miembro de las diferentes unidades, un miembro de radiología intervencionista (que en nuestro centro realizan además las técnicas de aumentación) (fig. 2), dos miembros rehabilitadores de la Unidad de Lesionados Medulares. A partir de aquí y dependiendo de las necesidades del caso se incorporan miembros de la unidad del dolor y miembros de radiología intervencionista vascular.
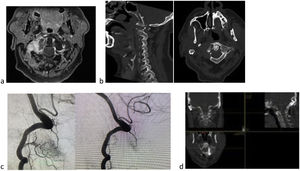
Varón de 60 años con carcinoma renal de células claras. Metástasis masa lateral de C1 (a), con dolor, fractura patológica (b) y alteración eje mirada. Tokuhashi 7, SINS 13 (b) y Bilsky 1a. Se trata de una lesión inestable, en paciente con expectativa de supervivencia inferior a los seis meses si seguimos score de Tokuhashi, pero con opciones de tratamiento autoinmune por parte de oncología y supervivencia esperable superior a los 18 meses, se decide estabilización y SBRT. Debido a supervivencia previsible se decide exéresis parcial para disminuir carga tumoral y optimizar SBRT (d). Debido a que se trata de tumor hipervascular se recomienda embolización previa, a pesar del riesgo de isquemia medular en esta localización (c).
La periodicidad es semanal y se presentan los casos dudosos en su indicación. El resto de los casos en los que la indicación o tratamiento generen menos dudas, o los casos urgentes se valoran mediante interconsultas o grupo telefónico multidisciplinar. Usamos un lenguaje común, la inestabilidad vertebral se valora mediante SINS; el grado de compresión radiológica según Bilsky (ambos por los radiólogos, el SINS sin considerar presencia dolor que se discute en comité); la lesión neurológica es valorada por el equipo de lesionados medulares y la SV prevista es discutida con el oncólogo según opciones o líneas de tratamiento posibles y estado general, la respuesta previsible que tenga el paciente combinado con score de Tokuhashi (tabla 1).
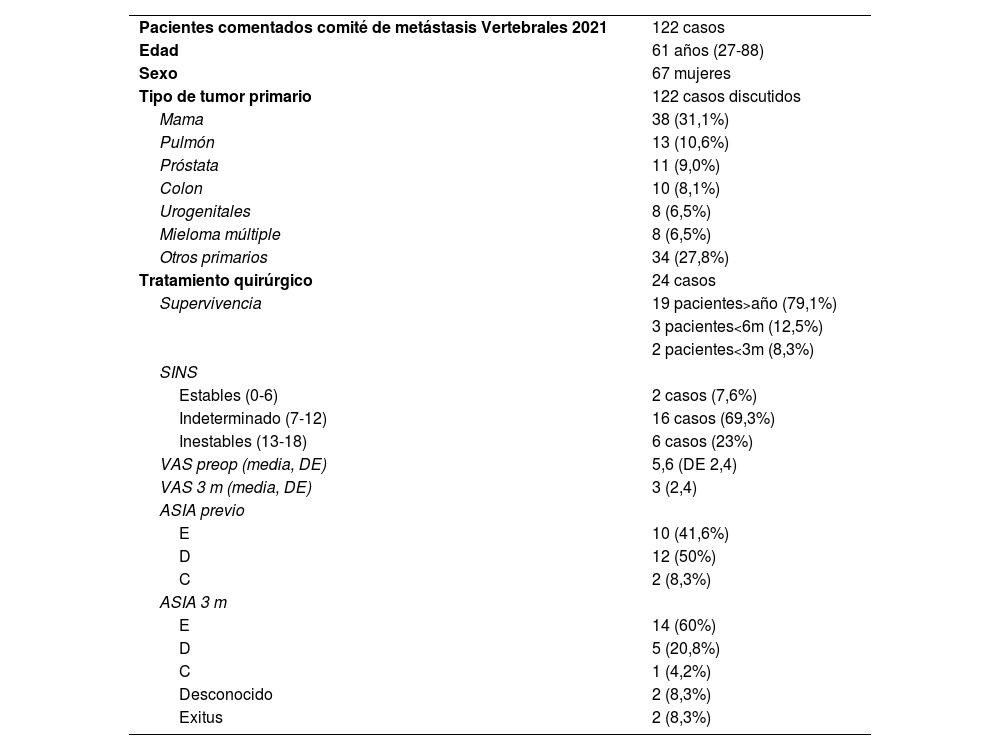
Tabla descriptiva de los pacientes discutidos en comité durante 2021
| Pacientes comentados comité de metástasis Vertebrales 2021 | 122 casos |
| Edad | 61 años (27-88) |
| Sexo | 67 mujeres |
| Tipo de tumor primario | 122 casos discutidos |
| Mama | 38 (31,1%) |
| Pulmón | 13 (10,6%) |
| Próstata | 11 (9,0%) |
| Colon | 10 (8,1%) |
| Urogenitales | 8 (6,5%) |
| Mieloma múltiple | 8 (6,5%) |
| Otros primarios | 34 (27,8%) |
| Tratamiento quirúrgico | 24 casos |
| Supervivencia | 19 pacientes>año (79,1%) |
| 3 pacientes<6m (12,5%) | |
| 2 pacientes<3m (8,3%) | |
| SINS | |
| Estables (0-6) | 2 casos (7,6%) |
| Indeterminado (7-12) | 16 casos (69,3%) |
| Inestables (13-18) | 6 casos (23%) |
| VAS preop (media, DE) | 5,6 (DE 2,4) |
| VAS 3 m (media, DE) | 3 (2,4) |
| ASIA previo | |
| E | 10 (41,6%) |
| D | 12 (50%) |
| C | 2 (8,3%) |
| ASIA 3 m | |
| E | 14 (60%) |
| D | 5 (20,8%) |
| C | 1 (4,2%) |
| Desconocido | 2 (8,3%) |
| Exitus | 2 (8,3%) |
No consideramos, en grupo de pacientes quirúrgicos, aquellos a los que se les han realizado técnicas de aumentación o ablación más menos combinadas con RT. Solo pacientes que han sido intervenidos por Unidad de Raquis.
VAS: Visual Analogic Scale; ASIA: American Spinal Injury Association.
Las metástasis vertebrales pueden provocar serias complicaciones en el contexto de un paciente frágil como el paciente de cáncer.
Las mejoras en el tratamiento, tanto a nivel sistémico como local han abierto mucho las posibilidades de tratamiento de estos pacientes, haciendo compleja la toma de decisiones.
Si bien existen diversos algoritmos que nos pueden guiar en la toma de decisiones, todos estos modelos han demostrado ser todavía imprecisos, por lo que se acaba recomendando una valoración e indicación individualizada.
La discusión y toma de decisiones conjunta en estos casos complejos mejora el tratamiento en estos pacientes, si bien todavía está por demostrar que mejore la SV.
Nivel de evidenciaNivel de evidencia III.
Conflicto de interesesLos autores declaran no presentar conflicto de intereses en relación al presente trabajo.
FinanciaciónLos autores declaran que no han recibido financiación para la realización de la presente investigación, la preparación del artículo, ni su publicación.