La enfermedad de Perthes produce frecuentemente una coxa anesférica congruente. La causa más ampliamente aceptada es el colapso óseo inicial, pero algunos autores hacen referencia a la lesión fisaria como causante de esta deformidad. Nos proponemos analizar este proceso de ovalización en casos de Perthes anesféricos congruentes.
MétodosEstudio retrospectivo de casos-control de 48 casos unilaterales de Perthes clase III-IV que no fueron operados. Los resultados se compararon con las 48 caderas contralaterales sanas. Se determinaron las siguientes variables radiológicas tanto en proyección AP como en lateral, y en 4 momentos del curso de la enfermedad: índice de ovalización (IO), distancia artículo-trocantérica, ángulo intrafisario, borramiento fisario, presencia de doble núcleo de reosificación epifisario, longitud fisaria e índice de Reimers.
ResultadosEl IO inicial fue de 1,7 en la fase de reosificación precoz y el IO final de 2,07 al cierre fisario. El IO en los casos control fue invariablemente de 1,4. Hubo una relación directa entre un índice alto y la aparición inicial de un doble núcleo de osificación epifisaria, borramiento fisario asimétrico y el aumento del ángulo intrafisario en ambas proyecciones radiográficas.
ConclusionesEl proceso de ovalización de la cabeza femoral se produce de forma progresiva a lo largo de la enfermedad y no solo durante el colapso óseo. Se inicia en la fase de reosificación y finaliza al cesar el crecimiento. Los signos de riesgo iniciales encontrados fueron la aparición del doble núcleo de reosificación, la angulación progresiva de la fisis y el aumento progresivo del IO.
Perthes disease often produces a congruent nonspherical coxa. The most widely accepted cause is initial bone collapse, but some authors refer to physeal injury as the cause of this deformity. We analyze this elliptical process in cases of congruent nonspherical Perthes.
MethodsRetrospective case-control study of 49 unilateral class III-IV Perthes cases that were not operated on. Results were compared with 49 healthy contralateral hips. The following radiological variables were determined both in AP and lateral projection, and at 4 points in time of the disease: ovalization index (OI), arthrotrochanteric distance, intraphysial angle, physeal narrowing, presence of double epiphyseal reosification nucleus, physeal length and Reimers index.
ResultsThe initial OI was 1.7 in the early reosification phase and final OI was 2.07 at physeal closure. The OI in the control cases was invariably 1.4. There was a direct relation between a high index and the initial appearance of a double epiphyseal ossification nucleus, asymmetric physeal effacement and the increase of the intraphyseal angle in both radiographic projections.
ConclusionsThe elliptical process of the femoral head occurs progressively throughout the disease and not only during bone collapse. It starts in the reosification phase and ends when growth stops. The initial risk signs found were the appearance of the double nucleus of reosification, the progressive angulation of the physis and the progressive increase in the rate of ovalization.
La enfermedad de Legg-Calvé-Perthes también se llama «de la coxa plana» y produce una morfología final anesférica congruente, clases III y IV de Stulberg1–3, en más del 30% de los casos1. La forma final de la cabeza femoral va a depender del grado de colapso óseo producido en las primeras fases de necrosis/fragmentación, y del crecimiento alterado de la fisis de la cabeza que produce deformidades evolutivas durante las fases de reosificación/remodelación4–8.
A diferencia del colapso óseo que puede recuperarse, la necrosis de la capa de células basales de la fisis no es recuperable. La necrosis asimétrica o incompleta del cartílago fisario produce un crecimiento irregular del platillo. Se inicia ya en la fase de reosificación y se magnifica durante la fase de remodelación, una vez cura la fase necrótica7–11. Esta anesfericidad fue ya descrita por Nelson3 con el «Deformity Index» y lo presentó como el proceso de ensanchamiento y aplanamiento cefálico. No llegó a detectar signos predictores que anticiparan su desarrollo.
La lesión fisaria es de difícil determinación por métodos radiológicos pero se puede inferir una vez que aparecen las consecuencias lógicas, como son las alteraciones progresivas de la forma del extremo proximal del fémur, que incluyen el sobrecrecimiento del trocánter mayor, el cuello ancho y corto, el borramiento fisario, la epífisis de menor altura y la discrepancia de longitud de miembros inferiores5–8.
Nos proponemos estudiar este proceso de ovalización de la cabeza femoral producida en los casos de cabezas anesféricas congruentes (clases III y IV de Stulberg). Así mismo, intentamos determinar aquellos factores que puedan estar presentes al inicio para etiquetarlos como factores de riesgo de la aparición de la coxa ovoide y plana.
Material y métodosSe revisaron retrospectivamente todos los casos de enfermedad de Legg-Calvé-Perthes que fueron vistos por los autores y seguidos hasta el final del crecimiento. Se descartaron los casos bilaterales y los casos operados. Los criterios de inclusión fueron la presencia de una cabeza femoral anesférica congruente, clases III y IV de Stulberg1,2. Se descartaron los casos con falta de seguimiento clínico-radiológico completo desde el inicio hasta la madurez esquelética.
La serie objeto de análisis incluyó 48 pacientes (48 caderas), 25 fueron clase III y 23 clase IV de Stulberg. Como grupo control se tomó el lado sano. La edad media al diagnóstico fue de 3,9años (rango 2,2-6,1). Se evaluó la duración total de la enfermedad.
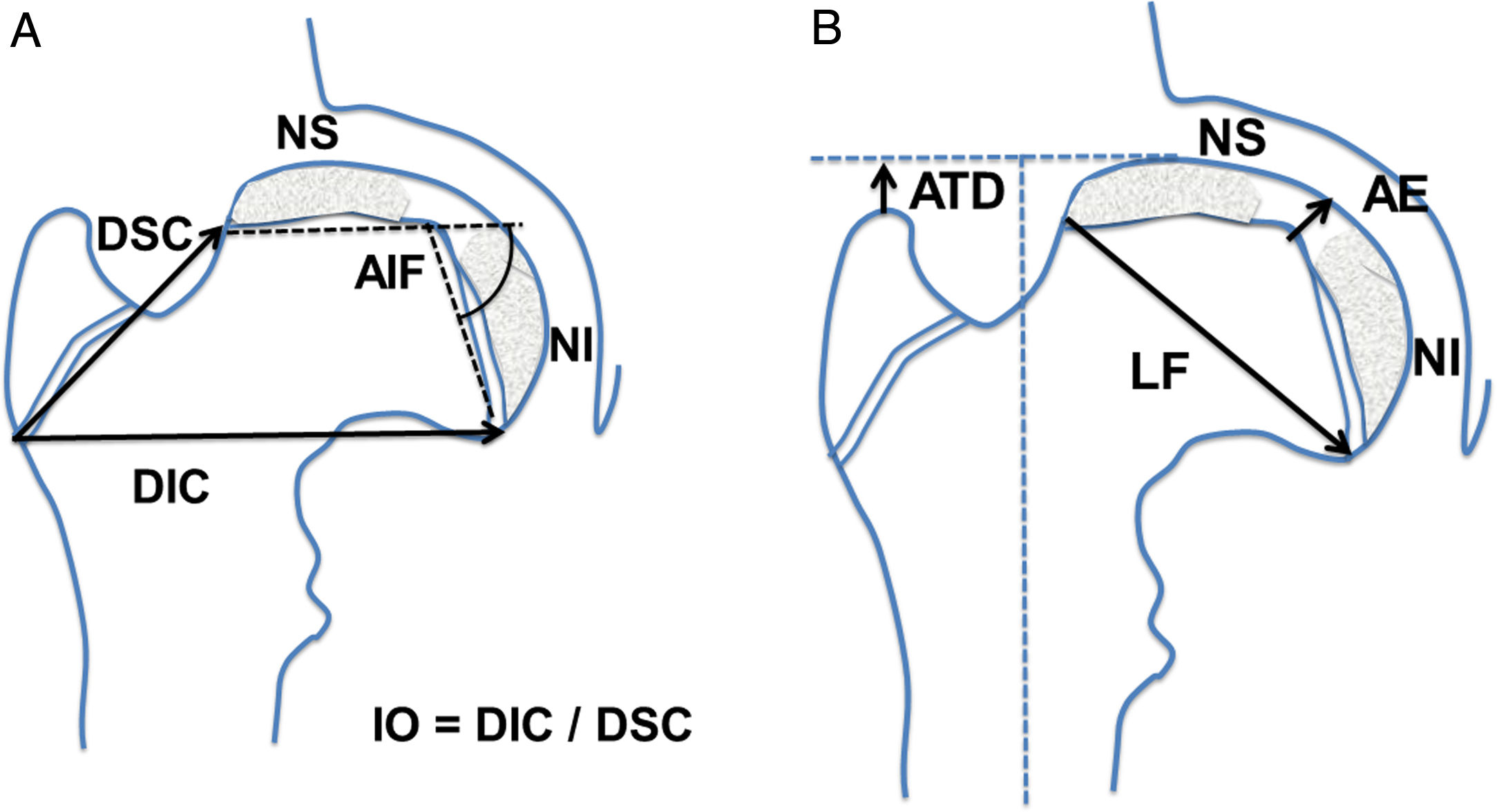
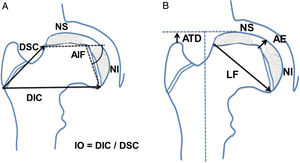
Se determinaron las siguientes mediciones radiográficas en la proyección anteroposterior de cadera: distancia artículo-trocantérea (ATD), distancia superior del cuello, distancia inferior del cuello, altura epifisaria central, ángulo intrafisario, longitud fisaria, presencia de doble núcleo de reosificación epifisario y estrechamiento o borramiento fisario. Se cuantificó además la cantidad de cabeza extruida, de cabeza intruida y el índice de extrusión de Reimers. Se calculó el índice de ovalización como el cociente entre la distancia inferior del cuello dividido por la distancia superior del cuello (fig. 1).
Esquema de las mediciones realizadas en la proyección anteroposterior de la cadera. (a) AIF: ángulo intrafisario; DIC: distancia inferior del cuello; DSC: distancia superior del cuello; IO: índice de ovalización; NI: núcleo de reosificación inferior; NS: núcleo epifisario de reosificación superior. (b) AE: altura epifisaria en el centro; ATD: distancia artículo-trocantérea; LF: longitud fisaria o diámetro cefálico; NI: núcleo de reosificación inferior; NS: núcleo epifisario de reosificación superior.
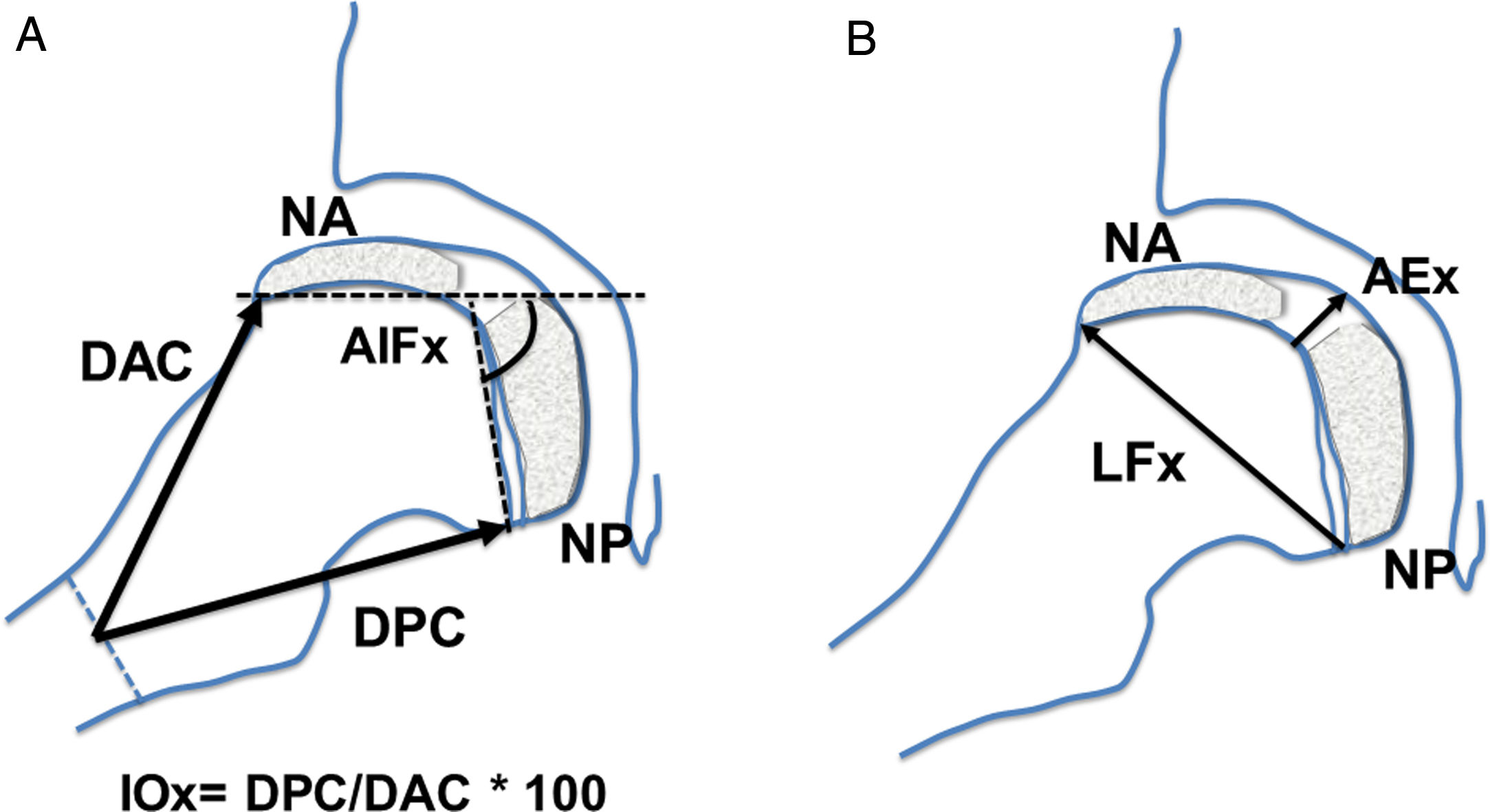
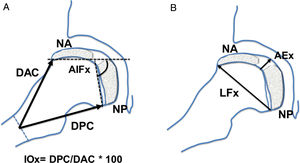
En la proyección lateral en rana o de Löwenstein se determinaron las siguientes mediciones: distancia anterior del cuello, distancia posterior del cuello, altura epifisaria central, ángulo intrafisario, longitud fisaria, presencia de doble núcleo de osificación epifisario, estrechamiento fisario (fig. 2). Se calculó el índice de ovalización axial como el cociente entre la medida posterior del cuello y la medida anterior del cuello multiplicado por 100 (fig. 2).
Esquema de las mediciones realizadas en la proyección lateral, en rana o de Löwenstein de la cadera. (a) AIFx: ángulo intrafisario axial; DAC: distancia anterior del cuello; DPC: distancia posterior del cuello; IOx: índice de ovalización axial; NA: núcleo epifisario de reosificación anterior; NP: núcleo de reosificación posterior. (b) AEx: altura epifisaria axial en el centro; LFx: longitud fisaria o diámetro cefálico axial; NA: núcleo epifisario de reosificación anterior; NP: núcleo de reosificación posterior.
Todas estas mediciones radiográficas se valoraron en 4 momentos diferentes de la evolución de la enfermedad. La primera se realizó pasado un año del inicio de la reosificación, alrededor de los 6años, y la última al final del crecimiento, tras el cierre fisario (alrededor de los 16años). Los otros 2 controles radiográficos se realizaron en momentos equidistantes entre ambos, es decir, a los 9 y 12años de edad. De esta forma se tuvo el control de los tamaños y longitudes de la cabeza femoral a lo largo de la infancia, incluyendo el periodo de enfermedad y la fase de remodelación. Se empleó el sistema DICOM de imágenes en tiempo real (DICOM 3.0 Conformance Statement system, IRE Store Channel® versión 4; Philips).
Para el estudio estadístico se empleó el programa SPSS (versión 15; IBM, Chicago, IL, EE.UU.). La estadística incluyó la comparación de variables cuantitativas con la t de Student tras comprobar la normalidad y la homogeneidad de varianzas. La comparación de variables cuantitativas requirió el test de ANOVA, junto al análisis de Tukey post hoc. En casos de varianzas no homogéneas aplicamos el test de Wilcoxon. En la comparación de variables cualitativas se aplicó el test de contingencia. El nivel de significación fue de p<0,05.
ResultadosEn la serie estudiada, el inicio de la enfermedad se produjo a una edad media de 3,9años y presentó una duración de 7,4años (rango 3,8-12,1), siendo el final del proceso a los 11,3años de edad.
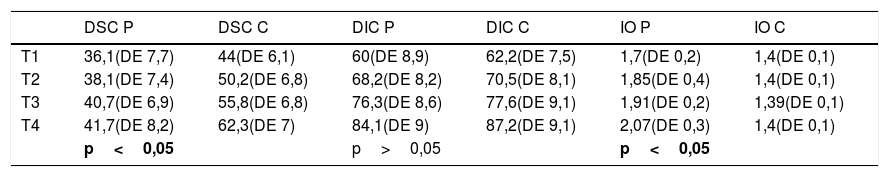
Los resultados de las medidas en proyección anteroposterior del cuello y los índices de ovalización están descritos en las tablas 1–3, junto a la longitud fisaria, ATD, longitud fisaria e índice de Reimers.
Resultados obtenidos con respecto a las distancias de cuello inferior y superior. Incluye además el resultado del índice de ovalización de los casos control y de los enfermos
| DSC P | DSC C | DIC P | DIC C | IO P | IO C | |
|---|---|---|---|---|---|---|
| T1 | 36,1(DE 7,7) | 44(DE 6,1) | 60(DE 8,9) | 62,2(DE 7,5) | 1,7(DE 0,2) | 1,4(DE 0,1) |
| T2 | 38,1(DE 7,4) | 50,2(DE 6,8) | 68,2(DE 8,2) | 70,5(DE 8,1) | 1,85(DE 0,4) | 1,4(DE 0,1) |
| T3 | 40,7(DE 6,9) | 55,8(DE 6,8) | 76,3(DE 8,6) | 77,6(DE 9,1) | 1,91(DE 0,2) | 1,39(DE 0,1) |
| T4 | 41,7(DE 8,2) | 62,3(DE 7) | 84,1(DE 9) | 87,2(DE 9,1) | 2,07(DE 0,3) | 1,4(DE 0,1) |
| p<0,05 | p>0,05 | p<0,05 | ||||
T1, T2, T3, T4 son los 4 momentos cuando se midieron las variables.
DE: desviación estándar; DIC C: distancia inferior de cuello en casos control; DIC P: distancia inferior de cuello en casos de Perthes; DSC C: distancia superior de cuello en los casos control; DSC P: distancia superior de cuello en Perthes; IO P: índice de ovalización en Perthes; IO C: índice ovalización en controles.
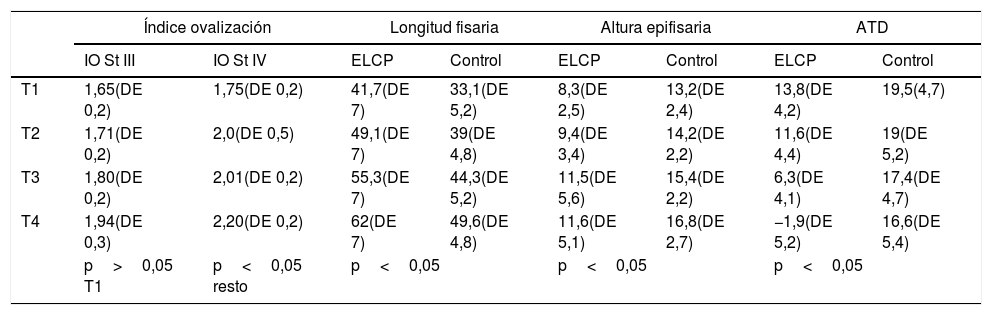
Resultados de las variables: índice de ovalización según grados de Stulberg, longitud fisaria, altura epifisaria y distancia artículo-trocantérea
| Índice ovalización | Longitud fisaria | Altura epifisaria | ATD | |||||
|---|---|---|---|---|---|---|---|---|
| IO St III | IO St IV | ELCP | Control | ELCP | Control | ELCP | Control | |
| T1 | 1,65(DE 0,2) | 1,75(DE 0,2) | 41,7(DE 7) | 33,1(DE 5,2) | 8,3(DE 2,5) | 13,2(DE 2,4) | 13,8(DE 4,2) | 19,5(4,7) |
| T2 | 1,71(DE 0,2) | 2,0(DE 0,5) | 49,1(DE 7) | 39(DE 4,8) | 9,4(DE 3,4) | 14,2(DE 2,2) | 11,6(DE 4,4) | 19(DE 5,2) |
| T3 | 1,80(DE 0,2) | 2,01(DE 0,2) | 55,3(DE 7) | 44,3(DE 5,2) | 11,5(DE 5,6) | 15,4(DE 2,2) | 6,3(DE 4,1) | 17,4(DE 4,7) |
| T4 | 1,94(DE 0,3) | 2,20(DE 0,2) | 62(DE 7) | 49,6(DE 4,8) | 11,6(DE 5,1) | 16,8(DE 2,7) | −1,9(DE 5,2) | 16,6(DE 5,4) |
| p>0,05 T1 | p<0,05 resto | p<0,05 | p<0,05 | p<0,05 | ||||
T1, T2, T3, T4 son los 4 momentos cuando se midieron las variables.
ATD: distancia artículo-trocantérea; DE: desviación estándar; ELCP: enfermedad de Legg-Calvé-Perthes; IO St III y IV: índice de ovalización según los grados de Stulberg III y IV.
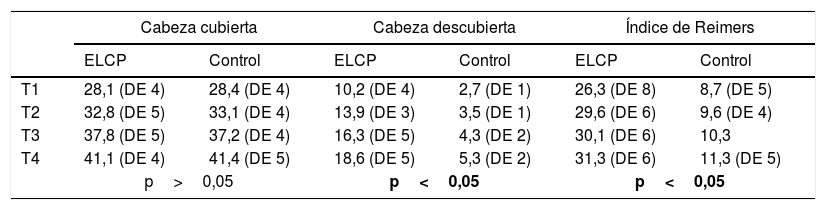
Resultados de las variables extrusión cabeza femoral según el índice de Reimers: cantidad de cabeza cubierta/cabeza descubierta*100
| Cabeza cubierta | Cabeza descubierta | Índice de Reimers | ||||
|---|---|---|---|---|---|---|
| ELCP | Control | ELCP | Control | ELCP | Control | |
| T1 | 28,1 (DE 4) | 28,4 (DE 4) | 10,2 (DE 4) | 2,7 (DE 1) | 26,3 (DE 8) | 8,7 (DE 5) |
| T2 | 32,8 (DE 5) | 33,1 (DE 4) | 13,9 (DE 3) | 3,5 (DE 1) | 29,6 (DE 6) | 9,6 (DE 4) |
| T3 | 37,8 (DE 5) | 37,2 (DE 4) | 16,3 (DE 5) | 4,3 (DE 2) | 30,1 (DE 6) | 10,3 |
| T4 | 41,1 (DE 4) | 41,4 (DE 5) | 18,6 (DE 5) | 5,3 (DE 2) | 31,3 (DE 6) | 11,3 (DE 5) |
| p>0,05 | p<0,05 | p<0,05 | ||||
T1, T2, T3, T4 son los 4 momentos cuando se midieron las variables.
DE: desviación estándar; ELCP: enfermedad de Legg-Calvé-Perthes.
En el grupo de enfermedad de Legg-Calvé-Perthes, la presencia de un doble núcleo de reosificación epifisario fue encontrado en 43 casos en la primera medición realizada (90% de los casos). En 33 caderas se pudo detectar su presencia en al menos 2 mediciones sucesivas (69% lo presentaron durante 6 años). La presencia de un doble núcleo de osificación epifisario en más de 2 mediciones fue significativamente más frecuente en los casos clase IV de Stulberg (p<0,05). En los casos control no hubo ninguna cadera con un doble núcleo epifisario.
En cuanto al borramiento fisario, en la primera medición hubo 35 borramientos fisarios parciales en los 48 y en la segunda medición hubo 47 casos con borramiento fisario. En la medición final tanto los casos como los controles presentaron borramiento total de la fisis. Ningún borramiento fisario estuvo presente en el grupo control hasta el final del cierre de crecimiento.
En la proyección anteroposterior, la altura epifisaria en casos de Perthes fue de 7,8mm (DE 2,1) en la primera medición, en la segunda 8,8mm (DE 2,4), en la tercera 8,9mm (DE 2,4) y al final del crecimiento fue de 10mm (DE 4,2). En el grupo control fue de 12,2mm (DE 2,3) en la primera medición, en la segunda 14mm (DE 2,1), en la tercera 15,6mm (DE 1,9) y al final del crecimiento 16,6mm (DE 2). Mostraron diferencias significativas (p<0,05). La diferencia de altura final entre una cabeza sana y una con Perthes fue 6,6mm más baja en esta última.
Todas las caderas enfermas mostraron algún tipo de angulación fisaria en la proyección anteroposterior con un ángulo intrafisario de 43,3° en la primera medición, 58,1° en la segunda, 63,3° en la tercera y de 72,5° al final del crecimiento (p<0,05). Ningún tipo de angulación fue determinado en el grupo control.
En lo que respecta a la proyección axial o lateral de Löwenstein, obtuvimos un índice de ovalización axial en los enfermos de 104 (DE 6,1) en la primera medición, 106,6 (DE 8) en la segunda, 108,9 (DE 8) en la tercera y de 112,7 (DE 8,6) en la última medición. La comparación de los índices entre los casos y los controles mostró una p<0,05. El índice de ovalización en los controles fue de 99,6 (DE 3,5) en la primera medición, de 98 (DE 3,8) en la segunda, de 98,3 en la tercera (DE 5,1) y de 97,6 (DE 4,7) en la cuarta.
La longitud fisaria axial en casos de Perthes según los 4 momentos de medición fue de 39,6mm (DE 10), 48,5mm (DE 7,4), 55,9mm (DE 6,2) y 62mm (DE 7,3), mientras que en el grupo control fue: 34mm (DE 5,5), 39,2mm (DE 4,7), 45mm (DE 5,1) y final de 49,3mm (DE 5). La diferencia de longitud de la fisis cefálica entre los casos y los controles fue de 8,6mm en la primera medición (p<0,05), 10,1mm (p<0,05), 11mm (p<0,05) y final de 12,4mm (p<0,05). Al final del seguimiento la longitud fisaria llega a ser 12mm mayor en el Perthes con respecto al lado sano, lo que equivale a tener una cabeza un 25% más ancha (49,6 frente a 62).
La angulación fisaria axial fue de 47,3° (DE 24) en la primera medición, 57,5° (DE 25,5) en la segunda, 63,5° (DE 27) en la tercera y de 67,4° (DE 30) al final del crecimiento. Las caderas control nunca mostraron angulación fisaria.
DiscusiónLa necrosis ósea a ambos lados de la fisis cefálica producirá obligatoriamente necrosis del platillo de crecimiento4,6,8, especialmente en casos de necrosis masiva8,12–15. La lesión necrótica de la capa germinativa estaría dentro de lo esperable debido a su irrigación terminal7,8,16 y a que el riego sanguíneo llega a través del hueso epifisario6. La afectación fisaria supone un mal pronóstico final5,8,12,16–19 y algunos autores estiman que el 30% de los Perthes sufrirán arresto fisario11.
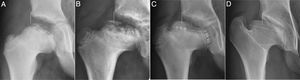
Los signos radiológicos directos de lesión fisaria son difíciles de determinar al inicio del proceso8,10,12. Los más incipientes incluyen el estrechamiento y borramiento fisario precoz o la existencia de puentes óseos metafiso-epifisarios10,16 que actúan como puntos de anclaje y frenado al crecimiento15. También puede producirse merma de las células germinales aun sin perder su totalidad, de manera que disminuiría el potencial de multiplicación celular6,17. Pruebas como la RNM tampoco son capaces de determinar la lesión necrótica fisaria en el periodo inicial de fragmentación. En fases más avanzadas puede detectar la presencia de puentes fisarios, deformidades ondulantes en W o en M o presencia de quistes óseos epifiso-metafisarios8,20. Pero la RNM no puede mostrar realmente la capacidad de crecimiento residual de la fisis21, ni determinar la pérdida de células germinales. Este potencial real de crecimiento solamente puede ser detectado a posteriori, cuando se producen las alteraciones óseas secundarias como el hipocrecimiento mantenido de la cabeza femoral. Incluyen la discrepancia de longitud femoral, que puede llegar a 5cm5,10,12,19,22, el sobrecrecimiento relativo del trocánter mayor12,22–25 o la deformidad progresiva de la cabeza durante la fase de remodelación5, con aplanamiento y extrusión6,8 (figs. 3 y 4). Varios autores23,24 encontraron que las cabezas ovalizadas tuvieron una lesión fisaria que causó la deformidad. Así, describieron que las cabezas ovoides (clases III y IV) fueron de mayor tamaño y sufrieron un crecimiento irregular.
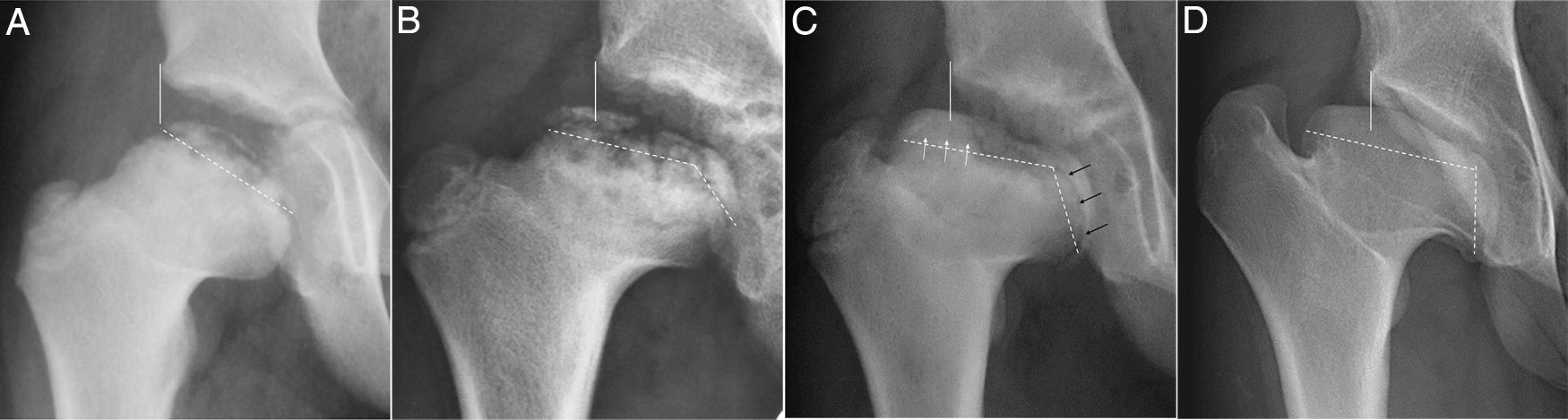
Serie radiográfica de un Perthes con inicio a los 4 años. (a) Fase de reosificación precoz con 18 meses de evolución. Línea vertical continua o línea de Perkins. La línea discontinua marca la fisis cefálica. (b) Inicio de la angulación fisaria y aparición incipiente de 2 núcleos de reosificación epifisarios. (c) Obsérvese mayor extrusión, cierre fisario del núcleo lateral con flechas blancas y fisis productiva en núcleo medial con flechas negras. Entre ambos núcleos se ve una zona condral sin osificar. (d) Resultado final a los 16 años. Coxa magna, plana y extrusa. Muestra máxima angulación fisaria, extrusión cefálica y sobrecrecimiento del trocánter. Grado IV de Stulberg.
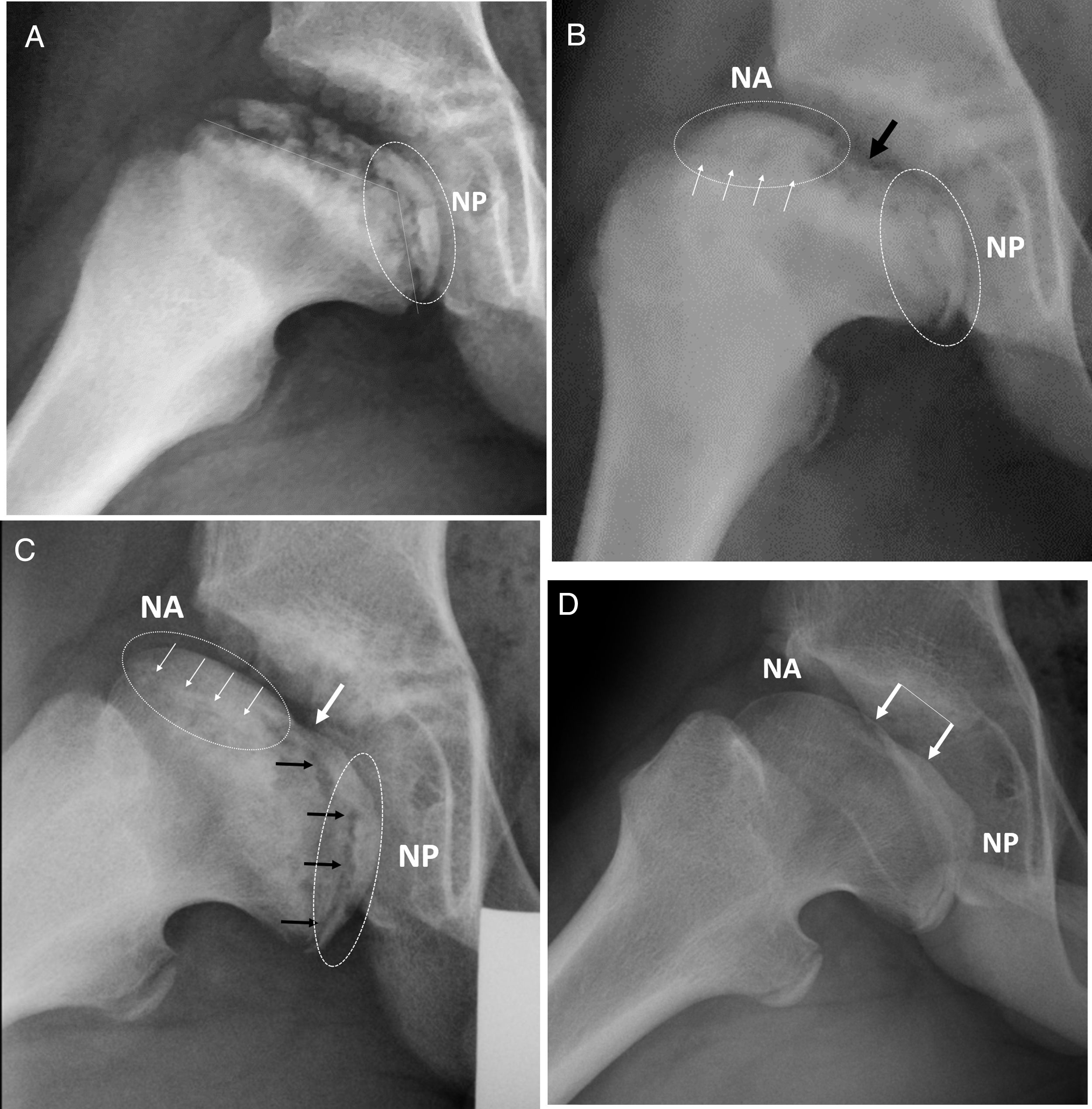
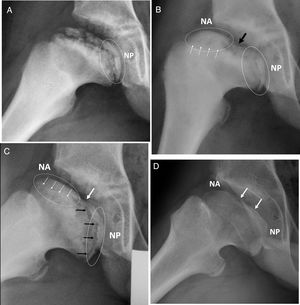
Serie radiográfica del caso anterior, proyección lateral. (a) Fase de reosificación con 2 años de evolución desde el inicio. Obsérvese la angulación fisaria bajo línea discontinua. NP: núcleo de reosificación epifisaria en localización posterior. (b) Se observa ya el doble núcleo de reosificación anterior (NA) y posterior (NP). La flecha negra indica la zona central sin reosificar entre ambos núcleos. Las flechas blancas indican el borramiento o cierre fisario precoz. (c) Obsérvese asimetría fisaria con cierre de hemifisis anterior (flechas bancas). La hemifisis posterior continúa productiva y en crecimiento (flechas negras). Ovalización progresiva con ambos núcleos epifisarios alejándose. (d) Resultado final, Stulberg IV. Las flechas indican la zona central plana osificada tras crecimiento del núcleo posterior.
Nuestra observación de los casos más ovalizados, la clase IV de Stulberg, mostró que el aplanamiento y ovalización progresivos de la epífisis puede ser producto de un crecimiento asimétrico debido seguramente al crecimiento fisario irregular que se produce6. De la misma manera que crece el trocánter mayor, también puede crecer parte de la cabeza donde la fisis no se afectó. Esto podría definirse como un sobrecrecimiento relativo del cuadrante posteroinferior de la cabeza femoral. Bowen4 describió 2 tipos de arresto fisario: uno en la zona lateral y otro en la zona central de la fisis. Determinó que solo la lesión lateral producía una cabeza ovalada, explicando así que la fisis es la causante de la forma final de óvalo. Los resultados de nuestra serie corroboran también que este arresto fisario parcial, producido en una parte aislada de la cabeza, y más específicamente en el cuadrante anterolateral, es el causante de la forma oval. Su extensión final varía de un paciente a otro y esto explicaría que similares grados de necrosis ósea vistos en la radiografía de cadera producen morfologías ovaladas diferentes. Tanto en los estudios de imagen en 3 dimensiones como en la observación de especímenes anatómicos humanos, muestran una zona de mayor deformidad y aplastamiento en el cuadrante anterolateral de la cabeza femoral11. En cambio, la zona posteromedial no se daña y es la que finalmente crece y protruye durante la fase final de reosificación6.
Los datos aquí reportados son concluyentes, y muestran la alteración del crecimiento cefálico cuando se comparan las longitudes inferior y superior del cuello femoral. El crecimiento armónico de ambas longitudes junto al crecimiento normal en altura de la epífisis produce una cabeza esférica. En los casos de enfermedad de Legg-Calvé-Perthes, la lesión fisaria anterolateral impide el crecimiento de la distancia superior del cuello, que apenas aumenta a lo largo del proceso, mientras sí lo hace el lado sano (p<0,05). En contraposición, la fisis subyacente del cuadrante posteroinferior permanece intacta y crece a velocidad normal con aumentos de la distancia inferior del cuello similares al grupo control (p>0,05). Esta asimetría de crecimiento cefálico hace que el índice de ovalización vaya aumentando a lo largo de toda la infancia, aún más allá del proceso necrótico. Mientras tanto, el índice de ovalización de los controles permanece invariable próximo a 1,4 por el crecimiento armónico de ambas longitudes, distancia inferior del cuello y distancia superior del cuello (fig. 1).
Lo mismo ocurre en la proyección lateral, donde el índice se mantiene siempre menor de 100 en los casos control. Estas cabezas femorales sanas con crecimiento simétrico muestran aumentos similares en la distancia anterior del cuello y en la distancia posterior del cuello. En contraposición, las cabezas con Perthes presentan un índice en progresión desde 104 inicial hasta 112 al finalizar el crecimiento. El arresto fisario en esta proyección se produce en la hemifisis anterior de la cabeza femoral. La consecuencia es el menor crecimiento de la distancia anterior del cuello, manteniéndose intacta la longitud posterior (distancia posterior del cuello) por tener una hemifisis posterior sana (fig. 1).
Los índices de ovalización varían consecuentemente cuando comparamos las clases III y IV de Stulberg. Si en la primera medición los índices son superponibles en ambos grupos (aplanamiento debido a colapso óseo), a medida que la enfermedad evoluciona los índices van diferenciándose cada vez más, siendo mayor en la clase IV (ovalización debida a causa fisaria de crecimiento).
La longitud fisaria es superponible al diámetro cefálico y presenta también un aumento progresivo en los casos. La explicación más lógica es que la fisis medial, no dañada, aporte un crecimiento normal o aumentado por la hipervascularización del proceso. Observamos que en la fase inicial, las diferencias de diámetro entre cabezas del grupo control y el grupo de Perthes fue de 8,6mm, mientras que al final del crecimiento las cabezas con Perthes fueron 12mm mayores, un 29% menor (p<0,05). Como puede observarse en los datos, las diferencias fueron aumentando progresivamente, incluso después de haber superado el proceso necrótico en la fase de remodelación. Este hallazgo sería un signo inequívoco de que la fisis, al menos en su zona posterior y medial, continúa su crecimiento. Se observa además que la epífisis es más baja en su punto central, siendo al final del crecimiento menor en 6,6mm en casos de Perthes. Por lo tanto, la cabeza al final del crecimiento en los Perthes ovalizados es 12mm más ancha y 6,6mm más baja.
La imagen radiográfica de una fisis sana es la de una línea traslucida más o menos irregular, pero con una forma esférica y de concavidad inferior6. Su apariencia es similar en ambas proyecciones. Lo mismo que han descrito varios autores, en esta serie hemos observado una angulación central que produce una imagen angular con el vértice central8,20 (fig. 3). Se ha descrito que se asocia a mal pronóstico final desde el punto de vista de la esfericidad6, hecho que coincide con nuestros resultados. El estudio del ángulo intrafisario mostró un aumento paulatino conforme evolucionó la ovalización. Esta angulación está relacionada con el cierre de forma consistente de la hemifisis anterolateral, que parece así horizontalizarse. La incurvación fisaria también se produce en la proyección lateral y la hemifisis que se cierra precozmente en la mitad anterior. La porción posterior continúa su crecimiento normal, deformando la epífisis y generando ovalización progresiva, y en los casos más intensos, además, un aplanamiento central. Esta zona aplanada corresponde a la parte epifisaria situada en la máxima angulación, o zona central entre ambas hemirramas fisarias. El resultado final es una cabeza clase IV de Stulberg.
La mayor parte de los autores describieron mejores resultados en pacientes con inicio temprano de la enfermedad por la ventaja de presentar una fisis abierta que pudiera remodelar las deformidades de una cabeza necrótica. No obstante, esto es cierto en casos con fisis con crecimiento regular y simétrico5,25. En casos de lesión fisaria asimétrica, el resultado debería ser el contrario. Cuanto más joven sea el paciente, más deformidad final habrá. Y este hecho es el encontrado en nuestra serie, donde a pesar de una edad media muy joven, 3,9años, los resultados fueron de anesfericidad congruente. En este sentido, Bowen5 describió que los 100 casos de su serie con lesión fisaria tuvieron resultados pobres a pesar de que los niños tuvieron un comienzo por debajo de los 6años, y apuntó también que la causa debería ser una fisis con crecimiento alterado.
La aparición de un doble núcleo de reosificación epifisario a lo largo de la enfermedad es un signo radiológico no descrito previamente. Lo hemos podido observar solamente en los casos ovalizados (figs. 3 y 4). Ambos núcleos van desarrollándose de forma paralela e independiente y se fusionan en los momentos finales del desarrollo. Sin embargo, en algunos casos dejan una zona central sin reosificación, y coincide con el punto donde la fisis más se angula. Finalmente, esta zona central no osificada deja una imagen radiológica de osteocondritis. El doble núcleo de reosificación se observó en el 90% de las caderas ovalizadas. Se trata de un signo radiológico con una fuerte asociación con casos más ovalizados, donde además de su presencia se determina mayor persistencia a lo largo del tiempo. El 70% de estos Perthes lo mantienen más allá de 6 años de evolución, y es más frecuente en los grados IV de Stulberg.
Mientras en la proyección anteroposterior se observa un núcleo externo y otro medial, en la radiografía lateral los núcleos asientan en la parte anterior y posterior. Sintetizando ambas proyecciones podemos concluir que se trata de 2 únicos núcleos de reosificación, y que asientan en el cuadrante anterolateral y en el cuadrante posteromedial de la esfera cefálica, hecho que se pudo confirmar en controles con RNM. Mientras la fisis donde asienta el cuadrante anterolateral sufre un borramiento y cierre precoz, la fisis del cuadrante posteromedial continúa productiva. Se comportarían como 2 placas tectónicas de la tierra que se van separando. El tejido epifisario que se encuentra entre ambos núcleos es tejido condral y es el último en reosificar. Se trata de la zona de la cabeza que más se aplana.
Los datos muestran que el exceso de tamaño de la cabeza produce su extrusión fuera del límite acetabular. El índice de Reimers aumenta progresivamente a lo largo de la enfermedad, lo que significa que la cabeza va extruyéndose según avanza su anómalo crecimiento. La superficie de cabeza cubierta por el acetábulo es similar en ambos grupos, enfermos y controles. Esto significa que el aumento del tamaño cefálico produce la salida de la cabeza por rebosamiento y no por subluxación, y algunos estudios16 muestran que la forma del cotilo se aplana al final de la enfermedad. Hipotetizamos que el cotilo en las fases finales del crecimiento, cuando la cabeza está reosificada, toma la forma plana de la cabeza. La norma inicial es la opuesta, donde la cabeza femoral necrosada coge la forma esférica del acetábulo, teoría de la contención.
Numerosos autores han estudiado la reproductibilidad de las mediciones radiográficas de la cadera, intra- e interobservador3,8,16,24,26–28, incluso en casos de estudios mediante RNM8. Mediciones de la cabeza femoral en anchura, longitud, esfericidad, o en lo concerniente al cotilo, han mostrado una alta correlación entre los observadores. Por ello los resultados de esos estudios dan suficiente soporte estadístico para validaciones en mediciones similares como la presente. El presente trabajo ha pasado por alto repetir dichos estudios de reproductibilidad y hemos realizado directamente las mediciones radiográficas.
En conclusión, podemos decir que los casos de Perthes que presenten un aumento progresivo del índice de ovalización por encima de 1,4 tienen riesgo de desarrollar cabezas anesféricas congruentes, especialmente si asocian borramiento fisario de la zona anterolateral, angulación intrafisaria progresiva y presencia del doble núcleo.
Esos 4 hallazgos radiológicos conjuntamente podrían ser valorados como signos de mal pronóstico, con riesgo de desarrollar cabezas ovales clases III y IV de Stulberg.
Es necesario realizar estudios que puedan determinar si la hemiepifisiodesis del cuadrante posteromedial, que sería el responsable del hipercrecimiento asimétrico de la cabeza femoral, podría prevenir la ovalización.
Nivel de evidenciaNivel de evidencia III casos control.
Conflicto de interesesLos autores declaran no tener ningún tipo de conflicto de intereses.