Evaluar la eficacia y seguridad de la administración de una dosis única intravenosa de ácido tranexámico como medida de ahorro transfusional en prótesis total primaria de rodilla.
Material y métodosEstudio observacional prospectivo de la administración de ácido tranexámico en pacientes intervenidos de prótesis total primaria de rodilla desde noviembre de 2013 a febrero de 2015, en los que se utilizó un sistema de recuperación de sangre autóloga. Se incluyeron en el estudio 98 pacientes distribuidos en dos grupos de 49 pacientes según la exposición a la administración de ácido tranexámico. La variable principal del estudio fue el número de pacientes que precisaron autotransfusión del sistema de recuperación de sangre autológa.
ResultadosNo se registraron pérdidas durante el seguimiento. No hubo diferencias significativas entre ambos grupos con respecto a las variables preoperatorias y hospitalarias. Los valores medios de hemoglobina y hematocrito preoperatorios, a las 24 y 48 h postoperatorias eran similares en ambos grupos. El volumen medio de sangrado en el sistema de recuperación de sangre autóloga y la pérdida media estimada de sangre fue menor en los pacientes a los que se había administrado ácido tranexámico, siendo las diferencias significativas. Ningún paciente del grupo en el que se administró ácido tranexámico precisó autotransfusión sanguínea. No se precisó alotransfusión sanguínea en los pacientes de la cohorte. No se registraron eventos adversos relacionados con la administración del ácido tranexámico.
ConclusionesEl uso de una dosis única 15 mg/kg de ATX intravenoso en PTR primaria ha presentado una tasa de no autotransfusión ni alotranfusión sanguínea del 100%, sin aumento en la incidencia de eventos trombóticos. Por ello recomendamos su utilización en este grupo de pacientes, con una indicación que debe ser individualizada, justificar su uso en la historia clínica y precisar del consentimiento informado del paciente.
Nivel de evidencia III.
To evaluate the effectiveness and safety of a single intravenous dose of tranexamic acid in order to reduce blood loss in total knee replacement.
Materials and methodsProspective observational study of the administration of tranexamic acid in patients undergoing primary total knee arthroplasty from November 2013 to February 2015, in which an autologous blood recovery system was used. The study included 98 patients, distributed into two groups of 49 patients according to whether or not they received intravenous tranexamic acid. The primary endpoint was the number of patients requiring autologous transfusion from the recovery system autologous blood recovery system.
ResultsNo drop-outs were recorded during follow-up. There were no significant differences between groups as regards the preoperative and hospital variables. The mean preoperative haemoglobin and haematocrit at 24 and 48hours postoperatively were similar in both groups. The average volume of bleeding in the autologous blood recovery system and estimated average blood loss was lower in patients who had been administered tranexamic acid, with significant differences. No patients in the group that was administered tranexamic acid required blood autotransfusion. The transfusion rate was zero in the two groups. No adverse events related to the administration of tranexamic acid were recorded.
ConclusionsIntravenous administration of tranexamic acid, according to the described protocol, has presented a non-autotransfusion or allo-transfusion rate of 100%, with no increased incidence of thrombotic events. Thus, its use in this group of patients is recommended. The indication should be individualized, its use justified in the patient medical records, and informed consent is mandatory.
La cirugía protésica de rodilla (PTR) es un procedimiento que precisa transfusión sanguínea alogénica entre el 39 y el 67% de los pacientes1. La liberación de la isquemia al final de la intervención produce un sangrado por aumento de la actividad fibrinolítica que obliga en ocasiones a realizar transfusiones sanguíneas alógenas en los pacientes, no exentas de complicaciones y riesgos. Además estas transfusiones pueden afectar negativamente el resultado de la cirugía e incrementan el riesgo de infección perioperatoria, la estancia hospitalaria y el coste sanitario del proceso asistencial2,3. En consecuencia se recomienda aplicar medidas de política transfusional para disminuir las pérdidas sanguíneas en el perioperatorio4.
El uso de sistemas de recuperación perioperatoria de sangre autóloga (RSA) disminuye el riesgo relativo de transfusión alógena en un 42% según el estudio de la Cochrane en PTR, con unas condiciones de calidad de sangre de absoluta garantía5. Para ello, se precisa de un sangrado en el sistema en las primeras 4 h mayor de 400ml, que debe ser transfundido antes de que se cumplan las 6 h. Además no es recomendable la transfusión de grandes volúmenes por los riesgos y complicaciones que pueda conllevar6.
El ácido tranexámico (ATX) es un derivado sintético de la lisina con una actividad antifibrinolítica pura. Su mecanismo de acción se basa en la unión al enlace de la lisina del plasminógeno, bloqueando la unión de la fibrina al complejo activador del plasminógeno-plasmina7. Otros posibles mecanismos de acción son un efecto protector de las plaquetas al inhibir el factor de activación plaquetar y la disminución de la pérdida de albúmina intracapilar manteniendo el volumen intravascular8. La administración de ATX como medida de ahorro transfusional en PTR presenta una fuerte evidencia en la literatura con respecto a su eficacia y seguridad, en estudios randomizados y metaanálisis, con tasas de transfusión sanguínea alógena y sangrado perioperatorio muy bajos9–11.
La hipótesis de trabajo fue que el ATX intravenoso en dosis única de 15 mg/kg permitiría evitar la alotransfusión y la autotransfusión sanguínea en PTR primaria.
Material y métodoSe diseñó un estudio observacional prospectivo de la administración del ATX en pacientes intervenidos mediante PTR primaria en los que se utilizó un sistema de RSA, con inicio en noviembre 2013 y finalización en febrero de 2015. Para el cálculo del tamaño muestral se revisaron estudios previos que referían una tasa de autotransfusión del sistema de RSA en PTR del 34%12. Para un nivel de confianza del 95% y un poder estadístico del 90%, y suponiendo una tasa máxima de autotransfusión del sistema de RSA en los pacientes a los que se administrara el ATX del 10%, dados los resultados de disminución del sangrado perioperatorio referido en la literatura13,14, se precisaría de 49 pacientes en cada grupo. La aleatorización de los pacientes se realizó mediante el método para asignación aleatoria balanceada realizado previamente por un estadístico. Se enumeraron sobres opacos sellados, uno por cada sujeto de la muestra, que abría en quirófano el anestesista, en el momento de determinar si se administraba el ATX en suero fisiológico o solo el suero fisiológico.
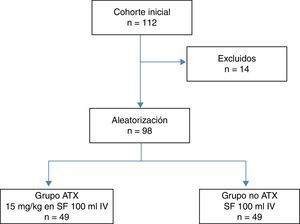
Durante dicho período se incluyeron en el estudio 112 pacientes con diagnóstico de gonartrosis e indicación de PTR. Como criterios de exclusión del estudio se establecieron la alergia al ATX, cardiopatía isquémica severa, insuficiencia renal severa, insuficiencia pulmonar severa, fallo hepático, enfermedad hematológica, retinopatía, rechazo en la administración de sangre alógena, INR> 1,4 y antecedente de enfermedad tromboembólica arterial o venosa. El estudio fue aprobado por el Comité Ético del hospital y se obtuvo el consentimiento informado en todos los pacientes.
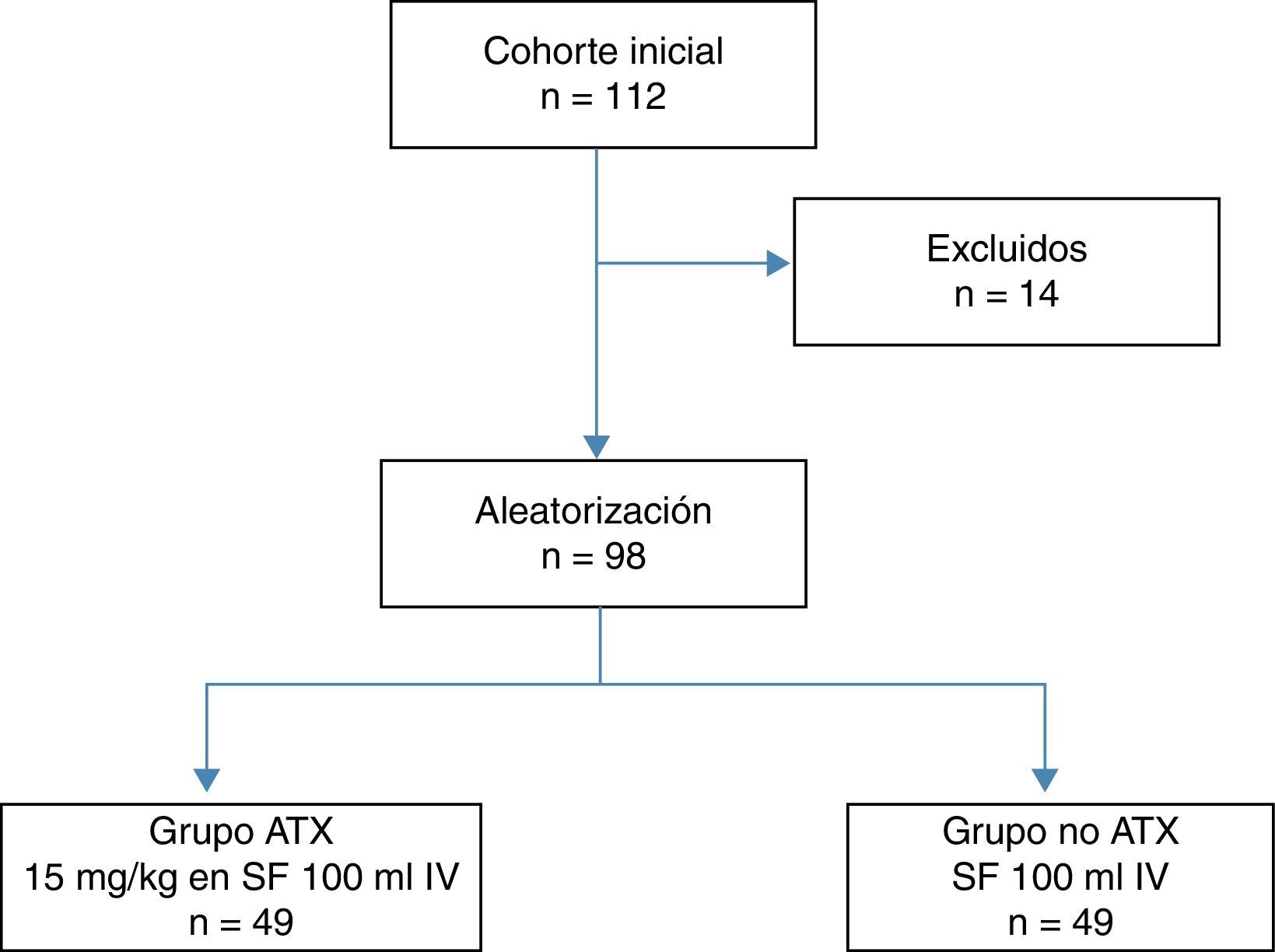
Del total de pacientes se excluyeron 14: 6 por comorbilidades severas, 4 por consumo de dicumarínicos y 4 por antecedente de enfermedad tromboembólica, con 98 pacientes restantes que constituyeron la cohorte de estudio, la cual se distribuyó en dos grupos de 49 pacientes según la exposición a la administración intravenosa del ATX (fig. 1). Un grupo de pacientes recibió una dosis intravenosa de 15 mg/kg de ATX (Anchafibrin®, Rottapharm) en suero fisiológico de 100ml entre 15 y 20 min antes de la retirada de la isquemia. Y en el otro grupo de pacientes se administró un suero fisiológico de 100ml entre 15 y 20 min antes de la retirada de la isquemia. En todos los pacientes se utilizó el sistema de RSA Bellovac® (sistema ABT del grupo Wellspect), para la reposición de sangre perdida durante la intervención quirúrgica. El tiempo límite de recogida y reinfusión de la sangre fueron entre las 4 y las 6 h tras la cirugía, y se reutilizaron cantidades superiores a 400ml e inferiores a 1.000ml.
Todas las cirugías fueron realizadas por tres cirujanos ortopédicos con experiencia en PTR por abordaje parapatelar interno bajo raquianestesia. El modelo de PTR fue idéntica en todos los pacientes (Genesis®, Smith and Nephew) estabilizada posteriormente y con los componentes cementados. El cemento utilizado fue Copal® G+C (Heraeus). Se protocolizó el uso de la isquemia de principio a fin de la intervención en todos los pacientes. La isquemia se retiró tras la colocación del vendaje compresivo y una vez colocado el drenaje del sistema de RSA.
En todos los pacientes se realizó bloqueo femoral como medida de control analgésico perioperatorio. Además se pautó analgesia convencional intravenosa durante las primeras 48 h (paracetamol, metamizol y tramadol). La profilaxis antibiótica se realizó con cefazolina o vancomicina preoperatoria y mantenida 24 h postoperatorias, y la antitrombótica con enoxaparina durante 30 días al alta hospitalaria. No se indicaron dosis posteriores en planta de hospitalización de ATX. A las 24 h los pacientes se levantaron al sillón e iniciaron la fisioterapia activa según las indicaciones dadas por el médico rehabilitador. A las 48 h se realizó la cura de la herida, se retiró el sistema de RSA y se autorizó la carga con andador.
Se indicó la transfusión sanguínea si el valor de hemoglobina era menor de 8 g/dl en pacientes asintomáticos sin patología cardíaca y menor de 9 g/dl en pacientes sintomáticos o con patología cardíaca asociada.
La variable principal del estudio fue el número de pacientes que precisaron autotransfusión del sistema de RSA. Como variables secundarias se registraron variables epidemiológicas, hemoglobina y hematocrito pre- y postoperatorios a las 24 y 48 h, sangrado en el sistema de RSA, número de pacientes que precisaron alotransfusión sanguínea, estancia hospitalaria, reingresos y eventos adversos durante los tres meses postoperatorios relacionados con el uso del ATX. También se determinó la incidencia del uso del ATX en el ahorro del coste del proceso asistencial. El seguimiento de los pacientes fue de 3 meses desde la intervención.
Para estimar la pérdida sanguínea en la cirugía se utilizaron dos métodos. El primero fue la determinación del sangrado en el sistema de RSA. El segundo consistió en la aplicación de la fórmula de Mercuriali basándonos en el hematocrito preoperatorio y el hematocrito a las 48 h15.
Para la recogida de datos y su posterior procesamiento su utilizó el programa SPSS 17.0 para Windows. Para determinar la distribución normal se usó la prueba de Kolmogorov-Smirnov. Se aplicó el test de Fisher para el contraste de variables cualitativas y la prueba de la «t» de Student para la comparación de medias de muestras independientes de las variables numéricas con distribución normal. Se consideró significativo un valor de p igual o menor de 0,05.
ResultadosNo se registraron pérdidas durante el seguimiento.
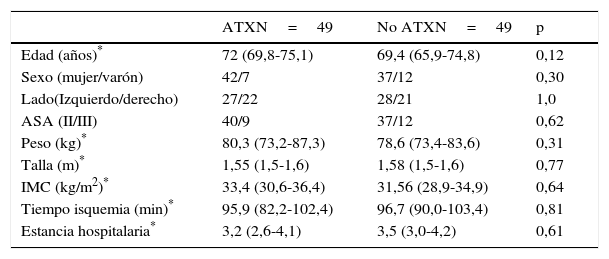
No hubo diferencias significativas entre ambos grupos con respecto a la edad, sexo, lado, grado ASA, peso, talla, IMC, tiempo medio de isquemia durante la intervención y estancia hospitalaria (tabla 1).
Datos generales de la serie
| ATXN=49 | No ATXN=49 | p | |
|---|---|---|---|
| Edad (años)* | 72 (69,8-75,1) | 69,4 (65,9-74,8) | 0,12 |
| Sexo (mujer/varón) | 42/7 | 37/12 | 0,30 |
| Lado(Izquierdo/derecho) | 27/22 | 28/21 | 1,0 |
| ASA (II/III) | 40/9 | 37/12 | 0,62 |
| Peso (kg)* | 80,3 (73,2-87,3) | 78,6 (73,4-83,6) | 0,31 |
| Talla (m)* | 1,55 (1,5-1,6) | 1,58 (1,5-1,6) | 0,77 |
| IMC (kg/m2)* | 33,4 (30,6-36,4) | 31,56 (28,9-34,9) | 0,64 |
| Tiempo isquemia (min)* | 95,9 (82,2-102,4) | 96,7 (90,0-103,4) | 0,81 |
| Estancia hospitalaria* | 3,2 (2,6-4,1) | 3,5 (3,0-4,2) | 0,61 |
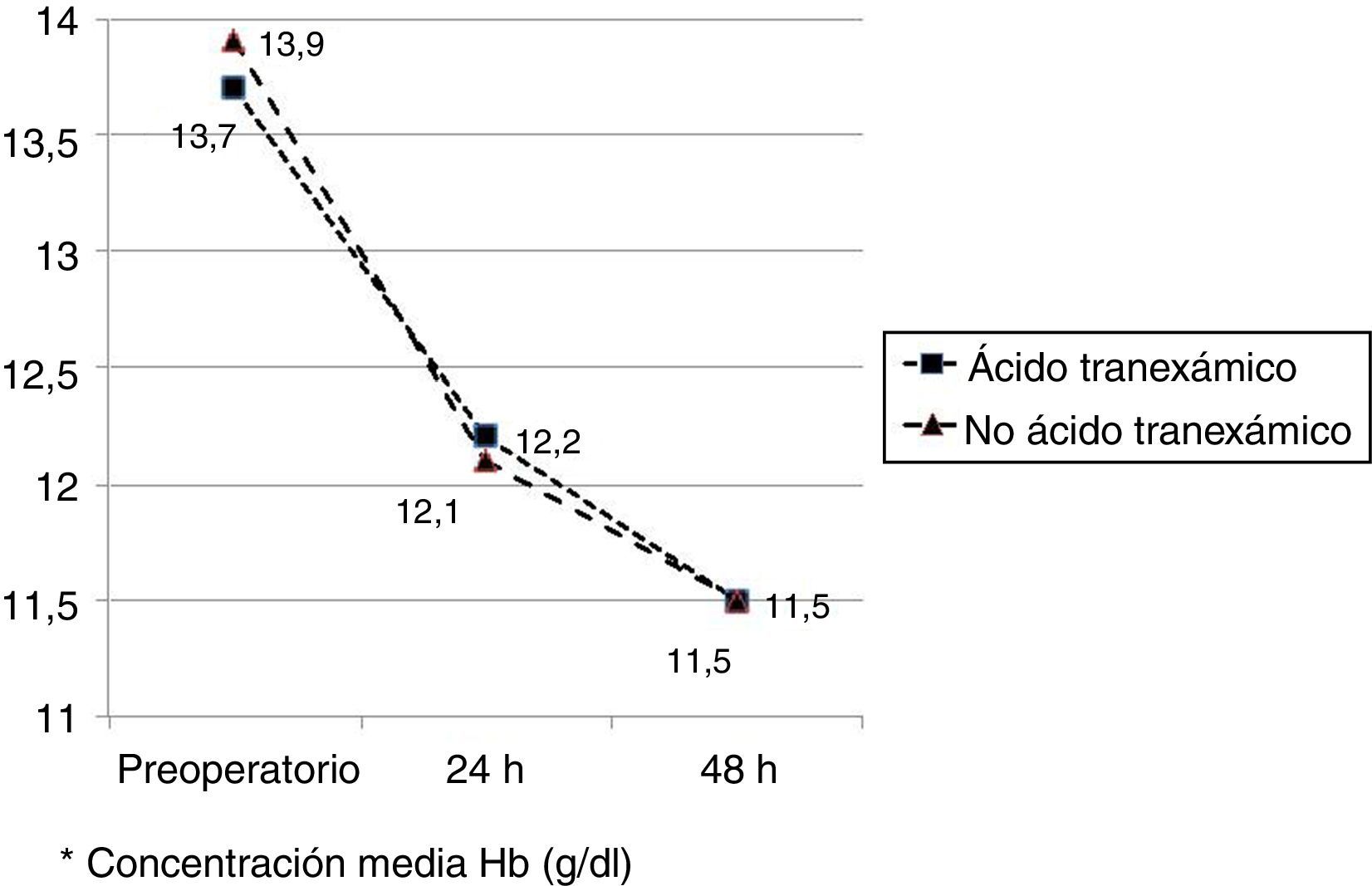
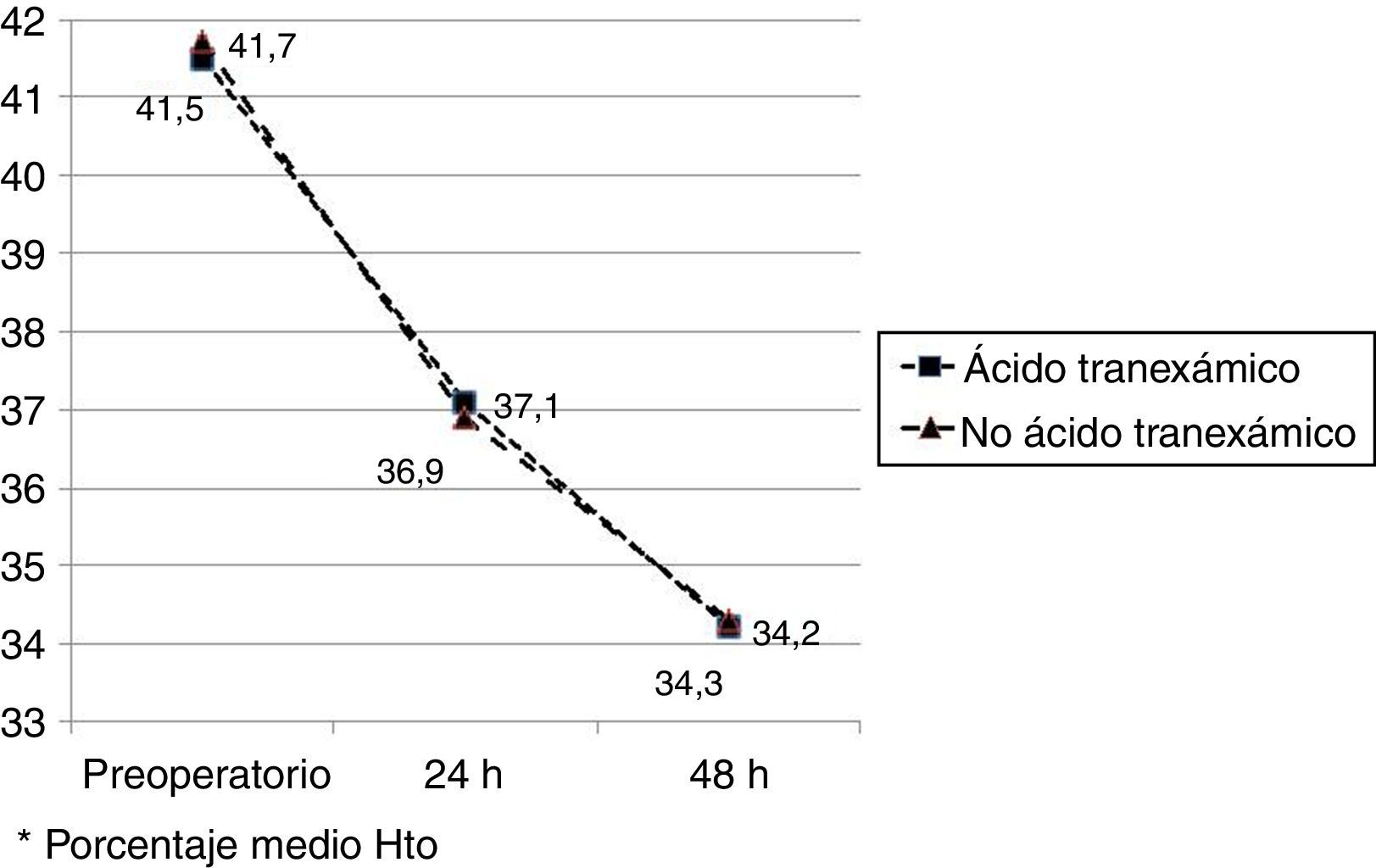
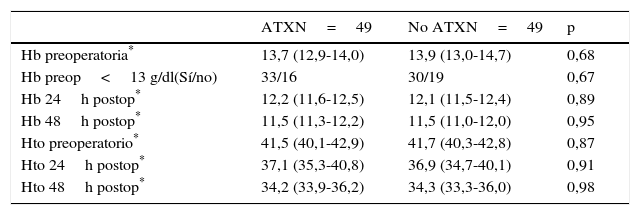
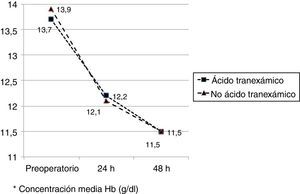
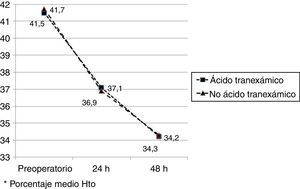
Los valores medios de hemoglobina y hematocrito preoperatorios y postoperatorios eran similares en ambos grupos. En 33 pacientes (67,3%) de los pacientes a los que se había administrado ATX y en 30 pacientes (61,2%) a los que no se había administrado ATX, el valor de la hemoglobina preoperatoria era menor de 13 g/dl, sin ser las diferencias significativas. El descenso medio en el valor de hemoglobina y hematocrito postoperatorio fue similar entre ambos grupos. A las 24 fue de 1,6 y 4,4 puntos en el grupo de pacientes tratados con ATX; y 1,7 y 4,8 puntos en el grupo a los que no se había administrado; y a las 48 h 2,2 y 2,9; y 2,4 y 2,6 respectivamente. (tabla 2, figs. 2 y 3).
Niveles de hemoglobina y hematocrito
| ATXN=49 | No ATXN=49 | p | |
|---|---|---|---|
| Hb preoperatoria* | 13,7 (12,9-14,0) | 13,9 (13,0-14,7) | 0,68 |
| Hb preop<13 g/dl(Sí/no) | 33/16 | 30/19 | 0,67 |
| Hb 24h postop* | 12,2 (11,6-12,5) | 12,1 (11,5-12,4) | 0,89 |
| Hb 48h postop* | 11,5 (11,3-12,2) | 11,5 (11,0-12,0) | 0,95 |
| Hto preoperatorio* | 41,5 (40,1-42,9) | 41,7 (40,3-42,8) | 0,87 |
| Hto 24h postop* | 37,1 (35,3-40,8) | 36,9 (34,7-40,1) | 0,91 |
| Hto 48h postop* | 34,2 (33,9-36,2) | 34,3 (33,3-36,0) | 0,98 |
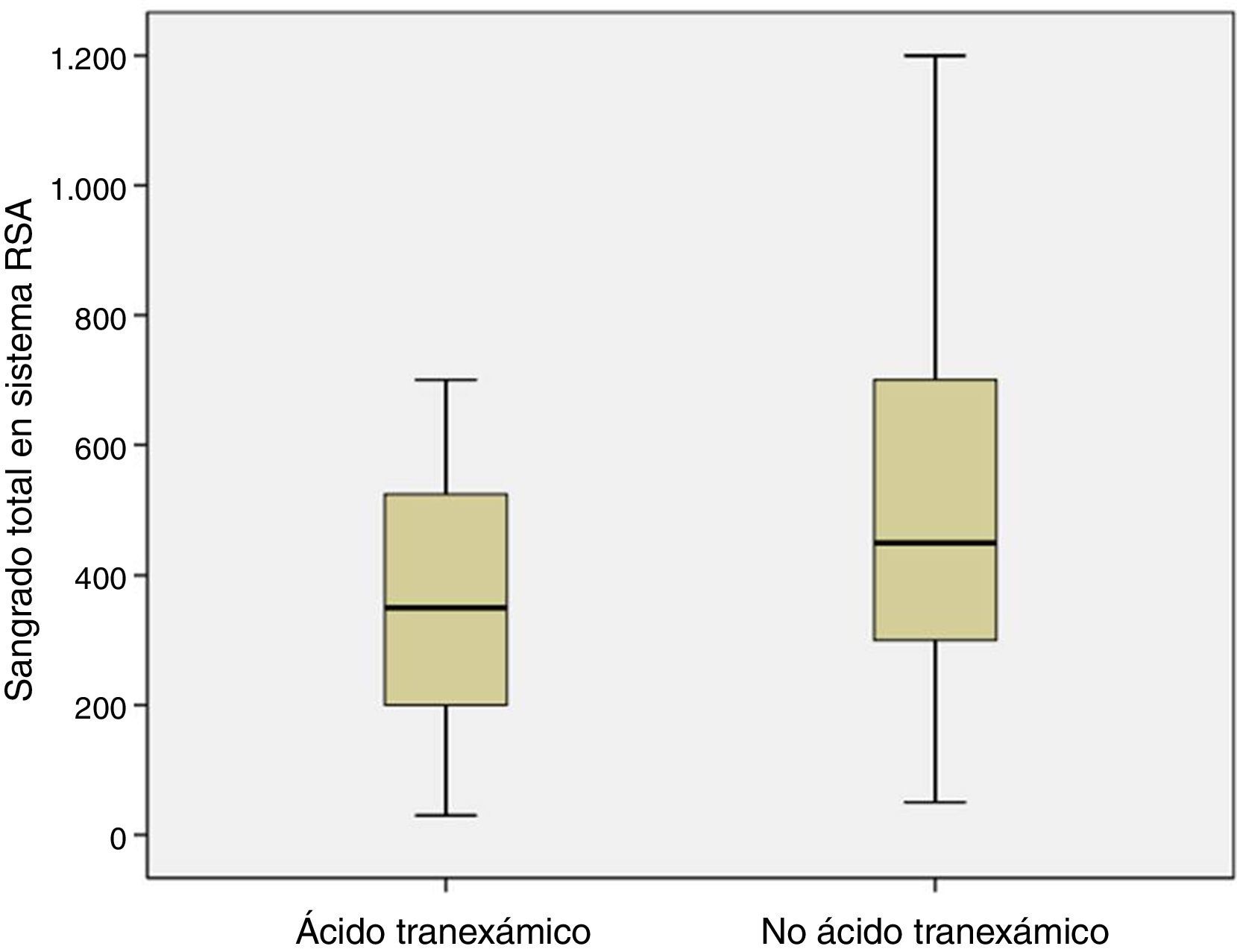
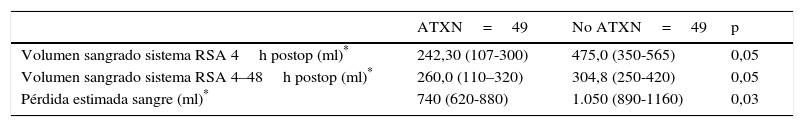
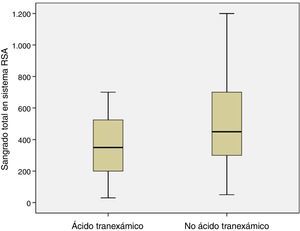
El volumen medio de sangrado en el sistema de RSA a las 4 h postoperatorias fue menor en los pacientes a los que se había administrado ATX que en los pacientes a los que no se había administrado (p=0,05). El sangrado medio en el sistema de RSA entre las 4 h y las 48 h postoperatorias también fue menor en el grupo de pacientes a los que se administró ATX frente a los pacientes a los que no se había administrado (p=0,05). Y la pérdida media estimada de sangre fue menor en el grupo de pacientes a los que se administró ATX frente a los pacientes a los que no se había administrado (p=0,03) (tabla 3, fig. 4).
Ningún paciente del grupo en el que se administró ATX precisó autotransfusión sanguínea por sangrado mayor de 400ml en las primeras 4 h postoperatorias, frente a 39 (69,3%) pacientes en el grupo que no se había administrado (p<0,001). No se precisó alotransfusión sanguínea en los pacientes de la cohorte.
Dos pacientes (4,0%) presentaron hipotensión arterial durante la reinfusión de sangre autóloga, sin posteriores secuelas. No se registraron síntomas ni signos clínicos de complicación tromboembólica durante el ingreso hospitalario ni en el seguimiento durante los tres primeros meses postoperatorios. Ningún paciente reingresó durante los primeros tres meses tras la cirugía.
DiscusiónEl hallazgo más importante de nuestro estudio es que la administración de una dosis única intravenosa de 15 mg/kg de ATX en PTR primaria ha asociado una tasa de no transfusión autóloga ni alogénica del 100%, sin presentar complicaciones tromboembólicas en los tres primeros meses tras la cirugía.
El grupo de los antifibrinolíticos utilizados como medida de ahorro de sangre en la PTR incluye la aprotinina, el ácido épsilon aminocaproico y el ATX. La aprotinina ha demostrado su eficacia en estudios publicados16. Pero fue retirada del mercado al ponerse en duda el balance beneficio-riesgo en pacientes sometidos a cirugía cardíaca extracorpórea. El ácido épsilon aminocaproico también reduce el sangrado y las necesidades transfusionales en la PTR17, aunque los resultados de un metaanálisis no lo confirman18 y el documento Sevilla 2013 no recomienda su administración para disminuir el sangrado y/o la tasa transfusional en cirugía ortopédica con una evidencia 1B4. Y su potencia es 10 veces menor que la del ATX4,19.
Existe controversia en la utilización del ATX como medida de disminución del sangrado perioperatorio en cirugía ortopédica al no estar incluida como indicación en ficha técnica20. En consecuencia necesita de justificación de su uso en la historia clínica y el consentimiento informado del paciente19, lo cual realizamos en nuestro estudio.
En la bibliográfía se observa una gran variabilidad en cuanto a la dosis y pauta de utilización de ATX9,21,22. La mayoría de los estudios refieren dosis intraoperatoria inicial entre 10 y 25 mg/kg, seguida o no de dosis postoperatorias. Hourlier23 compara el uso de una dosis única de 30 mg/kg con una dosis de 10 mg/kg seguido de infusión continua de 2 mg/kg por hora durante 20 h, sin diferencias en cuanto a eficacia y seguridad, aunque en cirugía protésica de cadera. Alshryda21 indica en su metaanálisis que la reducción en la necesidad de alotransfusión se mantiene independiente de si se utiliza una dosis única o múltiple. Y Aguilera7 aconseja dosis intravenosas fijas de 1 a 2 g para evitar errores de cálculo o sobredosificación. Por otro lado, recientes artículos han iniciado otra línea de investigación mediante la administración intraarticular de ATX con resultados no inferiores a la administración intravenosa24,25. En nuestro estudio se utilizó una dosis única intravenosa de 15mg/kg de ATX entre 15 y 20 min antes de la retirada de la isquemia.
La reducción en el sangrado en redón, la pérdida estimada de sangre y la necesidad de alotransfusión sanguínea es un resultado común en los estudios consultados de serie de casos14,23, y en los metaanálisis9,21,26. Poeran10 realiza un estudio retrospectivo en 510 hospitales de EE. UU. con 872.416 pacientes intervenidos de cirugía protésica primaria de rodilla o cadera con disminución significativa (7,7% frente a 21%) de la necesidad de autotransfusión o alotransfusión sanguínea. Para calcular la pérdida estimada de sangre se describen varias fórmulas en la literatura15. En nuestro estudio hemos utilizado la fórmula de Mercuriali, aunque con los valores de hematocrito y hemoglobina a las 48 h, que son menos precisos por la hemodilución que a los 5 días, lo cual es una limitación a tener en cuenta. El volumen de sangre recogido en el sistema de RSA experimentó una reducción del 35,5% en los pacientes tratados con ATX, la pérdida estimada de sangre una reducción del 29,5% y ningún paciente precisó de alotransfusión sanguínea.
La seguridad en la utilización del ATX en cirugía protésica primaria de rodilla genera incertidumbre por los factores de riesgo de enfermedad tromboembólica. Poeran10 no refiere mayor incidencia significativa de complicaciones tromboembólicas en los pacientes tratados con ATX en su estudio retrospectivo (0,6% frente a 0,8%). Gillete27 revisa retrospectivamente 2.046 pacientes intervenidos de cirugía primaria de cadera o rodilla a los que se administró ATX; con aspirina, warfarina y dalteparina como profilaxis tromboembólica, y sin diferencias significativas entre los tres grupos (0,35%; 0,15%; 0,52%). Y Whiting28 valora retrospectivamente 402 pacientes ASA III y IV; 240 a los que se administró ATX durante la cirugía protésica de cadera o rodilla, y 162 a los que no se administró, con una incidencia de complicaciones tromboembólicas de 2,5% frente al 2,6%. En nuestro estudio no se han detectado síntomas ni signos de complicación tromboembólica, si bien no hemos realizado de manera rutinaria Doppler venoso para detectar la presencia de tromboembolismo subclínico.
El nivel óptimo de Hb previa a la PTR que minimiza el riesgo de transfusión es de 13g/dl19. Según criterios de la OMS, niveles subóptimos se presentan hasta en un 30% de los pacientes COT29. Dos medidas se recomiendan para su corrección. Por una lado, si se trata de una anemia ferropénica, la ferroterapia, por su bajo coste y fácil administración, con un grado de recomendación 2B19, pero siempre que haya una buena tolerancia por el paciente y se disponga del tiempo necesario para conseguir la corrección adecuada. Y por otro la eritropoyetina humana recombinante, con protocolos de administración que presenta un grado de recomendación 1A19 para la reducción de la transfusión alogénica, y siempre que se disponga del tiempo preoperatorio adecuado. En nuestra serie, 63 pacientes (64,2%) presentaban niveles subóptimos de Hb preoperatoria, sin haber aplicado ninguna de las recomendaciones para su corrección por falta de tiempo entre la valoración preanestésica y la fecha señalada para la intervención. Tanto la administración de ATX como el uso del sistema de RSA han evitado la necesidad de transfusión alogénica en este grupo de pacientes de riesgo.
El impacto económico en el proceso asistencial es un impulsor del uso del ATX en PTR. El coste total de una ampolla de ATX de 1 g es de 21 euros, de un sistema de RSA no lavada entre 96 y 151 euros, de una unidad de concentrado de hematíes de 243 euros, de 1.000 mg de hierro intravenoso entre 220 y 285 euros, y de 40.000 U de eritropoyetina humana recombinante de 235 euros; sin tener en cuenta la mayor estancia hospitalaria por la necesidad de transfusión sanguínea19. En nuestra serie ningún paciente ha precisado alotransfusión sanguínea, bien por el uso del ATX intravenoso en dosis única o bien por el uso del sistema de RSA; y no se ha incrementado la estancia hospitalaria. Por ello hemos modificado en nuestro servicio el protocolo multimodal para reducir la tasa de transfusión alogénica en pacientes intervenidos mediante PTR, de modo que en los pacientes en los que está indicado el uso del ATX, no se utiliza un sistema de RSA.
Actualmente la Sociedad Española de Anestesiología y Reanimación recomienda en su Documento Sevilla 20134 la RSA en artroplastia de rodilla con un grado de recomendación 1B, y el uso del ATX con un grado de recomendación 2A en cirugía ortopédica. Y la Sociedad Europea de Anestesiología y Reanimación22 un grado de recomendación 1A y 2A respectivamente.
Con las limitaciones de nuestro estudio, el uso de una dosis única de 15 mg/kg de ATX intravenoso en PTR primaria ha presentado una tasa de no autotransfusión ni alotransfusión sanguínea del 100%, sin aumento en la incidencia de eventos trombóticos. Por ello recomendamos su utilización en este grupo de pacientes, con una indicación que debe ser individualizada, justificar su uso en la historia clínica y precisar del consentimiento informado del paciente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónLos autores declaran que no han tenido financiación alguna.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.