La remodelación ósea periprotésica tras la implantación de un vástago femoral no cementado es atribuible a factores mecánicos y biológicos, en respuesta a la nueva situación biomecánica que determina la prótesis. Entre los primeros se conoce la influencia del tamaño, geometría y rigidez del implante, el tipo de aleación utilizada, si se trata de un diseño de anclaje metafisario, diafisario o total, el tipo y extensión del recubrimiento y la configuración recta o anatómica1-4. Entre los biológicos se considera fundamental la calidad de la fijación primaria obtenida, la carga a la que se somete el implante, así como la masa ósea inicial que determina la rigidez ósea del fémur proximal5. No obstante, la influencia de cada uno de estos factores varía en cada paciente y es difícil atribuir a alguno de ellos las diferencias en el remodelado que a veces se aprecian entre pacientes inicialmente semejantes.
La evaluación del remodelado óseo en el seguimiento habitual de los pacientes protetizados se lleva a cabo mediante controles radiográficos seriados. Sin embargo, esta técnica se ve influida por variables como el tipo de película utilizada, la técnica de exposición, la distancia al objetivo y la exposición del fémur; asumiendo que se detectan cambios cuando la variación de masa ósea alcanza el 30%-40%4. La incorporación de la densitometría ósea (DEXA) al estudio del remodelado periprotésico ha permitido detectar y cuantificar de forma reproducible estos cambios, y actualmente es la técnica de elección para determinar los cambios de masa ósea a lo largo del tiempo5-8.
Dadas las numerosas variables que influyen en el remodelado óseo es excepcional poder estudiar alguna de ellas de forma aislada in vivo. Son pocos los estudios que comparan la evolución de la masa ósea en un grupo de pacientes con variables homogéneas en los que se implantan vástagos con diferencias en su geometría, diseño o zona de anclaje y permitir así estudiar la influencia de esa variación en el remodelado, de forma aislada. Con ese objetivo se diseñó un estudio prospectivo en el que dos grupos de pacientes, de características clínicas y biológicas semejantes, fueron protetizados usando los dos diseños del vástago ABG. Mediante densitometría ósea se han determinado los cambios acaecidos a lo largo del primer año postoperatorio y se han cuantificado las diferencias en el remodelado atribuibles a los cambios en el diseño.
MATERIAL Y MÉTODO
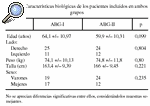
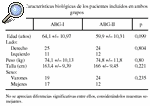
Para el estudio del remodelado periprotésico femoral en torno a los dos modelos de vástago ABG (ABG-I y ABG-II) se diseñó un estudio prospectivo, en el que se utilizó la masa ósea de la cadera sana como control. Los pacientes eran asignados a un equipo quirúrgico según el día que acudían por primera vez a consulta. El primer equipo utilizó el vástago ABG-I y el segundo el ABG-II. Se utilizó como criterio de evolución la variación de la masa ósea en las 7 áreas de Gruen, tanto de la cadera enferma como de la sana, utilizada como control. Las determinaciones de masa ósea se realizaron con el densitómetro HOLOGIC QDR 1000, en ambas caderas en el preoperatorio y al año postoperatorio, y en la enferma, además, a los 15 días y a los 6 meses de la intervención. Para la fiabilidad de las exploraciones se consideró fundamental la colocación del paciente, por lo que se diseñó un protocolo de colocación. Los pacientes se colocaban en posición supina sobre la tabla del escáner, con las rodillas y caderas en extensión y todo el miembro en posición neutra apoyado sobre un dispositivo de plástico rígido al que se fijaba con cintas de velcro. Los criterios de inclusión en el estudio fueron el tener indicación para este tipo de implante en pacientes afectos de coxartrosis primaria, la cadera contralateral sana y la aceptación de participar en el estudio. De este modo, se incluyeron en cada grupo 36 pacientes, sin apreciarse entre ellos diferencias significativas respecto a la edad, sexo, lateralidad, peso y talla (tabla 1). La recogida de datos se realizó mediante la anamnesis y la historia clínica. Las características técnicas del densitómetro utilizado son: error de precisión en fémur 1,5% a 2%; error de exactitud 2% a 4%, hasta un 10% en pacientes obesos; radiación al paciente menor de 3mRem, tiempo de exploración 8 minutos y error debido a la variabilidad interexplorador entre 1,6%-2%6,7.
Los implantes utilizados (fig. 1) fueron las dos versiones del vástago ABG (Howmedica), I y II. Se trata de un vástago anatómico no cementado, de anclaje metafisario por ajuste a presión y fabricado en titanio. A nivel metafisario presenta un diseño anterior y posterior en forma de escamas para aumentar la estabilidad del implante y, a ese nivel, está recubierto de hidroxiapatita. La cola del implante es delgada y corta, evitando el contacto endomedular con la diáfisis. Las diferencias introducidas en el vástago ABG-II son: discreto ensanchamiento anteroposterior metafisario, cola más corta, de menor diámetro y ultrapulida para evitar el anclaje óseo a este nivel y el contacto endomedular; todo ello con objeto de conseguir una transferencia de cargas a nivel proximal y evitar la atrofia ósea por puenteo de fuerzas, así como la incidencia de dolor en el muslo.
Figura 1. Imagen de los dos implantes utilizados. El vástago ABG-II (izquierda) muestra mayor diámetro metafisario anteroposterior, y una cola más corta, delgada y pulida que el vástago ABG-I (derecha).
La intervención se llevó a cabo en todos los casos mediante un abordaje posteroexterno con el paciente en posición decúbito lateral. Tras la artrotomía y la luxación de la cabeza femoral, la osteotomía se realizaba a 30° a partir de la fosita digital, intentando preservar la vascularización e inervación del cuello femoral. La preparación se llevaba a cabo con raspas sucesivas y un fresado diafisario de, al menos, 2 mm mayor que el diámetro de la cola del vástago. Se elegía el implante que consiguiera un bloqueo satisfactorio en la metáfisis femoral, buscando dejar un manguito de hueso esponjoso alrededor del implante, al menos en la zona del cálcar. En el postoperatorio inmediato, se autorizaba el apoyo parcial a partir del cuarto día, los pacientes abandonaban el bastón a las 6 semanas y se autorizaba la marcha sin ayuda a los tres meses.
Para la comparación de porcentajes se utilizó la prueba Chi cuadrado, para las medias la «t» de Student-Fisher para datos libres o apareados, según conviniera y el coeficiente de correlación de Pearson.
RESULTADOS
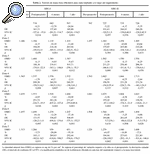
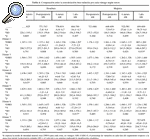
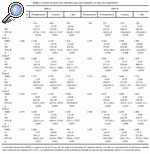
La evolución de la masa ósea en estos dos grupos de pacientes a lo largo del primer año postoperatorio se recoge en las tablas 2 y 3. Se apreció una pérdida ósea generalizada en torno a ambos implantes al cabo de los 12 meses, pero fue más llamativa en el implante ABG-I, que ya era evidente a los 6 meses. De este modo, con el vástago ABG-I, la variación de la masa ósea a los 6 meses oscilaba entre el +0,7% en la zona 4 al 26,96% en la zona 7; en contraste estuvo lo observado con el ABG-II, cuya modificación osciló entre +0,08% en la zona 2 al 14,89% en la zona 7. En ese momento ya existían diferencias significativas en dos zonas, que pasaron a serlo en las 7 zonas a los 12 meses. Al final del primer año la pérdida ósea en torno al vástago ABG-I oscilaba entre el 2,11% en la zona 4 al 35,19% en zona 7, mientras que para el vástago ABG-II la variación osciló entre +0,64% en la zona 2 a 17,9% en la zona 7.
Para completar la investigación se estudiaron los cambios de masa ósea en torno a estos implantes para varones y para mujeres. Para la población masculina la variación de masa ósea a lo largo del seguimiento apenas mostró diferencias entre ambos tipos de vástago; únicamente en la zona 6 se apreciaban diferencias significativas a los 12 meses.
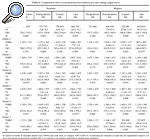
Sin embargo, en el grupo de mujeres, de entrada con fémures más pequeños y con menor masa ósea inicial, se observó al final del seguimiento que la pérdida periprotésica fue menor con el vástago ABG-II, con diferencias significativas en las zonas 2, 3, 4 y 6 (tabla 4).
Finalmente, respecto a la evolución de la masa ósea de la cadera sana, tomada como control, se observó que las variaciones oscilaron entre 0,96% a 3,51% al final de los 12 meses, sin ser significativa en ninguna de las 7 áreas, atribuyéndose este leve descenso al reposo parcial de las primeras semanas y a la pérdida ósea involutiva.
DISCUSION
La pérdida de masa ósea tras la implantación de una prótesis total de cadera es un hecho cuantificado desde las observaciones de Kilgus et al6, quienes ya apreciaron densitométricamente descensos del 20% al 34,8% en pacientes portadores de prótesis no cementadas, seguidos entre 1 a 7 años. Pritchett et al9 compararon 50 vástagos con 5 diseños diferentes a los 3 años de implantación mediante DEXA, observando descensos del 8% al 57%, según el implante, pero siempre de predominio proximal. Con vástagos hechos a medida Martini et al10 detectan mediante DEXA una pérdida ósea entre 5% a 21,1% a los 21 meses, siendo el cálcar la zona más afectada. Vidalain et al11, con vástagos recubiertos de hidroxiapatita determinan mediante DEXA una pérdida del 22% de masa ósea en la zona 7 ya al tercer mes, que alcanza el 41% al final del año. En nuestro país, Vidal et al12 detectan pérdidas del 31% en cálcar y del 20,5% en trocánter mayor a los 6 meses. Comparando vástagos a medida frente a vástagos estándar Zerahn et al13 encuentran pérdidas óseas sensiblemente menores en los primeros, que alcanzan el 11,9% a los 12-38 meses de seguimiento. Con el vástago Zweymueller, Korovessis et al14 encuentran un descenso del 32% en la zona del trocánter menor y del 18,6% en la zona 4 a los 12 meses de la intervención. La conclusión que puede extraerse de la bibliografía es que la pérdida ósea periprotésica es un fenómeno que afecta a todos los implantes, con un gradiente de proximal a distal, que se inicia precozmente (en torno al tercer mes, coincidiendo con el apoyo completo de la extremidad) y perdura hasta el segundo o tercer año.
Respecto a los factores dependientes del implante que influyen en la intensidad y localización de este remodelado se ha observado que el diseño y la geometría tienen un papel relevante. Los vástagos no cementados pueden tener collar o no, ser de diseño recto, anatómico o en cuña, poseer una geometría que les haga de apoyo metafisario o de apoyo completo, con recubrimiento poroso a nivel exclusivamente proximal o completo, porosos, mallados o recubiertos de hidroxiapatita, de ajuste línea a línea, por press-fit o encaje en forma de cuña1-3,5. Todos ellos se han relacionado con una pérdida variable de masa ósea periprotésica, con pérdida ósea proximal por atrofia debida al puenteo de fuerzas y por asociar un porcentaje de pacientes con dolor en muslo atribuido al efecto punta15. El diseño del vástago ABG-I buscaba minimizar estos problemas, pero estudios previos han mostrado que fueron alcanzados sólo en parte16. Las cifras de pérdida ósea al año de evolución obtenidas en este estudio coinciden con las aportadas por otros autores. Entre ellos, Massari et al17 aprecian una pérdida del 3,8% al 32,3% con mayor afectación proximal. Otros estudios han demostrado la existencia de atrofia proximal y persiste un porcentaje bajo de pacientes (en torno al 4%) con dolor en el muslo. Los cambios introducidos en el modelo ABG-II buscaban mejorar estos resultados. El aumentar el tamaño anteroposterior del implante pretende un mayor relleno metafisario, más adaptado a la anatomía femoral a ese nivel y con mejor transmisión de las cargas de torsión entre el implante y el fémur. La cola del implante, más delgada, breve y pulida, busca minimizar el contacto endostal y el efecto punta, así como no ser zona de anclaje óseo, que queda limitado a la zona metafisaria (zonas 1 y 7, y la parte proximal de las zonas 2 y 6). De esta manera parece haberse conseguido un anclaje verdaderamente metafisario, estable y suficiente para una transmisión eficaz de cargas entre el implante y el fémur capaz de promover la conservación ósea en zonas proximales y distales. El presente estudio muestra que la pérdida ósea durante el primer año postoperatorio es sensiblemente menor en el modelo ABG II, con cifras semejantes a los mejores resultados obtenidos con vástagos fabricados a medida. Queda por ver en estudios posteriores si será capaz de evitar la atrofia del fémur proximal y la incidencia de dolor en el muslo.
Las diferencias observadas entre sexos con el uso de estos implantes pueden justificarse por la diferencia en el contenido mineral inicial y el módulo óseo femoral. Otros autores han descrito ya un patrón de remodelado distinto entre sexos, encontrando una pérdida ósea significativamente mayor en mujeres, aunque con el mismo gradiente de proximal a distal1. En mujeres, con fémures más pequeños, una menor masa ósea inicial y un hueso más porótico se apreciaban mayores cambios resortivos a nivel proximal y distal en comparación con los varones, usando el mismo tipo de implante. Sin embargo, en este estudio se ha observado una pérdida ósea menor en las pacientes que recibieron un vástago ABG-II. Dado que la transmisión de cargas entre el implante y el fémur se efectúa en la zona en que se alcanza un equilibrio entre la rigidez del implante y la rigidez del fémur, parece que el diseño de este nuevo vástago traslada a áreas más proximales la transferencia de cargas. Esto permite a estas pacientes mantener el estímulo fisiológico para la conservación ósea en zonas más proximales que en el vástago ABG-I que, al parecer, se situaba en la zona de transición metafiso-diafisaria. En varones, con fémures más grandes y con mayor contenido mineral, la transferencia de cargas parece llevarse a cabo en ambos vástagos en la parte más proximal del fémur, sin apreciarse diferencias entre implantes.
En conclusión, los cambios introducidos en el diseño del vástago ABG parecen conseguir un anclaje metafisario eficaz, capaz de transmitir cargas al fémur proximal que minimizan la atrofia ósea a ese nivel y son estímulo suficiente para la conservación ósea en zonas más distales. Obtiene cifras de remodelado óseo semejantes a los vástagos hechos a medida a partir de tomografía axial computarizada (TAC) previas. Parecen especialmente indicados en mujeres en quienes es deseable evitar el uso de vástagos grandes o de anclaje más distal que pueden conducir a una mayor atrofia ósea proximal, y que no sean candidatas a implantes cementados.
Conflicto de intereses. Los autores no hemos recibido ayuda económica alguna para la realización de este trabajo. Tampoco hemos firmado ningún acuerdo por el que vayamos a recibir beneficios u honorarios por parte de alguna entidad comercial. Por otra parte, ninguna entidad comercial ha pagado ni pagará a fundaciones, instituciones educativas u otras organizaciones sin ánimo de lucro a las que estemos afiliados.