La espectrometría de masas en tándem (MS-MS) ha permitido ampliar el alcance del cribado neonatal. Eso hace más complicado determinar el momento más adecuado para la toma de muestra, sobre todo en recién nacidos prematuros y/o bajo peso y/o ingresados en unidades neonatales. El objetivo del presente estudio ha sido revisar las normas de toma de muestra de los distintos programas en estas situaciones, a nivel nacional e internacional.
Se obtienen los datos a través de páginas web de salud pública, de plataformas de búsqueda o por contacto con los centros.
Existe gran disparidad de criterios para la toma de una nueva muestra, incluso dentro de un mismo país. La limitación de información disponible, hizo imposible obtener resultados de muchos países, en particular de África, Asia o Latinoamérica.
A pesar de que cada vez más estados se acogen a las recomendaciones del Clinical and Laboratory Standards Institute u otros organismos internacionales, el aumento del coste que implica, hace muy difícil conseguir la estandarización.
The most significant breakthrough in the newborn screening (NBS) programs was the introduction of the tandem mass spectrometry (MS-MS) to the laboratory, which makes it possible to detect multiple disorders. However, it is difficult to choose the ideal time for the specimen collection, particularly in preterm, low birth weight, and sick newborns.
The aim of this study was to revise the protocols, in national and international programs for specimen collection in these newborns.
Data were collected from web pages of public health, internet searches, and contact with the laboratories.
The results showed a great disparity in criteria for a new specimen collection, as well as among different centres within a country. It has been difficult to obtain this information from many countries in Africa, Asia, and Latin America.
Although an increasing number of laboratories follow the recommendations of the Clinical and Laboratory Standards Institute or other international guidelines, the increased cost involved makes standardisation difficult.
El principal objetivo de los programas de cribado neonatal, es detectar a aquellos neonatos susceptibles de padecer alguna de las patologías incluidas en su cartera de servicios.
La aplicación de la espectrometría de masas en tándem al cribado neonatal y los avances terapéuticos han permitido que sean cada vez más las patologías incluidas en dichos programas1. Son condiciones básicas de dichos programas, establecer el momento adecuado para la toma de muestra y los puntos de corte para cada marcador de enfermedad, en el momento de dicha extracción.
Aunque mayoritariamente está establecido que esta se realice en los laterales del talón, entre las 24 y 72 h de vida del recién nacido (RN), existen bastantes diferencias entre los diferentes programas, no solo de diferentes países, sino incluso dentro de un mismo país. Internacionalmente algunos programas utilizan sangre de cordón, mientras otros utilizan sangre capilar extraída a las pocas h de vida, o hasta los 5-8 días y en la actualidad es una práctica bastante extendida utilizar sangre venosa obtenida del dorso de la mano mediante aguja o palomita2.
Cuantas más patologías se criban, más difícil resulta decidir el momento más adecuado para la toma de muestra, ya que varía en función de cada una de ellas. Cada marcador tiene su propia y mejor «ventana de cribado», definido como el período con más probabilidad de detectar la enfermedad antes de que aparezcan síntomas clínicos o el daño sea irreversible. Para unas patologías 5 días puede ser tarde, p. ej. hiperplasia adrenal congénita (HAC) y para otras 24-48 h demasiado pronto, p. ej. homocistinuria3.
También es complicado obtener los puntos de corte adecuados para este grupo de neonatos, debido a la baja incidencia de la mayoría de las patologías. Cada laboratorio debe determinar los propios, con su metodología y en su población.
Pero si bien estos temas están más o menos resueltos cuando se trata de RN a término, el mayor problema lo tenemos con los RN pretérmino y los de bajo peso, o con aquellos RN enfermos o que requieren permanecer en unidades neonatales de vigilancia.
La prematuridad se define como el nacimiento antes de las 37 semanas de gestación (SG) y el bajo peso el inferior a 2500g. En estos casos los valores de algunos marcadores difieren considerablemente de los que presenta un RN a término. El periodo ventana de muchos marcadores es diferente en estos niños y eso condiciona la toma de muestra. Además los puntos de corte para los RN a término no sirven para estos casos ya que su utilización da lugar a falsos positivos (FP) o falsos negativos (FN). Además muchos de los RN atendidos en las unidades neonatales están con nutrición parenteral o están sometidos a transfusiones, a terapias complejas o cirugía. Todos estos factores afectan de diferente forma las concentraciones de los marcadores utilizados en el cribado, de ahí que debamos ser muy cautelosos a la hora de interpretar los resultados obtenidos3,4.
Todos los programas disponen de protocolos, que contemplan una nueva toma de muestra cuando el RN alcanza el período correspondiente a la edad gestacional a término o por lo menos a los 15 días de la primera extracción, o cuando alcanzan un peso inferior a los 2500g. o cuando no estén sometidos a nutrición parenteral (NP) ni fármacos. También recomiendan que si debe de recibir una transfusión se realice la extracción de la muestra para el cribado antes de esta.
La tasa de RN pretérmino ha aumentado drásticamente en las últimas décadas, alrededor de un 20% desde los 90, situándose entre el 10 y el 13% de todos los nacidos vivos. Al mismo tiempo los avances en neonatología han permitido que la supervivencia de estos RN, incluso nacidos con 23 SG, haya aumentado considerablemente3,5.
ObjetivosLa Comisión de Diagnóstico Perinatal de la Sociedad Española de Medicina de Laboratorio, ante la disparidad de criterios en cuanto a la toma de muestra en prematuros y bajo peso en los diferentes programas y dada la importancia de que se realice en el momento adecuado, decidió revisar los protocolos utilizados por los diferentes programas, no solo a nivel de nuestro país, sino en general, en la comunidad internacional y revisar las recomendaciones que hacen los organismos relacionados con el cribado neonatal para estos casos.
Material y métodosSe ha realizado una búsqueda bibliográfica al respecto, en las páginas web de los programas, publicaciones de divulgación/información y publicaciones científicas. En esta revisión se tornó claro lo difícil que es obtener esta información en algunos de los programas. En nuestro país, no todas las consejerías de salud, de las diferentes Comunidades Autónomas, disponen de una página web para consultar su programa de cribado neonatal ni disponen de un documento oficial al respecto o este es de difícil acceso. Podemos encontrar páginas o folletos informativos, publicaciones en que se detalla cuándo se realiza la extracción de la muestra y dónde, pero los protocolos a seguir en caso de RN prematuros o bajo peso, es difícil encontrarlos. Dicha información se ha obtenido por contacto directo con los responsables de los laboratorios de cribado.
En el ámbito internacional, si bien muchos países en Europa y América del norte tienen programas completamente establecidos, a veces no existen documentos publicados del propio programa. La mayoría disponen de páginas de divulgación y de ayuda a los padres, pero resulta difícil acceder a los protocolos que se salen del cribado estándar y por tanto ver qué criterios aplican en el caso que nos ocupa.
No ha sido posible obtener información de muchos países de Asia, África y Latinoamérica, porque no disponen de programas de cribado neonatal, por el idioma o porque salud pública no dispone en la web de dicha información, ni se encuentra publicada.
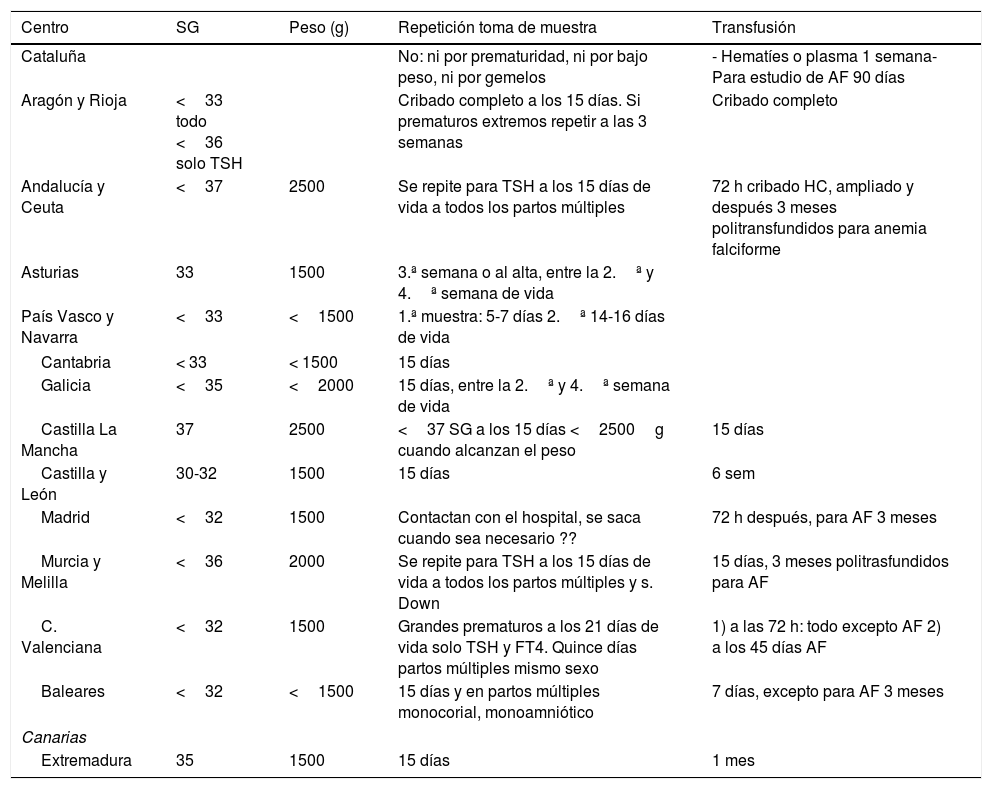
ResultadosEn nuestro país existen 16 Laboratorios de Cribado Neonatal. Andalucía cuenta con dos y el País Vasco realiza el de Navarra. Si bien la mayoría realizan la primera extracción a las 48 h de vida del RN, los protocolos a seguir en caso de prematuros, bajo peso y en caso de transfusión, difieren considerablemente. Se recogen los datos en la tabla 1.
España
| Centro | SG | Peso (g) | Repetición toma de muestra | Transfusión |
|---|---|---|---|---|
| Cataluña | No: ni por prematuridad, ni por bajo peso, ni por gemelos | - Hematíes o plasma 1 semana- Para estudio de AF 90 días | ||
| Aragón y Rioja | <33 todo <36 solo TSH | Cribado completo a los 15 días. Si prematuros extremos repetir a las 3 semanas | Cribado completo | |
| Andalucía y Ceuta | <37 | 2500 | Se repite para TSH a los 15 días de vida a todos los partos múltiples | 72 h cribado HC, ampliado y después 3 meses politransfundidos para anemia falciforme |
| Asturias | 33 | 1500 | 3.ª semana o al alta, entre la 2.ª y 4.ª semana de vida | |
| País Vasco y Navarra | <33 | <1500 | 1.ª muestra: 5-7 días 2.ª 14-16 días de vida | |
| Cantabria | < 33 | < 1500 | 15 días | |
| Galicia | <35 | <2000 | 15 días, entre la 2.ª y 4.ª semana de vida | |
| Castilla La Mancha | 37 | 2500 | <37 SG a los 15 días <2500g cuando alcanzan el peso | 15 días |
| Castilla y León | 30-32 | 1500 | 15 días | 6 sem |
| Madrid | <32 | 1500 | Contactan con el hospital, se saca cuando sea necesario ?? | 72 h después, para AF 3 meses |
| Murcia y Melilla | <36 | 2000 | Se repite para TSH a los 15 días de vida a todos los partos múltiples y s. Down | 15 días, 3 meses politrasfundidos para AF |
| C. Valenciana | <32 | 1500 | Grandes prematuros a los 21 días de vida solo TSH y FT4. Quince días partos múltiples mismo sexo | 1) a las 72 h: todo excepto AF 2) a los 45 días AF |
| Baleares | <32 | <1500 | 15 días y en partos múltiples monocorial, monoamniótico | 7 días, excepto para AF 3 meses |
| Canarias | ||||
| Extremadura | 35 | 1500 | 15 días | 1 mes |
AF: anemia falciforme.
Que se atengan a los criterios estrictos de prematuridad y bajo peso solo lo hacen Andalucía y Castilla la Mancha.
La mayoría solo repiten extracción a los RN de menos de 35 SG o de menos de 32 SG e incluso de menos de 30 SG. En cuanto al peso solo repiten a los nacidos con peso inferior a 1500g o a 2000g. Pero tampoco hay acuerdo en cuanto al momento de realizar dicha extracción. La mayoría optan por tomar una nueva muestra a los 15 días de vida. Solamente los Programas de Cribado de Andalucía (que también realiza el cribado de los RN de Ceuta) y Murcia (que también realiza el cribado de los RN de Melilla) contemplan la extracción de una tercera muestra, al alta, en grandes prematuros (menos de 31 SG) y muy bajo peso (inferior a 1500g).
En cuanto a los RN transfundidos los criterios son también muy dispares. En algunas comunidades realizan la nueva extracción a las 72 h de la transfusión. En otras transcurridos entre 8 y 10 días y en alguna al mes o a las 6 semanas. En bebés politransfundidos en Andalucía y Murcia realizan la extracción a los tres meses de la última transfusión. Y para el cribado de anemia falciforme también hay discrepancias. Si bien la mayoría de los centros repiten muestra a los tres o cuatro meses de la transfusión, en otros, teniendo en cuenta la vida media del hematíe transfundido lo hacen a los 45 días.
En el resto de los países europeos, en Australia y Asia, es bastante común tomar la primera muestra entre las 48 y 72 h de vida, excepto en el Reino Unido que se realiza al 5.° día o entre 5.° y 8.° días de vida. En Estados Unidos en general se toma a las 24 h o antes de las 48 h de vida. Hay pocos datos sobre Latinoamérica y países del este y sur de África.
Del mismo modo los criterios de repetición para prematuros, bajo peso y transfundidos también varían considerablemente incluso dentro de un mismo país.
Aunque algunos países disponen de programas de cribado centralizados, Portugal, Austria o Alemania, en otros cada región o estado maneja sus propios protocolos, como Francia o Bélgica.
En el Reino Unido disponen de un documento unificado para el cribado neonatal (actual 2015), a los RN de igual o menos de 32 SG se les realiza otra extracción a los 28 días de vida o al alta para el cribado completo6. En caso de transfusión deben transcurrir 72 h antes de tomar la nueva muestra. En cambio en Newcastle, un condado de Inglaterra, se realiza extracción de nueva muestra a los RN de <36 SG cuando alcanzan la edad equivalente a 36 SG. En caso de transfusión siguen el mismo criterio que los demás y para la anemia falciforme repiten a los 3 meses7–9.
En Ontario, Canadá, realizan la primera toma de muestra entre las 48 y 72 h de vida y en caso de RN de menos de 33 SG o de peso inferior a 1500g realizan extracción de otra muestra a las 3 semanas o al alta10.
En EE. UU. cada estado tiene su propio programa, algunos muy semejantes y otros no tanto. En el estado de Nueva York, la primera muestra se toma a las 24 h o máximo 72 h y en RN de peso inferior a 2000g se toma una segunda muestra entre las 48-72 h y una tercera a los 28 días de vida o al alta. En los transfundidos se realiza extracción de nueva muestra a los tres días y para anemia falciforme a los 4 meses. En Minessota a los RN de peso inferior a 1800g les extraen dos muestras más, a las 2 y las 4 semanas de vida. Lo mismo en Michigan. En cambio en Massachusetts repiten extracción a las 2, 6 y 10 semanas de vida a todos los RN con peso inferior a 1500g. En Oregón a todos los RN les extraen dos muestras, la primera a las 24-48 h de vida y la segunda a los 10-15 días. A los prematuros, bajo peso o enfermos les sacan tres, la primera al ingreso (24h de vida normalmente), la segunda entre las 48-72 h y la tercera a los 28 días o al alta11–13. En Irán repiten extracción a las 2 semanas en RN con peso inferior a 2500g.
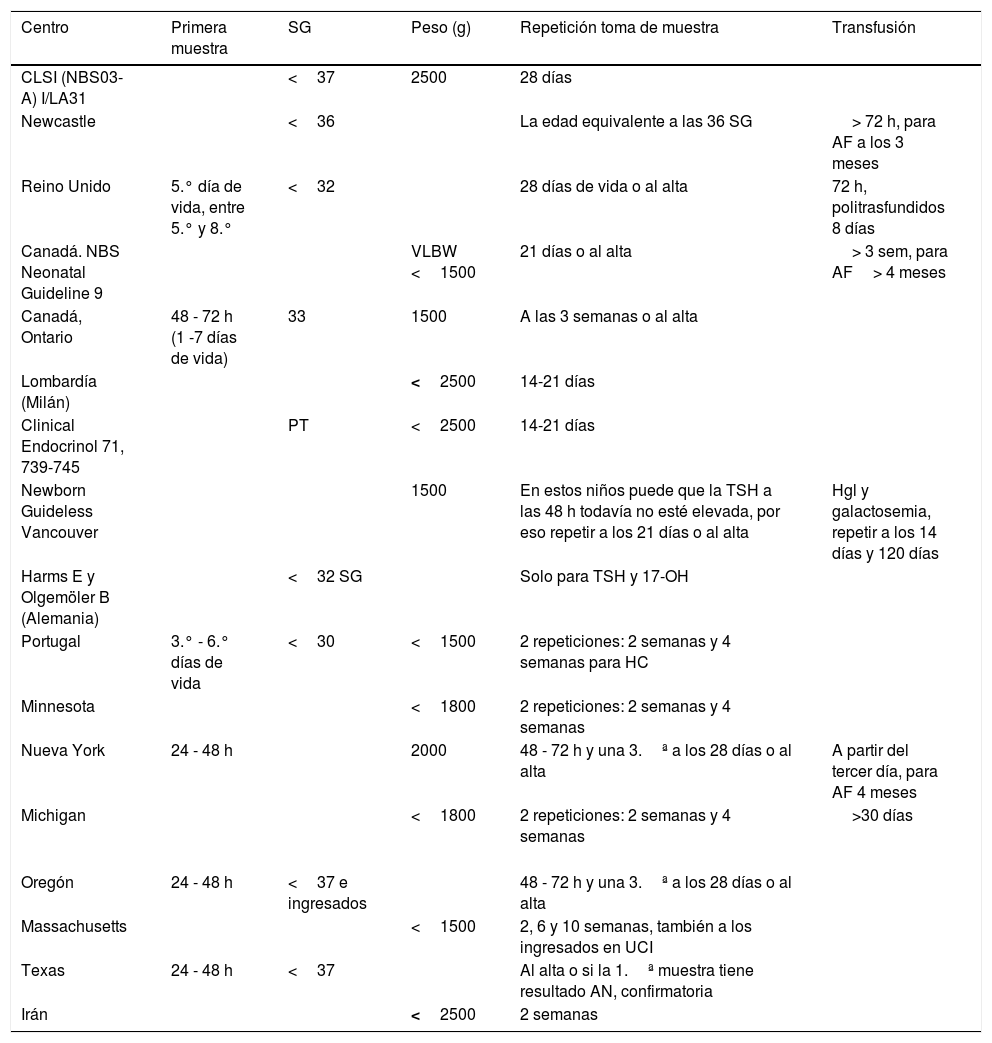
La tabla 2 ilustra estos ejemplos. Son solo ejemplos de la disparidad de estrategias que presentan los programas de cribado neonatal.
Otros países
| Centro | Primera muestra | SG | Peso (g) | Repetición toma de muestra | Transfusión |
|---|---|---|---|---|---|
| CLSI (NBS03-A) I/LA31 | <37 | 2500 | 28 días | ||
| Newcastle | <36 | La edad equivalente a las 36 SG | > 72 h, para AF a los 3 meses | ||
| Reino Unido | 5.° día de vida, entre 5.° y 8.° | <32 | 28 días de vida o al alta | 72 h, politrasfundidos 8 días | |
| Canadá. NBS Neonatal Guideline 9 | VLBW <1500 | 21 días o al alta | > 3 sem, para AF> 4 meses | ||
| Canadá, Ontario | 48 - 72 h (1 -7 días de vida) | 33 | 1500 | A las 3 semanas o al alta | |
| Lombardía (Milán) | <2500 | 14-21 días | |||
| Clinical Endocrinol 71, 739-745 | PT | <2500 | 14-21 días | ||
| Newborn Guideless Vancouver | 1500 | En estos niños puede que la TSH a las 48 h todavía no esté elevada, por eso repetir a los 21 días o al alta | Hgl y galactosemia, repetir a los 14 días y 120 días | ||
| Harms E y Olgemöler B (Alemania) | <32 SG | Solo para TSH y 17-OH | |||
| Portugal | 3.° - 6.° días de vida | <30 | <1500 | 2 repeticiones: 2 semanas y 4 semanas para HC | |
| Minnesota | <1800 | 2 repeticiones: 2 semanas y 4 semanas | |||
| Nueva York | 24 - 48 h | 2000 | 48 - 72 h y una 3.ª a los 28 días o al alta | A partir del tercer día, para AF 4 meses | |
| Michigan | <1800 | 2 repeticiones: 2 semanas y 4 semanas | >30 días | ||
| Oregón | 24 - 48 h | <37 e ingresados | 48 - 72 h y una 3.ª a los 28 días o al alta | ||
| Massachusetts | <1500 | 2, 6 y 10 semanas, también a los ingresados en UCI | |||
| Texas | 24 - 48 h | <37 | Al alta o si la 1.ª muestra tiene resultado AN, confirmatoria | ||
| Irán | <2500 | 2 semanas |
AF: anemia falciforme.
La definición del periodo de toma de muestra para el cribado neonatal en RN a término y con peso adecuado a la edad gestacional no es consensual pues tiene entre otras cosas que adaptarse a la realidad de la organización de los distintos sistemas de sanidad. Esta definición se complica mucho más en RN prematuros, con bajo peso o enfermos, que deben ser ingresados en unidades de neonatología o de cuidados intensivos. La prematuridad influye en los niveles de aminoácidos, enzimas y otros marcadores endocrinos, como constatan Wilson et al.4. Los valores de 17-OH-progesterona (17-OHP) deberían corregirse por la edad gestacional para evitar FP de HAC14. Slaugter et al., observaron en 17-OHP que la tasa de FP alcanzaba el 3,53% si la muestra se extraía antes de las 48 h de vida, mientras que la frecuencia disminuía al 1,95% al extraerse pasadas las 48 h de vida15.
Algunas acilcarnitinas están más elevadas en RN pretérmino16, aunque la experiencia al respecto, en otros centros, indica que si están más elevadas es por suplementos de carnitina que suelen llevar en la parenteral, pero suelen tener los mismos valores que los niños a término, incluso a veces más bajos siendo las muestras igual, de 48 h. Del mismo modo un gran número de RN prematuros y con peso bajo, entre un 25-90% presentan hipotiroxinemia17 pero el riesgo de hipotiroidismo congénito (HC) es 1,5 veces superior en pretérminos que en RN a término18. En un estudio realizado con datos del laboratorio de cribado de Ohio se determinó que los niveles de tirotropina eran 4 veces superiores cuando las muestras se extrajeron en menos de 24 h15. Con un apropiado punto de corte en la tirotropina (TSH), se pueden evitar repeticiones para el cribado de HC, según Korada et al.19. Los niveles de metionina pueden verse alterados en estos RN20.
Una de las preguntas que nos hacemos muchos es si hay que ajustar los resultados por la edad gestacional. Algunos estudios demuestran que la tasa de FP es inversamente proporcional a la edad gestacional y al peso15,21.
La Asociación Americana de Pediatría recomienda que el crecimiento y desarrollo de niños nacidos prematuramente sea monitorizado ajustando la edad del RN con el grado de prematuridad5.
Al hecho de la inmadurez de su organismo y por tanto de todos sus sistemas y al retraso en el desarrollo, se añade el estar sometidos a diferentes condiciones como soporte nutricional, transfusiones, medicación, etc., que pueden afectar tanto a la toma de muestra como a la interpretación de los resultados.
Un gran número de factores que afectan a los RN en las Unidades de neonatología o cuidados especiales, asociados a su situación clínica y a los tratamientos que reciben, son todavía desconocidos. Incuso con puntos de corte ajustados, en estos casos se obtiene un elevado porcentaje de resultados anormales, en su mayoría FP, pero no debemos olvidar la posibilidad de FN. Su complejidad afecta no solo a los ensayos de laboratorio, sino sobre todo a su interpretación.
Si nos atenemos a los términos prematuro y bajo peso estrictamente, debería repetirse la extracción a todos los RN de menos de 37 SG y de menos de 2500g. Pero en realidad, como se ve en el apartado anterior, cada programa decide qué criterio aplicar, normalmente por problemas de coste-efectividad ya que, de repetir muestra a todos los RN de menos de 37 SG, a repetirla solamente a los de menos de 30 SG, se evitan muchas determinaciones. Lo mismo ocurre con el peso.
En estos casos se hace necesario extraer una nueva muestra o varias, además de la primera, que se extrae siempre, cuando las condiciones a las que está sometido el RN mejoren o cuando el peso y la edad gestacional correspondan a los adecuados para un RN a término.
De ahí la importancia de establecer unas pautas claras de actuación en estos casos y de que todo el personal que intervenga en el cuidado de estos RN esté al corriente de los protocolos a seguir y de extraer las muestras en el momento adecuado. Al mismo tiempo el laboratorio deberá tener clara constancia del momento exacto en que se ha tomado cada muestra, ya que de ello dependerá la interpretación de los resultados.
Al margen de estas discrepancias y en vistas a paliarlas, el CLSI editó en 2009 una guía, «Newborn Screening for Preterm, Low Birth Weight, and Sick Newborns; Approved Guideline (NBS03-A, I/LA31-A)»3,22, que se está revisando en 2017 y que recoge las mejores prácticas para el cribado neonatal de prematuros y otros RN de riesgo en las Unidades de cuidados especiales. Su objetivo es establecer las condiciones idóneas y ayudar a todas las personas que intervienen en el cuidado de estos RN, para que el cribado neonatal en estos casos se realice con la máxima fiabilidad, en el periodo más corto de tiempo y con el menor número de muestras.
Para estos casos, la recomendación del CLSI en su documento es que deberían tomarse tres muestras, cada una con sus ventajas y desventajas.
Primera: en el momento de ingreso en la Unidad de cuidados neonatales. La mayoría de estos niños ingresan entre las 1 y 24 h desde el nacimiento. Debemos interpretar los resultados con cautela ya que muchos pueden normalizarse en la segunda muestra.
En este periodo los resultados son fiables para hemoglobinas, galactosemia (teste de Beutler) y biotinidasa y nos dará valores basales para aminoácidos (AA) y acilcarnitinas. Pese a ello, un valor normal no descarta la presencia de alteración, podemos tener FN al respecto. Además al estar los RN catabólicos en las primeras 48h de vida, la probabilidad de detectar un error de la oxidación de ácidos grasos es mayor. Al extraerla en este momento se asegura la obtención de la misma. Como desventajas podemos tener FN y FP para TSH, 17-OHP, tripsina inmunorreactiva (IRT) o T-cell receptor excision circles (TREC). También puede ser inadecuada para algunas enfermedades lisosomales. En estos casos se puede informar como resultado no concluyente y que precisa repetir en otra muestra. En todos los casos se precisará otra muestra.
Segunda: entre las 48 y 72 h de vida. Debería realizarse solo en aquellos RN en que la primera muestra se sacó antes de las 24 h de vida y en aquellos en que la primera muestra presenta resultados anormales. Debe realizarse el panel completo de nuevo. Esta muestra debería dar resultados fiables para HC (a menos que el programa use como marcador TSH, como ocurre en nuestro país) hiperplasia adrenal congénita, fibrosis quística, la mayoría de las aminoacidopatías, salvo que el bebé esté con NP, acidurias y defectos de la oxidación de ácidos grasos. Para las enfermedades de Pompe, Krabbe, Gaucher y Fabry, solo si el RN tiene 34 SG o más.
Desventajas, los desórdenes de carnitina pueden estar enmascarados o presentar falsas elevaciones por carnitina añadida a las soluciones parenterales. Lo mismo puede ocurrir con algunos trastornos de AA o del metabolismo de ácidos grasos por suplementos nutricionales o calóricos. Puede no identificar HC con elevación tardía de TSH.
Tercera muestra: a los 28 días de vida o al alta. Principalmente para RN de más de 34 SG y/o peso inferior a los 2000g. Entre las ventajas permite la detección de HC con elevación tardía de TSH ya que los RN prematuros pueden tardar hasta un mes para la maduración de la función tiroidea y detectar HAC u homocistinuria de aparición tardía en niños pretémino, aunque nuestra duda es que, si solo se criba para HC y marcadores alterados en la muestra anterior, se nos pueden escapar estas dos.
En muchos casos este espécimen resuelve previas anomalías tales como elevación de múltiples AA o carnitina por NP.
Esta muestra no debe usarse para resolver alteraciones de IRT o acilcarnitinas ya que sus concentraciones descienden con la edad.
Otra desventaja es el coste que supone una tercera determinación.
No deja de ser chocante que existan tantas diferencias entre los diferentes programas, a pesar de las recomendaciones de instituciones como el Center for Disease Control and Prevention23, el Clinical and Laboratory Standards Institute3, la Academia Americana de Pediatría, el U.S. Newborn Screening System Guidelines o el UK Newborn Screening Programme Centre24, que han dedicado tiempo y recursos para estudiar y evaluar los factores que intervienen en la fiabilidad de las pruebas de cribado neonatal, revisar el significado y duración de las interferencias detectadas y proporcionar recomendaciones para la toma de muestra en lo referente al tiempo y número de las mismas.
Está claro que queda mucho por hacer. Que la situación de muchos de estos RN es incontrolable porque intervienen gran cantidad de factores, muchos desconocidos y que resulta muy complicado establecer unas pautas de actuación. Pero por lo menos deberíamos aprovechar toda la investigación que se ha llevado a cabo hasta el momento, que no es poca.
Sería bueno que los diferentes programas adoptaran las recomendaciones de estas guías no solo para estandarizar protocolos, sino sobre todo para mejorar la calidad del cribado neonatal y el seguimiento de estos RN.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses..