En el cribado combinado de primer trimestre se emplean marcadores bioquímicos y ecográficos que se ven modificados por distintos factores, como peso, gemelaridad, tabaquismo, etc. El objetivo de este estudio es analizar la influencia del sexo fetal en estos marcadores y la repercusión en el resultado del cribado de trisomía 21.
Material y métodosEstudio observacional, descriptivo y retrospectivo (2013-2015). Se excluyeron las gestaciones múltiples. Variables analizadas: medición de la translucencia nucal, la concentración de gonadotropina coriónica humana libre, la proteína plasmática A asociada al embarazo y sus correspondientes múltiplos de la mediana corregidos. Se comparan las medianas de las variables en gestaciones con feto masculino y femenino, afectas y no afectas.
ResultadosIncremento del 23,62% en la mediana del múltiplo de la mediana de la gonadotropina coriónica humana libre corregido y del 3,65% en la mediana del múltiplo de la mediana de la proteína plasmática A asociada al embarazo corregido en gestaciones con fetos femeninos. Este aumento se cumple tanto en gestaciones con feto afecto como no afecto de trisomía 21. Sexo masculino: tasa de detección 86,9%, tasa de falsos positivos 3,36%. Sexo femenino: tasa de detección 90,9%, tasa de falsos positivos 4,10%.
ConclusionesEl incremento sobre todo de los niveles de gonadotropina coriónica humana libre origina un aumento de la tasa de detección y de la tasa de falsos positivos en gestaciones con feto femenino. La aplicación de un factor de corrección por sexo requiere de estudios coste-efectividad.
In first trimester combined screening, biochemical and ultrasound markers are used that are modified by different factors such as weight, twins, smoking, etc. The aim of this study is to analyse the influence of foetal gender on these markers, and the repercussion on the result of the screening of trisomy 21.
Material and methodsAn observational, descriptive and retrospective study (2013-2015) was conducted. Multiple gestations were excluded. Variables analysed: nuchal translucency, free human chorionic gonadotrophin concentration, pregnancy-associated plasma protein A, and their median corrected multiples. A comparison was made of the medians of the variables in gestations with male and female foetuses, affected and non-affected.
ResultsThere was a 23.62% increase in the median of the median corrected multiple free human chorionic gonadotrophin and 3.65% in the median of the median corrected multiple pregnancy-associated plasma protein A, in gestations with female foetuses. This increase is observed in gestations with foetuses affected and non-affected by trisomy 21. Male gender: detection rate 86.9%, false positive rate 3.36%. Female gender: detection rate 90.9%, false positive rate 4.10%.
ConclusionsThe increase, especially in free human chorionic gonadotrophin levels, leads to an increase in detection rate and false positive rate in gestations with a female foetus. The application of a correction factor by gender requires cost-effectiveness studies.
La mejora continua de la calidad es un objetivo primordial en los programas de cribado prenatal de cromosomopatías. El eje central, aunque no único, debe ser la mejora del resultado final entendiendo como tal la correspondencia entre el riesgo informado y la dotación cromosómica del feto. Otros aspectos como un nivel de cobertura universal o un alto grado de satisfacción de usuarias y profesionales también deben considerarse objetivos de esta mejora continua.
Actualmente la estrategia de despistaje con más implantación es el cribado combinado de primer trimestre (CC1T), basado en la utilización simultánea de 2 marcadores bioquímicos medidos en suero materno (proteína plasmática A asociada al embarazo [PAPP-A] y fracción beta libre de la gonadotropina coriónica humana [β-HCG libre]), junto con un marcador ecográfico (la medida de la translucencia nucal [TN] del feto). Una tasa de detección (TD) superior al 85% para una tasa de falsos positivos (TFP) inferior al 5% debe ser el objetivo de calidad en términos de resultado final, ya que esto asegura que el programa será coste-efectivo y además aceptable para las expectativas de usuarias y profesionales1.
Las herramientas empleadas para la mejora del resultado final de estos programas han sido de 2 tipos: por una parte, el uso de nuevos marcadores bioquímicos (factor de crecimiento placentario) y/o ecográficos (hueso nasal, ductus, regurgitación tricúspide), que sustituyen o se añaden a los ya existentes, proporcionando unos resultados limitados en términos de coste-efectividad; la segunda opción es la modificación de la estrategia de cribado empleada, fundamentalmente mediante modelos contingentes en los que tras el CC1T se clasifican las gestaciones en 3 grupos: alto riesgo, a las que se aplica una prueba diagnóstica (cariotipo tras técnica invasiva), riesgo intermedio, en las que se indica una segunda prueba de cribado, y gestaciones de bajo riesgo, que continúan con sus controles habituales. El empleo de estrategias contingentes sí parece suponer una mejora notable, más aún con la incorporación a la misma del diagnóstico prenatal no invasivo como prueba de cribado de segunda línea para esas gestantes de riesgo intermedio. Esto puede suponer una mejora en las tasas de detección y un descenso en el número de técnicas invasivas efectuadas2.
Conjuntamente con lo indicado en el párrafo anterior, continúa siendo deseable la mejora de la calidad en el riesgo final informado en el CC1T. En este sentido, la calidad de la medida de los marcadores y la normalización de los valores obtenidos son esenciales para la misma. Esta normalización depende del cálculo del múltiplo de la mediana (MoM) de cada marcador, que corrige el cambio fisiológico de los mismos según la edad gestacional, y de un segundo elemento que pretende controlar la influencia de ciertas características maternas y gestacionales (factores de corrección). Algunos de estos factores son de importancia capital, como el peso materno y la gestación múltiple3. Otros factores maternos, aunque menos importantes, son también tenidos en cuenta por los distintos softwares empleados en el cálculo del riesgo (tabaquismo, presencia de diabetes mellitus, etnia y técnicas de reproducción asistida)4. Por último, algunos factores que según la bibliografía pueden modificar los valores de los marcadores, generalmente no son incorporados en estos programas (paridad, sexo fetal, etc.)5,6.
El control de la repercusión de estos factores se puede abordar con la ayuda de distintas herramientas. La más habitual suele ser cuantificar la proporción en que aumenta o disminuye el valor de un marcador en función de la presencia de una característica determinada (por ejemplo, sexo fetal masculino). Este valor será el factor de corrección fijo por el que tendremos que multiplicar el MoM si está presente esa característica, obteniéndose así el MoM corregido. Se recomienda que, si se dispone de suficiente experiencia y número de casos, estos factores se calculen localmente.
Con respecto a la influencia del sexo fetal, distintos estudios5,6 señalan que los fetos femeninos presentan niveles más elevados de PAPP-A y de β-HCG libre. Es conocido que las hormonas placentarias tienen un papel relevante en la diferenciación sexual del feto; así, la HCG puede unirse a receptores LH/HCG situados en el testículo fetal y estimular la esteroidogénesis durante el primer trimestre de gestación, siendo esta interacción necesaria para la correcta diferenciación masculina. Por el contrario, existen menos datos sobre el papel que la HCG placentaria juega en la diferenciación sexual de los fetos femeninos5. Se ha planteado que la elevación de los niveles de HCG puede ser explicada por la expresión diferencial de algunos genes por el trofoblasto, que no son inactivados y son sobreexpresados por la placenta en presencia de un feto femenino7. También se ha teorizado sobre la posibilidad de que las diferencias en los niveles de HCG entre sexos se deban a fenómenos no genéticos que afectan a la madre (estado nutricional, estrés, exposición a productos químicos o a estrógenos exógenos).
El objetivo del presente trabajo es analizar la influencia del sexo fetal en los marcadores empleados en el CC1T y su posible repercusión en el resultado final del programa.
Material y métodoDiseño: estudio observacional, descriptivo y retrospectivo, efectuado a partir de las gestantes incluidas en el Programa de Cribado Prenatal de Anomalías Congénitas del Área de Gestión Sanitaria Sur de Sevilla. El periodo de estudio ha sido el comprendido entre enero de 2013 y diciembre de 2015 (no se han considerado los estudios efectuados en 2016 ya que no se han producido todos los nacimientos y no se dispone, por tanto, del resultado final de las gestaciones). Se han excluido las gestaciones múltiples.
Descripción del programa: CC1T descentralizado en 2 pasos, realizado bajo consentimiento informado, con determinación de β-HCG libre y PAPP-A entre las semanas 8 y 13+6 y ecografía entre las semanas 10+4 y 14+0 para datar la gestación mediante la longitud craneocaudal y la medición de la TN.
Marcadores bioquímicos: la cuantificación de los niveles de PAPP-A y β-HCG libre fue realizada por electroquimioluminiscencia en un analizador Cobas 6000 (Roche Diagnostics, Rotkreuz, Suiza).
Biometría fetal: la medición de la longitud craneocaudal y la TN se efectuó por ecografía transvaginal por ecografistas autorizados según las normas de la Fetal Medicine Foundation8. Los ecógrafos utilizados para la valoración ecográfica fueron: Toshiba Famio (Toshiba Medical Systems Corporation, Japón) y Sonoline Adara (Siemens Medical Solutions, Erlangen, Alemania).
Cálculo de riesgo: se realizó mediante la aplicación corporativa del Sistema de Información del Programa Andaluz de Cribado de Anomalías Congénitas. El punto de corte utilizado para indicar la realización de pruebas invasivas fue de 1/280 en el caso de la trisomía 21.
Estudios citogenéticos: se realizaron los diagnósticos genéticos a partir de muestras obtenidas por técnicas invasivas (biopsia de vellosidades coriales o amniocentesis) de gestantes con CC1T positivos, restos ovulares, así como de los recién nacidos con sospecha clínica de trisomía 21, en cuyo caso el espécimen para la realización del diagnóstico fue sangre periférica. Dichos estudios genéticos fueron realizados por un laboratorio externo.
Variables analizadas: medición de TN, MoM de TN, concentración sérica de β-HCG libre, MoM de β-HCG libre, MoM corregido de β-HCG libre, concentración sérica de PAPP-A, MoM PAPP-A, MoM corregido de PAPP-A. Para la corrección del MoM de β-HCG libre y PAPP-A se utilizaron los siguientes factores: etnia y peso de la gestante, presencia de diabetes y/o de hábito tabáquico. El sexo al nacimiento se obtuvo a partir de la historia clínica de las gestantes del estudio o por el cariotipo en casos de técnicas invasivas o aborto.
Análisis estadístico: a partir del módulo de estadísticas del Sistema de Información del Programa Andaluz de Cribado de Anomalías Congénitas se exportaron los datos a una hoja de cálculo Excel Office 2010 de Microsoft®, y se analizaron con el programa estadístico SPSS® versión 22 (IBM SPSS Statistic 22). Se aplicó la prueba U de Mann-Whitney y la prueba W de Wilcoxon para muestras independientes, con la finalidad de comparar según el sexo fetal las medianas de las variables estudiadas tanto en afectos como en no afectos.
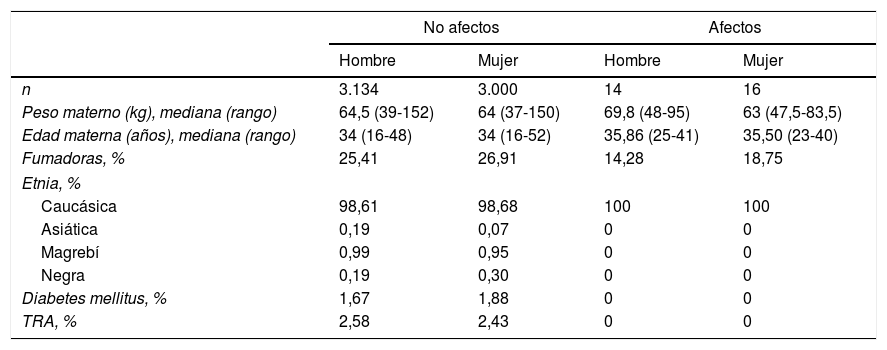
ResultadosDurante el periodo estudiado se efectuaron un total de 6.164 CC1T en gestaciones simples. De ellos, 3.148 (51,07%) correspondían a fetos masculinos y 3.016 (48,93%) a fetos femeninos. Las características gestacionales (peso y edad materna, etnia, tabaquismo, diabetes y técnicas de reproducción asistida) en función del sexo de las gestaciones no afectas y afectas quedan resumidas en la tabla 1.
Características gestacionales (afectas y no afectas)
| No afectos | Afectos | |||
|---|---|---|---|---|
| Hombre | Mujer | Hombre | Mujer | |
| n | 3.134 | 3.000 | 14 | 16 |
| Peso materno (kg), mediana (rango) | 64,5 (39-152) | 64 (37-150) | 69,8 (48-95) | 63 (47,5-83,5) |
| Edad materna (años), mediana (rango) | 34 (16-48) | 34 (16-52) | 35,86 (25-41) | 35,50 (23-40) |
| Fumadoras, % | 25,41 | 26,91 | 14,28 | 18,75 |
| Etnia, % | ||||
| Caucásica | 98,61 | 98,68 | 100 | 100 |
| Asiática | 0,19 | 0,07 | 0 | 0 |
| Magrebí | 0,99 | 0,95 | 0 | 0 |
| Negra | 0,19 | 0,30 | 0 | 0 |
| Diabetes mellitus, % | 1,67 | 1,88 | 0 | 0 |
| TRA, % | 2,58 | 2,43 | 0 | 0 |
TRA: técnicas de reproducción asistida.
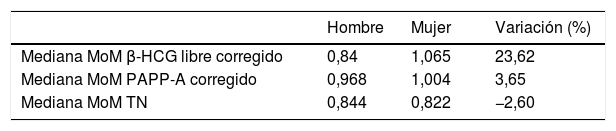
Observamos que las medianas de los MoM corregidos (valor normalizado de los marcadores según las características gestacionales) son más elevadas en gestaciones con feto femenino tanto en el caso de la PAPP-A como de la β-HCG libre. Esta elevación es más llamativa en el caso de la β-HCG libre, con un incremento del 23,6%. Las medianas de los MoM corregidos de los marcadores en función del sexo se muestran en la tabla 2.
Medianas de los múltiplos de la mediana corregidos de los marcadores bioquímicos y ecográficos por sexo
| Hombre | Mujer | Variación (%) | |
|---|---|---|---|
| Mediana MoM β-HCG libre corregido | 0,84 | 1,065 | 23,62 |
| Mediana MoM PAPP-A corregido | 0,968 | 1,004 | 3,65 |
| Mediana MoM TN | 0,844 | 0,822 | −2,60 |
β-HCG libre: fracción beta libre de la gonadotropina coriónica humana; MoM: múltiplo de la mediana; PAPP-A: proteína plasmática A asociada al embarazo; TN: translucencia nucal.
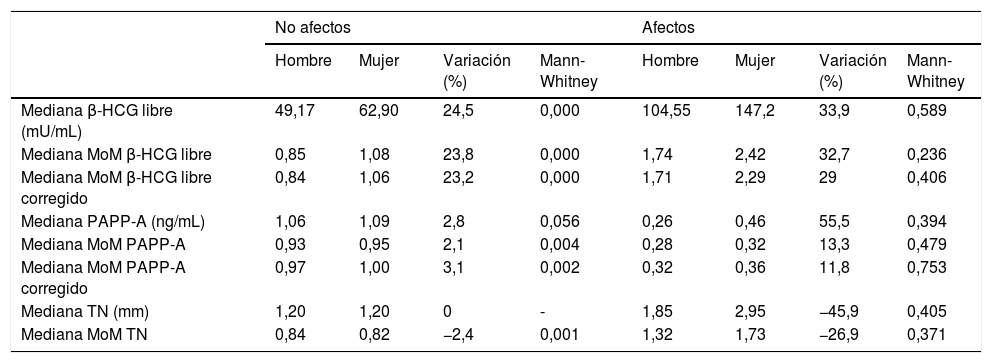
Cuando se analizan las diferencias en los distintos marcadores bioquímicos y ecográficos (expresados como mediana de las medidas, mediana de los MoM y mediana de los MoM corregidos) entre gestaciones con feto masculino y femenino en el grupo de afectos y en el de no afectos vemos que el patrón antes descrito (PAPP-A y β-HCG libre más altas en gestaciones con feto femenino) se cumple en todos los casos, tanto en gestaciones con feto afecto como no afecto de trisomía 21. Además, como se describió anteriormente, esta elevación es más llamativa en el caso de la β-HCG libre. Sin embargo, cuando se considera la significación estadística de estas diferencias, dicha significación es evidente en el caso de los no afectos, pero no queda demostrada en los afectos (tabla 3).
Medianas de los marcadores bioquímicos y ecográficos en afectos y no afectos por sexo
| No afectos | Afectos | |||||||
|---|---|---|---|---|---|---|---|---|
| Hombre | Mujer | Variación (%) | Mann-Whitney | Hombre | Mujer | Variación (%) | Mann-Whitney | |
| Mediana β-HCG libre (mU/mL) | 49,17 | 62,90 | 24,5 | 0,000 | 104,55 | 147,2 | 33,9 | 0,589 |
| Mediana MoM β-HCG libre | 0,85 | 1,08 | 23,8 | 0,000 | 1,74 | 2,42 | 32,7 | 0,236 |
| Mediana MoM β-HCG libre corregido | 0,84 | 1,06 | 23,2 | 0,000 | 1,71 | 2,29 | 29 | 0,406 |
| Mediana PAPP-A (ng/mL) | 1,06 | 1,09 | 2,8 | 0,056 | 0,26 | 0,46 | 55,5 | 0,394 |
| Mediana MoM PAPP-A | 0,93 | 0,95 | 2,1 | 0,004 | 0,28 | 0,32 | 13,3 | 0,479 |
| Mediana MoM PAPP-A corregido | 0,97 | 1,00 | 3,1 | 0,002 | 0,32 | 0,36 | 11,8 | 0,753 |
| Mediana TN (mm) | 1,20 | 1,20 | 0 | - | 1,85 | 2,95 | −45,9 | 0,405 |
| Mediana MoM TN | 0,84 | 0,82 | −2,4 | 0,001 | 1,32 | 1,73 | −26,9 | 0,371 |
β-HCG libre: fracción beta libre de la gonadotropina coriónica humana; MoM: múltiplo de la mediana; PAPP-A: proteína plasmática A asociada al embarazo; TN: translucencia nucal.
La TD para el CC1T para la trisomía 21 en gestaciones con fetos masculinos fue del 86,9%, con una TFP de 3,36%, mientras que para gestaciones con fetos femeninos fue de 90,9 y 4,10%, respectivamente.
DiscusiónLos programas de cribado no suelen tener implementados el sexo fetal en el software que emplean para el cálculo de riesgo. Sin embargo, existe base bibliográfica9 que señala la presencia de concentraciones superiores de β-HCG libre y PAPPA-A en el caso de fetos de sexo femenino, estando el porcentaje de incremento en torno al 14 y el 6%, respectivamente. Los resultados de este trabajo son coincidentes con dicha bibliografía, y aunque en nuestro estudio este comportamiento se presenta tanto si consideramos la concentración medida como los MoM sin corregir, la comparación más adecuada debe establecerse en función de los MoM corregidos, ya que es el valor normalizado que minimiza la posible influencia de otros factores (peso, etnia, etc.) sobre esos marcadores. De esta forma, hemos evidenciado un incremento del 23,62% para la mediana de MoM corregido de β-HCG libre y del 3,65% para la mediana de MoM corregido de PAPP-A. Consideramos muy significativa la elevación de los valores de MoM corregido de β-HCG libre por la importancia que puede tener en la estimación del riesgo final.
Estos resultados se confirman al valorar la influencia del sexo fetal en función de que la gestación esté afecta o no de una trisomía 21. En el caso de la mediana de MoM corregidos de β-HCG libre y en concordancia con la bibliografía9, el porcentaje de incremento en gestaciones con feto femenino es mayor en los afectos (29%) frente a los no afectos (23%). Sin embargo, al analizar la significación estadística de estos cambios se ha evidenciado en los no afectos, pero no así en los afectos. Creemos que este hecho se debe al bajo y desigual tamaño muestral (30 afectos/6.134 no afectos). Aunque esto constituye una limitación del estudio, pensamos que no invalida sus conclusiones y que con un mayor número de casos en el grupo de afectos probablemente se lograría esa significación, tal como sucede en la bibliografía9.
Con respecto al marcador ecográfico (TN), en nuestro estudio se observa, en gestaciones con feto de sexo femenino, un ligero descenso del 2% en la mediana del MoM de TN. Este descenso, aunque menor, es concordante con lo publicado por otros autores (9,4%)9. En la bibliografía se postulan distintas hipótesis para la justificación fisiológica de este comportamiento de la TN, relacionadas todas ellas con una maduración más tardía en fetos masculinos que puede conducir a un llenado diastólico alterado, provocando una acumulación del líquido nucal10.
Ante estos datos debemos plantear qué interés clínico tiene lo expuesto y si debemos incluir el sexo fetal dentro de los factores de corrección empleados en los programas de cribado prenatal de cromosomopatías. El perfil de marcadores que aparece en gestaciones con feto femenino (aumento marcado de MoM corregido de β-HCG libre, con un aumento limitado de MoM corregido de PAPP-A y descenso también discreto de MoM de TN) parece generar un aumento de las TD y de las TFP. Esto es ciertamente lo que se objetiva con nuestro trabajo, ya que, en caso de sexo femenino, la TD se incrementa un 4% y la TFP un 0,74%. Si se aplicasen factores de corrección por sexo y se minimizasen estas diferencias, entendemos que dada la prevalencia relativamente baja de la trisomía 21, el descenso de la TD implicaría en nuestra serie un falso negativo adicional aproximadamente cada 3 años. Aunque también hay que señalar que una proporción importante de los falsos negativos por CC1T son rescatados en la ecografía morfológica de la semana 20 por las malformaciones asociadas que presentan. Por el contrario, la reducción del 0,74% en la TFP habría supuesto en nuestro programa ofertar 45 técnicas invasivas menos en ese mismo periodo de estudio. Esta disminución de procedimientos invasivos es importante por los costes y las complicaciones asociadas que implican estas técnicas (pérdidas gestacionales del 1%, estrés materno, etc.). Por todo ello, consideramos necesario disponer de una serie más larga y efectuar un riguroso estudio de coste-efectividad.
En cualquier caso, la implementación de este factor de corrección, como hemos visto en la introducción, es sencillo y puede efectuarse con los datos de cada centro. Desde el punto de vista organizativo, el único problema podría derivarse de la necesidad de conocer el sexo fetal en el momento de efectuar la ecografía de la semana 12. A este respecto, algunos estudios señalan que el sexo fetal se puede asignar correctamente en el 85,13% de los casos en esa ecografía. En concreto, se asigna de forma correcta en el 78,32% de los casos en la semana de gestación 11, en el 84,49% de los casos en la semana 12 y en el 93,7% de los casos en la semana 13. El 82,5% de los varones y el 87,84% de las mujeres fueron asignados correctamente11. Según otros autores12, la utilización del llamado «signo sagital» o, como alternativa, el «tubérculo genital» en la ecografía de la semana 12 permite asignar correctamente el sexo fetal en prácticamente el 100% de los casos. De cualquier forma, en aquellos mínimos procedimientos en los que existiese duda en la asignación del sexo se podría repetir la exploración ecográfica antes de la semana 14, que suele ser el límite superior de tiempo para informar el CC1T en la mayoría de los programas.
Por último, queremos señalar que la corrección por sexo fetal puede ser una herramienta más a considerar dentro de las medidas para mejorar los programas de cribado prenatal, más aún con el interés creciente por parte de los obstetras en mejorar y ampliar el control del embarazo en el primer trimestre de gestación, extendiéndolo no solo a las cromosomopatías, sino también a otras morbilidades (preeclampsia, diabetes gestacional, etc.), donde el sexo fetal y su influencia en los niveles maternos de diversas hormonas, y no solo la β-HCG (testosterona, DHEA-S, etc.), pueden jugar un papel en la fisiopatología de las mismas13.
En conclusión, el sexo fetal modifica los valores de los marcadores empleados en los programas de cribado prenatal de cromosomopatías. Es especialmente significativa la elevación de los MoM corregidos de β-HCG libre en gestaciones con sexo femenino. Esto condiciona en dichas gestaciones una elevación de la TD y la TFP en el caso de la trisomía 21, siendo necesarios estudios de coste-efectividad que justifiquen o no la introducción del sexo fetal como factor de corrección.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes
Conflicto de interesesLos autores declaran que no presentan ningún conflicto de intereses.