En la práctica clínica, la sospecha de síndrome antifosfolípido (SAF) se basa en las recomendaciones de las guías sobre a quienes tomar muestras ante los factores que generen riesgo de SAF. Sin embargo, estas recomendaciones se basan en el consenso de expertos, dado que no se ha cuantificado adecuadamente el peso de cada uno de esos factores.
Materiales y métodosEstudio observacional analítico de casos y controles, anidado en una cohorte retrospectiva de pacientes con trombosis venosa o arterial en quienes se sospechó clínicamente SAF. Se compararon los pacientes con diagnóstico confirmado de SAF según criterios de Sapporo o resultado inicial triple positivo (casos) con los pacientes negativos para SAF (controles). Se evaluó la asociación entre el diagnóstico de SAF y diferentes factores clínicos y paraclínicos.
ResultadosSe incluyeron 68 pacientes (72% mujeres, 41,2% trombosis venosa profunda, 29,4% tromboembolismo pulmonar). En 18 casos se confirmó SAF. No hubo diferencias significativas de edad en pacientes con y sin confirmación del diagnóstico (44,0±17,9 vs. 51,2±14,9, p=0,069). En el análisis multivariado se encontró una asociación entre tener SAF y enfermedad autoinmune (OR: 12,1; IC95%: 1,47-99,00; p=0,02), prolongación del TPT (OR: 17,6; IC95%: 1,80-172,33; p=0,014), trombocitopenia <150.000 (OR: 18,6; IC95%: 2,18-158,87; p=0,008) y antecedente de eventos previos de trombosis (OR: 6,1 por cada evento; IC95%: 1,23-30,52; p=0,027).
ConclusionesEn los pacientes con trombosis arterial o venosa existe una mayor posibilidad de confirmar SAF en aquellos con antecedentes de enfermedad autoinmune, prolongación del TPT mayor de 5segundos, trombocitopenia y eventos previos de enfermedad trombótica. En estos casos es recomendable solicitar anticuerpos para SAF.
In clinical practice, there is no established guidance on the timing of sample collection when suspicion of antiphospholipid syndrome (APS) arises. Instead, only a list of risk factors for APS exists, without adequate quantification of the significance of each factor.
Materials and methodsAnalytical observational case-control study, nested in a retrospective cohort of patients with venous or arterial thrombosis in whom APS was suspected. Patients with a confirmed diagnosis of APS according to the Sapporo criteria or triple positive initial result (cases) were compared with patients negative for APS (controls). The aim was to assess the association between the diagnosis of APS and various clinical and paraclinical factors.
Results68 patients were included (72% women, 41.2% with deep venous thromboembolism and 29.4% with pulmonary embolism). In 18 patients APS was confirmed. There were no significant differences in age in patients with and without confirmation of the diagnosis (44.0±17.9 vs. 51.2±14.9, P=.069). In the multivariate analysis, a significant and independent association was found between having APS and rheumatic disease (OR: 12.1, P=.02), PTT prolongation (OR: 17.6, P=.014), platelet count <150,000 (OR: 18.6, P=.008), and a history of previous thrombosis events (OR: 6.1 for each event, P=.027).
ConclusionsIn patients with arterial or venous thrombosis, there is a greater possibility of confirming APS if there is a history of rheumatic disease, prolongation of PTT to more than 5seconds, thrombocytopenia, and previous events of thrombotic disease. In these patients, it is advisable to screen for APS, to prevent the further occurrence of thrombotic events.
El síndrome antifosfolípido (SAF) es una enfermedad autoinmune caracterizada por morbilidad obstétrica y trombos venosos o arteriales, en presencia de anticuerpos antifosfolípidos. Su prevalencia estimada es de 6,19 hasta 50 pacientes por 100.000 habitantes1. Es importante su diagnóstico temprano, ya que los perfiles de moderado y alto riesgo incrementan de 42 a 59 la probabilidad de tener una trombosis venosa2, por lo cual, al identificarlos y tratarlos (generalmente con warfarina), se pueden prevenir los eventos. Las guías de manejo de la Sociedad de Hematología Británica (British Society for Haematology [BSH])3,4 y de la Sociedad Internacional de Trombosis y Hemostasia (International Society on Thrombosis and Haemostasis [ISTH])5 recomiendan que la anticoagulación continúe de manera indefinida después de un evento trombótico arterial o venoso. Las guías de la Liga Europea contra el Reumatismo (European League Against Rheumatism [EULAR])4 recomiendan anticoagulación de manera indefinida, excepto en el caso del primer evento ocasionado con un patrón diferente a alto riesgo y que no tenga factores de riesgo para recurrencia.
Los criterios de clasificación del SAF se definieron en Sapporo en 1998 y fueron modificados en Sídney en 20066. De acuerdo con esta definición, es necesario haber experimentado un evento trombótico o un evento obstétrico asociado con positividad persistente (en dos muestras separadas por al menos 12semanas) de anticuerpos β2-glicoproteína tipo IgM o IgG, anticuerpos contra cardiolipinas IgG o IgM y anticogulante lúpico.
En general, en las guías de manejo sobre toma de anticuerpos para el SAF se sugiere tomar los anticuerpos antifosfolípidos cuando el paciente tenga historia familiar o trombosis venosa recurrente, múltiples trombos, trombosis en sitios inusuales, o una edad menor de 50años al momento de un evento no provocado7-10. Sin embargo, en la práctica clínica no hay una recomendación específica sobre a quiénes tomar las muestras, sino una lista de factores que generan riesgo de tener SAF, sin que se haya cuantificado adecuadamente su peso. Al encontrar estos factores, la decisión de solicitar los anticuerpos se basa en el juicio clínico de cada médico. Esto puede llevar a la solicitud innecesaria de paraclínicos, lo que puede aumentar los costos de atención. De hecho, la prevalencia de anticuerpos para SAF positivos en pacientes con eventos trombóticos no supera el 26,1%11, por lo que solicitar la prueba a todos los pacientes sería ineficiente.
Una aproximación para superar esa dificultad es identificar y cuantificar el peso de las variables clínicas y paraclínicas que permitan reconocer a los pacientes que con más probabilidad tendrán SAF. El objetivo del presente estudio es evaluar, en pacientes con eventos trombóticos arteriales y venosos, qué factores demográficos, clínicos y paraclínicos predicen el diagnóstico clínico de SAF, a partir de una cohorte de pacientes manejados en una institución de referencia en Colombia.
Materiales y métodosEstudio observacional analítico de casos y controles anidado en una cohorte histórica, en el que se evaluó a pacientes con eventos trombóticos que fueron manejados en un hospital universitario en Colombia entre septiembre de 2019 y enero de 2023. Se incluyeron pacientes mayores de 18años, con evento trombótico al ingreso (trombosis venosa profunda proximal, trombosis venosa profunda distal, tromboembolismo pulmonar, trombosis portal, trombosis de senos venosos, trombosis de la vena esplénica, trombosis de la vena renal, trombosis venosa mesentérica, trombosis yugular interna o trombosis arterial), y en quienes, ante la sospecha de hipercoagulabilidad, el médico tratante les hubiese solicitado medición de anticuerpos antifosfolípidos. Se excluyeron los pacientes con condiciones que generaran falsos positivos de anticuerpos antifosfolípidos (infección por hepatitisC, hepatitisB, sífilis, virus de la inmunodeficiencia humana (VIH), neoplasia hematológica, neoplasias gastrointestinales, genitourinarias, pulmonares y pacientes embarazadas.
Se identificó a los pacientes a partir del registro de valoraciones del servicio institucional de clínica de anticoagulación. Dentro de ellos se identificó a los pacientes con diagnóstico nuevo de evento trombótico, a quienes por la sospecha de hipercoagulabilidad se les habían solicitado mediciones de anticuerpos para SAF. Se procedió a recolectar la información clínica y paraclínica de interés a partir de la información consignada en el sistema de información de historias clínica del hospital, utilizando un formato de recolección estandarizado. La información recolectada incluía las variables demográficas, antecedentes de aborto, antecedentes de eventos trombóticos previos, antecedentes de otras enfermedades autoinmunes (lupus eritematoso sistémico, síndrome de Sjögren, miopatía inflamatoria, entre otras), uso de anticonceptivos orales, tipo de evento trombótico al ingreso, tiempo parcial de tromboplastina (TPT) y niveles de plaquetas al momento del evento, considerando trombocitopenia una cifra de plaquetas inferior a 150.000, y el resultado de anticuerpos para SAF (IgM e IgG anticardiolipinas, IgM e IgG anti β2-glicoproteína, y anticoagulante lúpico). Si el resultado de las pruebas iniciales para SAF era positivo, se buscó el resultado confirmatorio en la historia clínica, que hubiese sido tomado con al menos 12semanas de diferencia.
Para el análisis de la información se crearon cuatro grupos: 1)los pacientes positivos confirmados, es decir, aquellos que cumplieron con los criterios de clasificación de Sapporo12 para SAF; 2)los pacientes triple positivos (tres pruebas positivas en la medición inicial), considerando su riesgo de hasta 33 veces de generar trombosis13; 3)los pacientes positivos en la medición inicial (una o dos pruebas) pero sin confirmación de positividad a las 12semanas, y 4)los pacientes negativos, es decir, aquellos que tuvieron un panel negativo inicial, o uno positivo inicial pero con control negativo en la medición de control a las 12semanas. Los valores de corte del laboratorio para anticuerpos anticardiolipinas y β2-glicoproteína fueron de 20GPLU/ml para IgG y 20MPLU/ml para IgM. El punto de corte para el ratio de anticoagulante lúpico fue mayor a 1,2. El uso del punto de corte menor al recomendado por criterios de Sapporo se ha evidenciado en otras publicaciones como factor de riesgo para trombosis14. La técnica usada para procesar las mediciones fue inmunoanálisis enzimático.
Para el análisis descriptivo se reportaron números absolutos, en tanto que para las variables categóricas se usaron proporciones, y para las variables continuas (media y desviación estándar o medianas y rango intercuartílico) se emplearon medidas de tendencia central y de dispersión, dependiendo de la distribución de los datos. Se usó la prueba de Shapiro Wilk para evaluar el supuesto de distribución normal. Para la comparación de subgrupos se usaron las pruebas χ2, U de Mann-Whitney o una prueba t según el tipo de variable. Se utilizó la prueba de Kruskal Wallis para la comparación de variables continuas en tres o más grupos. Finalmente, para el análisis de regresión logística se definieron como casos los pacientes que cumplieran con los criterios de clasificación de Sapporo o un resultado triple positivo (grupos1 y2), y como controles los pacientes negativos (grupo4). La asociación entre cada factor y el diagnóstico de SAF se evaluó primero en un análisis univariado y después en un análisis multivariado, incluyendo inicialmente todas las variables asociadas en el análisis univariado, y las que se han descrito como asociadas en estudios previos. Con posterioridad, se seleccionaron las variables con el método de stepwise backward, incluyendo en el modelo final las variables que mostraron asociación estadísticamente significativa (p<0,05). El análisis estadístico se realizó con el paquete de análisis estadístico Stata (Stata Statistical Software: Release 16, TX: StataCorp LP).
Consideraciones éticasEl protocolo fue aprobado por el comité de ética institucional del hospital donde se llevó a cabo la investigación, en consonancia con el código ético de la OMS (Declaración de Helsinki) sobre experimentación en humanos. De acuerdo con la Resolución 8430 de 1993, este estudio se categoriza como investigación sin riesgo. Dado que se trata de una cohorte retrospectiva de una base de datos, no se realizó la toma de consentimiento informado. Los autores declaran que este artículo no contiene información personal que permita identificar a los pacientes.
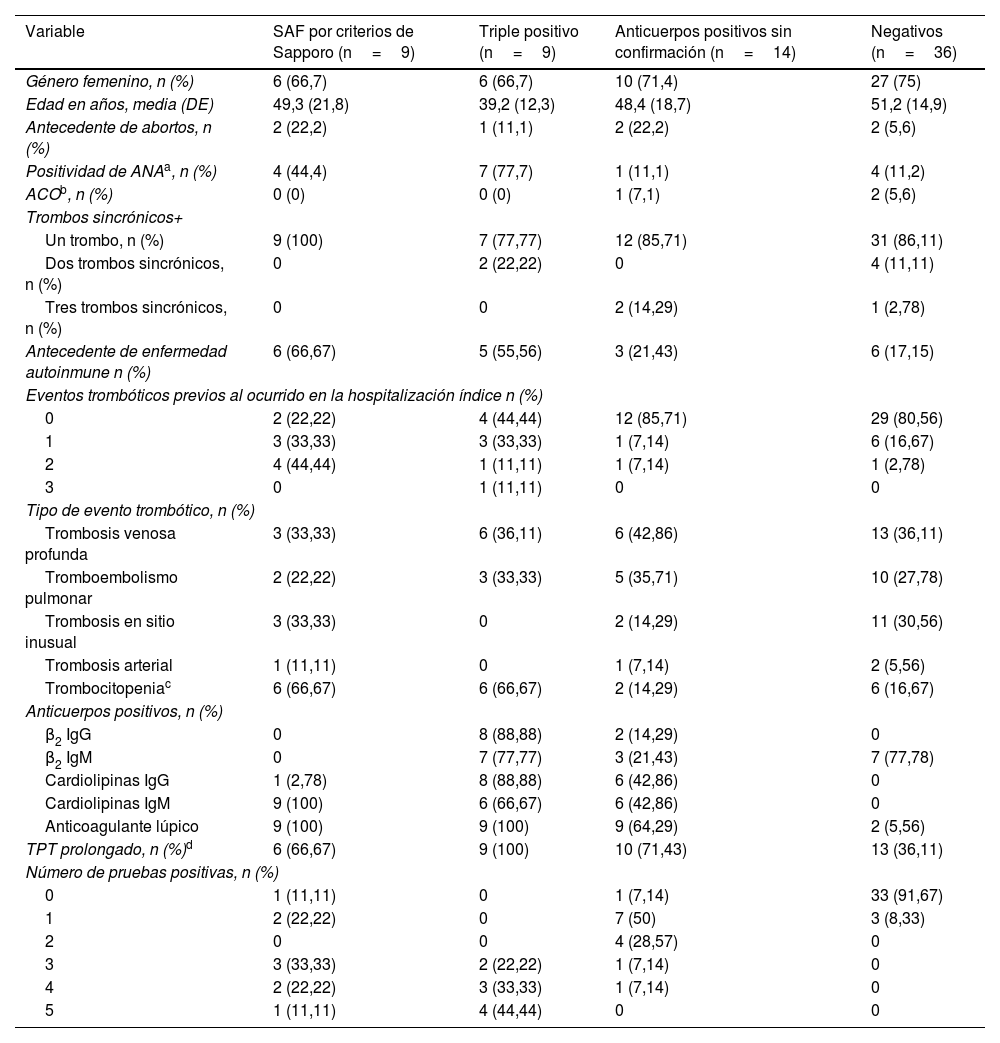
ResultadosEn el análisis se incluyeron 68 pacientes, 9 de los cuales tuvieron criterios positivos de Sapporo (grupo1), otros 9 fueron triple positivo en la medición inicial (grupo2), 14 fueron positivos en la prueba inicial sin confirmación posterior (grupo3) y 36 fueron negativos (grupo4). Las características clínicas y demográficas, de acuerdo con el grupo de análisis, se presentan en la tabla 1. El promedio de edad en los diferentes grupos estuvo entre 39 y 52años, la mayoría fueron mujeres (72%), y los tipos de eventos trombóticos más frecuentes fueron trombosis venosa profunda (41,2%) y tromboembolismo pulmonar (29,4%). Las características clínicas y la positividad de SAF fueron similares entre los cuatro pacientes que presentaron trombosis arteriales.
Variables demográficas y clínicas de los pacientes incluidos en el estudio
| Variable | SAF por criterios de Sapporo (n=9) | Triple positivo (n=9) | Anticuerpos positivos sin confirmación (n=14) | Negativos (n=36) |
|---|---|---|---|---|
| Género femenino, n (%) | 6 (66,7) | 6 (66,7) | 10 (71,4) | 27 (75) |
| Edad en años, media (DE) | 49,3 (21,8) | 39,2 (12,3) | 48,4 (18,7) | 51,2 (14,9) |
| Antecedente de abortos, n (%) | 2 (22,2) | 1 (11,1) | 2 (22,2) | 2 (5,6) |
| Positividad de ANAa, n (%) | 4 (44,4) | 7 (77,7) | 1 (11,1) | 4 (11,2) |
| ACOb, n (%) | 0 (0) | 0 (0) | 1 (7,1) | 2 (5,6) |
| Trombos sincrónicos+ | ||||
| Un trombo, n (%) | 9 (100) | 7 (77,77) | 12 (85,71) | 31 (86,11) |
| Dos trombos sincrónicos, n (%) | 0 | 2 (22,22) | 0 | 4 (11,11) |
| Tres trombos sincrónicos, n (%) | 0 | 0 | 2 (14,29) | 1 (2,78) |
| Antecedente de enfermedad autoinmune n (%) | 6 (66,67) | 5 (55,56) | 3 (21,43) | 6 (17,15) |
| Eventos trombóticos previos al ocurrido en la hospitalización índice n (%) | ||||
| 0 | 2 (22,22) | 4 (44,44) | 12 (85,71) | 29 (80,56) |
| 1 | 3 (33,33) | 3 (33,33) | 1 (7,14) | 6 (16,67) |
| 2 | 4 (44,44) | 1 (11,11) | 1 (7,14) | 1 (2,78) |
| 3 | 0 | 1 (11,11) | 0 | 0 |
| Tipo de evento trombótico, n (%) | ||||
| Trombosis venosa profunda | 3 (33,33) | 6 (36,11) | 6 (42,86) | 13 (36,11) |
| Tromboembolismo pulmonar | 2 (22,22) | 3 (33,33) | 5 (35,71) | 10 (27,78) |
| Trombosis en sitio inusual | 3 (33,33) | 0 | 2 (14,29) | 11 (30,56) |
| Trombosis arterial | 1 (11,11) | 0 | 1 (7,14) | 2 (5,56) |
| Trombocitopeniac | 6 (66,67) | 6 (66,67) | 2 (14,29) | 6 (16,67) |
| Anticuerpos positivos, n (%) | ||||
| β2 IgG | 0 | 8 (88,88) | 2 (14,29) | 0 |
| β2 IgM | 0 | 7 (77,77) | 3 (21,43) | 7 (77,78) |
| Cardiolipinas IgG | 1 (2,78) | 8 (88,88) | 6 (42,86) | 0 |
| Cardiolipinas IgM | 9 (100) | 6 (66,67) | 6 (42,86) | 0 |
| Anticoagulante lúpico | 9 (100) | 9 (100) | 9 (64,29) | 2 (5,56) |
| TPT prolongado, n (%)d | 6 (66,67) | 9 (100) | 10 (71,43) | 13 (36,11) |
| Número de pruebas positivas, n (%) | ||||
| 0 | 1 (11,11) | 0 | 1 (7,14) | 33 (91,67) |
| 1 | 2 (22,22) | 0 | 7 (50) | 3 (8,33) |
| 2 | 0 | 0 | 4 (28,57) | 0 |
| 3 | 3 (33,33) | 2 (22,22) | 1 (7,14) | 0 |
| 4 | 2 (22,22) | 3 (33,33) | 1 (7,14) | 0 |
| 5 | 1 (11,11) | 4 (44,44) | 0 | 0 |
ACO: anticonceptivos orales.
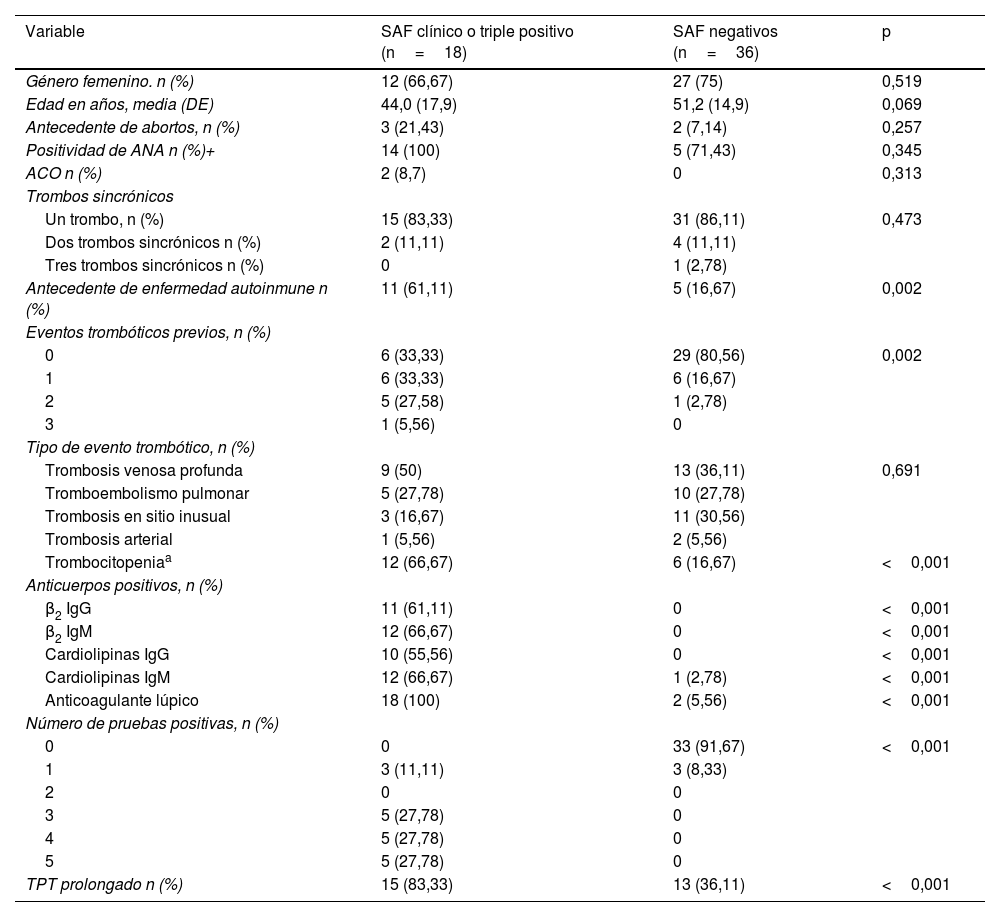
En la tabla 2 se presenta una comparación entre los pacientes con diagnóstico confirmado de SAF o triple positivos (grupos1 y2) y los pacientes negativos (grupo4). No se encontraron diferencias significativas en la edad (44,0±17,9 vs. 51,2±14,9, p=0,069), pero sí mayor frecuencia de antecedente de enfermedad autoinmune (61,1% vs. 16,7%, p=0,002) y mayor frecuencia de eventos trombóticos previos (p=0,002). De igual forma, en el grupo de pacientes con SAF confirmado fue más frecuente la prolongación de al menos 5 segundos en el TPT (83,3% vs. 36,1%, p<0,001) y la trombocitopenia (66,7% vs. 16,7%, p<0,001).
Comparación entre pacientes con SAF clínico o triple positivo vs. SAF negativo
| Variable | SAF clínico o triple positivo (n=18) | SAF negativos (n=36) | p |
|---|---|---|---|
| Género femenino. n (%) | 12 (66,67) | 27 (75) | 0,519 |
| Edad en años, media (DE) | 44,0 (17,9) | 51,2 (14,9) | 0,069 |
| Antecedente de abortos, n (%) | 3 (21,43) | 2 (7,14) | 0,257 |
| Positividad de ANA n (%)+ | 14 (100) | 5 (71,43) | 0,345 |
| ACO n (%) | 2 (8,7) | 0 | 0,313 |
| Trombos sincrónicos | |||
| Un trombo, n (%) | 15 (83,33) | 31 (86,11) | 0,473 |
| Dos trombos sincrónicos n (%) | 2 (11,11) | 4 (11,11) | |
| Tres trombos sincrónicos n (%) | 0 | 1 (2,78) | |
| Antecedente de enfermedad autoinmune n (%) | 11 (61,11) | 5 (16,67) | 0,002 |
| Eventos trombóticos previos, n (%) | |||
| 0 | 6 (33,33) | 29 (80,56) | 0,002 |
| 1 | 6 (33,33) | 6 (16,67) | |
| 2 | 5 (27,58) | 1 (2,78) | |
| 3 | 1 (5,56) | 0 | |
| Tipo de evento trombótico, n (%) | |||
| Trombosis venosa profunda | 9 (50) | 13 (36,11) | 0,691 |
| Tromboembolismo pulmonar | 5 (27,78) | 10 (27,78) | |
| Trombosis en sitio inusual | 3 (16,67) | 11 (30,56) | |
| Trombosis arterial | 1 (5,56) | 2 (5,56) | |
| Trombocitopeniaa | 12 (66,67) | 6 (16,67) | <0,001 |
| Anticuerpos positivos, n (%) | |||
| β2 IgG | 11 (61,11) | 0 | <0,001 |
| β2 IgM | 12 (66,67) | 0 | <0,001 |
| Cardiolipinas IgG | 10 (55,56) | 0 | <0,001 |
| Cardiolipinas IgM | 12 (66,67) | 1 (2,78) | <0,001 |
| Anticoagulante lúpico | 18 (100) | 2 (5,56) | <0,001 |
| Número de pruebas positivas, n (%) | |||
| 0 | 0 | 33 (91,67) | <0,001 |
| 1 | 3 (11,11) | 3 (8,33) | |
| 2 | 0 | 0 | |
| 3 | 5 (27,78) | 0 | |
| 4 | 5 (27,78) | 0 | |
| 5 | 5 (27,78) | 0 | |
| TPT prolongado n (%) | 15 (83,33) | 13 (36,11) | <0,001 |
ACO: anticonceptivos orales.
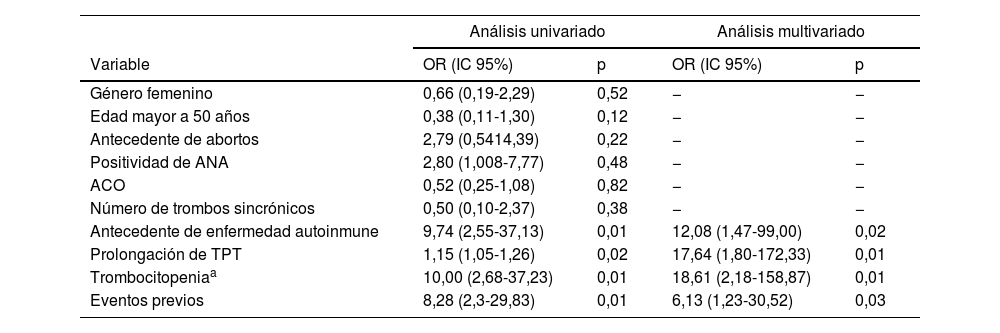
En la tabla 3 se presenta el análisis univariado o multivariado de los factores asociados con el diagnóstico de SAF clínico o triple positividad de anticuerpos. En el análisis univariado se encontró que el antecedente de enfermedad autoinmune (OR: 9,74; IC95%: 2,55-37,13; p=0,01), la prolongación del TPT por encima de cinco segundos (OR: 1,15; IC95%: 1,05-1,26; p=0,02), la trombocitopenia (OR: 10,0; IC95%: 2,68-37,23; p=0,01) y los eventos previos (OR: 8,28; IC95%: 2,3-29,83; p=0,01) estuvieron asociados al diagnóstico de SAF clínico. En el análisis multivariado se encontró que los factores independientemente asociados al diagnóstico fueron la presencia de enfermedad autoinmune (OR: 12,1; IC95%: 1,47-99,00; p=0,02), prolongación del TPT (OR: 17,6; IC95%: 1,80-172,33, p=0,01), trombocitopenia menor a 150.000 (OR: 18,6; IC95%: 2,18-158,87; p<0,01) y la presencia de eventos previos de trombosis (OR: 6,1 por cada evento; IC95%: 1,23-30,52; p=0,03).
Análisis univariado o multivariado de los factores asociados con el diagnóstico de SAF o triple positividad de anticuerpos
| Análisis univariado | Análisis multivariado | |||
|---|---|---|---|---|
| Variable | OR (IC 95%) | p | OR (IC 95%) | p |
| Género femenino | 0,66 (0,19-2,29) | 0,52 | − | − |
| Edad mayor a 50 años | 0,38 (0,11-1,30) | 0,12 | − | − |
| Antecedente de abortos | 2,79 (0,5414,39) | 0,22 | − | − |
| Positividad de ANA | 2,80 (1,008-7,77) | 0,48 | − | − |
| ACO | 0,52 (0,25-1,08) | 0,82 | − | − |
| Número de trombos sincrónicos | 0,50 (0,10-2,37) | 0,38 | − | − |
| Antecedente de enfermedad autoinmune | 9,74 (2,55-37,13) | 0,01 | 12,08 (1,47-99,00) | 0,02 |
| Prolongación de TPT | 1,15 (1,05-1,26) | 0,02 | 17,64 (1,80-172,33) | 0,01 |
| Trombocitopeniaa | 10,00 (2,68-37,23) | 0,01 | 18,61 (2,18-158,87) | 0,01 |
| Eventos previos | 8,28 (2,3-29,83) | 0,01 | 6,13 (1,23-30,52) | 0,03 |
ACO: anticonceptivos orales.
El presente estudio encontró que existe una mayor posibilidad de confirmación del diagnóstico de SAF en caso de: antecedentes de enfermedad autoinmune, prolongación del TPT a más de 5 segundos, trombocitopenia y eventos trombóticos previos. Otras variables, como la edad menor a 50años, una trombosis en sitio inusual y la morbilidad en el embarazo no estuvieron significativamente asociadas.
Los autores de los criterios de clasificación de Sapporo modificados sugieren que no es práctico tener criterios de exclusión estrictos para el estudio de SAF, ya que en un solo paciente pueden converger múltiples factores de riesgo6. La ISTH, con base en la evidencia de sus sugerencias previas y otras guías al respecto, sugiere realizar anticuerpos antifosfolípido para evaluar el perfil de riesgo en pacientes que probablemente tienen SAF10, como: 1)edad menor a 50años con ACV o AIT; 2)eventos tromboembólicos no provocados o trombosis arterial; 3)trombosis en sitio inusual; 4)trombosis microvascular; 5)trombosis venosa recurrente no explicada por anticoagulación, no adherencia, o malignidad, y 6)morbilidad en el embarazo que cumpla criterios de Sapporo.
Las guías de la BSH3, con base en evidencia indirecta, dado que los estudios utilizados no son estudios que permitan evaluar causalidad, consideran solicitar los anticuerpos en las siguientes situaciones: 1)siete días después de finalizar el manejo anticoagulante para trombosis venosa no provocada, o 2)adultos jóvenes (<50años) con evento cerebrovascular isquémico.
Nuestro estudio refuerza la importancia de algunos factores en este listado como eventos previos no provocados, pero no encuentra asociación con otros, como la edad, de forma independiente. Es probable que esta diferencia se explique porque la edad es un factor de confusión, y que la asociación encuentre explicación en la presencia de otras enfermedades autoinmunes que suelen presentarse en personas más jóvenes.
La asociación documentada en pacientes con enfermedad autoinmune era esperable. De hecho, el SAF está frecuentemente asociado a varias de estas entidades, como se ilustra en la cohorte de seguimiento de 1.000 pacientes con SAF, donde se encontró una asociación con lupus en el 36,2%, Sjögren en el 2,2% y artritis reumatoide en el 1,8%15, y en una cohorte de 128 pacientes con SAF en la que al cabo de 8años el 8% desarrollaron lupus16.
El papel de la plaqueta en el SAF está bien definido, y es central en su patogénesis17. La explicación más probable de la trombocitopenia tiene que ver con el consumo secundario a activación por trombosis, lo que explica la fuerte asociación que encontramos entre SAF y valores <150.000 plaquetas. Su frecuencia se estimó en una revisión de literatura con un total de 1.455 pacientes con una prevalencia del 25%18. En este último artículo sugieren la trombocitopenia como un posible factor pronóstico. Durante el desarrollo de la presente investigación se propusieron nuevos criterios de clasificación de SAF por parte del American College of Rheumatology [ACR] y EULAR19. Dichas guías reconocen también la importancia de la trombocitopenia en el diagnóstico del SAF, y llegan a incluirla como un dominio clínico nuevo que puede aportar puntos a la clasificación del paciente con SAF19.
A diferencia de nuestro estudio, otras cohortes previas, como la de Cervera et al.15, el repositorio y la base clínica internacional APS ACTION, y el estudio de Díaz, que es la mayor cohorte colombiana de SAF20, no encontraron una prevalencia importante de la prolongación del TPT. Sin embargo, las nuevas guías de la ACR y EULAR 202319 sí reconocen la importancia del anticoagulante lúpico en el diagnóstico de SAF, dándole más importancia cuando es persistentemente positivo. El anticoagulante lúpico es un estudio que se basa en la prolongación del TPT, lo cual es un efecto paradójico de una enfermedad procoagulante como el SAF. Su explicación es que los estudios de TPT son ensayos dependientes de la anticoagulación con fosfolípidos, de modo que, al haber anticuerpos contra estos últimos, se prolonga el tiempo de coagulación. Inicialmente, se deben utilizar dos estudios iniciales, ya que esto permite reducir los falsos positivos. Dentro de estos estudios se encuentra el TPT. Nuestros resultados sugieren, por tanto, que la prolongación del TPT debería considerarse un factor pretest que sugiere riesgo alto de tener un diagnóstico confirmado de SAF después de seguir el proceso diagnóstico completo.
Nuestros resultados sugieren que, a la hora de estudiar un paciente con una trombosis venosa o arterial, debe prestarse especial atención al antecedente de enfermedad autoinmune o sospecha clínica de esta, trombocitopenia, eventos previos y TPT prolongado sin otra causa aparente. La presencia de cualquiera de ellos, y más aun de varios de ellos de forma simultánea, debería aumentar la sospecha de SAF y llevar a tomar el perfil de anticuerpos para confirmarlo.
Nuestra población fue muy pequeña con respecto a los pacientes con SAF secundario, por lo que no se realizó una comparación de los dos grupos; sin embargo, la literatura no muestra diferencias significativas entre estas dos poblaciones21.
Es escasa la literatura que compara grupos de pacientes que cumplen y no cumplen los criterios de SAF de Sapporo modificados. Un estudio en Canadá22 incluyó a 524 pacientes entre los 18 y los 50años con un evento venoso no provocado. De ellos, 491 fueron estudiados para SAF y 44 cumplieron los criterios de clasificación de Sapporo. En el 59,1% de los casos se encontró que una de las tres pruebas era positiva, el 25% tenían dos pruebas positivas, y el 15,9% eran triples positivos. No se hallaron diferencias en los dos grupos de SAF confirmado por criterios de Sapporo modificado, y negativos, con respecto a género de los pacientes, historia previa de eventos arteriales, trombosis venosa profunda, tromboembolismo pulmonar, y la edad no fue un factor diferencial en su estudio. Su único hallazgo diferencial fue la proporción de anticonceptivos orales (ACO). Estos hallazgos son similares a los que encontramos en nuestra población.
Con respecto a la realización del cribado de SAF, la guía de seguimiento de tromboembolismo pulmonar de la Sociedad de Cardiología Europea (European Society of Cardiology [ESC])9 propone limitar la detección de SAF a pacientes con tromboembolismo pulmonar no provocado que presentan factores de riesgo para SAF. Doce de los 16 miembros del panel propusieron evaluar a los pacientes con tromboembolismo pulmonar no provocado para detectar SAF, en caso de episodios previos de enfermedad arterial o trombosis microvascular, trombosis previa en sitios inusuales, complicaciones del embarazo como abortos espontáneos recurrentes o preeclampsia/eclampsia, enfermedades autoinmunes, edad más joven (<50años) o pacientes con un TPT activado prolongado previo al tratamiento inexplicable. Sin embargo, es importante tener en cuenta que la decisión de definir qué pacientes estaban en riesgo estuvo dividida en los miembros del panel, dada la ausencia de evidencia fuerte que respalde una u otra decisión. Nuestros datos soportan la recomendación para algunos de esos factores, como la presencia de TPT prolongado, enfermedad autoinmune o eventos trombóticos previos. Evaluar si en otros casos, como el antecedente de complicaciones obstétricas o la edad <50años, se debe considerar sistemáticamente la toma de pruebas para SAF requerirá estudios adicionales.
La principal limitación de este estudio es el tamaño de la muestra, relativamente pequeña, lo que reduce la precisión de los resultados. De hecho, es posible que con un mayor tamaño de muestra otras variables como la edad y la localización del trombo pudiesen llegar a estar asociadas al diagnóstico, aunque muy probablemente con una fuerza menor al encontrado para las variables aquí presentadas. Posteriormente, para definir el impacto independiente de cada variable, deberán realizarse estudios multicéntricos con un mayor tamaño de muestra.Dichos estudios podrían permitir en el futuro crear una escala que permita discriminar los pacientes con bajo o alto riesgo de SAF, lo que resultaría de gran utilidad clínica.
Otra limitación del estudio aquí presentado es que los estudios se realizaron con posterioridad al diagnóstico de la trombosis, con un correspondiente inicio de anticoagulación. Eso podría tener un sesgo al realizarlo posterior al inicio de la anticoagulación y no poder confirmar el diagnóstico con las pruebas tomadas 12 semanas después en una proporción de pacientes con resultado negativo. Sin embargo, lo evidenciado en el estudio refleja lo que se hace en la vida real, dado el riesgo que supone suspender el anticoagulante durante el periodo agudo, para toma de pruebas o suspenderlo para los exámenes de confirmación a las 12 semanas.
También debe reconocerse que en algunos casos no se encontraron documentados claramente los antecedentes obstétricos, dado que no estaban consignados en las historias clínicas. Si bien la información faltante fue limitada, el grupo investigador prefirió no reportar dichos antecedentes para evitar sesgos en el reporte.
Una limitación adicional de nuestro estudio es que no se pudo evaluar si los mismos factores encontrados pueden predecir un diagnóstico de SAF según los nuevos criterios propuestos recientemente por ACR y EULAR en el año 2023. Nuestra metodología retrospectiva impide hacer este análisis, dado que dichos criterios incorporan nuevos dominios clínicos, como la presencia al examen de livedo racemosa o lesiones de vasculopatía livedoide, o la documentación de complicaciones como hemorragia pulmonar, hemorragia suprarrenal, enfermedad miocárdica o compromiso valvular cardiaco. Dichos dominios hasta ahora no han sido registrados sistemáticamente en la historia clínica en múltiples instituciones, incluida la nuestra. Se necesitarán nuevos estudios prospectivos, en los que se evalúen dichos dominios, para confirmar nuestros hallazgos con los nuevos criterios del 2023.
Finalmente, el número de pacientes con trombosis arterial fue mínimo, por lo cual la validez externa en esta población es muy limitada. Se requerirán estudios adicionales en pacientes con trombosis arterial como manifestación clínica para confirmar nuestros hallazgos. De igual forma, algunos pacientes con diagnóstico de SAF pudieron quedar excluidos al no ser solicitadas las pruebas cuando el médico tratante no sospechaba la enfermedad.
En conclusión, se encontró una mayor posibilidad de confirmación del diagnóstico de SAF en caso de antecedentes de enfermedad autoinmune, prolongación del TPT a más de cinco segundos, trombocitopenia y eventos trombóticos previos. En estos pacientes es muy recomendable solicitar anticuerpos para SAF. Aplicar esta recomendación podría hacer que el rendimiento diagnóstico mejore, de modo que aumente la proporción de confirmación diagnóstica y se racionalice el uso de los recursos.
FinanciaciónLa financiación fue proporcionada por el Hospital Universitario San Ignacio y la Pontificia Universidad Javeriana (Bogotá, Colombia).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.