El síndrome autoinmune/inflamatorio inducido por adyuvantes (ASIA) comprende un espectro de manifestaciones clínicas asociadas con la exposición a distintos adyuvantes, los cuales tienen en común la generación de autoanticuerpos no específicos a partir de la pérdida de tolerancia inmune.
ObjetivoEl objetivo del estudio fue llevar a cabo una revisión narrativa de la literatura sobre la patogénesis que subyace al síndrome de ASIA, su diferenciación de otros procesos autoinmunes definidos y las perspectivas de la investigación futura en este campo.
Materiales y métodosSe hizo una revisión narrativa de la literatura en Pubmed, Embase y LILACS, se incluyeron todo tipo de publicaciones en el tema, sin límite de tiempo, en inglés y español. Finalmente, se incluyen 25 artículos publicados desde 1990, a partir de los cuales se revisa la patogénesis, los criterios diagnósticos y su diferenciación de otros procesos autoinmunes definidos.
ResultadosLa aparición del síndrome de ASIA parece estar vinculada a una predisposición genetica individual (HLA-DRB1*01 o HLA-DRB4) y es el resultado de la interacción de factores externos y endógenos que desencadenan fenómenos de autoinmunidad. En los últimos años, los médicos son más conscientes de la relación entre la exposición a los adyuvantes y el desarrollo de síntomas larvados en el tiempo que pueden corresponder a un síndrome de ASIA. La evidencia actual que apoya su existencia aún es controvertida. El diagnóstico oportuno requiere un enfoque multidisciplinario y podría hacer necesario un tratamiento inmunosupresor en casos particulares.
ConclusionesLa exposición a adyuvantes y su relación con la aparición de fenómenos de autoinmunidad ha sido reconocida en los ultimos años. En la práctica clínica pueden encontrarse casos del síndrome de ASIA, a pesar de que la evidencia que sustenta la relación entre adyuvantes y manifestaciones clínicas autoinmunes aún es debatida. Los criterios clasificatorios del síndrome de ASIA requieren validación en diversas poblaciones, antes de ser aplicados en la selección de pacientes para estudios clínicos. Es necesario identificar los factores de riesgo para el síndrome de ASIA, con el fin de comprender mejor la fisiopatología y hacer un diagnóstico oportuno.
Adjuvant-induced autoimmune/inflammatory syndrome (ASIA) comprises a spectrum of clinical manifestations associated with exposure to diverse adjuvants that have in common the generation of non-specific autoantibodies and loss of immune tolerance.
ObjectiveThis study aimed to develop a narrative review of the literature about the pathogenesis underlying ASIA syndrome, its differentiation from other defined autoimmune diseases, and prospects for future research in this field.
Materials and methodsA narrative review of the literature was conducted using Pubmed, Embase, and LILACS. All publications on the subject were included, with no time limit in English and Spanish. Finally, 25 articles published since 1990 were included, from which we reviewed the pathogenesis, diagnostic criteria, and its differentiation from other defined autoimmune processes.
ResultsThe appearance of ASIA syndrome seems to be linked to an individual's genetic predisposition (HLA-DRB1*01 or HLA-DRB4) and is the result of the interaction of external and endogenous factors that trigger autoimmune phenomena. In recent years, physicians have become more aware of the relationship between exposure to adjuvants and the development of underlying signs and symptoms that may correspond to ASIA syndrome. The current evidence supporting its existence is still contradictory. A timely diagnosis requires a multidisciplinary approach and could require immunosuppressive treatment in particular cases.
ConclusionsIn recent years a relationship between exposure to adjuvants and the appearance of autoimmunity phenomena has been recognized. In clinical practice, physicians can find cases of ASIA syndrome. However, the evidence is still debated on the relationship between adjuvants and autoimmune clinical manifestations. ASIA syndrome classification criteria require validation in various populations before being applied to select patients for clinical studies. It is necessary to identify the risk factors for ASIA syndrome to understand its pathophysiology and make a timely diagnosis.
En el año 1964, Miyoshi et al. comunicaron por primera vez las posibles complicaciones del tratamiento con rellenos de silicona y parafina, incluidas bajo el nombre de enfermedad adyuvante humana (EAH). Entre el 2008 y el 2012, Alijotas-Reig et al. describieron una serie de casos que denominaron «enfermedad similar a la adyuvante humana», para hacer referencia a las manifestaciones desencadenadas por bioimplantes sintéticos diferentes a la silicona y la parafina1,2.
En el año 2011, Shoenfeld y Agmon-Levin acuñaron el término síndrome autoinmune/autoinflamatorio inducido por adyuvantes (ASIA, por sus siglas en inglés), para describir ciertas manifestaciones clínicas, resultado de una respuesta inmune a los adyuvantes. Dichas condiciones aparecen con un tiempo de latencia variable (desde 3 semanas hasta varios años), producto de la interacción entre factores genéticos y ambientales en ciertas poblaciones de riesgo3.
El síndrome de ASIA es un conjunto de síntomas y signos que se presentan en personas expuestas a adyuvantes (sustancias capaces de aumentar la inmunogenicidad de un antígeno sin despertar una respuesta inmune per se) presentes en excipientes de vacunas (sales de hidróxido o fosfato de aluminio), prótesis (mamarias, glúteas o rellenos faciales) e incluso dispositivos médicos (como marcapasos). Teóricamente, estos adyuvantes pueden generar una pérdida de la tolerancia, y con ello una disregulación de la inmunidad humoral y celular frente a antígenos propios, en los pacientes con una predisposición genética dada por la mayor prevalencia de algunos alelos (p. ej., HLA-DQ2 y DRW53)3,4.
En términos generales, el síndrome de ASIA agrupa 4 entidades: el síndrome de miofascitis macrofágica, el síndrome de la guerra del Golfo, la siliconosis y los fenómenos posvacunales específicos de algunas vacunas que tienen hidróxido de aluminio como adyuvante (p. ej., vacuna contra VHP e influenza). Se ha propuesto la inclusión de una quinta enfermedad, denominada síndrome de edificio enfermo (sick building syndrome), que no es aceptada por algunos autores, ya que consiste principalmente en manifestaciones generales inespecíficas y respiratorias, probablemente relacionadas con una susceptibilidad aumentada a estímulos medioambientales como la polución y la contaminación aérea3,4. Por esta razón y debido a que la demostración de este síndrome se basa principalmente en el autorreporte de síntomas, el síndrome del edificio enfermo no será parte de esta revisión.
El diagnóstico es de exclusión. La historia clínica y los antecedentes personales son claves, y ciertos anticuerpos específicos guardan relación con el síndrome (e. g., los anticuerpos antiescualeno). Por otro lado, la resonancia magnética (RM) ha demostrado ser útil para la localización de la silicona a distancia, documentar granulomas en tejido celular subcutáneo y músculos5.
Para su diagnóstico, en el año 2011 Shoenfeld y Agmon-Levin3 propusieron 12 criterios clínicos. La presencia de 2 criterios mayores o uno mayor y 2 menores es suficiente para clasificar como síndrome de ASIA. Dichos criterios son poco específicos, algunos de sus componentes no están suficientemente definidos, y en la práctica podrían llevar a clasificar erróneamente como síndrome de ASIA varias enfermedades autoinmunes como el lupus o la artritis reumatoide. Recientemente, Alijotas-Reig propuso nuevos criterios clasificatorios para síndrome de ASIA, pero ambas propuestas aun no han sido validadas6.
Se presenta una revisión narrativa de la literatura acerca del síndrome de ASIA, desde los fundamentos fisiopatológicos, sus características clínicas y el abordaje diagnóstico que le permitan al personal sanitario reconocer oportunamente casos sospechosos en la práctica clínica.
ObjetivoLlevar a cabo una revisión narrativa de la literatura sobre la patogénesis que subyace al síndrome de ASIA, su diferenciación de otros procesos autoinmunes definidos y las perspectivas de la investigación futura en este campo.
MetodologíaBúsqueda de la literaturaSe hizo una búsqueda bibliográfica en las bases de datos PubMed, Embase y LILACS, para lo cual se utilizaron los términos MeSH «ASIA syndrome» AND «Silicone» AND «Review» entre enero y abril del año 2022.
No hubo límite de tiempo para las publicaciones, dado que la mayoría de los estudios provienen de cohortes retrospectivas analizadas en diferido, y que los criterios diagnósticos propuestos para el síndrome de ASIA han venido modificándose con el tiempo.
PoblaciónSe incluyeron los estudios con pacientes mayores de 18 años que cumplieran los criterios diagnósticos del síndrome de ASIA, de acuerdo con lo reportado en la literatura.
Criterios de inclusiónSe incluyeron todo tipo de publicaciones en el tema, como reportes de caso, ensayos clínicos, revisiones narrativas, revisiones sistemáticas, cartas al editor y editoriales. Así mismo, se filtró por idioma inglés, con lo que se encontraron inicialmente 62 resultados.
Selección de los estudiosSe incluyeron en su mayoría revisiones generales del tema, limitando la selección finalmente a 25 artículos publicados a partir del año 1990, teniendo en cuenta su relevancia, objetividad y pertinencia de contenido.
ResultadosDefiniciónASIA comprende un conjunto de síntomas y signos clínicos que aparecen con un tiempo de latencia variable luego de la exposición a un adyuvante (aluminio, escualeno, pristano o silicona), que pueden cumplir o no criterios de clasificación definidos para algunas enfermedades inmunomediadas (lupus, artritis reumatoide, miopatías inflamatorias, esclerosis sistémica, vasculitis o sarcoidosis), o incluso fibromialgia3,4.
El síndrome de miofascitis macrofágica es la infiltración de macrofágos y linfocitos T CD8+ cargados de nanopartículas de aluminio en la fascia y el músculo estriado esquelético, en ausencia de necrosis/daño de la fibra muscular o depósito de proteínas del sistema de complemento. Ha sido descrito en relación con vacunas (e. g., contra virus de hepatitis B) que contienen hidróxido de aluminio. El síndrome está estrechamente asociado a polimorfismos en el complejo mayor de histocompatibilidad HLA-DRB1*014,6.
El síndrome de la guerra del Golfo agrupa fatiga crónica y trastornos del sueño relacionados con la exposición a escualeno, y probablemente hidróxido de aluminio, en pacientes expuestos a vacunación contra el ántrax. Guarda semejanza con la fibromialgia, pero su relación con anticuerpos antiescualeno sugiere un imbalance en la regulación de las células T ayudadoras tipo 2 (Th2)4.
La siliconosis o síndrome de incompatibilidad a implantes de silicona se presenta como las anteriores condiciones descritas. La respuesta inmune aberrante (tanto a nivel clínico como de autoanticuerpos circulantes) facilitada por esta sustancia puede disminuir luego del retiro del material implantado3.
En reportes y series de casos, se han descrito fenómenos postvacunales que recuerdan síntomas relacionados con autoinmunidad, por ejemplo, artralgias, mialgias, fatiga y malestar general en pacientes expuestos a vacunación contra VPH e influenza, en relación con adyuvantes de hidróxido y fosfato de aluminio. Algunos pacientes con patología autoinmune preexistente podrían presentar reactivación de la sintomatología luego de la aplicación de vacunas. Sin embargo, la evidencia de la seguridad y eficacia de las vacunas no soporta una asociación entre estas y la aparición de fenomenos autoinmunes, por lo que en el futuro la identificación de factores de riesgo en la población, así como el seguimiento clínico a largo plazo (estudios post-marketing y pragmáticos), ayudarían a definir mejor un balance riesgo/beneficio con respecto a la vacunación en población adulta. Hoy por hoy, es indiscutible el beneficio de la vacunación en la prevención de enfermedades infecciosas y sus complicaciones, y los riesgos de fenómenos postvacunales graves son mínimos. No se ha descrito consistentemente una relación causa-efecto entre vacunación y aparición del síndrome de ASIA3.
EpidemiologíaDesde el año 2011 y hasta la fecha, se han reportado más de 4.479 casos considerados como síndrome de ASIA. El 92,7% de los pacientes fueron mujeres y los casos estuvieron asociados principalmente a adyuvantes presentes en vacunas contra el virus del papiloma humano y la hepatitis B. En esta revisión sistemática se informó de un 6,8% de casos graves y una mortalidad del 0,24%7. La prevalencia varía entre el 0,5 y el 25,7%, siendo más frecuentes las presentaciones clínicas compatibles con enfermedades autoinmunes poligénicas como la artritis reumatoide y el lupus eritematoso sistémico. Las condiciones autoinflamatorias son raras (0,5-2,5%)7. En nuestro medio, a la fecha no se dispone de datos sobre la frecuencia y los factores de riesgo asociados al síndrome de ASIA. Por otra parte, la relación entre adyuvantes y la aparición de fenómenos autoinmunes sigue siendo un tema controvertido. No obstante, algunos estudios observacionales han sugerido una relación entre la exposición a adyuvantes y fenómenos autoinmunes/autoinflamatorios8,9.
En el año 1996, un estudio de cohorte retrospectivo comparó a 10.830 mujeres con implantes mamarios de silicona, con mujeres no expuestas, y se encontró que el riesgo relativo (RR) para el desarrollo de cualquier enfermedad del tejido conectivo fue de 1,24 (IC 95%: 1,08-1,41; p=0,0015), considerado estadísticamente significativo, especialmente para enfermedad indiferenciada/mixta del tejido conectivo. Este estudio tenía un alto riesgo de sesgos, ya que el desenlace primario fue el autorreporte de enfermedades del tejido conectivo. No se encontró un aumento significativo del riesgo de lupus eritematoso sistémico ni para otras enfermedades inmunomediadas, y el RR tampoco alcanzó significación estadística8.
En un estudio de casos y controles, Watad et al. demostraron una asociación entre implantes de silicona y la aparición de enfermedades autoinmunes, con una OR de 1,22 (IC 95%: 1,18-1,26). Las asociaciones más fuertes se encontraron para sarcoidosis, síndrome de Sjögren y esclerosis sistémica9.
Por otra parte, Gabriel et al., en un estudio basado en la cohorte de Olmsted County (Minnesota, EE. UU.), no evidenciaron mayor riesgo de enfermedades del tejido conectivo entre mujeres con implantes mamarios (RR: 1,06; IC 95%: 0,34-2,97)10. En el año 1995, Sánchez-Guerrero et al. publicaron en el New England Journal of Medicine, los resultados de una cohorte retrospectiva de 1.183 mujeres con implantes mamarios de silicona, seguida entre los años 1976 y 1990. El RR ajustado por edad fue de 0,6 (IC 95%: 0,2-2,0), que tampoco fue estadísticamente significativo. Este estudio utilizó criterios estandarizados para el diagnóstico de enfermedades autoinmunes, y no simplemente el autorreporte de síntomas relacionados11.
En el año 2000, Janowsky et al. hicieron un metaanálisis, y concluyeron que los implantes mamarios de silicona podían considerarse seguros. Sin embargo, este metaanálisis excluyó el estudio de Hennekens et al., debido al autorreporte de síntomas mencionado12. Si no se excluyera este estudio, el riesgo relativo de desarrollar una enfermedad del tejido conectivo habría aumentado de insignificante a significativo, con un valor de 1,38,13.
De acuerdo con lo anterior, la relación entre el síndrome de ASIA y la exposición a implantes es controversial. Los estudios que demuestran dicha asociación tienen un alto riesgo de sesgos, dados principalmente por el autoreporte de síntomas y la ausencia de seguimiento a largo plazo. Es probable que el desarrollo de enfermedades autoinmunes sea un evento infrecuente y probablemente no relacionado con los implantes; sin embargo, series de casos han mostrado que, desde un punto de vista fisiopatológico, algunos síntomas pueden aparecer luego de la exposición a adyuvantes. Existen factores de riesgo asociados con una mayor frecuencia del síndrome de ASIA (tabla 1)14.
Factores de riesgo asociados con síndrome de incompatibilidad de los implantes de silicona o siliconosis
| Grupos de riesgo | Ejemplos comunes |
|---|---|
| Reacción autoinmune previamente descrita a un agente adyuvante | VacunasImplantes: de silicona8,12,22,25 y rellenos diferentes a silicona (mamarios, gluteos, orofaciales)27 |
| Condiciones autoinmunes preexistentes | Lupus eritematoso sistémico, artritis reumatoide, tiroiditis de Hashimoto, diabetes mellitus tipo 1, etc. |
| Historia de condiciones alérgicas/trastornos atópicos | Ezcema, fiebre del heno, alergia al polen y ácaros del polvo, alergia a medicamentos, alergia al caucho o al látex |
| Predisposición al desarrollo de autoinmunidad (historia familiar, desencadenantes medioambientales) | HLA-DR4, DRB1, DR53, DQA1*0102HLA-CTabaquismo, obesidad |
Fuente: tomado de Soriano et al.13.
Los adyuvantes son sustancias que aumentan la respuesta inmunitaria frente a antígenos, pero por sí mismas son incapaces de generar dicha respuesta. Son en gran medida sustancias exógenas que se administran de forma intencionada (p. ej., el hidróxido de aluminio en las vacunas) o no intencionada (p. ej., los plastificantes).
Estas sustancias pueden inducir una liberación progresiva del antígeno, disminuir su depuración o causar una exposición prolongada del antígeno a las células presentadoras de antígenos (CPA)15. Adicionalmente, los agentes infecciosos o derivados de estos pueden actuar como adyuvantes. Un ejemplo clásico es la inducción de tiroiditis linfocítica autoinmune en modelos animales inyectados con tiroglobulina más el adyuvante completo de Freund. Edelman propone la siguiente clasificación de los adyuvantes, dependiendo de su mecanismo inmunológico4,15:
- •
Potenciadores de la respuesta inmune frente al antígeno al que van asociados (inmunidad innata y adaptativa).
- •
Vehículos que facilitan la interacción antígeno-receptor en células de la inmunidad innata y adaptativa.
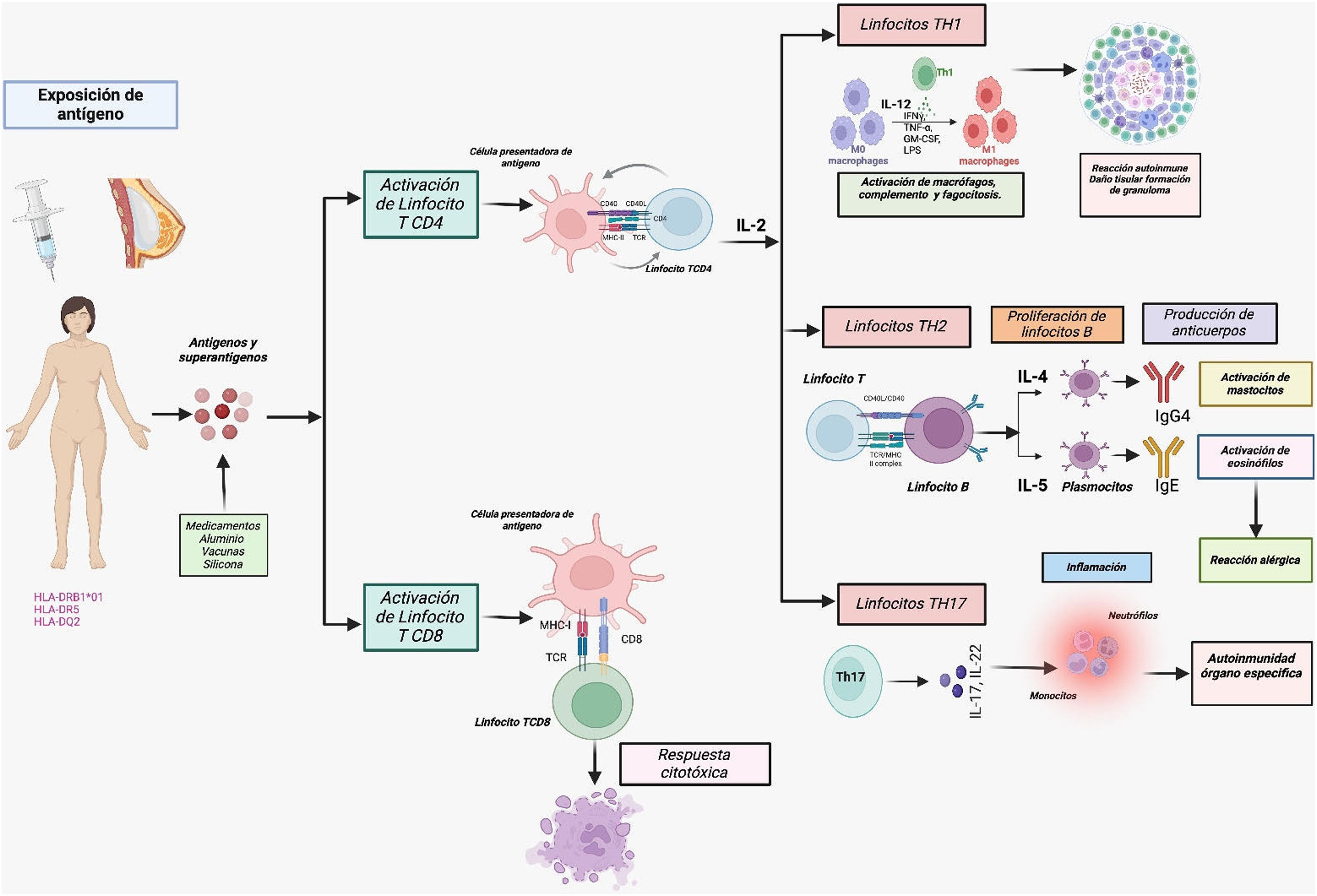
Los adyuvantes aumentan la respuesta inmune innata al imitar moléculas conservadas en la evolución, como paredes bacterianas o residuos de ADN-CpG no metilados, y uniéndose a los receptores tipo Toll (TLR) en CPA16. La respuesta innata lleva también a la activación de los inflamasomas tipo NLRP3 o directamente de macrófagos (u otras células con capacidad fagocítica como neutrófilos), linfocitos citolíticos naturales (células NK) o células linfocíticas innatas, mediante varios receptores (receptores tipo Toll, de tipo NOD y de lectina tipo C). Además, los adyuvantes pueden mejorar la respuesta adaptativa, al promover la interacción de células dendríticas con células T, aumentando la captación de antígenos por parte de las CPA (fig. 1).
Activación de la respuesta inmune en el síndrome de ASIA. Cuando un individuo con determinados alelos de HLA de tipo 1 o 2 (es decir, HLA-DRB1*01, HLA-DR5 y HLA DQ2) se expone a adyuvantes, estos pueden facilitar una interacción anormal entre antígeno y receptor en las células presentadoras de antígeno y macrófagos. Estas células producen citocinas que conducen a una pérdida de la tolerancia inmunológica, lo que induce respuestas inmunes humorales (linfocitos B y células plasmáticas que producen autoanticuerpos) o celulares (con activación de linfocitos T CD4 y CD8), lo que perpetúa el proceso inflamatorio, con la posterior disfunción endotelial, inflamación persistente y daño tisular secundario.
Fuente: elaboración propia.
Por su parte, un área del genoma que codifica los complejos mayores de histocompatibilidad (MHC) —el locus conocido como sistema de antígenos leucocitarios humanos (HLA)— es de especial importancia. El HLA codifica proteínas que intervienen en la presentación de antígenos y está íntimamente implicado en el reconocimiento de patógenos y en la autoinmunidad. La codificación de los HLA es muy diversa entre individuos y poblaciones. Los polimorfismos en el HLA, especialmente el HLA-DRB1, explican tanto la rareza como la mayor susceptibilidad de algunos individuos a desarrollar enfermedades autoinmunes y respuestas patológicas frente a los adyuvantes. Se ha considerado que 3 haplotipos de HLA de clase I y II (HLA DR2DQ6, DR4DQ8 y DR3DQ2) explican la asociación con la mayoría de las enfermedades autoinmunes17,18.
La clasificación de las enfermedades autoinmunes en clusters discretos está bien reconocida, pero comparten un trasfondo genético y ambiental común: es necesario que los factores ambientales externos (agentes infecciosos, adyuvantes, silicona, sales de aluminio, etc.) confluyan para promover la aparición de la enfermedad en individuos genéticamente susceptibles5.
Curiosamente, se ha visto que varias afecciones como la sarcoidosis, el síndrome de Sjögren, la enfermedad indiferenciada del tejido conectivo y el síndrome de incompatibilidad a los implantes de silicona comparten aspectos patogénicos, lo que explica la posibilidad de encontrar síndromes de superposición en el tiempo7.
Papel patogénico de la silicona en el síndrome de ASIALa silicona comprende un grupo de polímeros sintéticos que contienen átomos de silicona y oxígeno alternados. Tiene varias presentaciones físicas potenciales, como líquido, resinas y elastómeros, determinadas por la cantidad de sus siloxanos polimerizados14. En casos del síndrome de incompatibilidad a implantes de silicona, se ha planteado que la medición de anticuerpos tipo IgG contra receptores adrenérgicos y muscarínicos acoplados a proteína G puede servir como marcador temprano de autoinmunidad, que precede a la aparición de autoanticuerpos convencionales (anticuerpos antinucleares [ANA], antígeno nuclear extraíble [ENA], anti-DNA y anti-cardiolipina IgM e IgG); además, tales anticuerpos están directamente implicados en el daño de fibras nerviosas pequeñas relacionadas con fatiga crónica y debilidad muscular, así como síntomas gastrointestinales autonómicos inespecíficos19–21.
En pacientes con siliconosis existe la posibilidad de formar material capsular periprotésico como parte de una respuesta inflamatoria a cuerpo extraño, consistente en tejido capsular fibrótico que contiene miofibroblastos, linfocitos CD4+, macrófagos y células gigantes multinucleadas adyacentes, lesión conocida como siliconoma15,22; sin embargo, no todos estos casos evolucionan hacia un síndrome de ASIA.
Así mismo, algunos estudios in-vitro han demostrado que las células mononucleares en sangre periférica (PBMC) de individuos con reacciones inflamatorias de aparición tardía luego de inyecciones de silicona presentan niveles basales más altos de interleucina-6 y TNF-α que las PBMC de individuos sanos; estos individuos no mostraron la presencia de células T CD4+ de memoria contra la silicona, ya que la expresión de CD69 y la producción de IFN-γ o IL-2 estaban ausentes, lo que sugiere que la silicona podría inducir respuestas inflamatorias mediante un mecanismo adyuvante y no como antígeno22.
Cuéllar et al. analizaron a 813 individuos con implantes mamarios de silicona, a fin de detectar ANA, para lo cual utilizaron una línea celular HEp-2. Se detectó una positividad de ANA inusualmente alta (57,8%). Cabe destacar que los patrones de inmunofluorescencia nucleolar y anticentrómero que pueden observarse en la esclerosis sistémica variedad difusa y limitada, se encontraron en el 13,4 y el 1,06% de pacientes, respectivamente23.
En conclusión, la mayoría de las hipótesis apuntan a que en individuos genéticamente susceptibles, la exposición a silicona conduce a alteraciones inicialmente de la inmunidad innata, seguido de pérdida de la tolerancia y generación de poblaciones de linfocitos T y B autorreactivos, con el resultado final de reacciones granulomatosas a cuerpo extraño y respuesta de citocinas relacionadas con manifestaciones sistémicas diversas24.
DiagnósticoEl síndrome de ASIA requiere para su diagnóstico el antecedente de exposición a un adyuvante. Existen asociaciones especiales entre adyuvantes presentes en vacunas y manifestaciones compatibles con el síndrome de ASIA, publicadas sobre todo en series y reportes de casos:
- •
Síndrome de Guillain-Barré (SGB) posterior a vacunas contra la influenza o vacunas de vector adenoviral contra COVID-19. Sin embargo, el riesgo es muy bajo, su asociación es fuertemente controversial e insignificante con respecto al riesgo de SGB luego de infección natural o en población no vacunada.
- •
Mielitis transversa posterior a vacuna de polio oral.
- •
Artritis luego de inmunización contra difteria-tétano-pertussis (DPaT) y triple viral (MMR).
- •
Trombocitopenia autoinmune luego de la vacuna triple viral (MMR).
- •
Del 2011 al 2016 se reportaron más de 4.000 casos de síndrome de ASIA, la mayoría de los cuales se han informado con vacunas (especialmente contra el virus del papiloma humano e influenza), implantes de silicona y rellenos de aceite mineral7.
Las manifestaciones clínicas del síndrome de ASIA incluyen síntomas inespecíficos (mialgias, artralgias, fiebre, fatiga, insomnio) o aquellos más asociados con enfermedades autoinmunes (síntomas secos, rash malar, úlceras orales, linfadenopatías, serositis, artritis, miositis, fenómeno de Raynaud, púrpura, livedo reticularis o fenómenos desmielinizantes o de daño axonal). La fatiga es el síntoma predominante y puede ser el último en desaparecer luego del retiro de los implantes. Las artralgias aparecen en el 90% de los pacientes y tienden a ser mecánicas, a diferencia del compromiso articular inflamatorio en la artritis reumatoide o el lupus eritematoso sistémico.
Las mialgias pueden imitar la distribución de una miopatía inflamatoria, siendo de predominio proximal en el 90% de casos. Desde el punto de vista de manifestaciones específicas de autoinmunidad, los síntomas secos (xeroftalmia y xerostomía) se presentan en el 75% de los pacientes, mientras que del 30 al 50% pueden tener fenómeno de Raynaud25.
Por otra parte, el síndrome de miofascitis macrofágica se presenta con fatiga, astenia, mialgias, artralgias, debilidad muscular, alteraciones cognitivas e insomnio. Un cuadro más grave, similar a las miopatías inflamatorias, también puede ocurrir, e incluso se ha descrito una polineuropatía desmielinizante similar al síndrome de Guillain-Barre. En otros síndromes posvacunales, estos síntomas son en su mayoría leves en comparación con la miofascitis macrofágica y pueden incluir fiebre, síntomas gastrointestinales y respiratorios, principalmente.
El síndrome de la guerra del Golfo se caracteriza por fatiga, trastornos del sueño, mialgias y debilidad muscular, similar al cuadro clínico de la fibromialgia (uno de los síndromes de amplificación central del dolor). La presencia de anticuerpos antiescualeno se describe hasta en el 95-100% de los casos.
La siliconosis guarda similitud con los síntomas inespecíficos descritos en el síndrome de miofascitis macrofágica, pero con una mayor frecuencia de trastornos cognitivos y neurológicos (cefalea, parestesias y ánimo depresivo), que ocurren en 30-60% de los casos. Este síndrome ocurre bien sea con implantes intactos o luego de su rotura y puede asociarse a la presencia de diversos autoanticuerpos. El período de latencia es muy variable, oscila entre 6 a 70 meses luego de los implantes. Con frecuencia, los signos inflamatorios locales (edema, calor, eritema y dolor en el sitio de implante del material protésico) preceden a la aparición de manifestaciones sistémicas. La presentación como una enfermedad autoinmune (artritis reumatoide, lupus, esclerosis sistémica, síndrome de Sjögren, enfermedad mixta del tejido conectivo, miopatías inflamatorias, sarcoidosis o vasculitis) ocurre en el 11% de los casos luego de los implantes1,25.
Después de medio siglo de uso de implantes de silicona en el mundo, la seguridad biológica sigue siendo objeto de debate. En el año 1992, la United States Food and Drug Administration (FDA) restringió el uso de los implantes mamarios de silicona en los Estados Unidos, debido a los informes sobre cuadros similares a fibromialgia y autoinmunidad. El síndrome de ASIA es un diagnóstico de exclusión, y debe descartarse primero procesos infecciosos o autoinmunes como causa de la clínica anotada. En la tabla 2 se describen los criterios diagnósticos propuestos por Shoenfield et al., los cuales fueron modificados por Alijotas-Reig en el año 2015. Estos criterios no han sido validados y algunos autores plantean que tienen poca especificidad2,3.
Criterios sugeridos para el diagnóstico de síndrome de ASIA
| Criterios mayores |
| - Exposición a un estímulo externo específico (infección, vacuna, silicona, adyuvante) antes del inicio de las manifestaciones clínicas.- La aparición de manifestaciones clínicas «típicas»:• Mialgia, miositis o debilidad muscular• Artralgia o artritis• Fatiga crónica, sueño no reparador o alteraciones del sueño• Manifestaciones neurológicas (especialmente asociadas a la desmielinización)• Deterioro cognitivo, pérdida de memoria• Fiebre, xerostomía- La eliminación del agente incitador induce a la mejoría clínica- Biopsia típica de los órganos implicados |
| Criterios menores |
| - La aparición de autoanticuerpos o anticuerpos dirigidos al adyuvante sospechoso- Otras manifestaciones clínicas (p. ej., síndrome del intestino irritable)- HLA específico (es decir, HLA DRB1, HLA DQB1)- Evolución de una enfermedad autoinmune (p. ej., esclerosis sistémica) |
ASIA: síndrome autoinmune/inflamatorio inducido por adyuvantes; HLA: antígenos leucocitarios humanos.
Fuente: tomado de Watad et al.4.
La elevación de reactantes de fase aguda y la hipergammaglobulinemia policlonal son los hallazgos más frecuentes en el síndrome de ASIA en los primeros días o meses de la enfermedad. La anemia de la enfermedad crónica es una manifestación tardía. Es importante solicitar paraclínicos dentro del diagnóstico diferencial, tales como:
- •
Hormona estimulante tiroidea (TSH): el hipotiroidismo primario puede cursar con fatiga, mialgias y un cuadro similar a la miopatía inflamatoria.
- •
Niveles de 25-hidroxivitamina D: su deficiencia puede empeorar los síntomas descritos en pacientes con el síndrome de ASIA y así mismo puede simular una miopatía inflamatoria.
- •
Enzimas musculares: creatinfosfoquinasa total, lactato deshidrogenasa y transaminasas (AST, ALT), ya que orientan al diagnóstico de miopatías inmunomediadas.
Los estudios de autoanticuerpos no son específicos, y entre estos, los ANA son positivos en el 15-30% de los pacientes. Estas ayudas de laboratorio deben interpretarse en el contexto clínico apropiado, teniendo en cuenta que hasta el 10% de los pacientes con el síndrome de ASIA reúnen criterios clasificatorios para enfermedades inmunomediadas específicas25,26.
Como es frecuente la presencia de síntomas secos y fenómeno de Raynaud, es necesario en estas circunstancias descartar síndrome de Sjögren primario o esclerosis sistémica, por lo que se recomienda realizar biopsia de glándula salival menor y capilaroscopia, respectivamente. Si el paciente presenta mialgias y debilidad muscular proximal, está indicada la realización de la RM para la búsqueda de miositis y edema muscular sugestivo de miopatía inflamatoria. Si este examen no está disponible, puede ser útil la electromiografía con velocidades de neuroconducción para la búsqueda de un patrón miopático sugestivo de dicha condición25.
Con relación a las imágenes diagnósticas, la RM es fundamental para evaluar la integridad del implante, los cambios inflamatorios asociados, la presencia de rotura, las colecciones, la diseminación del material a distancia, y además es útil para definir un abordaje quirúrgico para su retiro. La presencia de calcificaciones y nódulos granulomatosos alrededor del implante también ha sido descrita en pacientes con síndrome de ASIA. Por tanto, cuando exista sospecha de rotura del material protésico (dolor o cambios inflamatorios adyacentes al sitio quirúrgico), es fundamental solicitar este estudio para complementar el diagnóstico y el seguimiento15.
TratamientoAunque se carece de estudios bien diseñados y guías de manejo basadas en la evidencia que demuestren los efectos positivos de ciertos fármacos en los trastornos inflamatorios locales tipo paniculitis, relacionados con los bioimplantes, su eficacia se ha comunicado en informes y series de casos. Además de medidas farmacológicas específicas, es recomendable el cese del tabaquismo, así como la corrección de la deficiencia de vitamina D, especialmente en pacientes con fatiga, artralgias y mialgias27.
Los corticosteroides sistémicos son el tratamiento más utilizado para las reacciones adversas agudas y retardadas inmunomediadas por el relleno. A la fecha, no se han descrito casos refractarios cuando se han utilizado dosis medias-altas de prednisona (0,5 a 1mg/kg/día)28,29.
Dado el carácter crónico de estas reacciones patológicas, en ocasiones los pacientes pueden desarrollar criterios de corticodependencia, por lo que se han propuesto agentes ahorradores de esteroides tales como antimaláricos, ciclosporina, tacrolimus y, anecdóticamente, azatioprina, metotrexato, micofenolato mofetilo y minociclina. Alijotas-Reig et al. (resultados no publicados) en un modelo in-vitro, utilizando células mononucleares de sangre periférica (PBMC) de pacientes con lesiones granulomatosas y autoinmunes relacionadas con silicona, ácido hialurónico y acrilamidas, demostraron que todos los fármacos mencionados anteriormente eran capaces de inhibir en diferentes grados, diversas citoquinas proinflamatorias como TNF-α, el IFN-γ, la IL1-β, la IL-2 y la IL-630,31.
La mayoría de los registros publicados a la fecha reportan una aceptable respuesta clínica en más del 70% de los casos tratados durante 2 años. Para ello, pueden requerirse combinaciones de glucocorticoides y fármacos inmunomoduladores, siendo uno de los más estudiados el tacrolimus32. Tacrolimus inhibe la producción de IL-2 y bloquea la proliferación de células T. En un análisis retrospectivo a través de datos clínicos, bioquímicos e histopatológicos de 45 pacientes que cumplían criterios diagnósticos para síndrome de ASIA de aparición tardía, relacionados con los bioimplantes (3 meses o más tras el procedimiento), prácticamente todos los casos refractarios a los demás inmunosupresores respondieron a tacrolimus, generalmente a dosis bajas. Solo se utilizaron dosis altas en el 20% de los pacientes tratados. No se observaron efectos adversos clínicos o biológicos relevantes1,32.
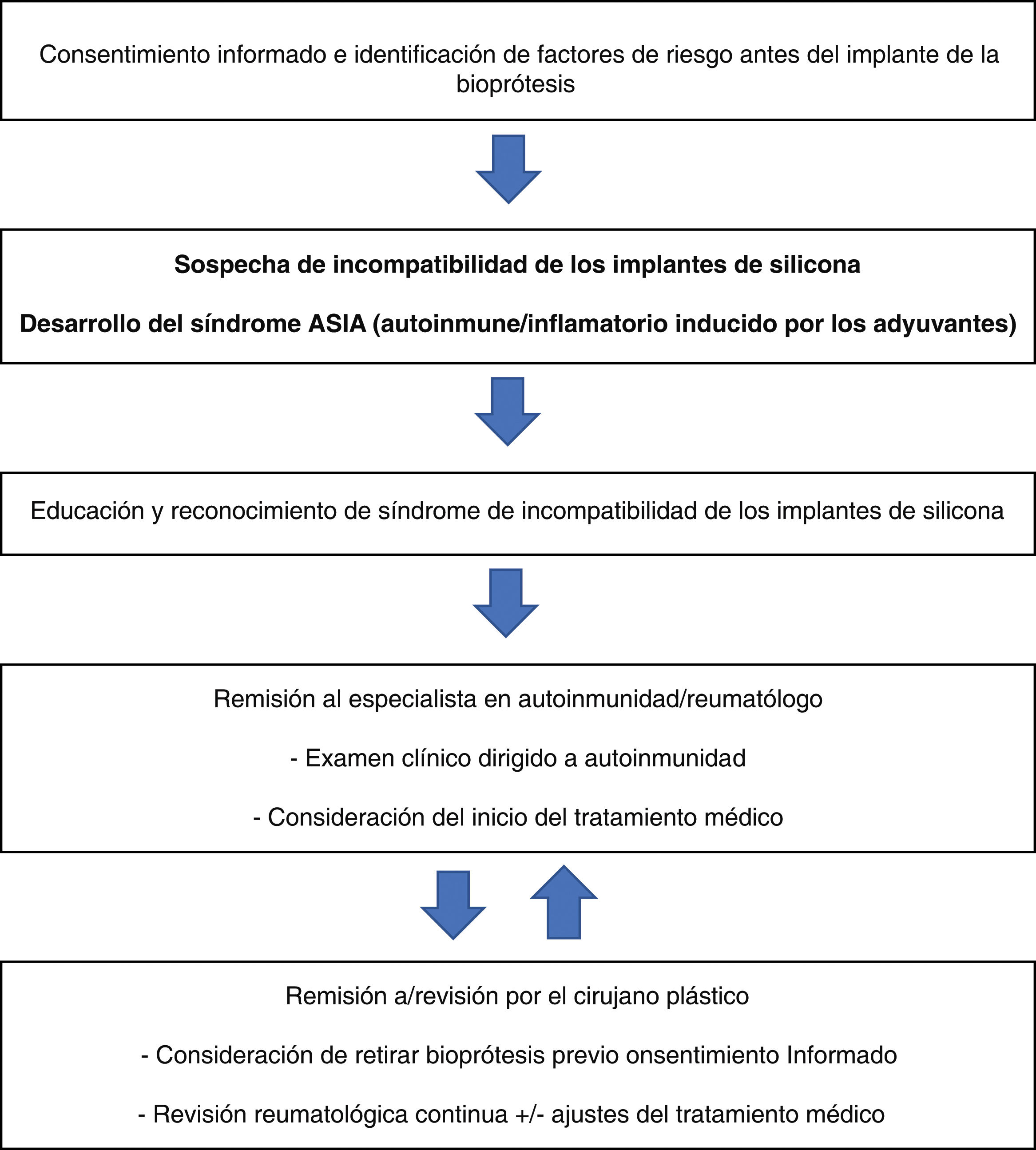
El papel de la extracción del implante es objeto de debate; sin embargo, el retiro se recomienda en los casos sistémicos, graves o refractarios, y se logra una mejoría clínica objetiva en cerca del 50%. Por ejemplo, Maijers et al. describieron una cohorte de 80 mujeres en la que 52 de ellas optaron por el explante de las prótesis de silicona; de estas, 27 tuvieron una mejoría parcial de los síntomas y 9 una resolución completa de estos33,34. Finalmente, en la figura se propone un algoritmo de manejo en siliconosis (fig. 2).
Propuesta de manejo para el paciente con síndrome de incompatibilidad de los implantes de silicona o siliconosis.
Fuente: tomado de Shoenfeld y Agmon-Levin3.
Existe una relación soportada por modelos experimentales (estudios en animales), descriptivos (reportes y series de casos) y observacionales (estudios de casos y controles) entre exposición a adyuvantes y síntomas relacionados con autoinmunidad/autoinflamación. Los estudios de cohortes, con un diseño apropiado y seguimiento a largo plazo, no soportan dicha asociación, pero en la práctica clínica pueden encontrarse casos del síndrome de ASIA asociados a silicona, aceites minerales, escualeno e hidróxido de aluminio.
Es prioritaria la validación de los criterios clasificatorios propuestos para el síndrome de ASIA, con el fin de que en los estudios se incluyan poblaciones más homogéneas. La sospecha clínica y el antecedente exposicional siguen siendo fundamentales para el abordaje diagnóstico.
Se requieren estudios a gran escala que tengan criterios de inclusión bien definidos, desenlaces reproducibles y seguimiento a largo plazo, que permitan identificar factores epigenéticos modificables y no modificables. Los nuevos avances en farmacogenómica nos permitirán comprender aún mejor la respuesta inmune desencadenada por adyuvantes, con el fin de anticiparnos a sus efectos adversos en el tiempo y, de ser posible, extrapolar estos hallazgos al campo de la cirugía plástica y reconstructiva, donde se hace uso activo de bioprótesis a base de silicona.
Consideraciones éticasEl actual trabajo cumple con la normativa vigente en investigación bioética.
FinanciaciónNo se recibió ningún tipo de financiación para la elaboración de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a la Dra. Gloria Vásquez Duque, profesora del programa de Reumatología de la Facultad de Medicina de la Universidad de Antioquia.