Identificar si los polimorfismos rs11179000, rs136494 y rs4570625 del gen de la triptófano hidroxilasa 2 están asociados a trastorno depresivo mayor en una muestra de población colombiana.
MétodosEstudio de casos y controles en el que se comparó a sujetos con trastorno depresivo mayor diagnosticado en algún momento de la vida adulta o con síntomas activos en el momento de la valoración y sujetos sin enfermedad psiquiátrica. Se estudió a los sujetos en el Departamento de Psiquiatría de la Facultad de Medicina y en el Instituto de Genética de la Universidad Nacional de Colombia. Se genotipificaron los polimorfismos usando reacción en cadena de la polimerasa en tiempo real y sondas Taqman. Además de buscar asociación entre trastorno depresivo mayor y estos polimorfismos de un solo nucleótido, se exploró asociación con otros factores relacionados previamente con depresión.
ResultadosNo se encontró asociación estadísticamente significativa entre las frecuencias genotípicas o alélicas de cada polimorfismo y el trastorno depresivo mayor. Se observó asociación entre sexo y complicaciones durante el embarazo/parto y trastorno depresivo mayor.
ConclusionesNo se halló asociación entre polimorfismo alguno y el trastorno depresivo mayor.
Identify whether rs11179000, rs136494 and rs4570625 polymorphisms of the tryptophan hydroxylase 2 gene, are associated with a major depressive disorder in a sample of the Colombian population.
MethodsCase-control study was conducted in which a comparison was made between subjects diagnosed with major depressive disorder at some point in adulthood or active symptoms at the time of evaluation, and subjects with no psychiatric disease. Subjects were studied in the Department of Psychiatry, Faculty of Medicine and the Institute of Genetics at the National University of Colombia. Polymorphisms were genotyped using Taqman probes in real time PCR. As well as studying the association between major depressive disorder and these (single nucleotide polymorphisms (SNPs), the association with other factors previously associated with depression were also analysed.
ResultsNo statistically significant association between genotypic and allelic frequencies of each polymorphism and major depressive disorder was found. Association between sex and complication during pregnancy / childbirth and major depressive disorder was observed. Association between sex and complication during pregnancy / childbirth and major depressive disorder was observed.
ConclusionsThere was no association between any polymorphism and major depressive disorder.
El trastorno depresivo mayor (TDM) es una enfermedad asociada a altas tasas de morbilidad y mortalidad1–3. Según la Organización Mundial de la Salud (OMS), se espera que en 2020 la depresión sea la segunda causa principal de discapacidad y en 2030, la principal causa de carga por enfermedad en el mundo1.
El TDM se considera enfermedad compleja desde el punto de vista genético4. En la base de esta herencia compleja, la expresión de múltiples genes con efecto menor podría estar modulada por diferentes factores ambientales. Por lo tanto, determinados genotipos de riesgo conferirían mayor susceptibilidad a sufrir la enfermedad que otros genotipos sin riesgo ante una misma exposición a un factor ambiental de riesgo4,5.
La heredabilidad del TDM se ha estimado entre el 37 y el 70%, la cual varía entre estudios4–6, y el riesgo de que los familiares en primer grado de los pacientes la sufran es 2-3 veces mayor que el de la población general1,5,7. Se ha encontrado una fuerte asociación entre su aparición y diferentes genes involucrados en la producción y el transporte de serotonina5. Uno de estos genes, es el de la triptófano hidroxilasa 2 (TPH2). La triptófano hidroxilasa (TPH) es la enzima limitadora de la síntesis de serotonina en la rata. La TPH1 y la TPH2 son isoformas de la TPH. Ambas isoformas se expresan en el cerebro, pero la TPH2 se expresa predominantemente en las neuronas productoras de serotonina del núcleo del rafe y la TPH1 está presente además en tejidos periféricos, como corazón, riñones, pulmones, glándula adrenal, hígado y duodeno8. La TPH2 fue descubierta luego de comprobarse que ratones genéticamente deficientes en TPH seguían expresando serotonina en el cerebro, pero no en tejidos periféricos, y no mostraban diferencias en los comportamientos regulados por la serotonina respecto a los animales sin deficiencia de TPH9.
Investigaciones en ratones demostraron que mutaciones funcionales en la TPH2 conducen a una reducción pronunciada en la actividad de esta enzima10–12. En un estudio de Zhang et al. en humanos, se identificó un polimorfismo funcional (Arg441His) que resultó en una reducción del 80% de la actividad enzimática de la TPH2 cuando se expresaba en un sistema de cultivo celular. Se halló mayor presencia del alelo mutante (1463A) en pacientes con TDM que en los sujetos de control10,13, aunque este hallazgo no se repitió en estudios posteriores14–16.
Se ha encontrado que diferentes polimorfismos de nucleótido simple (SNP) del gen TPH2 pueden ser factores de riesgo8,17,18 o protectores19 del TDM y su gravedad20,21. Sin embargo, otros estudios no han encontrado esta asociación22,23.
Los estresores psicosociales también influyen en la aparición del TDM, en especial si se presentan al principio del desarrollo24; la pérdida temprana de un cuidador es uno de los eventos estresantes asociados fuertemente con la depresión25–27. En cuanto a la interacción herencia-ambiente, estudios en animales muestran que la variación alélica de la función de la TPH2 está regulada por eventos estresantes que llevan a resultados desfavorables semejantes a los trastornos emocionales28,29. Algunas investigaciones en humanos han encontrado mayor reactividad a la exposición de eventos estresantes de la vida y mayor nivel de síntomas depresivos en los portadores de ciertas variantes alélicas del gen TPH224,29.
Este estudio se lleva a cabo con el fin de determinar la asociación entre los SNP rs1117900017, rs13864948,20 y rs45706256,21,24 del gen TPH2 y el TDM en una muestra de población colombiana. Hasta donde se sabe, este es el primer estudio realizado en Colombia que analiza la asociación entre polimorfismos del TPH2 y el TDM.
Materiales y métodosSe realizó un estudio de casos y controles. Se incluyó como casos a los sujetos nacidos en Colombia, con edades entre 18 y 60 años, que asistieron a la consulta del Departamento de Psiquiatría de la Facultad de Medicina de la Universidad Nacional de Colombia durante el periodo comprendido entre febrero y noviembre de 2014 y fueron diagnosticados de TDM según los criterios del DSM-IV-TR30. Todos los participantes fueron evaluados por dos psiquiatras con experiencia en diagnóstico clínico mediante aplicación de entrevista psiquiátrica (docentes de psiquiatría con más de 10 años de experiencia). La exploración se apoyó en el seguimiento de un modelo de entrevista semiestructurada utilizado habitualmente en los formatos de historia clínica manejados en el Departamento de Psiquiatría de la Universidad Nacional de Colombia. A todos los pacientes se les aplicó una encuesta para conocer datos sociodemográficos y antecedentes clínicos. La gravedad de la depresión se evaluó en los sujetos con TDM que tenían síntomas activos en el momento de la valoración, aplicando la escala de depresión de Hamilton de 17 ítems (HAMD-17)31. Se excluyó a los pacientes con enfermedades autoinmunitarias y neurodegenerativas, lesiones cerebrales, cáncer y enfermedad psiquiátrica diferente de TDM. En la muestra de casos se analizó por separado a los sujetos con TDM en algún momento de la vida adulta (criterio laxo) y a los sujetos con TDM, síntomas activos en el momento de la valoración y puntuación ≥ 8 en la HAMD-17 (criterio estricto).
Como grupo control se incluyó a los sujetos nacidos en Colombia que asistieron a una convocatoria organizada para participar en el estudio entre febrero y noviembre de 2014. A todos se los evaluó igualmente mediante entrevista semiestructurada por el personal que evaluó a los sujetos que conformaron el grupo de casos. Se excluyó a los sujetos con historia de trastorno psiquiátrico. Los controles tenían edades comprendidas entre los 18 y los 60 años.
Los casos y los controles fueron incluidos en el estudio previo consentimiento informado. Este estudio fue aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad Nacional de Colombia.
Procedimientos de laboratorioTodos los procedimientos de laboratorio se llevaron a cabo con enmascaramiento del estado de caso o control.
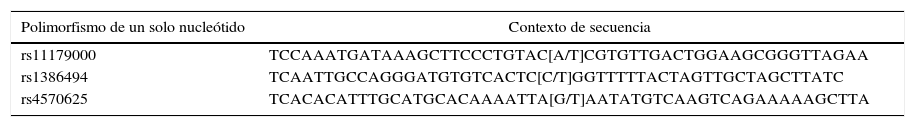
Los tres SNP genotipificados, están enumerados en la base de datos de SNP (dbSNP) del Centro Nacional para la Información Biotecnológica (NCBI)32. Para el rs1386494 se llevó a cabo la amplificación de la hebra complementaria, mientras que para los otros dos SNP se amplificó la hebra molde. El contexto de la secuencia genética se muestra en la tabla 1.
La metodología empleada para la genotipificación fue la de reacción en cadena de la polimerasa en tiempo real (RT-PCR) utilizando sondas Taqman33. Se preparó la mezcla maestra para cada polimorfismo usando para cada reacción 2,5 μl de Taqman maxter mix 2× (Applied Biosystems) y 0,5 μl de Taqman Assay 10×; el volumen total de la mezcla maestra dependió del total de muestras a procesar, incluyendo control negativo y positivo. Se añadieron al tubo de PCR 3 μl de mezcla maestra y 2 μl de ADN para un volumen total de 5 μl. Se dio vórtex y se centrifugó. La RT-PCR se realizó en un termociclador para tiempo real CFX96™ (Bio Rad) empleando el protocolo indicado en la tabla 2.
Análisis estadísticoEl cálculo de tamaño de muestra se efectuó teniendo en cuenta un modelo de regresión logística binaria, buscando estimar una odds ratio (OR) de 2,517, dada una proporción 1:1 de casos y controles, asumiendo un valor de significación del 5% y una potencia del 80%. Con estos supuestos, el tamaño de muestra calculado fue de 214 sujetos; estos cálculos se realizaron con el programa PASS®.
Para el análisis estadístico descriptivo, se usaron medidas de resumen acordes con las características de las variables: mediana [intervalo intercuartílico] para las variables continuas dependiendo de la asimetría de las distribuciones y porcentaje para las variables categóricas. Los análisis de asociación se efectuaron inicialmente con métodos bivariables utilizando pruebas exactas de Fisher o la de la χ2 dependiendo de las características de las tablas de contingencia. Se compararon medianas entre grupos de casos y controles utilizando pruebas de suma de rangos de Wilcoxon para dos muestras. Las covariables incorporadas para análisis y caracterización fueron: edad, sexo (femenino/masculino), frecuencias genotípicas, frecuencias alélicas, pérdida de un cuidador antes de los 12 años (sí/no), complicación durante el embarazo/parto (sí/no) y antecedente de padres con diagnóstico de TDM (sí/no). Además se utilizaron métodos multivariables mediante regresión logística binaria en los cuales la variable dependiente fue ser caso (criterio laxo o estricto), para lo cual se trabajaron modelos independientes; como variable independiente, para todos los modelos, se tomó el genotipo correspondiente a cada polimorfismo. Para el análisis de covariables, en los modelos logísticos, las que estuvieran significativamente asociadas con p < 0,1 al realizar los análisis bivariables (sexo, complicación durante el embarazo/parto, pérdida de un cuidador antes de los 12 años) se introdujeron en los modelos multivariables para evaluar su papel como modificadores de efecto o confusores en el análisis de asociación. Las medidas de asociación se estimaron como OR. Para los procedimientos de control de covariables, se evaluaron términos de interacción dentro de los modelos (sexo, complicación durante el embarazo/parto, pérdida de un cuidador antes de los 12 años). Excepto para los procesos iniciales de construcción de modelos logísticos, para efectos de pruebas de hipótesis se asumieron valores de p < 0,05. Todos los análisis se realizaron con el programa estadístico R.
Las frecuencias alélicas se obtuvieron por recuento directo a partir de los genotipos observados y, a partir de las frecuencias encontradas, se determinó si la población se encontraba en equilibrio de Hardy-Weinberg.
ResultadosCasos definidos con el criterio laxoSe incluyó en el grupo de casos con criterio laxo a 102 pacientes, a los que se comparó con 114 sujetos del grupo control. Se encontró asociación estadísticamente significativa entre sexo y ser caso o control: en el grupo de casos, el 71% de los pacientes con TDM eran mujeres y el 29%, varones; mientras que, en el grupo control, tanto varones como mujeres representaron el 50% (χ2(1)= 9,48; p = 0,002; OR = 2,4; intervalo de confianza del 95% [IC95%], 1,36-4,21). La mediana de edad de los casos era 26 [14] años y la de los controles, 24 [9]; esta diferencia no fue estadísticamente significativa (prueba de suma de rangos, p = 0,08).
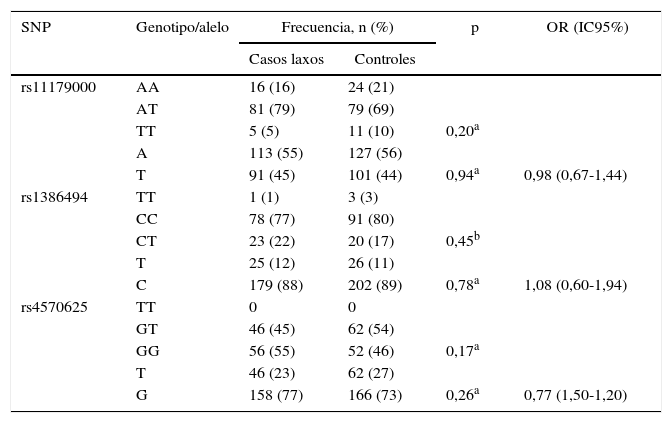
No se encontró asociación estadísticamente significativa entre las frecuencias genotípicas y alélicas de cada uno de los SNP estudiados y el TDM. Los resultados se presentan en la tabla 3.
Frecuencias genotípicas y alélicas de los polimorfismos de TPH2 en casos laxos y controles
| SNP | Genotipo/alelo | Frecuencia, n (%) | p | OR (IC95%) | |
|---|---|---|---|---|---|
| Casos laxos | Controles | ||||
| rs11179000 | AA | 16 (16) | 24 (21) | ||
| AT | 81 (79) | 79 (69) | |||
| TT | 5 (5) | 11 (10) | 0,20a | ||
| A | 113 (55) | 127 (56) | |||
| T | 91 (45) | 101 (44) | 0,94a | 0,98 (0,67-1,44) | |
| rs1386494 | TT | 1 (1) | 3 (3) | ||
| CC | 78 (77) | 91 (80) | |||
| CT | 23 (22) | 20 (17) | 0,45b | ||
| T | 25 (12) | 26 (11) | |||
| C | 179 (88) | 202 (89) | 0,78a | 1,08 (0,60-1,94) | |
| rs4570625 | TT | 0 | 0 | ||
| GT | 46 (45) | 62 (54) | |||
| GG | 56 (55) | 52 (46) | 0,17a | ||
| T | 46 (23) | 62 (27) | |||
| G | 158 (77) | 166 (73) | 0,26a | 0,77 (1,50-1,20) | |
IC95%: intevalo de confianza del 95%; OR: odds ratio; SNP: polimorfismo de un solo nucleótido.
En cuanto a la asociación con la pérdida de un cuidador, se encontró que el 10,8% de los sujetos con TDM habían perdido un cuidador antes de los 12 años, en comparación con el 3,5% de los sujetos del grupo control; esta diferencia fue estadísticamente significativa (χ2(1)= 4,40; p = 0,03; OR = 3,32; IC95%, 1,02-10,79).
Se encontró asociación estadísticamente significativa entre TDM y antecedente de complicación durante el embarazo/parto —el 27% de los casos frente al 13% de los controles (χ2(1)= 6,09; p = 0,01; OR = 2,37; IC95%, 1,18-4,77)— así como con el antecedente de amenaza de aborto, que fue más frecuente entre los casos que entre los controles (el 3,9 frente a 0 respectivamente; prueba exacta de Fisher, p = 0,04).
No se encontró diferencia estadísticamente significativa entre los dos grupos con respecto a tener un padre con depresión: el 25 frente al 20% (χ2(1)= 1,33; p = 0,24; OR = 1,6; IC95%, 0,71-3,56).
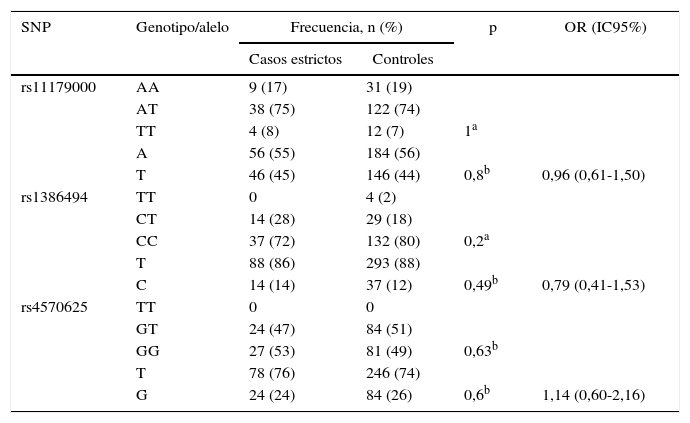
Casos definidos con el criterio estrictoEn esta categoría, se evaluó a 51 sujetos del grupo de casos y 165 del grupo control. No se halló asociación estadísticamente significativa entre TDM y las frecuencias genotípicas y alélicas de cada SNP (tabla 4). Tampoco se encontró diferencia estadísticamente significativa con la edad: casos frente a controles, 26 [20] frente a 25 [12] años. La presencia de trastorno depresivo no se asoció con el antecedente de pérdida de un cuidador antes de los 12 años (el 9,8 frente al 6,1%; prueba exacta de Fisher, p = 0,35; OR = 1,7; IC95%, 0,54-5,17) ni con el antecedente de depresión en un padre (el 20 frente al 10,9%; χ2(1)= 2,79; p = 0,09; OR = 2,04; IC95%, 0,87-4,76).
Frecuencias genotípicas y alélicas de los polimorfismos de TPH2 en casos estrictos y controles
| SNP | Genotipo/alelo | Frecuencia, n (%) | p | OR (IC95%) | |
|---|---|---|---|---|---|
| Casos estrictos | Controles | ||||
| rs11179000 | AA | 9 (17) | 31 (19) | ||
| AT | 38 (75) | 122 (74) | |||
| TT | 4 (8) | 12 (7) | 1a | ||
| A | 56 (55) | 184 (56) | |||
| T | 46 (45) | 146 (44) | 0,8b | 0,96 (0,61-1,50) | |
| rs1386494 | TT | 0 | 4 (2) | ||
| CT | 14 (28) | 29 (18) | |||
| CC | 37 (72) | 132 (80) | 0,2a | ||
| T | 88 (86) | 293 (88) | |||
| C | 14 (14) | 37 (12) | 0,49b | 0,79 (0,41-1,53) | |
| rs4570625 | TT | 0 | 0 | ||
| GT | 24 (47) | 84 (51) | |||
| GG | 27 (53) | 81 (49) | 0,63b | ||
| T | 78 (76) | 246 (74) | |||
| G | 24 (24) | 84 (26) | 0,6b | 1,14 (0,60-2,16) | |
IC95%: intevalo de confianza del 95%; OR: odds ratio; SNP: polimorfismo de un solo nucleótido.
Se encontró asociación estadísticamente significativa con el sexo (casos, el 72,5% mujeres y el 27,5% varones; controles, el 55,8% mujeres y el 44,2% varones; χ2(1)= 4,56; p = 0,03; OR = 2,1; IC95%, 1,05-4,07), el antecedente de complicaciones durante el embarazo/parto (el 37,3 frente al 13,9%; χ2(1) = 13,52; p = 0,0002; OR 3,7; IC95%, 1,7-7,5) y el antecedente de amenaza de aborto (el 8% frente a 0; prueba exacta de Fisher, p = 0,002).
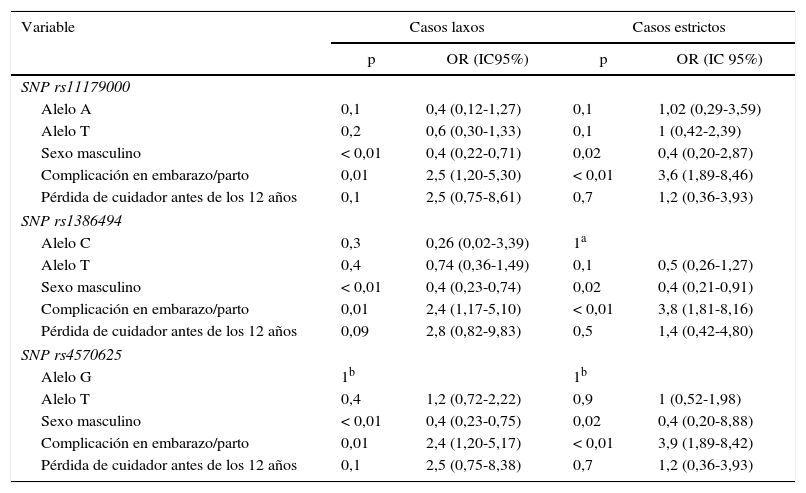
Análisis multivariableTras realizar el análisis multivariable, no se encontró asociación estadísticamente significativa entre el TDM y los tres SNP de TPH2. Esta falta de asociación se detecta habiendo ajustado el posible efecto de variables de confusión; dentro de este grupo, las covariables sexo y complicaciones durante el embarazo/parto introducidas en el diseño mostraron asociación estadísticamente significativa con TDM. Estos resultados se muestran en la tabla 5.
Análisis multivariable de casos laxos y estrictos
| Variable | Casos laxos | Casos estrictos | ||
|---|---|---|---|---|
| p | OR (IC95%) | p | OR (IC 95%) | |
| SNP rs11179000 | ||||
| Alelo A | 0,1 | 0,4 (0,12-1,27) | 0,1 | 1,02 (0,29-3,59) |
| Alelo T | 0,2 | 0,6 (0,30-1,33) | 0,1 | 1 (0,42-2,39) |
| Sexo masculino | < 0,01 | 0,4 (0,22-0,71) | 0,02 | 0,4 (0,20-2,87) |
| Complicación en embarazo/parto | 0,01 | 2,5 (1,20-5,30) | < 0,01 | 3,6 (1,89-8,46) |
| Pérdida de cuidador antes de los 12 años | 0,1 | 2,5 (0,75-8,61) | 0,7 | 1,2 (0,36-3,93) |
| SNP rs1386494 | ||||
| Alelo C | 0,3 | 0,26 (0,02-3,39) | 1a | |
| Alelo T | 0,4 | 0,74 (0,36-1,49) | 0,1 | 0,5 (0,26-1,27) |
| Sexo masculino | < 0,01 | 0,4 (0,23-0,74) | 0,02 | 0,4 (0,21-0,91) |
| Complicación en embarazo/parto | 0,01 | 2,4 (1,17-5,10) | < 0,01 | 3,8 (1,81-8,16) |
| Pérdida de cuidador antes de los 12 años | 0,09 | 2,8 (0,82-9,83) | 0,5 | 1,4 (0,42-4,80) |
| SNP rs4570625 | ||||
| Alelo G | 1b | 1b | ||
| Alelo T | 0,4 | 1,2 (0,72-2,22) | 0,9 | 1 (0,52-1,98) |
| Sexo masculino | < 0,01 | 0,4 (0,23-0,75) | 0,02 | 0,4 (0,20-8,88) |
| Complicación en embarazo/parto | 0,01 | 2,4 (1,20-5,17) | < 0,01 | 3,9 (1,89-8,42) |
| Pérdida de cuidador antes de los 12 años | 0,1 | 2,5 (0,75-8,38) | 0,7 | 1,2 (0,36-3,93) |
IC95%: intevalo de confianza del 95%; OR: odds ratio; SNP: polimorfismo de un solo nucleótido.
Solo el SNP rs1386494 se encontró en equilibrio de Hardy-Weinberg, tanto en la muestra total (p = 0,80) como en cada uno de los grupos: casos laxos (p = 0,93), controles laxos (p = 0,60), casos estrictos (p = 0,82) y controles estrictos (p = 0,70). Los SNP rs11179000 y rs4570625 no estaban en equilibrio. Pese a esto, los resultados de asociación entre estos dos SNP y el TDM fueron señalados, ya que no se consideró que el desequilibrio se debiera a errores en la tipificación, pues se obtuvieron frecuencias similares tanto en pacientes como en controles. Además, el análisis Taqman utilizado para las genotipificaciones es un análisis prediseñado en el que primers y sondas Taqman han sido validados y utilizados previamente (Applied Biosystems). Por otra parte, es posible que la falta de equilibrio se deba a otros factores, como el tamaño de la muestra, o que el efecto de mezcla en la población colombiana tenga influencia en que estos SNP no hayan alcanzado el equilibrio.
DiscusiónEl TDM tiene gran impacto en la salud en todo el mundo. Para esclarecer su etiología, se han investigado factores biológicos y ambientales, pero no se ha encontrado una causa que explique la génesis de la enfermedad.
En estudios previos, ciertos genotipos y alelos de los SNP rs11179000, rs1386494 y rs4570625 de TPH2 se han relacionado con TDM o síntomas afectivos, sin que se haya logrado caracterizar universalmente estos SNP para el TDM, debido a los pocos estudios y la variedad de resultados. Este estudio no ha encontrado asociación alguna entre estos tres SNP y TDM en la muestra tomada de la población colombiana. Algunos de las investigaciones adelantadas con estos SNP se mencionan a continuación.
De Araújo et al17 encontraron asociación entre el SNP rs11179000 y TDM de inicio tardío, al observar en el grupo de sujetos con TDM una frecuencia más alta del genotipo AA, por lo que concluyeron que ser portador homocigoto para A incrementaba 2 veces el riesgo de depresión de inicio tardío (p = 0,025).
En cuanto al SNP rs1386494, Zill et al8 realizaron un estudio de casos y controles para evaluar la asociación de este SNP con TDM. Observaron un incremento del alelo G en el grupo de casos respecto al grupo control (0,86 frente a 0,79; p = 0,012). Estos mismos autores detectaron asociación significativa entre ser portador del alelo G del SNP rs1386494 y suicidio (p = 0,038)34. Anttilla et al20 evaluaron a sujetos con TDM y resistencia al tratamiento a los que se manejó con terapia electroconvulsiva (TEC). Aunque no hallaron asociación entre respuesta a la TEC y el rs1386494, encontraron que los pacientes portadores del genotipo A/A tenían en la escala de depresión de Montgomery y Asberg más puntuación que los portadores de los genotipos A/G+G/G (p < 0,001). Además, los portadores del genotipo A/A también tenían más síntomas psicóticos. Otras investigaciones no encontraron asociación con este polimorfismo18,23.
Finalmente, se ha observado asociación entre el SNP rs4570625 y condiciones caracterizadas por desregulación emocional. Brown et al35 evaluaron la repercusión de la variante de este polimofismo en la respuesta de la amígdala a la amenaza, y se reveló mayor actividad en el área dorsal bilateral de la amígdala de los portadores del alelo T que en los homocigotos del alelo G (p < 0,05). Gutknecht et al36 encontraron mayor frecuencia del alelo T del rs4570625 en los pacientes con trastorno de personalidad del grupo B y C, en quienes se encuentran alteraciones de la regulación emocional tales como ansiedad, síntomas depresivos y agresión; en este estudio se halló mayor comorbilidad con trastornos del afecto y trastornos ansiosos. Serretti et al21 encontraron en los pacientes con TDM que el haloptipo G-A rs4570625–rs10748185 se asoció de manera significativa con una puntuación más alta en la escala de depresión de Montgomery y Asberg (p = 0,006), y Nobile et al24 analizaron los efectos del rs4570625 de TPH2 y el 5-HTTLPR y la asociación con un predictor ambiental (estructura familiar) en los síntomas depresivos en una población general de niños de 10-14 años, y encontraron evidencia que pertenecer a una familia de un solo padre y ser portador de la variante G del polimorfismo rs4570625 (G-703T) y el alelo corto del 5-HTTLPR se asocian, tanto solos como en aparente interacción gen-ambiente, con mayor puntuación en dicha escala. Un metanálisis publicado en mayo de 2012 mostró que el SNP rs4570625 (G703T) tenía fuerte asociación epidemiológica con TDM6. Por último, en un estudio realizado por Mandelli et al29, se observó mayor reactividad a la exposición de eventos estresantes de la vida y mayor nivel de síntomas depresivos en los portadores del genotipo TT del rs4570625 de TPH2.
Es posible que la falta de concordancia de los resultados entre nuestro estudio y los previos que muestran asociación se deba a las diferencias entre las estructuras genéticas de la población colombiana y otras poblacionales en las que se han adelantado este tipo de estudios. Las diferentes manifestaciones clínicas del TDM se presentan debido a que en las enfermedades complejas los componentes genéticos varían entre los individuos que las padecen37, por lo que la falta de homogeneidad de los cuadros depresivos entre los sujetos que estudiamos puede influir en la poca similitud de sus genotipos y alelos; además, que esta población no se encuentre en equilibrio de Hardy-Weinberg para los SNP rs11179000 y rs4570625 también influye en los resultados. Por otra parte, que no todos los sujetos que participaron en el estudio procedieran de la misma región de Colombia podría ser un factor modificador de los resultados, pero no se realizó un análisis estratificado de la población, debido a que la mayor parte de la muestra se tomó en la ciudad de Bogotá, donde predomina la población caucásica-mestiza. Para realizar un análisis estratificado de la población, se tendría que estudiar a las poblaciones caucásica (pura), amerindia (pura) y negra pura y conocer la composición y las frecuencias en cada uno de estos grupos, lo cual es casi imposible de realizar, dado que es muy difícil encontrar grupos puros, principalmente caucasoides. Además existen muy pocos grupos amerindios en la región andina colombiana, y la población negra se encuentra principalmente ubicada en regiones de la costa atlántica y pacífica del país, regiones que no se analizaron en la muestra.
Nosotros encontramos baja frecuencia del genotipo TT en los SNP rs11179000 y rs1386494 y ausencia de dicho genotipo en el SNP rs4570625, lo cual podría estar relacionado con que ser homocigoto para el alelo T sea desfavorable en nuestra población o, simplemente, que el tamaño de la muestra limite su hallazgo.
Por otra parte, nuestro estudio ha encontrado asociación con algunos factores sociodemográficos y clínicos. En el grupo de casos, mayor número de mujeres que de varones, en relación 2:1, por lo que se considera que ser mujer es factor de riesgo de TDM, hallazgo con significación estadística y en concordancia con las publicaciones previas, en las que se ha señalado que el TDM es 2-3 veces más común en las mujeres1.
Se encontró diferencia estadísticamente significativa entre complicación durante el embarazo/parto y TDM. Algunos estudios han descrito aumento del riesgo de depresión en adolescentes hijos de madres con depresión posparto38, y se ha señalado que el nivel educativo, la baja autoestima y el pobre apoyo social están relacionados con la depresión periparto39, factores de riesgo que también están asociados con complicaciones durante el embarazo, por lo que se podría hipotetizar que las madres de los sujetos con TDM que tuvieron complicaciones durante el embarazo/parto también cursaron con algún trastorno depresivo, ya sea asociado a los factores de riesgo comunes a ambas entidades o como síntoma reactivo a la complicación médica. El bajo peso al nacer puede asociarse a depresión a cualquier edad, y en un estudio realizado por Kaikkonen et al40, se encontró que, en un grupo de adultos mayores, la corta duración de la gestación se asociaba con puntuaciones más altas en el Inventario de Depresión de Beck y la Escala de Depresión para estudios epidemiológicos. Es posible que las diferentes complicaciones durante el embarazo/parto encontradas en esta muestra (como amenaza de aborto, parto pretérmino, sufrimiento fetal agudo y preeclampsia, entre otras) estuviesen asociadas a bajo peso al nacer o menor duración de la gestación; en todo caso, se halló que la variable complicación durante el embarazo/parto es factor de riesgo de TDM estadísticamente significativo, al igual que la amenaza de aborto entre las complicaciones, y podría ser un aspecto que evaluar en futuros estudios.
Aunque la evidencia señala mayor riesgo de sufrir depresión entre los familiares inmediatos de pacientes deprimidos, no se encontró diferencia estadísticamente significativa entre los sujetos con padres u otros familiares con TDM y los que no tenían este antecedente. Si se considera la heredabilidad como aportante a esta asociación, es posible que este hallazgo concuerde con la ausencia de asociación con los genotipos.
Finalmente, se ha determinado que las familias en que madre y padre biológicos se encuentran presentes, en general, se asocian con menor riesgo de disfunción de la descendencia41. La pérdida de un padre en la infancia se ha asociado fuertemente con depresión25–27. Nuestro estudio ha encontrado asociación entre pérdida de un cuidador antes de los 12 años y TDM en la categoría de casos laxos; sin embargo, cuando se evaluaron los casos con criterio estricto y en el análisis multivariable, pese a que esta variable continuó siendo factor de riesgo de TDM, se perdió la significación estadística. Homogeneizar la población del estudio y una muestra de mayor tamaño podrían modificar los resultados ambiguos.
ConclusionesNo se encontró asociación estadísticamente significativa entre los SNP rs11179000, rs136494 y rs4570625 de TPH2 y TDM. El sexo femenino y el antecedente de complicación durante el embarazo/parto, específicamente de amenaza de aborto, resultaron ser factores de riesgo asociados a TDM. El antecedente de un padre con TDM no se asoció con TDM en nuestro estudio, lo cual se puede corresponder con la ausencia de asociación con los genotipos. Por último, los resultados no fueron concluyentes respecto a la pérdida de un cuidador antes de los 12 años.
Para estudios posteriores, sería recomendable homogeneizar la población de estudio tomando como estrategias: subdividir el grupo de sujetos con TDM según las características de las manifestaciones clínicas y realizar los análisis según el grado de depresión y la presencia o ausencia de síntomas psicóticos o melancólicos. Aumentar el tamaño de la muestra podría derivar en equilibrio de Hardy-Weinberg de los SNP y resultados estadísticamente más significativos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo fue financiado por la División de Investigación, Sede Bogotá, Universidad Nacional de Colombia (código 23379).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a todos los sujetos que participaron en este estudio.