La polaridad predominante (PP) se ha propuesto como un especificador del trastorno afectivo bipolar (TAB) por su relación con variables clínicas y pronósticas. Es posible que esto se deba a una neurobiología subyacente distinta, de tal manera que los cambios encontrados por resonancia magnética estructural (RMe) en el TAB sean diferentes y específicos.
ObjetivosExplorar hallazgos de neuroimagen estructural en pacientes con TAB I de acuerdo con la PP.
MétodosEstudio de corte transversal que evaluó a 77 pacientes con TAB I usando la entrevista DIGS. Se estableció la PP utilizando la definición operativa de los 2 tercios de todos los episodios afectivos a lo largo de la vida para clasificar la PP en maniaca (PPM), depresiva (PPD) o indeterminada (PPI). Se les realizó RMe durante la fase de eutimia para medir estructuras intracraneales. Los datos obtenidos se analizaron mediante un modelo de regresión lineal ajustado por variables de confusión (consumo de medicamentos, consumo de alcohol, consumo de sustancias psicoactivas) y se compararon entre los 3 grupos para hallar la diferencia de medias estandarizada (DME).
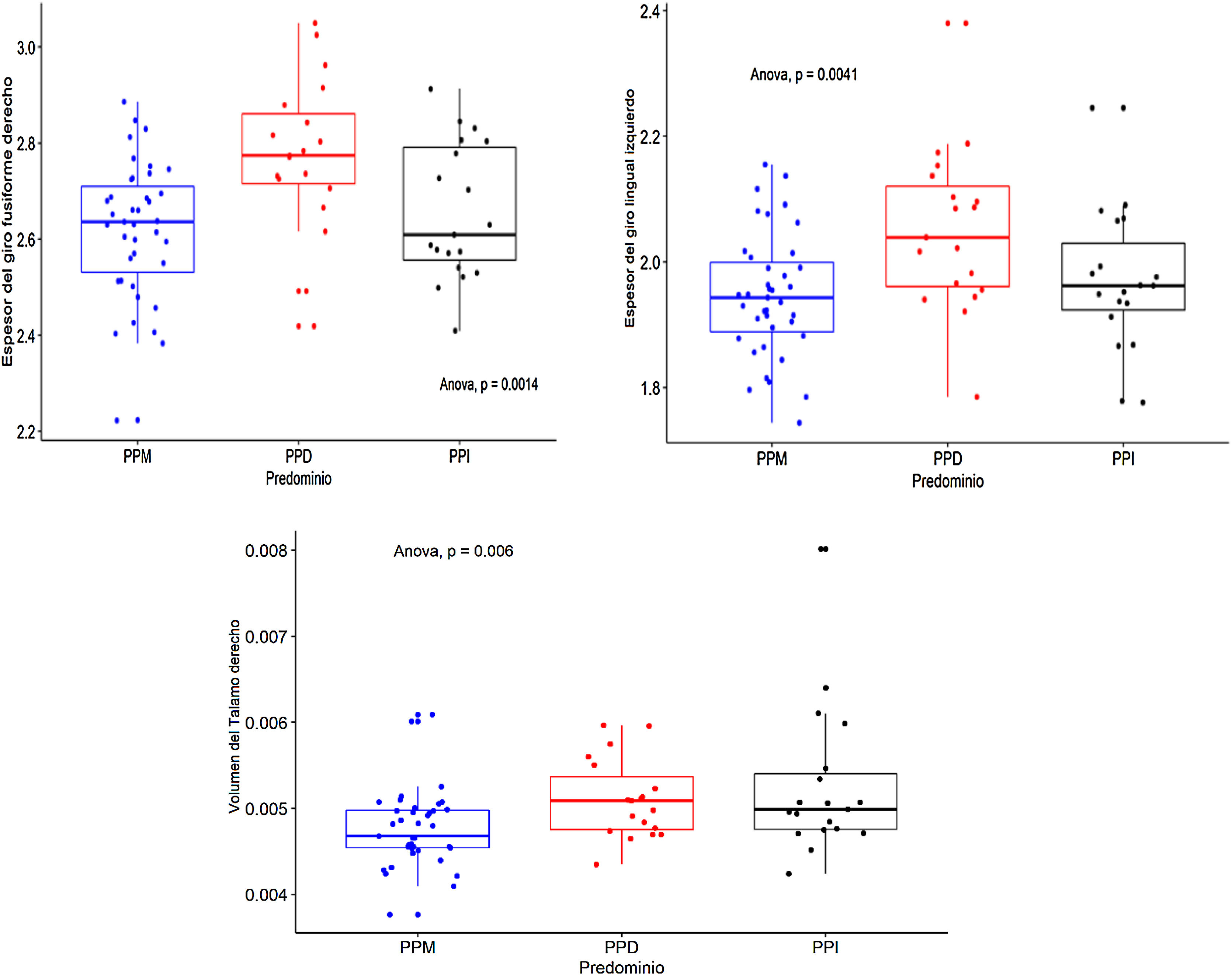
ResultadosSe encontraron diferencias con adecuado tamaño de efecto en 3 estructuras cerebrales tras ajustar por variables de confusión, específicamente en el giro fusiforme derecho y el giro lingual izquierdo, que fueron mayores en el grupo de PPD que en el de PPM (DME = 0,92; IC95%, 0,34-1,49; DME = 0,78; IC95%, 0,21-1,35). Asimismo en el tálamo derecho, que se mostró mayor en el grupo de PPI frente al de PPM (DME = 0,89; IC95%, 0,31-1,46).
ConclusionesSe observó una reducción del espesor del giro fusiforme derecho y el giro lingual izquierdo, así como del volumen talámico derecho en pacientes con TAB I con PPM, lo que respalda la hipótesis de que la PP cuenta con un correlato neurobiológico plausible y podría tener potencial utilidad como especificador del TAB.
Predominant polarity (PP) has been proposed as a specifier of bipolar disorder (BD) due to its relationship with clinical and prognostic variables. It is possible that this is due to a different underlying neurobiology, in such a way that the changes found by structural nuclear magnetic resonance imaging (sMRI) in BD are different and specific.
ObjectivesTo explore findings of structural neuroimaging in patients with BD type I (BD-I) according to PP.
MethodsCross-sectional study that evaluated 77 patients with BD-I using the DIGS interview. PP was established using the operative definition of two-thirds of all affective episodes throughout life to classify PP as manic (MPP), depressive (DPP) or indeterminate (IPP). MRIwas performed during the euthymia phase to measure intracranial structures. The data obtained was analysed using a linear regression model adjusted for confounding variables (drug use, alcohol use, psychoactive substance use) and were compared between the three groups finding the standardised mean difference (SMD).
ResultsDifferences with adequate effect size were found in three brain structures after adjusting for confounding variables, specifically in the right fusiform gyrus and the left lingual gyrus, which were greater in the DPP group than in the MPP group (SMD = 0.92; 95% CI = 0.34 to 1.49 and SMD = 0.78; 95% CI = 0.21 to 1.35). Likewise, in the right thalamus, it was shown to be greater in the IPP group compared to MPP group (SMD 0.89, 95% CI = 0.31 to 1.46).
ConclusionsA reduction in the thickness of the right fusiform gyrus and the left lingual gyrus, as well as the right thalamic volume was observed in patients with BD-I with PPM, which supports the hypothesis that PP has a plausible neurobiological correlate and could have potential utility as a BD specifier.
El trastorno afectivo bipolar (TAB) es un trastorno psiquiátrico grave que abarca un conjunto de alteraciones clínicas del estado del ánimo cuya etiología es multifactorial. Se lo considera una causa importante de discapacidad por el deterioro cognitivo y funcional que genera y se asocia con una elevada mortalidad, incluida la relacionada con suicidio1,2. Es un trastorno relativamente común, con una prevalencia mundial de todo el espectro bipolar a lo largo de la vida del 2,4% y la del TAB tipo I (TAB I), el 0,6%3,4. Es un trastorno crónico, episódico y recurrente, con una presentación clínica heterogénea dada por la presencia de al menos 1 episodio de manía y episodios afectivos en cantidad variable, ya sean otras manías, hipomanías, episodios depresivos mayores (EDM) o episodios mixtos, entre los cuales habitualmente hay periodos libres de síntomas o de eutimia5,6. Se ha descrito que los afectados pueden tener distintas trayectorias longitudinales. Jules Angst (1978)7 describió 3 «tipologías clínicas» en una población de bipolares: un tipo «MD», la de los que fueron hospitalizados por depresiones y manías por igual; un tipo maniaco «Md», y un tipo depresivo «Dm», cuyas hospitalizaciones en su mayoría fueron por manías o depresiones respectivamente. Estas observaciones originaron el concepto de polaridad predominante (PP), del cual se proponen 2 definiciones operativas. La primera es la del grupo de Colom et al.8, en Barcelona, utilizada con mayor frecuencia, que propone la PP como la superioridad de una polaridad, calculada como de al menos 2 tercios del número total de episodios previos. La segunda, el índice de Harvard, que resulta de un cociente entre la cantidad de episodios maniacos (e hipomaniacos) y el total de episodios depresivos; si la puntuación es > 1, se considera al paciente «predominantemente maniaco» y si es < 1, «predominantemente depresivo»9,10.
Diferentes estudios han descrito una asociación entre la PP y variables clínicas y pronósticas, por lo que se ha propuesto la PP como un especificador de curso y pronóstico del TAB I, pese a no estar incluido como tal en el DSM-511. Se ha encontrado, por ejemplo, que el tipo de primer episodio afectivo es un predictor de la PP posterior, con un valor predictivo positivo del 7580%12. La PP maniaca (PPM) es más frecuente en varones con mayor nivel educativo y antecedente familiar de trastornos del ánimo, un inicio más temprano de la enfermedad, hospitalización a más temprana edad, mayor uso de sustancias psicoactivas y mayor probabilidad de psicosis. Por su parte, la PP depresiva (PPD) se ha asociado con el sexo femenino, mayor probabilidad de conseguir pareja y casarse, un mayor retraso en el diagnóstico y el inicio del tratamiento adecuado, con un patrón de presentación estacional, comorbilidad con trastornos de personalidad, uso de alcohol y un mayor riesgo de conducta suicida y necesidad de terapia electroconvulsiva12–16. También hay diferencias en el tratamiento. Así, se ha visto que pacientes con PPM hacen más uso de estabilizadores del ánimo (principalmente litio, ácido valproico y lamotrigina) y antipsicóticos solos o en combinación con estabilizadores del ánimo, mientras que los pacientes con PPD toman más antidepresivos y benzodiacepinas17. También la PPD se ha encontrado como predictor de buena respuesta a la lamotrigina18,19, mientras que en la PPM hay buena respuesta al litio20.
Teniendo en cuenta las características específicas de cada PP y lo que pueden significar en la evolución de cada paciente, resulta prometedor evaluar si estas características cuentan con algún correlato neurobiológico que pueda explicar aspectos clínicos del trastorno en los que se pueda intervenir y prevenir desenlaces negativos futuros. Un instrumento útil para el estudio de la neurobiología es la resonancia magnética estructural (RMe), con la que es posible identificar cambios en la morfología cerebral, que si bien podrían ayudar a explicar la variabilidad del trastorno y en particular de la PP, se ha demostrado que a menudo no presenta asociaciones concluyentes y sufre la influencia de factores difíciles de controlar, lo que resta validez a los hallazgos, y es difícil determinar qué tanto de la heterogeneidad del trastorno y de la PP obedece a una neurobiología subyacente diferente de cada tipo de PP o si se trata de resultados de difícil interpretación producto de los inconvenientes metodológicos de los estudios que involucran análisis de neuroimágenes.
Así, en la literatura científica hay gran cantidad de estudios que evalúan aspectos neuroanatómicos en muestras de pacientes con TAB, tanto con RMe como con RM funcional (RMf), con resultados diversos, como hallazgos que demuestran cambios o alteraciones en diferentes estructuras o modificaciones en patrones de activación y conectividad en diferentes regiones cerebrales, dependientes del tipo de episodio afectivo, lo que apunta a la posibilidad de que estos hallazgos neuroanatómicos sean específicos del episodio de manía o de la depresión bipolar (DB), lo que nos lleva a plantearnos la hipótesis de que también pueda haber hallazgos específicos según el tipo de PP. Nuestro estudio tiene como objetivo identificar las diferencias en las imágenes de RMe entre los pacientes con TAB I según su tipo de PP en una muestra de pacientes de Antioquia.
MétodosEstudio descriptivo de corte transversal. Fue aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad de Antioquia. Los participantes firmaron el consentimiento informado. Fue una investigación de riesgo mínimo para los participantes y cumplió con las normas de investigación en seres humanos según lo dispuesto en la Resolución No 008430 de 1993 del Ministerio de Salud de Colombia y en la Declaración de Helsinki de 2013.
PoblaciónSe incluyó a los pacientes de una cohorte del proyecto PRISMA21 con diagnóstico de TAB I, según criterios diagnósticos del DSM-IV-TR establecidos por la entrevista diagnostica para estudios genéticos (DIGS), con edad entre 18 y 60 años, a quienes se les hubiera realizado RMe durante la eutimia, definida por una escala de manía de Young < 6 puntos y una escala de depresión de Hamilton < 7 puntos (inicialmente 82 pacientes). Se excluyó a los participantes con enfermedades neurológicas, discapacidad intelectual moderada o grave, autismo, trastornos de la personalidad, otros trastornos del estado de ánimo, esquizofrenia, antecedentes de traumatismo craneoencefálico, antecedente de terapia electroconvulsiva o contraindicaciones para la realización de la RMe (marcapasos, desfibrilador automático implantable, implante coclear, clips vasculares metálicos, prótesis vascular, stent vascular, dispositivo intrauterino, prótesis ortopédicas o fragmentos de metales en el cuerpo, como proyectiles de arma de fuego), de lo cual resultó una muestra definitiva de 77 pacientes.
Instrumentos y procedimientosDiagnostic Interview for Genetic Studies (DIGS) versión 3.0Desarrollada por el National Institute of Mental Healt (NIMH) en 1994 con fines de investigación sobre genética de las enfermedades mentales, fue validada para aplicarla a población colombiana. Está diseñada para la evaluación exhaustiva y el diagnóstico de individuos con trastornos mentales graves, como el TAB I22,23. Para el presente estudio, aplicaron la DIGS psiquiatras y residentes de psiquiatría entrenados. De esta entrevista se obtuvo información sociodemográfica y clínica (edad de inicio, duración del trastorno, número y tipo de los episodios afectivos, tratamiento psicofarmacológico recibido y los antecedentes de síntomas psicóticos, consumo de sustancias psicoactivas y conducta suicida).
Polaridad predominanteSe clasificó a los participantes según su PP, siguiendo la propuesta del grupo de Barcelona8, según la cual es necesario que al menos 2/3 de los episodios de un paciente en el curso longitudinal del trastorno deben ser EDM o manías (o hipomanías) para constituir la PPD o la PPM respectivamente. A los participantes en los que no se identificó ninguna de las 2 PP descritas se los clasificó como con PP indeterminada (PPI).
Imágenes de RMe cerebralLas RMe cerebrales se llevaron a cabo con un resonador Philips Achieva 3 Tesla de Nova Dual, con una duración aproximada de 1 h. Se obtuvieron secuencias en T1, y para el preprocesamiento y el análisis de los datos se empleó el programa Statistical Parametric Mapping versión 2005 (SPM5) (Department of Cognitive Neurology, University Collage, London). Todas las imágenes fueron realineadas para corregir cualquier movimiento del paciente durante la prueba mediante una trasformación de cuerpo rígido de 6 parámetros y la creación de una imagen promedio de todas las sesiones para los datos obtenidos. Las sesiones con parámetros de realineamiento > 4mm en cualquiera de los planos de movimiento (ejes x, y, z) se excluyeron del análisis estadístico, al igual que las sesiones con movimiento > 0,05 radianes en los planos de rotación. La imagen promedio luego se normalizó espacialmente a la plantilla del cerebro humano del Montreal Neurology Institute (MNI) mediante una transformación de 12 parámetros con 12 repeticiones no lineales y funciones base de 7 × 8 × 7. Después de la normalización, se efectuó un muestreo de todas las imágenes volumétricas con vóxels de 2 × 2 × 2 con una interpolación espacial trilineal. Todas las imágenes se sometieron a un proceso de suavizado con una amplitud de 8mm a la mitad del isotropismo máximo a partir de un filtro Gaussiano para compensar por la variabilidad entre sujetos y permitir que la teoría de campos aleatorios de Gauss rinda inferencias estadísticas correctas. Se analizaron estructuras corticales y subcorticales bilateralmente. Para el análisis de las estructuras corticales se utilizó el atlas de regiones cerebrales de interés de Desikan y Killiany. Se generó una base de datos teniendo en cuenta las medidas de espesor (mm), área (mm2) y volumen (mm3) obtenidas del software Freesurfer (http://surfer.nmr.mgh.harvard.edu). El volumen se calculó con el producto del espesor y el área. Para normalizar el volumen de estructuras cerebrales y poder compararlas entre sí, se usó la ecuación v′=v/VIC, donde v’ es el volumen normalizado, v es el volumen no normalizado y VIC es el volumen intracraneal total.
Análisis estadísticoLas características demográficas y clínicas de cada grupo de PP se describencon la mediana [intervalo intercuartílico] si eran continuas y con frecuencias y porcentajes si eran categóricas. Los datos de la neuroanatomía estructural se describen con la media ± desviación estándar y la comparación entre los grupos de cada PP se realizó mediante un modelo de regresión lineal ajustado por consumo de benzodiacepinas, alcohol y sustancias psicoactivas, litio, antipsicóticos, antidepresivos y ácido valproico, y asumiendo como grupo de referencia el de predominio maniaco por ser el de mayor frecuencia. Los resultados se presentan como diferencia de medias estandarizada (DME) con su respectivo intervalo de confianza del 95% (IC95%). Valores de la DME > 0,80, 0,50 o 0,20 se interpretaron como diferencias altas, moderadas o bajas respectivamente24. Ante las limitaciones del valor p y siguiendo las sugerencias de Greenland25, se calculó el valor s (Shannon information o surprise value) como s = –log2(p), donde p es el valor p del test estadístico utilizado26. El valor s debe interpretarse como una medida continua de la cantidad de información o bits suministrada por el test estadístico en contra de la hipótesis contrastada (en nuestro caso la hipótesis de ausencia de diferencias entre los diferentes grupos de estudio). Todos los análisis se llevaron a cabo en R/R studio27,28.
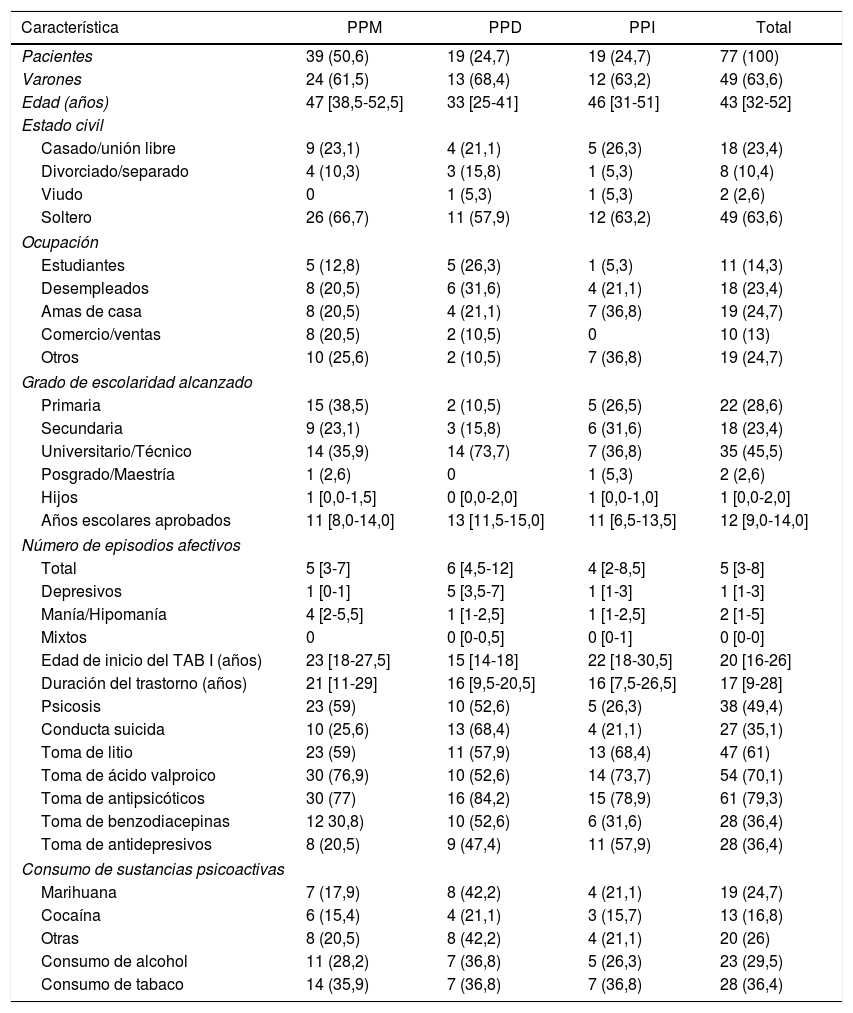
ResultadosCaracterísticas de los participantesSe incluyó a 77 individuos de 2058 años, en su mayoría varones (63,6%). En 58 pacientes (75,3%) se identificó la PP, en tanto que en 19 (24,7%) la PP resultó indeterminada. La caracterización sociodemográfica y clínica se muestra en la tabla 1.
Características sociodemográficas y clínicas de un grupo de pacientes con TAB I según la poralidad predominante
| Característica | PPM | PPD | PPI | Total |
|---|---|---|---|---|
| Pacientes | 39 (50,6) | 19 (24,7) | 19 (24,7) | 77 (100) |
| Varones | 24 (61,5) | 13 (68,4) | 12 (63,2) | 49 (63,6) |
| Edad (años) | 47 [38,5-52,5] | 33 [25-41] | 46 [31-51] | 43 [32-52] |
| Estado civil | ||||
| Casado/unión libre | 9 (23,1) | 4 (21,1) | 5 (26,3) | 18 (23,4) |
| Divorciado/separado | 4 (10,3) | 3 (15,8) | 1 (5,3) | 8 (10,4) |
| Viudo | 0 | 1 (5,3) | 1 (5,3) | 2 (2,6) |
| Soltero | 26 (66,7) | 11 (57,9) | 12 (63,2) | 49 (63,6) |
| Ocupación | ||||
| Estudiantes | 5 (12,8) | 5 (26,3) | 1 (5,3) | 11 (14,3) |
| Desempleados | 8 (20,5) | 6 (31,6) | 4 (21,1) | 18 (23,4) |
| Amas de casa | 8 (20,5) | 4 (21,1) | 7 (36,8) | 19 (24,7) |
| Comercio/ventas | 8 (20,5) | 2 (10,5) | 0 | 10 (13) |
| Otros | 10 (25,6) | 2 (10,5) | 7 (36,8) | 19 (24,7) |
| Grado de escolaridad alcanzado | ||||
| Primaria | 15 (38,5) | 2 (10,5) | 5 (26,5) | 22 (28,6) |
| Secundaria | 9 (23,1) | 3 (15,8) | 6 (31,6) | 18 (23,4) |
| Universitario/Técnico | 14 (35,9) | 14 (73,7) | 7 (36,8) | 35 (45,5) |
| Posgrado/Maestría | 1 (2,6) | 0 | 1 (5,3) | 2 (2,6) |
| Hijos | 1 [0,0-1,5] | 0 [0,0-2,0] | 1 [0,0-1,0] | 1 [0,0-2,0] |
| Años escolares aprobados | 11 [8,0-14,0] | 13 [11,5-15,0] | 11 [6,5-13,5] | 12 [9,0-14,0] |
| Número de episodios afectivos | ||||
| Total | 5 [3-7] | 6 [4,5-12] | 4 [2-8,5] | 5 [3-8] |
| Depresivos | 1 [0-1] | 5 [3,5-7] | 1 [1-3] | 1 [1-3] |
| Manía/Hipomanía | 4 [2-5,5] | 1 [1-2,5] | 1 [1-2,5] | 2 [1-5] |
| Mixtos | 0 | 0 [0-0,5] | 0 [0-1] | 0 [0-0] |
| Edad de inicio del TAB I (años) | 23 [18-27,5] | 15 [14-18] | 22 [18-30,5] | 20 [16-26] |
| Duración del trastorno (años) | 21 [11-29] | 16 [9,5-20,5] | 16 [7,5-26,5] | 17 [9-28] |
| Psicosis | 23 (59) | 10 (52,6) | 5 (26,3) | 38 (49,4) |
| Conducta suicida | 10 (25,6) | 13 (68,4) | 4 (21,1) | 27 (35,1) |
| Toma de litio | 23 (59) | 11 (57,9) | 13 (68,4) | 47 (61) |
| Toma de ácido valproico | 30 (76,9) | 10 (52,6) | 14 (73,7) | 54 (70,1) |
| Toma de antipsicóticos | 30 (77) | 16 (84,2) | 15 (78,9) | 61 (79,3) |
| Toma de benzodiacepinas | 12 30,8) | 10 (52,6) | 6 (31,6) | 28 (36,4) |
| Toma de antidepresivos | 8 (20,5) | 9 (47,4) | 11 (57,9) | 28 (36,4) |
| Consumo de sustancias psicoactivas | ||||
| Marihuana | 7 (17,9) | 8 (42,2) | 4 (21,1) | 19 (24,7) |
| Cocaína | 6 (15,4) | 4 (21,1) | 3 (15,7) | 13 (16,8) |
| Otras | 8 (20,5) | 8 (42,2) | 4 (21,1) | 20 (26) |
| Consumo de alcohol | 11 (28,2) | 7 (36,8) | 5 (26,3) | 23 (29,5) |
| Consumo de tabaco | 14 (35,9) | 7 (36,8) | 7 (36,8) | 28 (36,4) |
PP: polaridad predominante; PPD: polaridad predominante depresiva; PPI: polaridad predominante indeterminada; PPM: polaridad predominante maniaca.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
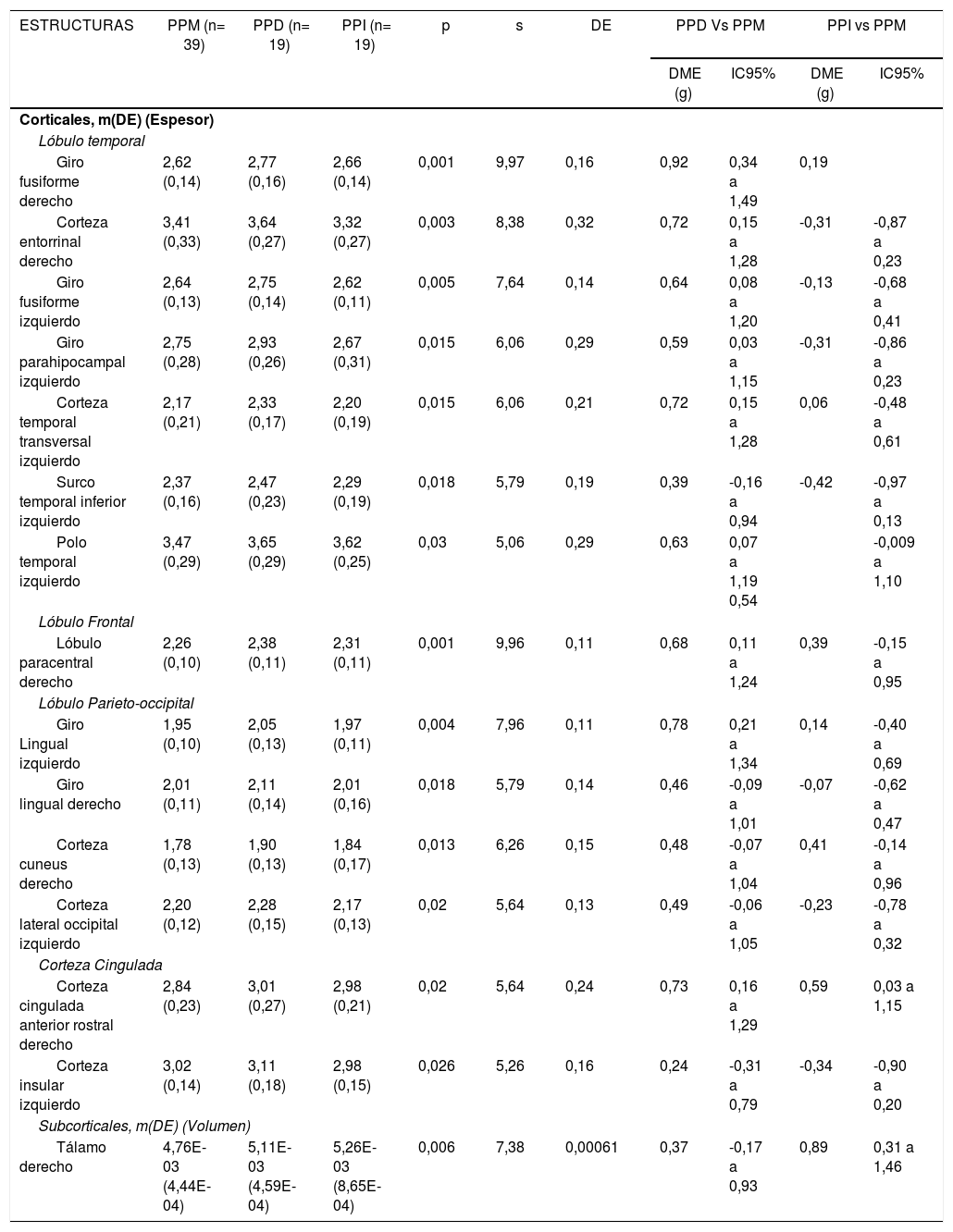
Se calcularon los volúmenes de 15 estructuras subcorticales y los espesores y las áreas de 35 estructuras corticales, derechas e izquierdas (en total, 157 mediciones de estructuras intracraneales). En la tabla 2 se muestran las comparaciones entre los 3 grupos, los valores p y s, con el tamaño del efecto ajustado. Las 3 estructuras que exhibieron diferencias con mayor tamaño de efecto fueron: el giro fusiforme derecho y el giro lingual izquierdo, cuyos espesores fueron mayores en el grupo de PPD que en el grupo de PPM: g = 0,92 (IC95%, 0,31-1,46) y g = 0,78 (IC95%, 0,21-1,34) respectivamente, y el tálamo derecho, cuyo volumen es mayor en el grupo de PPI que en el de PPM: g = 0,89 (IC95%, 0,3-1,49). En la figura 1 se muestran las diferencias de las estructuras con mayor tamaño de efecto en la comparación entre los grupos de PP. La totalidad de estructuras evaluadas se encuentra en la tabla 1 del material adicional.
Mediciones del espesor de estructuras corticales y el volumen de las subcorticales, según la polaridad predominante en un grupo de pacientes con TAB-I
| ESTRUCTURAS | PPM (n= 39) | PPD (n= 19) | PPI (n= 19) | p | s | DE | PPD Vs PPM | PPI vs PPM | ||
|---|---|---|---|---|---|---|---|---|---|---|
| DME (g) | IC95% | DME (g) | IC95% | |||||||
| Corticales, m(DE) (Espesor) | ||||||||||
| Lóbulo temporal | ||||||||||
| Giro fusiforme derecho | 2,62 (0,14) | 2,77 (0,16) | 2,66 (0,14) | 0,001 | 9,97 | 0,16 | 0,92 | 0,34 a 1,49 | 0,19 | |
| Corteza entorrinal derecho | 3,41 (0,33) | 3,64 (0,27) | 3,32 (0,27) | 0,003 | 8,38 | 0,32 | 0,72 | 0,15 a 1,28 | -0,31 | -0,87 a 0,23 |
| Giro fusiforme izquierdo | 2,64 (0,13) | 2,75 (0,14) | 2,62 (0,11) | 0,005 | 7,64 | 0,14 | 0,64 | 0,08 a 1,20 | -0,13 | -0,68 a 0,41 |
| Giro parahipocampal izquierdo | 2,75 (0,28) | 2,93 (0,26) | 2,67 (0,31) | 0,015 | 6,06 | 0,29 | 0,59 | 0,03 a 1,15 | -0,31 | -0,86 a 0,23 |
| Corteza temporal transversal izquierdo | 2,17 (0,21) | 2,33 (0,17) | 2,20 (0,19) | 0,015 | 6,06 | 0,21 | 0,72 | 0,15 a 1,28 | 0,06 | -0,48 a 0,61 |
| Surco temporal inferior izquierdo | 2,37 (0,16) | 2,47 (0,23) | 2,29 (0,19) | 0,018 | 5,79 | 0,19 | 0,39 | -0,16 a 0,94 | -0,42 | -0,97 a 0,13 |
| Polo temporal izquierdo | 3,47 (0,29) | 3,65 (0,29) | 3,62 (0,25) | 0,03 | 5,06 | 0,29 | 0,63 | 0,07 a 1,19 0,54 | -0,009 a 1,10 | |
| Lóbulo Frontal | ||||||||||
| Lóbulo paracentral derecho | 2,26 (0,10) | 2,38 (0,11) | 2,31 (0,11) | 0,001 | 9,96 | 0,11 | 0,68 | 0,11 a 1,24 | 0,39 | -0,15 a 0,95 |
| Lóbulo Parieto-occipital | ||||||||||
| Giro Lingual izquierdo | 1,95 (0,10) | 2,05 (0,13) | 1,97 (0,11) | 0,004 | 7,96 | 0,11 | 0,78 | 0,21 a 1,34 | 0,14 | -0,40 a 0,69 |
| Giro lingual derecho | 2,01 (0,11) | 2,11 (0,14) | 2,01 (0,16) | 0,018 | 5,79 | 0,14 | 0,46 | -0,09 a 1,01 | -0,07 | -0,62 a 0,47 |
| Corteza cuneus derecho | 1,78 (0,13) | 1,90 (0,13) | 1,84 (0,17) | 0,013 | 6,26 | 0,15 | 0,48 | -0,07 a 1,04 | 0,41 | -0,14 a 0,96 |
| Corteza lateral occipital izquierdo | 2,20 (0,12) | 2,28 (0,15) | 2,17 (0,13) | 0,02 | 5,64 | 0,13 | 0,49 | -0,06 a 1,05 | -0,23 | -0,78 a 0,32 |
| Corteza Cingulada | ||||||||||
| Corteza cingulada anterior rostral derecho | 2,84 (0,23) | 3,01 (0,27) | 2,98 (0,21) | 0,02 | 5,64 | 0,24 | 0,73 | 0,16 a 1,29 | 0,59 | 0,03 a 1,15 |
| Corteza insular izquierdo | 3,02 (0,14) | 3,11 (0,18) | 2,98 (0,15) | 0,026 | 5,26 | 0,16 | 0,24 | -0,31 a 0,79 | -0,34 | -0,90 a 0,20 |
| Subcorticales, m(DE) (Volumen) | ||||||||||
| Tálamo derecho | 4,76E-03 (4,44E-04) | 5,11E-03 (4,59E-04) | 5,26E-03 (8,65E-04) | 0,006 | 7,38 | 0,00061 | 0,37 | -0,17 a 0,93 | 0,89 | 0,31 a 1,46 |
Nota: Se presenta la media (desviación estándar), así como el valor de p y valor s de la comparación entre los tres grupos, También la DME ajustada por uso de benzodiacepinas, consumo de alcohol y sustancias psicoactivas, uso de litio, antipsicóticos, antidepresivos y acido valproico y asumiendo como grupo de referencia el de PPM.
Abreviaturas:PPM: Polaridad Predominante Maniaca; PPD: Polaridad Predominante Depresiva; PPI: Polaridad Predominante Indeterminada; p: Valor p; s: Valor s; DE: Desviación Estándar; DME: Diferencia de Medias Estandarizada; g: g de Hedges; IC95%: Intervalo de confianza del 95%
Gráfico de caja y bigotes con puntos que muestra la distribución del espesor del giro fusiforme derecho, el espesor del giro lingual izquierdo y el volumen del tálamo derecho, según la polaridad predominante (PPD, PPM y PPI). Los tamaños de efecto se hallaron comparando PPD>PPM (s = 9,97; DE = 0,16; DEM = 0,92), PPD>PPM (s = 7,96; DE = 0,11; DEM = 0,78) y PPI>PPM (s = 7,38; DE = 0,00061; DEM = 0,89) para las 3 estructuras respectivamente.
Con base en el análisis de los resultados de las RMe cerebrales de 77 pacientes con TAB I, nuestro estudio detecta en los pacientes con PPM una disminución del espesor de 2 estructuras corticales respecto a los pacientes con PPD: giro fusiforme derecho y giro lingual izquierdo. Por su parte, en las estructuras subcorticales se evidenció una disminución del volumen talámico derecho en el grupo de PPM frente al de PPI. Estas diferencias fueron ajustadas y cuentan con tamaño de efecto importante e intervalos de confianza estrechos. Estos datos pueden llevar a suponer que los episodios de manía y, por extensión, la PPM se relacionan con alteraciones estructurales en los pacientes con TAB I. Esto supone un efecto de los episodios de manía en estas estructuras cerebrales y está en relación con lo que se teoriza en diferentes publicaciones acerca de un efecto neurodegenerativo propio del TAB, que algunos estudios han atribuido en parte a disfunción de los mecanismos neuroinmunoendocrinos que llevan a hipercortisolismo y un estado proinflamatorio persistente, observado comúnmente en pacientes con trastornos afectivos29,30. Sin embargo, atribuir los hallazgos únicamente a neurodegeneración resulta complejo debido a la dinámica bidireccional, aún en estudio, entre los cambios estructurales y sus posibles causas. Es decir, la alteración estructural podría explicar las manifestaciones clínicas o, por el contrario, los procesos fisiopatológicos del TAB I que se expresan clínicamente como episodios afectivos podrían ser la causa de alteraciones estructurales específicas, sin obviar otra gran cantidad de factores asociados.
Al analizar nuestros resultados a la luz de la literatura disponible, hay pocos trabajos que analicen específicamente hallazgos de neuroimagen y PP. En uno de ellos, Kim et al.31 evaluaron las RM de 35 pacientes con TAB I y las compararon con las de 35 controles sanos; encontraron que los pacientes con TAB I tenían una disminución más marcada de la materia gris prefrontal bilateral, insular, temporal y parietal; además, aquellos con PPM mostraban a su vez una disminución del volumen del giro frontal superior, mayor que los del grupo con PPD o los controles sanos. Por su parte, Janiri et al.32 evaluaron imágenes de RM de 175 pacientes ambulatorios con TAB, sin tener en cuenta el subtipo, y los compararon con 150 controles sanos. Se enfocaron en la estructura hipocampal y realizaron comparaciones según la PP, y hallaron reducciones de volumen en porciones específicas del hipocampo en los pacientes con TAB y más acentuadas aún en quienes además pertenecían al subgrupo de PPD. Aunque pudiera parecer que los resultados de estos trabajos no están directamente relacionados con los del nuestro, ya que difieren en la PP que muestra las diferencias, si es probable algún grado de concordancia, dada principalmente por la localización temporal de los hallazgos estructurales en esos 2 estudios, así como en el nuestro, el cual encontró diferencias con tamaño de efecto grande en el giro fusiforme derecho (localización temporal inferior) y en el giro lingual izquierdo (occipitotemporal medial), en el subgrupo de PPM. Si bien es apresurado asegurar con base en nuestros hallazgos que haya asociaciones precisas, estos dan pie a pensar en el lóbulo temporal y algunas de sus estructuras como relevantes para comprender el TAB, algo que ya se ha planteado en diferentes estudios33,34.
Un estudio buscó identificar diferentes fenotipos neurocognitivos asociados con el temperamento y neuroanatómicos, su heredabilidad y su asociación con la gravedad del TAB I en 2 poblaciones estrechamente relacionadas y consideradas genéticamente aisladas, el Valle Central de Costa Rica y la región de Antioquia en Colombia, de donde es originara la población incluida en nuestro estudio. Entre otros hallazgos, se observaron reducciones del volumen del tálamo y el espesor cortical en los giros fusiformes y linguales; las alteraciones en estas 3 estructuras resultan heredables en esta población y los giros fusiformes y linguales, además de asociadas con la gravedad clínica del TAB I35. Los resultados de ese estudio, que destacan estas 3 estructuras como fenotipos neuroimagenológicos del TAB I, concuerdan con los hallazgos del nuestro.
Otros estudios que evaluaron neuroanatomía y TAB sin considerar la PP también mostraron cierto grado de concordancia con nuestras observaciones: que el giro fusiforme derecho, el giro lingual izquierdo y el tálamo derecho, aunque no son las únicas estructuras implicadas, sí tienen relevancia en la regulación de las emociones y el estado de ánimo36,39. Por ejemplo, un estudio evaluó las diferencias de los exámenes de morfometría basada en vóxels entre pacientes con TAB, pacientes con depresión unipolar y un grupo de controles sanos; evidenció que el grupo de pacientes con TAB mostraba una reducción marcada del volumen de sustancia gris bilateral en los hipocampos hasta los giros fusiformes, la corteza prefrontal dorsal, la ínsula, la amígdala, los núcleos caudados, los putámenes, los talamos y los giros linguales37. Por su parte, un metanálisis también de ENIGMA (Enhancing Neuroimaging Genetics through Meta-Analysis), que evaluó estructuras corticales en adultos con TAB, identificó que estos presentaban adelgazamiento de las regiones parietales y temporales inferiores, incluidos los giros fusiforme y temporal medial, que están relacionados con el procesamiento y la conciencia visuoespacial40. Este hallazgo se correlacionó a su vez con disminución del metabolismo del giro fusiforme derecho en los pacientes con TAB I y antecedentes de síntomas psicóticos, y se propuso que las alteraciones en esta estructura podrían considerarse biomarcador de psicosis en pacientes con TAB41. Esto parece afín a los resultados de nuestro estudio, en el que las alteraciones del giro fusiforme derecho fueron significativas en el subgrupo de PPM, que a su vez es el que presenta el mayor porcentaje de antecedentes de síntomas psicóticos durante el curso del trastorno.
Acerca del giro lingual izquierdo, en un estudio que comparó a pacientes con TAB y pacientes con depresión unipolar, los primeros presentaron disminución del volumen de la materia gris en 12 regiones cerebrales: el lóbulo VIII del cerebelo derecho, los putámenes derecho e izquierdo, el hipocampo izquierdo, la corteza precuneal derecha, los giros frontales superiores derecho e izquierdo, el giro precentral izquierdo, la corteza calcarina izquierda, el giro temporal inferior izquierdo, el fusiforme derecho y el lingual izquierdo42. Los autores encontraron en el grupo de pacientes con TAB mayor prevalencia de sobrepeso/obesidad y concentraciones de citocinas proinflamatorias más altas; observaciones similares han obtenido otros estudios en TAB43, aunque con afección de otras estructuras, datos que apuntan a un mecanismo neuroinflamatorio y endocrino en la fisiopatología del trastorno.
En lo concerniente al tálamo, es una estructura con múltiples conexiones con otras regiones cerebrales, como la corteza prefrontal orbital y medial, así como con otras estructuras límbicas implicadas en la regulación emocional, y se lo ha propuesto como una estructura determinante en la regulación del estado de ánimo, de la conducta y de la respuesta a estímulos ambientales. Hay evidencia de alteraciones en su volumen, como también de patrones de activación y conectividad en los trastornos afectivos cuando se comparan con controles sanos38,39,44. Haznedar et al.45 evaluaron volúmenes del tálamo en varios grupos de pacientes con TAB I, TAB II y ciclotimia e individuos sanos. Encontraron alteraciones volumétricas del tálamo según el subtipo clínico, principalmente en pacientes con TAB II, en los que se observaron asimetrías entre ambos tálamos y en pacientes con trastorno ciclotímico, que mostraron reducción bilateral del volumen talámico. Estos hallazgos pueden obedecer a las características propias de cada trastorno, un mayor número de episodios y dificultades en el diagnóstico oportuno del TAB II, o al efecto de tratamientos farmacológicos que pueden mitigar la pérdida o disminución de volumen de diferentes estructuras esperada, por ejemplo en el TAB I45. Estudios más recientes que evalúan el efecto de los episodios afectivos recurrentes han comparado neuroimágenes funcionales de pacientes en su primer episodio con las de pacientes con múltiples episodios afectivos, y se ha observado que los pacientes con curso crónico y múltiples descompensaciones presentan menor activación en los tractos prefrontal-estriado-amigdalino y de forma bilateral en los tálamos, las cortezas prefrontal ventrolateral, orbitofrontales y cingulada anterior, putámenes, caudados, amígdalas, área 22 de Brodmann y regiones parietales posteriores derechas. Es probable que alteraciones neurofisiológicas asociadas con un mayor número de episodios afectivos lleven a un decremento de la activación de redes neuronales implicadas en la regulación afectiva de los pacientes con TAB46, y a su vez tengan correlación teórica con alteraciones estructurales que pueden variar según la PP.
Todas estas observaciones corroboran lo complejo del trastorno y cómo la investigación en neuroimágenes puede ser un instrumento que permita plantear nuevas hipótesis y proporcione información relevante para una mejor comprensión de los procesos neurofisiológicos y patológicos subyacentes, por lo que se las propone como potenciales biomarcadores en el TAB47,48.
En lo que concierne a esta investigación en particular, la cual se basó en neuroimagen estructural, propone la presencia de un sustrato neurobiológico para la PP, que cobra fuerza como potencial especificador del curso clínico y pronóstico del TAB I. El análisis de la utilidad de los resultados de estudios como el nuestro debe hacerse teniendo en cuenta los estudios precedentes en la misma línea de investigación, que han revelado resultados heterogéneos y en ocasiones contradictorios, con estructuras implicadas que difieren de un estudio a otro, posiblemente debido a la influencia de múltiples factores. Por un lado, los propios del trastorno (fenotipos clínicos, especificadores), del individuo (factores genéticos) y medioambientales (eventos vitales o estresantes, factores epigenéticos) y la influencia de medicamentos como el litio, que se ha relacionado con cambios en algunas estructuras cerebrales49–51 y teóricamente podría tener un papel neuroprotector contra el trastorno. Por otro, también cobra importancia la metodología de cada estudio con la población estudiada, el tamaño y las características de la muestra, el seguimiento o la ausencia de este y el procesamiento de las neuroimágenes40. Todos estos elementos que difieren de un estudio a otro influyen en los resultados y hacen que haya escasa concordancia con estudios similares.
A pesar de la diversidad de estudios que se aproximan a la neuroanatomía del TAB, se carece de trabajos que hayan investigado específicamente la relación entre los hallazgos de neuroimagen estructural y la PP, razón por la cual consideramos que una de las fortalezas de nuestro estudio es la medición amplia de múltiples estructuras corticales y subcorticales, que pueden aportar al cuerpo de datos sobre la neuroanatomía estructural y favorecer una síntesis cuantitativa. Otra ventaja es el ajuste estadístico por variables de confusión al momento de analizar los resultados, lo que disminuye la injerencia de variables que afectan a la neurobiología. Entre las debilidades, resalta el tamaño muestral pequeño, que pudo haber llevado a errores de tipo II para identificar regiones de interés; sería útil la realización de más estudios que reproduzcan el nuestro con un mayor tamaño de muestra. Otra limitación es el posible sesgo de medición en algunas variables como el consumo de sustancias o los tratamientos recibidos, ya que, a pesar de que la DIGS 3.0 las incluye, pudo haber respuestas inexactas de los participantes o errores de registro del evaluador.
ConclusionesNuestro estudio encontró diferencias con tamaño de efecto grande compatibles con reducción del espesor del giro fusiforme derecho y el giro lingual izquierdo, y reducción del volumen talámico derecho en pacientes con PPM comparados con los grupos con PPD y PPI. Esto indica que la PP cuenta con un correlato neurobiológico plausible que a su vez tiene en las diferencias estructurales halladas posibles biomarcadores imagenológicos del TAB I con potencial utilidad en el proceso diagnóstico, como predictor de curso clínico o en la toma de decisiones terapéuticas. Se requieren estudios adicionales con un tamaño de muestra más grande y con posibilidad de seguimiento para evaluar cómo se producen en el tiempo los cambios neuroanatómicos de los pacientes con manifestaciones clínicas particulares, como el predominio de cada episodio afectivo.
FinanciaciónLos datos para la realización de esta investigación se obtuvieron de la muestra del la investigación PRISMA, financiada por Colciencias. Código: 501153730798, contrato 351-2011, convocatoria 537 DE 2011. No hubo ningun patrocinio adicional.
Conflicto de interesesNinguno.