La serotonina tiene gran implicación en la regulación del estado emocional y la ejecución de tareas cognitivas, de modo que los genes del transportador de serotonina (5-HTT, SLC6A4) y de los receptores de serotonina (HTR1A, HTR1B, HTR2A) se convierten en candidatos adecuados para estudiar los efectos de estos genes y sus variaciones polimórficas en las características de la depresión.
ObjetivoRevisión de reportes de investigación que hayan estudiado los efectos de las variantes de los genes del transportador y de los receptores de serotonina en las diferentes características clínicas de la depresión.
MétodosSe realizó una búsqueda en las bases de datos Scopus, Web of Science y PubMed con las palabras clave “depression”, AND “polymorphism”.
ConclusionesSegún la revisión de 54 artículos, se encontró que el alelo corto del polimorfismo de 5-HTTLPR es el factor de riesgo más reportado en relación con el desarrollo de depresión y su gravedad. Las variantes de los genes estudiados (SLC6A4, HTR1A, HTR1B y HTR2A) pueden generar alteraciones morfológicas de estructuras cerebrales.
Serotonin is highly implicated in the regulation of emotional state and the execution of cognitive tasks, so much so that the serotonin transporter genes (5-HTT, SLC6A4) and the serotonin receptor genes (HTR1A, HTR1B, HTR2A) have become the perfect candidates when studying the effects that these genes and their polymorphic variations have on depression characteristics.
ObjectiveA review of research reports that have studied the effects of variations in the serotonin transporter and receptor genes on different clinical features of depression.
MethodsA search of the Scopus, Web of Science and PubMed databases was conducted using the keywords (“depression” AND “polymorphism”).
ConclusionsAccording to the review of 54 articles, the short allele of the 5-HTTLPR polymorphism was found to be the most reported risk factor related to the development of depression and its severity. Variations in the genes studied (SLC6A4, HTR1A, HTR2A) can generate morphological alterations of brain structures.
Los trastornos depresivos están entre las enfermedades psiquiátricas más estudiadas porque son uno de los principales problemas de salud pública1 por su alta prevalencia, su edad de inicio temprana, su curso crónico y su naturaleza incapacitante. En el mundo la depresión es la principal causa de discapacidad, con más de 300 millones de personas actualmente afectadas. Ello supone un aumento > 18% entre 2005 y 20152.
Este trastorno se caracteriza por episodios en los que las emociones y los pensamientos negativos coexisten con alteraciones de las funciones cognitivas, así como cambios en el apetito, la libido y el sueño3. El Manual Diagnóstico y Estadístico de los Trastornos Mentales en su quinta edición (DSM-5) incluye los siguientes síntomas de depresión:
- •
Sentimientos de tristeza, desesperanza, inutilidad y culpa.
- •
Baja autoestima.
- •
Pensamientos negativos centrados en el suicidio.
- •
Déficit cognitivo que afecta a la motivación, la atención selectiva, la memoria episódica y la memoria de trabajo4.
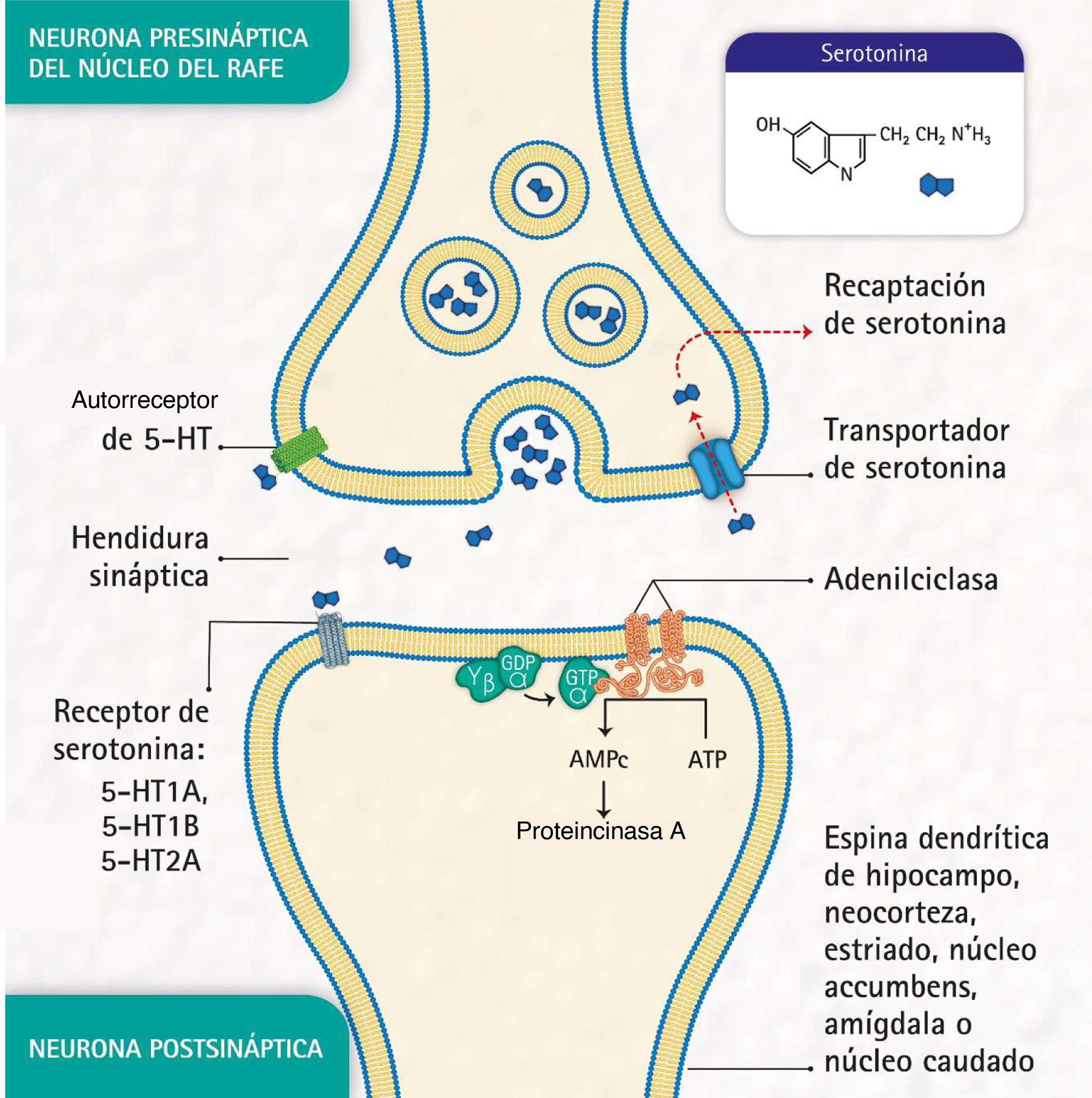
Estos trastornos también se caracterizan por alteraciones en la señalización sináptica mediada por sustancias como la serotonina (5-hidroxi-triptamina [5-HT]), neurotransmisor relacionado con la modulación del comportamiento social y la respuesta emocional de los individuos3. Esta sustancia se libera a partir de neuronas presinápticas ubicadas en los núcleos del rafe, los cuales cumplen la función de activar el sistema límbico. Posteriormente se une a receptores postsinápticos de serotonina situados principalmente en áreas límbicas como el hipocampo, la corteza, el estriado dorsal y el núcleo accumbens (fig. 1).
Procesos moleculares de bioseñalización de serotonina: liberación de serotonina por la neurona presináptica; unión de la serotonina a uno de los receptores en una neurona postsináptica; activación de la proteína G, la adenil ciclasa y las proteincinasa A; formación de adenosina monofosfato cíclico (AMPc); recaptación de serotonina por el transportador de serotonina en la neurona presináptica, y autorreceptor de serotonina en la neurona presináptica. (Representación realizada por los autores y diseñada por Melissa Zuluaga Hernández.).
La proteína transportadora de serotonina (5-HTT), ubicada en las neuronas presinápticas, participa en la recaptación de serotonina5, uno de los mecanismos para eliminar el neurotransmisor de la hendidura sináptica (fig. 1). La 5-HTT se codifica por el gen SLC6A4, ubicado en el cromosoma 17q11.1-17q12 6,7. La región polimórfica 5-HTTLPR —aproximadamente 1 kb aguas arriba de la región promotora— se ha reportado como mediadora de la influencia de eventos estresantes en la depresión humana8.
Por otro lado, el receptor de serotonina 1A (5-HT1A) —que abarca unos 1.200 pb y cuyo gen HTR1A se mapea en el cromosoma 5q11.2-13— es conocido como un potente regulador de la neurotransmisión serotoninérgica9 y se ha señalado que los autorreceptores localizados en las neuronas del rafe tienen un papel esencial en el efecto de los antidepresivos10.
Además, el receptor de serotonina 2A (5-HT2A), codificado por el gen HTR2A, situado en la posición 13q14-q21, es de particular importancia en los trastornos del estado de ánimo y está asociado con la respuesta a medicamentos antidepresivos11. Estos receptores se encuentran, principalmente, en la neocorteza, el núcleo caudado, el núcleo accumbens y el hipocampo.
Los polimorfismos en los genes que codifican para el transportador y los receptores de serotonina antes mencionados generan variantes proteicas con diferentes niveles de expresión y capacidad de transducción de señales12. Estas diferencias pueden ser importantes en la predisposición individual a contraer enfermedades psiquiátricas como la depresión13 y en las diferencias en la respuesta a fármacos.
Los resultados de estudios realizados en núcleos familiares de pacientes con depresión indican que esta enfermedad tiene un origen multifactorial que muestra un componente genético altamente complejo, con gran cantidad de loci implicados14, cada uno de los cuales contribuye con un tamaño muy pequeño al fenotipo, por lo que las variantes genéticas específicas se vuelven difíciles de identificar y los resultados de los estudios son discordantes15. Además, el tamaño de muestra inferior a 100 pacientes encontrado en el 48% de los estudios revisados puede aportar a la divergencia de los resultados obtenidos cuando se relacionan los polimorfismos en los genes SLC6A4, HTR1A, HTR1B y HTR2A con la depresión. Por lo tanto, el propósito de esta revisión es recopilar información científica sobre los efectos que tienen las variaciones genéticas del transportador y de los receptores de serotonina en las diferentes características clínicas de la enfermedad o en el riesgo de sufrirla para lograr mayor comprensión acerca de esta relación e identificar temas de estudio futuro.
MétodosLa búsqueda se realizó en las bases de datos Scopus, Web of Science y PubMed con artículos publicados desde 1996 hasta 2020 como fecha límite, y se llevó a cabo entre febrero y marzo de 2020. Se revisaron artículos principalmente en inglés con los términos “depression” AND “polymorphism”. Se restringió la aparición de estos términos al título y las palabras clave de los trabajos. Además, se tuvieron en cuenta artículos de investigación y de revisión y capítulos de libro.
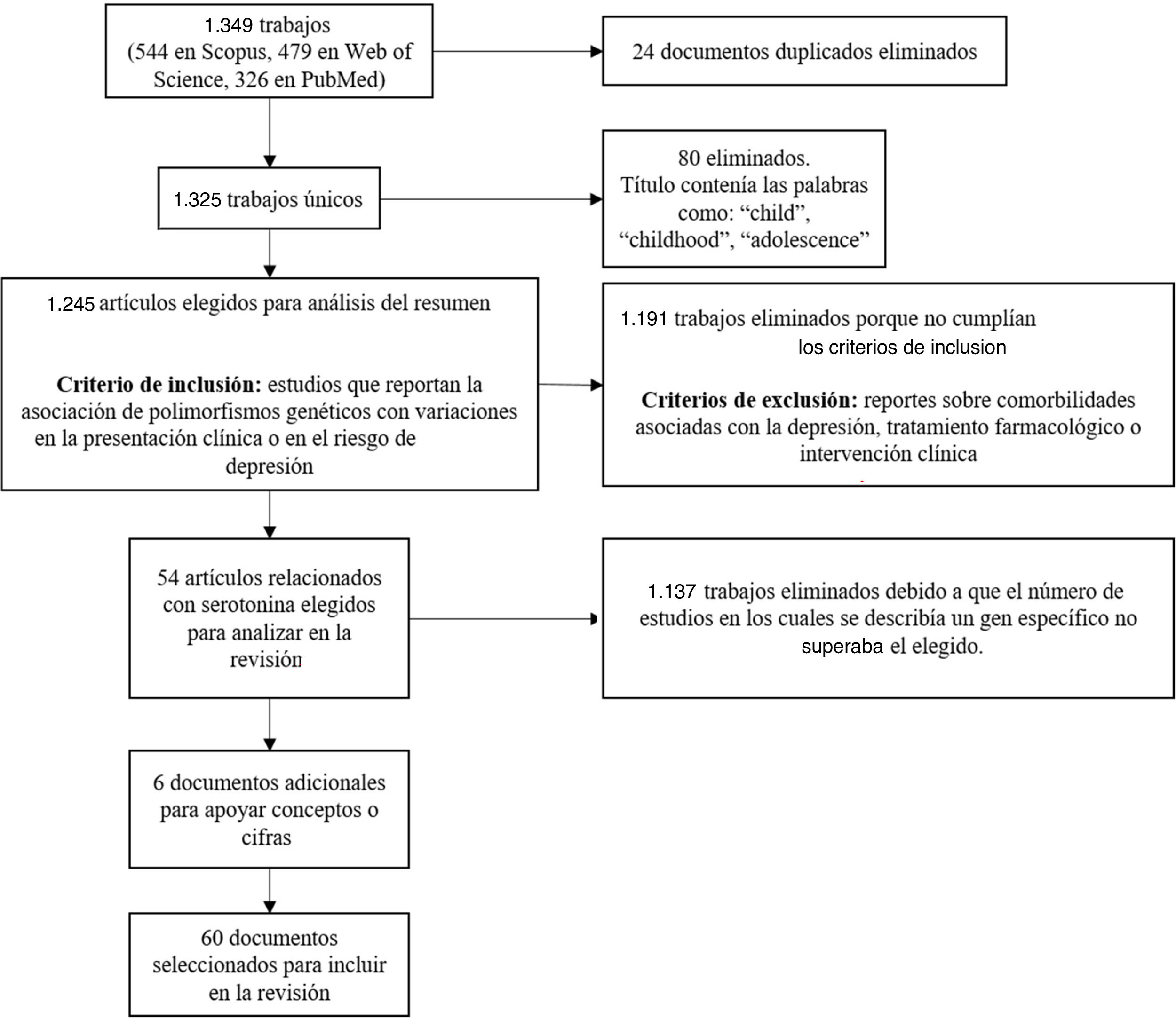
Se encontró un total de 1.349 artículos (544 en Scopus, 479 en Web of Science, 326 en PubMed); de estos, 24 estaban duplicados. Los documentos que en el título contenían palabras como “child”, “childhood” o “adolescence” se excluyeron porque la población de interés para esta revisión son los adultos. Luego de este filtro, se seleccionaron 1.245 trabajos para el análisis de los resúmenes con el fin de verificar el cumplimiento de los criterios de inclusión con escritos que reportaran la asociación de polimorfismos genéticos con variaciones en la presentación clínica o en el riesgo de sufrir depresión. Además, se descartaron los trabajos que reportaban comorbilidades con la depresión, tratamiento farmacológico o intervención clínica.
Tras aplicar los criterios de inclusión y exclusión, se seleccionaron los artículos con mayor cantidad de estudios asociados con genes, destacando los genes codificantes del transportador y de los receptores de serotonina (41 y 13 trabajos respectivamente) como candidatos para su inclusión en la presente revisión. De estos, se tuvieron en cuenta 54 artículos de investigación (fig. 2).
ResultadosEn la depresión influyen tanto un componente genético, que predispone al individuo a la enfermedad, como factores ambientales que afectan a su comportamiento16,17. La respuesta de un individuo a los eventos estresantes, incluso de poca intensidad, puede verse modulada por múltiples polimorfismos funcionales que afectan a varias vías neurobiológicas implicadas en la depresión, las cuales muestran efectos dependientes del estrés8,16.
Teniendo en cuenta la influencia genética en la predisposición a la depresión, los resultados de la información recopilada en esta revisión se presentan teniendo en cuenta los polimorfismos y las implicaciones de a) el gen transportador de serotonina (SLC6A4);b) los genes HTR1A y HTR1B de la familia 1 de los receptores de serotonina (5-HT1), y b) el gen HTR2A de la familia 2 de los receptores de serotonina (5-HT2).
Variaciones genotípicas asociadas con SLC6A4Gran parte de la investigación acerca del papel de la serotonina en la depresión se ha centrado en estudiar el polimorfismo del gen SLC6A4 ubicado en la región promotora 5-HTTLPR; sin embargo, los resultados de los estudios no concuerdan.
Una muestra de la discordancia de resultados son los trabajos de algunos investigadores que analizaron las variaciones polimórficas de la región promotora 5-HTTLPR. Por ejemplo, Gonda et al.13 no encontraron relación entre este polimorfismo y el riesgo de sufrir depresión en una muestra de población europea, mientras que Contreras et al.17 hallaron en una muestra de población americana que este polimorfismo genera un alto riesgo de depresión en expuestos a eventos estresantes.
Entre los polimorfismos de este gen, está caracterizado el rs25531, que se agrupa en formas «largas» (L) o «cortas» (S). El alelo largo consiste en una inserción de 44 pb y el alelo corto, en una deleción de igual tamaño. Los humanos pueden portar 3 genotipos posibles: una combinación de formas corta y larga (SL), corta y corta (SS) o larga y larga (LL). La presencia de estos 2 alelos ha sido objeto de estudio porque se ha encontrado que incide en el desarrollo de síntomas de depresión, dependientes de los acontecimientos estresantes que ha vivido la persona18. Sin embargo, Willeit et al.19 asociaron la presencia del alelo S con la depresión atípica y la presencia del alelo L con la depresión melancólica.
El genotipo de la región 5-HTTLPR está asociado con estilos de procesamiento de información negativos después de la exposición a eventos estresantes, lo que desencadena síntomas depresivos y sensibilidad al estrés20. Se ha evaluado en adultos si, en conjunto, el tipo de polimorfismo de la región 5-HTTLPR, los eventos traumáticos vividos en la niñez y las vivencias negativas recientes afectan a los posibles endofenotipos cognitivos de depresión (como la atención y la capacidad de reconocer emociones). Como resultado, se indicó que los alelos en 5-HTTLPR de baja expresión (o alelos S) pueden conferir un mayor riesgo de depresión, debido a que en las pruebas realizadas los portadores de estos alelos centran su atención en la información negativa21. Algunos autores han reportado que las personas que tienen el alelo corto presentan mayor riesgo de depresión, peor rendimiento cognitivo y aumento de la vulnerabilidad a sufrir deterioro cognitivo en la vejez respecto a las personas con alelo largo15,22. La frecuencia del genotipo SS es especialmente alta en sujetos con depresión aparecida antes de los 65 años23.
Además, Kendler et al.24 genotipificaron un grupo de gemelos varones y mujeres, y encontraron que los homocigotos de alelo corto (S) en el locus SLC6A4 son más sensibles a los efectos depresores de todos los eventos estresantes que aquellos con alelos largos (L). La influencia del genotipo SS se encontró fuertemente ligada a tener 2 o más familiares de primer grado con antecedentes de depresión25.
Es importante destacar que diferentes estudios indican que no es necesario un genotipo homocigoto de forma corta (SS), sino que basta con que haya un alelo S —aunque sea en heterocigosis (SL)— para que se genere un riesgo de depresión estadísticamente mayor14,17,26, además de que influye en la gravedad del trastorno27,28.
Otra de las variaciones comunicadas en los efectos del polimorfismo 5-HTTLPR en el estado emocional es el sexo de los pacientes. Rucci et al.29 indican, por ejemplo, que las mujeres con un trastorno unipolar y el genotipo SS pueden tener mayores niveles de depresión; resultado que también concuerda con el descrito por Song et al.30, pues encontraron mayor frecuencia de mujeres con diagnóstico de depresión y el alelo S.
Sumner et al.5 reportaron que las personas con alelo S homocigoto (SS) tienen una memoria autobiográfica de mejor desempeño que los portadores de alelos L (SL o LL); sin embargo, los autores también indican que el polimorfismo rs25531 no modifica la función del genotipo. Ello indicaría que esta variación no tiene efecto alguno en un posible diagnóstico de depresión y este resultado estaría en contraposición con los de los autores mencionados antes.
En relación con el aspecto anatómico del cerebro, se ha estudiado por resonancia magnética estructural la influencia del polimorfismo 5-HTTLPR en el grosor cortical de regiones involucradas en el procesamiento de emociones y el control cognitivo, así como en los volúmenes de diferentes estructuras en individuos con depresión, pero no se halló efecto alguno del genotipo de este polimorfismo en el grosor cortical de las regiones examinadas (región del giro cingular anterior y posterior, región fronto-lateral y parahipocampal). No obstante, se encontraron mayores volúmenes en el tálamo y el putamen izquierdo de los individuos homocigotos para el alelo L31.
En investigaciones mediante resonancia magnética de alta resolución, se encontró que los pacientes con el genotipo homocigoto largo (LL) tenían sustancia gris y sustancia blanca hipocampal significativamente más pequeña que los controles con el mismo genotipo32,33. Los autores indican que la disminución de los volúmenes del hipocampo en los pacientes con depresión mayor pero no en lo controles sanos podría relacionarse con el desarrollo del sistema nervioso central, la modulación de algunos efectos de la enfermedad, diferentes vulnerabilidades al estrés o diferentes respuestas al tratamiento antidepresivo. Si la mayor recaptación de serotonina de los sujetos con el genotipo LL modula el curso de la enfermedad, los volúmenes del hipocampo pueden verse afectados como resultado de la depresión o de procesos neurotóxicos relacionados con el estrés. El genotipo LL puede causar una vulnerabilidad distinta a la reacción de estrés. Una hipótesis postulada por otros autores es que el estrés y el aumento de glucocorticoides pueden contribuir a la pérdida de volumen del hipocampo a través de efectos glutamatérgico-tóxicos34. Además, el estrés disminuye la expresión del factor neurotrófico derivado del cerebro —que tiene efectos tróficos en las neuronas serotoninérgicas— en el hipocampo35.
Por su parte, Taylor et al.36 analizaron las diferencias en los efectos morfológicos que tiene sufrir episodios de depresión en las diferentes etapas de la vida (depresión de inicio temprano e inicio tardío). Los autores encontraron relación entre el diagnóstico de la afección y el genotipo homocigoto LL, específicamente en el hipocampo derecho, que es más pequeño en sujetos con depresión tardía que en quienes la sufrieron tempranamente.
Además de los estudios realizados con resonancia magnética, Cole et al.37 compararon a personas sanas y pacientes con depresión, y encontraron que el volumen del hipocampo no mostraba diferencias significativas entre los portadores de alelos S y los homocigotos LL. Sin embargo, en cerebros post mórtem se ha encontrado que los portadores de alelos cortos tienen un volumen significativamente reducido de la corteza cingulada anterior perigenual (pACC) y de la amígdala38. Estos resultados están relacionados con la conectividad funcional que existe entre estas 2 estructuras y podría predecir la variación en las medidas de los rasgos temperamentales relacionados con la ansiedad y la depresión.
Costafreda et al.39 analizaron los efectos de 5-HTTLPR en la conectividad entre las diferentes estructuras cerebrales. En su estudio encontraron que el genotipo con alelo corto en este polimorfismo se asocia con un aumento en la actividad de la amígdala y con un sesgo en la conectividad frontal-límbica. Se ha descrito que este polimorfismo modula la perfusión en estado de reposo en estructuras clave del procesamiento del estado de ánimo40.
Por otra parte, Mann et al.41 reportaron que las variaciones en SLC6A4 afectan directamente a la corteza prefrontal ventral, lo cual se puede reflejar en un deterioro generalizado de la función serotoninérgica implicado en el grado de captación de la serotonina, significativamente menor que el de los pacientes con depresión y los controles sanos42.
Schneider et al.43 discuten que la región promotora de SLC6A4 polimórfica —especialmente su polimorfismo de nucleótido simple rs25531— es factor de riesgo de depresión, teniendo en cuenta que, en su estudio, los portadores de alelos de riesgo (genotipo SS) mostraron una activación significativamente mayor de la amígdala bilateral cuando se mostraban imágenes con contenido emocional negativo. Esta relación del alelo S con la depresión también fue descrita por quienes encontraron mayor prevalencia de este alelo en pacientes hospitalizados con episodios depresivos44.
Además de los métodos con resonancia magnética, los cambios en la conectividad se han estudiado mediante los potenciales evocados auditivos. Por ejemplo, Cheng et al.45 evaluaron la respuesta a la onda P200 generada en la corteza primaria auditiva —la cual se caracteriza por una alta tasa de síntesis de serotonina— en personas con el alelo L en comparación con los homocigotos para el alelo S. En este último grupo hallaron una onda más corta que en los demás participantes, lo que según los autores señalaría una relación entre esta onda y el genotipo SS. Esto se debe a que la depresión puede alterar los procesos de respuesta a diferentes estímulos externos, y el genotipo descrito en el artículo está muy relacionado con la gravedad de la afección.
Otras regiones polimórficas que se han estudiado son los polimorfismos de repeticiones en tándem de número variable (variable number tandem repetition [VNTR]) en el intrón 2 del gen SLC6A4. Se denominan STin 2. Estas variaciones contienen un número variable de repeticiones en tándem de 17 pb, lo cual genera 3 alelos de VNTR: STin2.9, STin2.10 y STin 2.12, que contienen 9, 10 y 12 copias del elemento respectivamente. STin2.10 y STin 2.12 se han asociado con alteraciones neurológicas como trastornos del afecto6; sin embargo, Ogilvie et al.46 encontraron una diferencia significativa entre el grupo de control y el de depresión que se explica, en gran medida, por el exceso del alelo STin2.9 en el grupo de pacientes.
No obstante, pese a encontrarse gran respaldo de la relación entre la región polimórfica 5-HTTLPR y la depresión, hay un grupo de autores que, como resultado de sus investigaciones, no han encontrado relación entre estos 2 factores, lo que no respalda la hipótesis de que las variantes en dicha región contribuyan significativamente a la emocionalidad humana47. Entre ellos se encuentran Bachai et al.48, quienes estudiaron los posibles efectos de la privación parcial de sueño en pacientes con depresión y polimorfismos en SLC6A4. Sin embargo, este efecto fue solo transitorio y la mayoría de los pacientes sufrieron un aumento de los síntomas depresivos 2 días después de la intervención. Por otra parte, otros estudios que evaluaron el genotipo con presencia de alelo corto en un grupo de familias constituidas por padres, hijos gemelos y sus hermanos no encontraron asociación directa entre 5-HTTLPR y depresión49,50, aunque podría tener relación con signos clínicos específicos de la enfermedad51.
Además de la relación entre los polimorfismos del gen SLC6A4 y la depresión, se han abordado otros temas como las concentraciones de cortisol y colesterol relacionadas con el mismo trastorno, debido a que, para afrontar el estrés vivido por sucesos traumáticos, el organismo necesita generar respuestas adaptativas y eficaces. El resultado final más estudiado de este proceso es la variación en la concentración de cortisol, cuyos valores aumentados se asocian con la depresión. Por ello, las interacciones entre la respuesta del cortisol y el sistema serotoninérgico pueden afectar al volumen del hipocampo de, específicamente, los pacientes con depresión y genotipo homocigoto LL33.
Otras investigaciones también han apuntado a estudiar la relación entre la variación alélica de SLC6A4 y otros factores de riesgo; por ejemplo, la concentración de colesterol unido a lipoproteínas de alta densidad (cHDL). Los resultados obtenidos reportan que cifras bajas de este tipo de colesterol pueden ser un factor de riesgo de sufrir depresión en la vejez, pero la presencia del genotipo con el alelo S induce una mayor predisposición10. Las hipótesis biológicas que explican la relación entre la concentración de colesterol y la depresión sostienen que los hábitos de vida poco saludables pueden generar acumulación de tejido adiposo blanco, lo que aumenta la producción de citocinas y sustancias inflamatorias; esta respuesta inflamatoria puede, a su vez, ocasionar una hiperactivación del eje hipotálamo-hipófiso-adrenal (HPA), lo que estimula la liberación de lípidos en el torrente sanguíneo, resulta en una reducción de cHDL y tiene relación con el desarrollo de depresión52.
Polimorfismos estudiados en los genes de la familia HTR1 (HTR1A y HTR1B)El polimorfismo rs6295 del gen del receptor de serotonina 1A (HTR1A) se ha estudiado en profundidad porque puede tener efectos funcionales en la expresión génica. Dicho polimorfismo es una variación común en el sitio 1019 aguas arriba del área del promotor basal; por lo tanto, también se lo conoce53 como polimorfismo C(-1019)G.
La variante G del polimorfismo C(-1019)G se ha asociado con una alta expresión de los receptores 5-HT1A, la cual puede generar mayor riesgo de depresión y respuesta clínica deficitaria9, especialmente cuando el individuo se ha sometido a hechos estresantes durante la vida12. Los resultados de los estudios son discordantes, pero hay trabajos recientes que respaldan una asociación entre rs6295 y los trastornos del estado de ánimo como trastorno depresivo mayor y trastorno bipolar13.
Otro polimorfismo estudiado en esta familia es G861C, encontrado en el gen del receptor 1B de la serotonina (HTR1B). Este se ha relacionado con la inhibición del proceso de liberación de serotonina generado en los ganglios basales, principalmente porque estos receptores activan segundos mensajeros que inhiben la actividad de la adenilato ciclasa y gestionan la liberación del neurotransmisor. Huang et al.54 encontraron gran correlación entre este polimorfismo y el abuso de sustancias (cocaína) en pacientes diagnosticados de depresión mayor. Los autores manifiestan no conocer cómo la genética puede afectar al abuso de sustancias.
Las neuronas serotoninérgicas se proyectan a la mayoría de las partes del cerebro, y muestran heterorreceptores postsinápticos activos en la corteza, las regiones límbicas, el hipotálamo y la médula espinal. De este modo, el aumento en la recaptación de la serotonina por los transportadores presinápticos podría disminuir la disponibilidad de este neurotransmisor en el área extracelular, por lo que se afectaría la captación postsináptica y su posterior distribución a diferentes estructuras, lo que favorece la depresión1.
Variantes de HTR2A publicadasDe los polimorfismos asociados con el gen del receptor de serotonina 2A (HTR2A), 2 son los más estudiados: el polimorfismo de nucleótido sinónimo c.102C>T (rs6313) y el polimorfismo no sinónimo c.1354, p.His452Tyr (rs6313); según Minov et al.55 no se encontró relación diferencial con la depresión en un estudio que comparó a adultos con esta afección y controles sanos. El polimorfismo de nucleótido simple -1438A/G (rs6311), ubicado en la región promotora de HTR2A y estudiado en población del noreste de Tailandia, no se encontró asociado con riesgo de depresión56. Sin embargo, se recalca el papel fundamental que pueden desempeñar otras variaciones en este gen, como T102C(rs6313), en la etiología de la depresión.
Por otro lado, los resultados de Cao et al.57 y Gonda et al.13 señalan que el polimorfismo rs6311 parece ser un factor de susceptibilidad importante en la etiología de la depresión, debido a que puede afectar a la activación de otros genes implicados en la enfermedad.
DiscusiónAunque muchos de los autores incluidos en esta revisión coinciden en que la variación que más riesgo de depresión genera es la presencia del alelo corto en 5-HTTLPR, las diferencias reportadas en los resultados pueden deberse a factores metodológicos de los estudios, ya que todas las poblaciones provienen de ancestros de diferente origen, con frecuencias alélicas que pueden variar, lo que genera diferenciación en el desarrollo del trastorno de la depresión58.
Cuando se comparan los alelos S y L, el primero se asocia con menores recaptación de serotonina y eficiencia transcripcional del transportador de este neurotransmisor59, que desempeña un papel importante en la depresión.
La interacción entre gen y ambiente en la depresión es importante, ya que el alelo S en la región polimórfica 5-HTTLPR genera una predisposición a la depresión con mayor gravedad que el alelo L, pero probablemente no se desarrolle un cuadro depresivo a menos que el factor ambiental desencadenante, como vivir acontecimientos estresantes, también se produzca.
Los resultados con técnicas de imagen como la resonancia magnética difieren de aquellos que han estudiado únicamente el componente genético, ya que el análisis de imagen ha permitido encontrar cambios morfológicos importantes relacionados con el genotipo LL. Estas variaciones son la disminución en el volumen de diferentes estructuras como el hipocampo32,33,36, mientras que se encontraron mayores volúmenes de tálamo y putamen31 respecto a controles sanos. Estas técnicas también han permitido estudiar la conectividad cerebral; se ha hallado mayor activación de la amígdala bilateral ante estímulos visuales negativos en pacientes con alelo SS.
Los resultados han permitido reconocer que el tálamo desempeña un papel importante en la regulación de la expresión y la experiencia de la emoción. Además, se ha implicado en la fisiopatología del trastorno depresivo mayor.
En relación con la familia de genes HTR1, los estudios diferencian a grandes rasgos la función de los 2 tipos de receptores estudiados. 5-HT1A se relaciona con el riesgo de sufrir trastornos del estado de ánimo9,10,13, mientras que 5-HT1B se ha asociado con el abuso de sustancias en pacientes con depresión54. Este último resultado permite relacionar el sistema serotoninérgico con las adicciones, cuando comúnmente este comportamiento, visto desde la psicología, se relaciona con la vía dopaminérgica, tanto en el reforzamiento positivo como en el negativo60. Por ello, se propone evaluar el papel de la vía serotoninérgica en las adicciones; los resultados permiten cerrar la brecha hasta ahora relacionada con este tema y la tan importante influencia tanto de las adicciones como de la serotonina en la depresión.
Sobre HTR2A, al igual que otros estudiados en esta revisión, se reportan resultados discordantes; sin embargo, una interpretación alternativa de los resultados puede ser que la modulación del receptor 5-HT2A no sea el mecanismo etiológico primario en los trastornos de depresión, sino consecuencia del proceso de la enfermedad, y puede depender de la participación de otros genes.
Una explicación para la divergencia en los resultados de los diferentes estudios sobre los polimorfismos de los genes mencionados en esta revisión es la heterogeneidad fenotípica de los pacientes incluidos, dado que el diagnóstico se basa en los síntomas de cada persona, por lo que no necesariamente se garantiza una muestra homogénea en su etiología. Por ello podrían tener importancia los mapas de conectividad y las imágenes médicas como un biomarcador diagnóstico de la depresión, ya que estos pueden generar una relación entre la morfología y la funcionalidad de las diferentes estructuras involucradas en el desarrollo del trastorno.
Teniendo en cuenta que la depresión tiene origen multifactorial y poligénico, la heterogeneidad de los resultados, según algunos autores, puede atribuirse a que la mayoría de los estudios genéticos no tienen en cuenta factores ambientales como el efecto de los estresores. Además, han encontrado que otros genes como GALR2 (receptor de galanina tipo 2), BDNF (factor neurotrófico derivado del cerebro) y P2RX7 (receptor purinérgico P2X7) se han mostrado relevantes en la depresión en grupos expuestos a grados de estrés alto y moderado13, debido a que la respuesta del organismo al estrés puede estar mediada por diferentes vías y mecanismos. Por lo anterior, resulta relevante ampliar los estudios que relacionen estos genes con los estudiados en esta revisión, puesto que es importante aumentar la evidencia de la influencia de estos en el desarrollo de la depresión.
Para futuros trabajos, resulta importante utilizar diferentes tecnologías que permitan relacionar de manera integral las características morfológicas o funcionales con las genotípicas y conductuales. Con ello podría disminuir la brecha entre los diferentes resultados encontrados, además de postularse las diferentes técnicas de análisis de imagen o conectividad como ayudas diagnósticas de índole cuantitativa.
ConclusionesLa variación polimórfica en el gen SLC6A4 modera la sensibilidad de los individuos a los efectos depresivos de los eventos estresantes en gran medida, pues producen en individuos con genotipo homocigoto SS una mayor sensibilidad al impacto de los acontecimientos vividos.
Los procesos específicos de enfermedad relacionados con el sistema serotoninérgico pueden aumentar la susceptibilidad a las alteraciones morfológicas de regiones del cerebro. Por una parte, el alelo corto (S) se relaciona con una disminución en el volumen de estructuras como la amígdala y la corteza cingulada anterior perigenual y, por otra, la presencia del alelo largo (L) involucra la disminución del volumen del hipotálamo y el aumento del volumen de las estructuras como el tálamo y el putamen. La presencia del alelo corto en la región 5-HTTLPR es un contribuyente potencial al riesgo de sufrir cuadros de depresión más graves.
Conflicto de interesesLos autores del presente trabajo declaramos no tener conflictos de intereses.
Agradecemos al Ministerio de Ciencia, Tecnología e Innovación por el apoyo para el desarrollo de este trabajo durante la convocatoria 736 del 2018 para Jóvenes Investigadores en salud. El proyecto que da origen al presente trabajo recibe el apoyo de la Universidad Autónoma de Manizales (cód: 736-2018).