La reestenosis intrastent es la reacumulación de material tisular dentro del lumen de un vaso coronario en el sitio receptor de intervencionismo previo con balón o stent, como consecuencia a una respuesta normal de cicatrización que tiene la pared vascular ante la existencia de daño mecánico. Es el resultado de dos procesos histopatológicos: la hiperplasia neointimal, dada por la migración y proliferación del músculo liso y el depósito de matriz extracelular, y la remodelación vascular. Se manifiesta clínicamente con síntomas de isquemia y hallazgos angiográficos que evidencian reducción de al menos 50% de la luz del vaso previamente tratado con stent. Para el manejo se recomienda la utilización de stent medicados de segunda generación o balones impregnados de medicamento según el tipo de reestenosis a tratar. No se alienta a la utilización de stent o de balón convencionales como única medida para manejo de la reestenosis intrastent.
Intrastent restenosis is the reaccumulation of tissue within the lumen of a coronary vessel at the site of prior interventionism with a balloon or stent, as a result of the normal healing response of the vascular wall to mechanical damage. It is the result of two histopathological processes: neointimal hyperplasia due to smooth muscle migration and proliferation and extracellular matrix deposition; and vascular remodeling. It manifests clinically with symptoms of ischemia and angiographic findings showing at least a 50% reduction in the lumen of a vessel previously treated with a stent. Second generation medicated stents or drug eluting balloons are recommended for treatment, depending on the type of restenosis being treated. The use of conventional stents or balloons is not recommended as the sole treatment of intrastent restenosis.
Desarrollar un consenso de aproximación diagnóstica y terapéutica sobre la reestenosis intrastent coronario en adultos con el fin de unificar criterios diagnósticos y manejo en los servicios de Cardiología intervencionista de Colombia, con miras a cumplir metas de calidad y reunir lo recomendado por la literatura actual.
AlcanceLos servicios de Hemodinamia y Cardiología intervencionista son parte de las instituciones de salud públicas y privadas con alto nivel de complejidad. En estos se realizan procedimientos diagnósticos invasivos en sujetos sintomáticos de enfermedad coronaria, y se ofrece el respectivo manejo intervencionista como parte integral del tratamiento de la enfermedad coronaria. Por consiguiente, se requiere que los procedimientos estén estandarizados con el fin de aplicarlos con parámetros de calidad en Colombia.
Definiciones- •
Reestenosis: reducción en el diámetro y el área luminal.
- •
Reestenosis intrastent: reacumulación de material tisular dentro del lumen en el sitio de intervencionismo previo.
- •
Restenosis binaria: estrechamiento del 50% o más en la luz de un stent detectado en una angiografía de control.
- •
Restenosis clínica: combinación de reestenosis binaria con síntomas isquémicos o reestenosis del 70% o más de la luz, sin síntomas de isquemia.
Profesionales de Salud Médicos, con formación en Hemodinamia y Cardiología intervencionista debidamente certificados para ejecutar su ejercicio en el territorio colombiano.
DesarrolloPoblación objetoPacientes con edad igual o mayor a 18 años con enfermedad coronaria conocida, que hayan sido receptores de stent coronario y remitidos desde la consulta ambulatoria, de los servicios de urgencias, hospitalización o consulta externa con signos y síntomas sugestivos de isquemia coronaria y sean sometidos a angiografía coronaria documentándose reestenosis intrastent de acuerdo con lo definido en este documento.
MetodologíaSe realizó una revisión bibliográfica teniendo en cuenta las guías presentadas por European Heart Society – European APCI, American Heart Association, American College of Cardiology, Society SCAI, Sociedad Latinoamericana de Cardiología Intervencionista, base de datos como Medline, Pubmed, Cocrane y portales como TCTmd y PCR online, de donde se toman elementos para adaptarlos al entorno colombiano.
IntroducciónLa reestenosis tiene varias definiciones desde el punto de vista histológico, clínico y angiográfico.
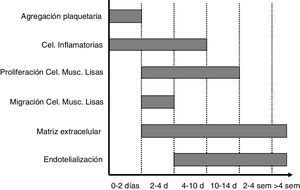
Desde el histológico, se define como la reacumulación de material tisular dentro del lumen de un vaso coronario en el sitio receptor de intervencionismo previo con balón o stent1, como consecuencia de la respuesta normal de cicatrización que tiene la pared vascular ante la existencia de daño mecánico; los procesos que llevan a esto son dos: hiperplasia neointimal y remodelamiento vascular. La primera es un proceso que se desarrolla durante varias semanas (fig. 1) y está dado por la migración y proliferación del músculo liso y el depósito de matriz extracelular2,3. El mecanismo de la reestenosis varía desde la angioplastia con balón donde el fenómeno es complejo y se caracteriza por engrosamiento neointimal, retroceso elástico y remodelamiento negativo, mientras que en la angioplastia con implantación de stent el fenómeno es más simple, solo con hiperplasia neointimal4.
Desde el punto de vista clínico, se refiere a la aparición de síntomas de isquemia asociada a reestenosis intrastent. En las diferentes publicaciones se presenta como TLR: revascularización de la lesión culpable, o TVR: revascularización del vaso culpable5.
Desde el angiográfico, se evalúa de forma dicotómica definiéndose si están presentes o no cuando la oclusión de la luz es igual o mayor al 50%, otros parámetros cuando se comparan dos estudios angiográficos realizados en diferente tiempo. Se denomina “late lumen loss” o pérdida tardía del lumen cuando se aprecia disminución de la luz ganada con la implantación del stent6.
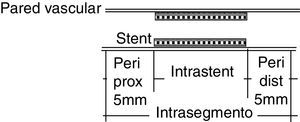
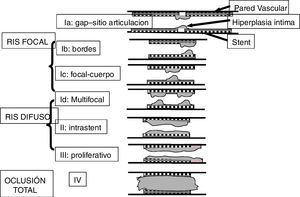
LocalizaciónLa reestenosis se puede presentar en diferentes lugares dentro del stent o en la zona adyacente al mismo. De acuerdo con la localización (fig. 2), se puede denominar:
- •
Intrastent: cuando está circunscrita dentro de los márgenes del stent.
- •
Peristent: compromete los cinco milímetros proximales o distales al borde del stent.
- •
Intrasegmento: afecta dentro del stent y los cinco milímetros proximales o distales al borde.
En la angiografía se puede clasificar con las siguientes características: focal, que puede estar presente entre el 20 a 40% de los casos, difusa en 40 a 50% y oclusiva total entre 6 a 8% (fig. 3)7.
Estos patrones se correlacionan con el aumento en la probabilidad de revascularización del vaso intervenido con stent metálico como en los casos de oclusión total o proliferativo. Situación similar se encuentra en los stent medicados, donde los patrones difusos se asocian a mayor riesgo de revascularización del vaso intervenido8.
Factores de riesgoLos factores que pueden llevar a la existencia de reestenosis se pueden clasificar en tres grupos: clínica, vaso o lesión y los inherentes al procedimiento9.
Los factores clínicos son: diabetes, angina inestable, falla renal crónica, género femenino, alergia al níquel, polimorfismo al gen de la enzima convertidora de angiotensina y a la glicoproteína IIb/IIIa y los genotipos mutantes del gen de la metilenetetrahidrofolato reductasa.
- •
En referencia al vaso o lesión: longitud de la lesión, localización proximal en la arteria descendente anterior, lesiones en puentes coronarios, tamaño de referencia del vaso y extensión de la placa.
- •
Inherente al procedimiento: diseño del stent en referencia al grosor del strut, longitud, área luminal obtenida posterior a la angioplastia y presión de implantación.
En un estudio realizado en 10.000 sujetos seguidos mediante angiografía10, se detectó reestenosis en 26% de la población. Los factores de riesgo asociados de forma independiente y detectados en el análisis multivariado fueron: tamaño pequeño del vaso (OR 1,59 por cada 0,5mm de disminución), longitud total del stent (OR 1,27), lesión de morfología compleja (OR 1,35), diabetes mellitus (OR 1,32), e historia de cirugía de revascularización miocárdica (OR 1,38).
TratamientoPara definir si se debe realizar intervencionismo sobre un vaso con reestenosis intrastent se evalúan los criterios planteados en la tabla 1.
Criterios para definir necesidad de nuevo intervencionismo en reestenosis intrastent
| Isquemia documentada |
| Estenosis>50% y uno de los siguientes: |
| Historia de angina recurrente, presumiblemente relacionada con el vaso objetivo. |
| Signos objetivos de isquemia en reposo (cambios ECG) o en test ejercicio, presumiblemente relacionada con el vaso objetivo. |
| Resultado anormal en prueba funcional invasiva |
| Flujo fraccional de reserva (FFR) igual o menor a 0,80. |
| Ultrasonido intravascular (IVUS) área mínima 4mm2 (6,0mm2 tronco). |
| Revascularización lesión blanco con estenosis 70% en ausencia de signos y síntomas isquémicos. |
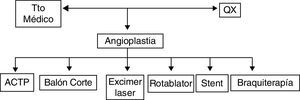
De acuerdo con el compromiso el espectro de manejo puede variar desde el tratamiento médico hasta en algunos casos quirúrgico. La angioplastia coronaria en los últimos años ha tenido una evolución acelerada donde diferentes técnicas como angioplastia con balón, angioplastia con balón de corte, aterectomía rotacional, braquiterapia, angioplastia con balón medicado e implantación de stent medicado intrastent han sido utilizadas como estrategias de manejo (fig. 4).
La angioplastia con balón tiene una tasa de éxito baja, ha tenido utilidad en lesiones fibroproliferativas no ateroscleróticas con alta tasa de reintrusión tisular. Tiene como efecto indeseable el llevar a sobreexpansión del stent. Tiene una tasa de nueva de reestenosis que varía entre 22 y 54%.
La angioplastia con balón de corte (cutting balloon), busca facilitar la dilatación a través del corte de la placa. El estudio RESCUT comparó la estrategia de angioplastia con balón versus angioplastia de corte. Al evaluar la tasa de reestenosis al séptimo mes no hubo diferencias, siendo el grupo de corte del 29,8% y balón 31,4%; igual observación se encontró en las variables clínicas11.
La ateroablación ya sea con aterótomo direccional, rotacional o con excimer láser no ha mostrado diferencias cuando se compara contra angioplastia con balón12.
La braquiterapia intracoronaria, que utiliza radiación localizada con iridio 192 (192Ir), demostró una reducción de la respuesta neointimal al inhibir la mitosis de las células musculares lisas. Como inconvenientes se reportó que a dosis baja el procedimiento era ineficaz y estimulante del crecimiento neointimal, mientras que a dosis altas generaba adelgazamiento de pared y formación de aneurismas; además de complicaciones como trombosis coronaria tardía (> 30 días) y estenosis de bordes. La indicación de esta terapia es para casos de reestenosis en stent convencional. Aunque la probabilidad de reestenosis con braquiterapia era baja respecto a la angioplastia con balón, al compararse con los stent medicados de primera generación la diferencia es estadisticamente menor en estos últimos 13.
La estrategia de implantación de stent comparado con solo angioplastia balón ha mejorado el resultado angiográfico y clínico a largo plazo, al igual que la tasa de reestenosis de 32% en angioplastia balón a 18-22% con stent metálico14; no obstante, el empleo de stent metálico convencional sin medicamento no tiene utilidad en el manejo de la reestenosis intrastent.
Cuando la reestenosis de un stent metálico es tratada con angioplastia balón, tiene una probabilidad a seis meses de nueva reestenosis hasta de un 50%; sin embargo, al utilizarse stent liberador de medicamentos de primera generación la probabilidad disminuye de forma significativa por debajo del 20%15; igual tendencia se observa con la necesidad de revascularización del vaso intervenido.
La tasa de reestenosis ha disminuido con el uso de los stent liberadores de medicamento, los cuales tienen por principio el uso de una sustancia citostática que demorará el proceso de cicatrización en los primeros tres meses16.
A pesar de los datos iniciales con los stent de primera generación liberadores de sirolimus de presentar tasas de reestenosis cercanas a cero, en estudios como el ISAR-DESIRE se encontró que podían ser del 14% para stent con sirolimus y del 22% para paclitaxel comparado con 45% en angioplastia con balón13. De igual forma, el estudio ISAR-DIABETES, documentó tasas de reestenosis del 16,5% para stent con paclitaxel y de forma estadísticamente significativamente menor en los stent de sirolimus con un 6,9%17.
En la tabla 2 se comparan varios aspectos entre el stent metálico y el medicado18.
Caracterización de la reestenosis según tipo de stent
| Stent metálico | Stent medicado | |
|---|---|---|
| Celularidad músculo liso | Alto | Bajo |
| Contenido proteoglicano | Moderado | Alto |
| Morfología | Difusa | Focal |
| Evolución | Pico 6 meses | Inicio tardío |
| Tiempo pérdida luminal tardía | Pérdida máxima 6-8 meses | Persiste hasta 5 años |
| Neoaterosclerosis | Infrecuente, tardío | Frecuente, temprano |
| Apariencia OCT | Homogéneo | Heterogéneo/capas |
Por su parte, el ISAR-DESIRE 2, comparó la tasa de reestenosis entre los stent de primera generación, siendo del 19% en sirolimus y 20,6 en paclitaxel, sin diferencias significativas 19.
Las fallas mecánicas o técnicas son factores que pueden llevar a reestenosis de un stent20,21. Las mecánicas se atribuyen a daño del polímero, falla del medicamento, posible resistencia, impactación inadecuada, fractura de strut o prolapso de placa, mientras que las técnicas se deben a barotrauma fuera del segmento cubierto por el stent o cubrimiento inadecuado de placas ateroscleróticas.
En el estudio SORT-OUT10 se determinaron como predictores de baja reestenosis el stent medicado de primera generación versus el stent convencional (OR 0,35) y los stent medicados de segunda generación versus los de primera (OR 0,67).
Como alternativa para el manejo de la reestenosis en stent convencionales y en medicados, los balones impregnados con paclitaxel han surgido como una alternativa de manejo, dado que son superiores al balón convencional, adicional a que liberan inmediatamente el medicamento sin mediar polímeros que puedan generar irritación y respuesta inflamatoria. Su efectividad en stent convencionales y medicados ha sido evaluada en varios estudios22–24. El balón medicado mostró mejores desenlaces clínicos y angiográficos versus el stent medicado con paclitaxel22.
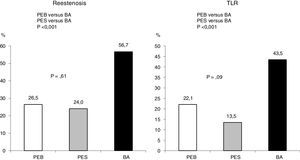
Para evaluar el mejor tipo de estrategia para manejar la reestenosis en un stent medicado con sustancia tipo limus, el estudio ISAR DESIRE 323, aleatorizó 402 pacientes a las siguientes estrategias: balón medicado con paclitaxel, stent medicado con paclitaxel y angioplastia con balón convencional. El seguimiento clínico y angiográfico en el primer año mostró, de manera significativa, que las menores tasas de reestenosis y revascularización del vaso intervenido se dieron con stent medicado con paclitaxel y con el balón medicado, sin diferencias entre estas dos estrategias (fig. 5).
PEB: balón medicado con paclitaxel, PES: stent medicado con paclitaxel, BA: balón convencional.
En otro estudio donde se usó balón medicado con paclitaxel, la tasa de reestenosis tardía a 18 meses fue estadísticamente mayor cuando se trataron stent medicados reestenosados (versus stent convencionales (16,8% vs. 2,5%, p<0,001)24 (fig. 6)
En el estudio RIBS IV se plantearon otras estrategias para el manejo de la reestenosis intrastent de stent medicado25. Se aleatorizó balón medicado con paclitaxel versus angioplastia con implantación de stent medicado de última generación liberador de everolimus. El desenlace compuesto de muerte cardíaca, infarto de miocardio y revascularización de vaso intervenido ocurrió en 16% del grupo de balón versus 7% en el grupo stent con everolimus, con diferencia estadísticamente significativa. En comparación, otro estudio26 demostró mejores desenlaces con el balón medicado que con el stent con everolimus.
Ante la presencia de una variedad de estudios para el manejo de reestenosis intrastent, los cuales cuentan con diferentes tamaños de muestra y nivel de poder, se han realizado diferentes metaanálisis que muestran disparidad en sus conclusiones en cuanto a cual estrategia prevalece entre el uso de balón medicado versus el stent medicado.
El uso de balones medicados y stent medicados ha mostrado superioridad ante la angioplastia con balón convencional e implantación de stent convencional, sin diferencias entre uno y otro27,28.
En contraste, un reciente metaanálisis de 27 estudios registra mejores desenlaces clínicos y angiográficos cuando se utiliza un stent medicado liberador de everolimus, siendo en 9% mejor al compararse con balón medicado; 9,4% al comparase con stent con sirolimus, 10,2% contra stent paclitaxel, 19,2% versus braquiterapia, 23,4% mejor que stent convencional, 24,2% contra angioplastia balón y 31,8% versus rotablación; los balones medicados demostraron ser la segunda terapia más efectiva, sin diferencias significativas al compararlos contra los stent liberadores de sirolimus o paclitaxel29.
Otro metaanálisis de 11 estudios demostró que el balón medicado al igual que el stent medicado, son superiores al balón convencional en cuanto a disminución de la revascularización del vaso intervenido, pero el balón medicado tuvo una tendencia a menor presencia de infartos30.
El uso de plataformas bioabsorbibles para el tratamiento de la reestenosis ha comenzado a mostrar su evidencia. En un estudio observacional demostró que puede llegar a ser una alternativa a tener en cuenta, no obstante la evidencia aun es mínima31.
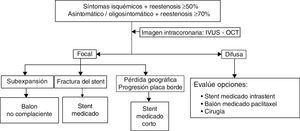
Para establecer con claridad la causa o el mecanismo que generó las reestenosis, y así definir la estrategia terapéutica, se debe realizar adicional a la angiografía coronaria, estudio de imagen intravascular coronaria con ultrasonido intravascular (IVUS) o tomografía de coherencia óptica (OCT) (tabla 3)32.
Utilidad de la imagen intracoronaria como estrategia para dirigir el tratamiento
| Tipo reestenosis | Mecanismo potencial | Opciones de tratamiento |
|---|---|---|
| Focal | Subexpansión | Angioplastia balón no complaciente |
| Fractura | Stent medicado | |
| Focal al borde del stent | Pérdida geográfica | Stent medicado |
| Progresión de placa | Stent medicado | |
| Difusa intrastent o proliferativa | Biología vascular / resistencia medicamento | Otro tipo de stent medicado / balón medicado / cirugía |
Como plan de manejo de la reestenosis intrastent de stent convencionales y stent medicados:
- •
Se recomienda la utilización intrastent de stent medicados de última generación o el uso de balones impregnados de medicamento.
- •
No se recomienda la utilización de balones o stent convencional (no medicados) como única medida de tratamiento para la reestenosis intrastent.
- •
De acuerdo con el criterio médico del cardiólogo intervencionista se considerará el ultrasonido intravascular (IVUS) o la tomografía de coherencia óptica (OCT) para evaluar el mecanismo causante de la reestenosis intrastent o como procedimiento para guiar intervenciones cardiovasculares adicionales.
Ninguno.
A la doctora Mónica Hernández, médica internista cardióloga por su apoyo en la revisión del documento.