La estrategia del control del ritmo o el mantenimiento del ritmo sinusal, basado en la fisiología y el compromiso fisiopatológico de la fibrilación auricular, es una prioridad en varios escenarios en el abanico de presentación de la enfermedad. Las guías generan recomendaciones con base en la evidencia en un amplio rango de áreas en relación con la fibrilación auricular. Tan solo 30 segundos de duración de la arritmia son suficientes para considerarla como factor de morbimortalidad1, de donde se deprenden indicaciones en el control de la coagulación así como del ritmo y de la frecuencia cardiaca. Varias herramientas se han puesto a la mano para restaurar, prevenir y mantener en ritmo sinusal; estas son la cardioversión farmacológica con antiarrítmicos, la cardioversión eléctrica y la ablación con catéter de radiofrecuencia.
En la literatura médica, numerosos estudios y ensayos clínicos han tratado de demostrar la superioridad del control del ritmo versus el control de la frecuencia, sin encontrar una diferencia clara en los desenlaces de impacto, principalmente en mortalidad. El control del ritmo conlleva mayor número de hospitalizaciones; sin embargo mejora de manera ostensible la calidad de vida de los pacientes al llevar a la remisión de los síntomas. A medida que más síntomas se manifiestan y más se compromete la calidad de vida, mayor indicación toma el control del ritmo. Otros factores que intervienen en la decisión del mantenimiento del ritmo sinusal son la edad menor de 65 años, el inicio reciente (< 7 días), la dificultad para controlar la frecuencia cardiaca, la sospecha o certeza de taquicardiomiopatía por remodelamiento, la fibrilación auricular debida a enfermedad aguda y el primer episodio de fibrilación auricular del paciente.
Este capítulo se concentrará en los medicamentos que por sus propiedades farmacológicas son capaces de lograr el objetivo de controlar el ritmo, su eficacia y sus posibles complicaciones2.
Gran cantidad de estudios comparan la efectividad de las estrategias en fibrilación auricular en diversos escenarios. En cuanto a controlar el ritmo versus la frecuencia, la eficacia es similar en pacientes mayores con síntomas leves. El aislamiento de venas pulmonares resulta ser la mejor conducta al compararse con los antiarrítmicos para disminuir las recurrencias de la enfermedad, especialmente en pacientes jóvenes con estructuralidad cardiaca leve y fibrilación auricular paroxística.
El control del ritmo tiene como objetivo cumplir como estrategia efectiva para la cardioversión de fibrilación auricular a ritmo sinusal, la reducción de paroxismos de fibrilación auricular y el mantenimiento del ritmo sinusal a largo plazo. Infortunadamente en nuestro medio no se cuenta con todo el arsenal farmacológico para lograr este objetivo, limitándose a unos cuantos representantes de los grupos de antiarrítmicos, por ejemplo, ibutilide, que es capaz de revertir con mayor eficacia los eventos de fibrilación auricular, con reportes de eficacia para restaurar el ritmo sinusal hasta en el 50% de los casos, en menos de 30 minutos, con frecuencia baja de complicaciones (entre el 3–4%) como taquicardia ventricular polimórfica por prolongación del segmento QT. Por otro lado, la amiodarona, posiblemente el antiarrítmico de mayor uso en el ámbito hospitalario, por vía endovenosa, es efectivo en numerosos casos para controlar la frecuencia cardiaca; sin embargo el control del ritmo casi siempre es tardío. Un estudio demostró que la administración de la dosis de carga oral de amiodarona en pacientes con fibrilación auricular, resultó en conversión a sinusal en alrededor del 25% de los casos en forma tardía (semanas). Es fundamental detectar las causas que conllevan la aparición de fibrilación auricular, principalmente estados agudos de enfermedad, ya que a pesar de su eficacia, de no resolverse el uso de estos agentes será inútil para lograr los objetivos trazados.
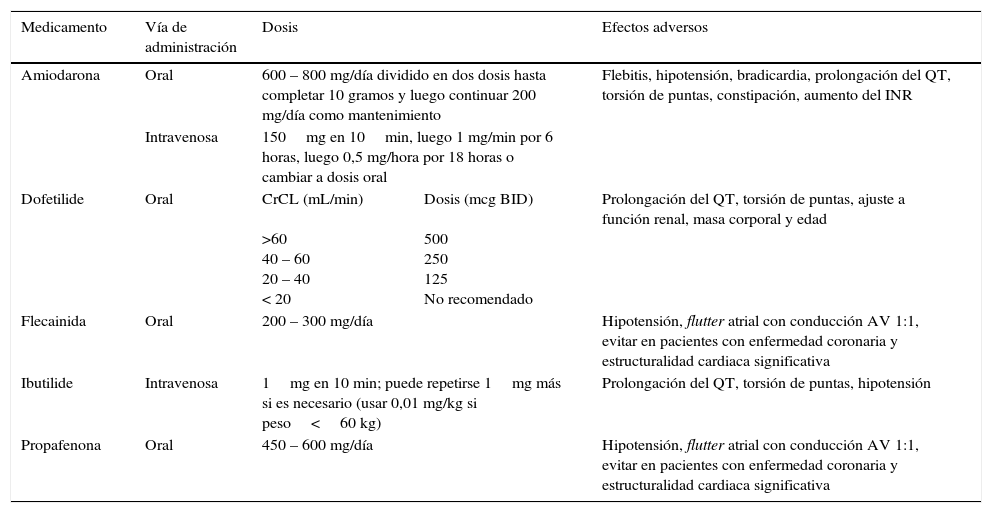
Las guías de manejo de fibrilación auricular de 2014, publicadas por el Colegio americano de cardiología (JACC, su sigla en inglés), proponen, con nivel de evidencia I, el uso de amiodarona, dofetilide, flecainida, dronedarona, propafenona y sotalol como medicamentos antiarrítmicos aprobados para mantener el ritmo sinusal. En la tabla 1 se resumen dosis, vía de administración y efectos adversos de cada medicación.
Medicaciones recomendadas para cardioversión farmacológica
| Medicamento | Vía de administración | Dosis | Efectos adversos | |
|---|---|---|---|---|
| Amiodarona | Oral | 600 – 800 mg/día dividido en dos dosis hasta completar 10 gramos y luego continuar 200 mg/día como mantenimiento | Flebitis, hipotensión, bradicardia, prolongación del QT, torsión de puntas, constipación, aumento del INR | |
| Intravenosa | 150mg en 10min, luego 1 mg/min por 6 horas, luego 0,5 mg/hora por 18 horas o cambiar a dosis oral | |||
| Dofetilide | Oral | CrCL (mL/min) >60 40 – 60 20 – 40 < 20 | Dosis (mcg BID) 500 250 125 No recomendado | Prolongación del QT, torsión de puntas, ajuste a función renal, masa corporal y edad |
| Flecainida | Oral | 200 – 300 mg/día | Hipotensión, flutter atrial con conducción AV 1:1, evitar en pacientes con enfermedad coronaria y estructuralidad cardiaca significativa | |
| Ibutilide | Intravenosa | 1mg en 10 min; puede repetirse 1mg más si es necesario (usar 0,01 mg/kg si peso<60 kg) | Prolongación del QT, torsión de puntas, hipotensión | |
| Propafenona | Oral | 450 – 600 mg/día | Hipotensión, flutter atrial con conducción AV 1:1, evitar en pacientes con enfermedad coronaria y estructuralidad cardiaca significativa | |
Tomada de: 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society.
Además de tener en cuenta los factores desencadenantes de la fibrilación auricular, será de igual importancia determinar aquellos que favorecen la aparición de efectos adversos según el perfil farmacológico de cada uno, tales como insuficiencia renal o hepática, nefropatías o condiciones perdedoras de potasio, bradicardia, historia de síncope, anormalidades de la conducción AV, bloqueo de rama, QT largo congénito, interacción proarrítmica de los medicamentos, falla cardiaca, hipertrofia ventricular izquierda entre otras3.
La eficacia y seguridad de los antiarrítmicos han sido evaluadas ampliamente. En un metaanálisis de 44 estudios se logró demostrar la reducción de recurrencias de fibrilación auricular con NNT 2 a 9. Todos los regímenes de fármacos tuvieron que suspenderse por sus efectos adversos con NNH 9 a 27, así como por el efecto proarrítmico de todos, excepto amiodarona y propafenona en este análisis; sin embargo, muchos de estos estudios tenían un corto tiempo de observación e incluían población relativamente sana.
La estructuralidad cardiaca desempeña un papel principal en la seguridad del uso de agentes antiarrítmicos y se ha asociado con el aumento del riesgo de arritmias inducidas por la medicación, principalmente arritmias ventriculares. Las manifestaciones de enfermedad cardiaca que predisponen a estos eventos incluyen la enfermedad coronaria, infarto previo, falla cardiaca e hipertrofia ventricular izquierda. Los antiarrítmicos del grupo IC (p. ej. propafenona), aumentan la mortalidad en este grupo de pacientes, así que debe evitarse su uso en esta población4.
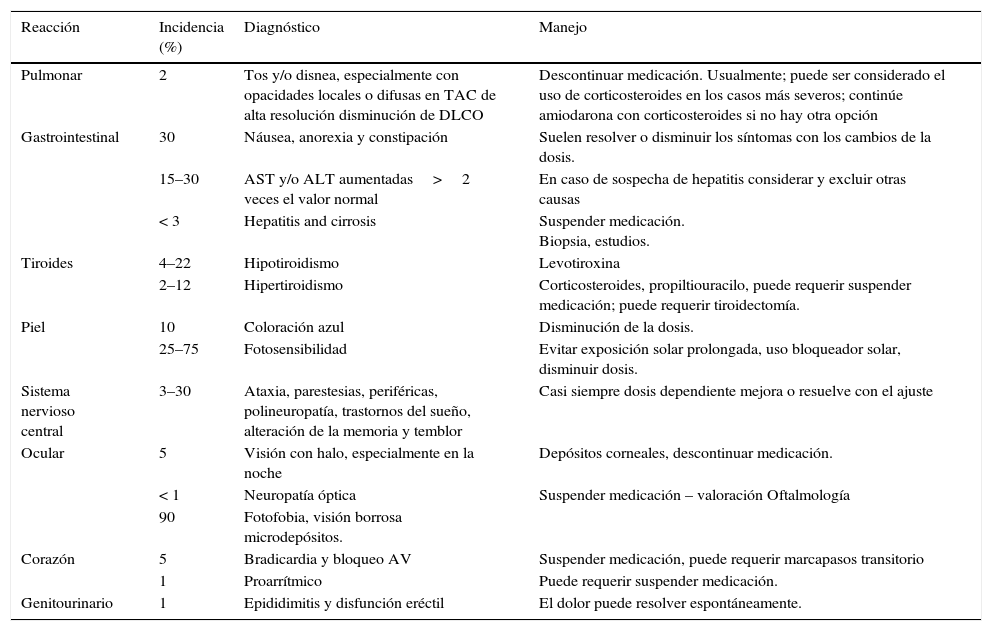
La amiodarona es tal vez el antiarrítmico de mayor uso en nuestro medio13, gracias a su mecanismo de acción “amplio”, su capacidad de resolver efectivamente gran cantidad de eventos arrítmicos agudos supra- y ventriculares, así como de controlar en forma crónica los mismos, además de ser el tratamiento más costo efectivo4. Su perfil de toxicidad y la frecuencia de aparición de sus efectos adversos, sugiere emplearlo solo cuando exista contraindicación o fracaso de otros agentes antiarrítmicos5. La amiodarona, con mecanismo de acción de bloqueo multicanal (corrientes de sodio, calcio, potasio), acción antagonista beta-adrenérgica, tiene una larga vida media por depósito en el tejido adiposo. Sus efectos cardiovasculares pueden presentarse marcadamente al inicio de la terapia, y los eventos adversos entre días hasta semanas. Los síntomas gastrointestinales pueden disminuirse si se fracciona la dosis, y estos se dan en relación con dosis mayor a 600mg/día (dosis de carga). Puede causar neumonitis intersticial que progresa a fibrosis pulmonar, siendo esta la complicación por toxicidad más relevante de cara al daño permanente y l riesgo de muerte secundario, entre 10 a 23% de los casos6–8. Ocurre por dos mecanismos, el primero por un efecto citotóxico directo por radicales libres de oxígeno y el segundo por reacción de hipersensibilidad9,10. Inhibe competitivamente las glicoproteínas CYP3A y CYP2C9, zona de metabolismo de múltiples medicaciones, por lo que interactúa ampliamente con varios fármacos, en especial warfarina y digoxina, obligando a la modificación de sus dosis. La toxicidad extracardiaca incluye alteraciones de la función tiroidea y hepática, cambios en la pigmentación ocular y de la piel, entre otros11 (tabla 2); recientemente un estudio relacionó el aumento de la incidencia de ataque cerebrovascular con el uso de amiodarona en pacientes con fibrilación auricular no valvular12.
Reacción adversas extracardíacas de los antiarrítmicos
| Reacción | Incidencia (%) | Diagnóstico | Manejo |
|---|---|---|---|
| Pulmonar | 2 | Tos y/o disnea, especialmente con opacidades locales o difusas en TAC de alta resolución disminución de DLCO | Descontinuar medicación. Usualmente; puede ser considerado el uso de corticosteroides en los casos más severos; continúe amiodarona con corticosteroides si no hay otra opción |
| Gastrointestinal | 30 | Náusea, anorexia y constipación | Suelen resolver o disminuir los síntomas con los cambios de la dosis. |
| 15–30 | AST y/o ALT aumentadas>2 veces el valor normal | En caso de sospecha de hepatitis considerar y excluir otras causas | |
| < 3 | Hepatitis and cirrosis | Suspender medicación. Biopsia, estudios. | |
| Tiroides | 4–22 | Hipotiroidismo | Levotiroxina |
| 2–12 | Hipertiroidismo | Corticosteroides, propiltiouracilo, puede requerir suspender medicación; puede requerir tiroidectomía. | |
| Piel | 10 | Coloración azul | Disminución de la dosis. |
| 25–75 | Fotosensibilidad | Evitar exposición solar prolongada, uso bloqueador solar, disminuir dosis. | |
| Sistema nervioso central | 3–30 | Ataxia, parestesias, periféricas, polineuropatía, trastornos del sueño, alteración de la memoria y temblor | Casi siempre dosis dependiente mejora o resuelve con el ajuste |
| Ocular | 5 | Visión con halo, especialmente en la noche | Depósitos corneales, descontinuar medicación. |
| < 1 | Neuropatía óptica | Suspender medicación – valoración Oftalmología | |
| 90 | Fotofobia, visión borrosa microdepósitos. | ||
| Corazón | 5 | Bradicardia y bloqueo AV | Suspender medicación, puede requerir marcapasos transitorio |
| 1 | Proarrítmico | Puede requerir suspender medicación. | |
| Genitourinario | 1 | Epididimitis y disfunción eréctil | El dolor puede resolver espontáneamente. |
ALT: alanino aminotransferasa; AST: aspartato aminotransferasa; DLCO: capacidad de difusión de monóxido de carbono.
Traducido de: Goldschlager N, et al. A Practical Guide for Clinicians Who Treat Patients with Amiodarone: 2007. Heart Rhythm. 2007;4(9).
Se recomienda la evaluación clínica y paraclínica de los efectos adversos y las posibles complicaciones, cada 3 a 6 meses durante el primer año y cada 6 meses por el tiempo de seguimiento. Este debe incluir al menos una vez al año: electrocardiograma, radiografía de tórax, pruebas de función tiroidea y enzimas hepáticas. Los niveles de amiodarona pueden ser útiles en los casos de arritmias recurrentes, aunque no se solicita de rutina13 (clase I, nivel de evidencia C) (tablas 3 y 4).
Interacciones con amiodarona
| Medicamento | Interacción |
|---|---|
| Digoxina | Incremento de la concentración y efectos cronotrópicos negativos en nodo AV y tracto gastrointestinal. Toxicidad neurológica. |
| Warfarina | Incremento en la concentración de la medicación y efectos adversos |
| Quinidina, procainamida, disopiramida | Incremento en la concentración de la medicación y efectos adversos; torsade de pointes. Bradicardia y bloqueo AV |
| Diltiazem, verapamilo y beta-bloqueadores | Bradicardia y bloqueo AV |
| Flecainida | Incremento en la concentración de la medicación y efectos adversos |
| Fenitoína | Hipotensión y bradicardia |
| Anestésicos | Incremento en la concentración de la medicación y efectos adversos |
| Ciclosporina | Alteración de la función hepática |
| Estatinas | Mialgias, miopatía, rabdomiólisis |
Recomendaciones para el seguimiento del paciente que recibe amiodarona
| Análisis | ¿Cuándo? |
|---|---|
| Pruebas de función hepática | Al inicio y cada 6 meses |
| Función tiroidea | TSH, T4 libre, T3 total al inicio y cada 6 meses |
| Radiografía de tórax | Al inicio y cada año |
| Evaluación oftalmológica | Al inicio y con la aparición de síntomas visuales |
| Pruebas de función pulmonar (con DLCO) | Al inicio y por disnea inexplicable, tos, especialmente en pacientes con enfermedad pulmonar, si la radiografía de tórax es sugestiva de anormalidad y si hay sospecha clínica de toxicidad pulmonar. |
| Tomografía axial de alta resolución | Al inicio y cuando sea relevante |
El sotalol, por su parte, previene la recurrencia, con tasas de efectividad de control del ritmo a un año entre el 30 al 50%. Se debe tener especial precaución en los pacientes con insuficiencia renal, dada su eliminación por orina, que implica el ajuste de su dosis. Debe evitarse el uso con otros fármacos que prolonguen el segmento QT. Los estudios han revelado una tendencia al aumento de la mortalidad asociada a la terapia con sotalol. Lamentablemente este fármaco no está disponible en nuestro medio.
La dronedarona es un análogo estructural de la amiodarona; tiene menor interacción y menor cantidad de efectos adversos, pero por la misma razón menor efectividad. Cuenta con múltiples acciones electrofisiológicas tal como la amiodarona; demostró capacidad para reducir los objetivos compuestos de muerte y complicaciones cardiovasculares en pacientes con fibrilación auricular paroxística o flutter atrial. Sin embargo, aumenta la mortalidad en pacientes con descompensación aguda de falla cardiaca con función ventricular deprimida, y está contraindicado en aquellos con clase funcional NYHA III o IV con falla cardiaca agudizada en las últimas cuatro semanas. En los casos con fibrilación auricular permanente, incrementa el riesgo de ataque cerebro-vascular, muerte cardiovascular y número de hospitalizaciones. Disminuye la excreción renal de creatinina sin afectar la filtración glomerular. Tiene fuerte interacción farmacológica con medicamentos del tipo azoles, digoxina, dabigatrán y macrólidos, por su metabolismo hepático en los citocromos CYP3A4 y CYP2D6. Pese a ello, no afecta el valor del INR al no tener interacción con la warfarina. Ha sido asociado con hepatotoxicidad severa y compromiso pulmonar después de 6 meses de tratamiento14.
En las guías europeas de 2010 y la actualización de 2012, se recomendó por estudios avanzados en fases III y IV (CRAFT, ACTI-IV, SCENE y AVRO trial), el uso de vernakalant para fibrilación auricular de reciente inicio (menor a 7 días o menor a 3 días en cirugía cardiaca) a dosis de 3mg/kg, endovenosos en 10 minutos, seguido por una segunda dosis de 2mg/kg en 10 minutos, pasados 15 minutos del primer bolo si es necesario. Está contraindicado en pacientes con presión sistólica menor a 100mm Hg, estenosis aórtica severa, falla cardiaca clase funcional III a IV, infarto de miocardio en los últimos 30 días o QT prolongado por aumentar la refractariedad atrial como mecanismo de acción. Los efectos indeseables son leves y van desde alteraciones del sentido del gusto, estornudos y parestesias a náuseas, que suelen resolverse pasados 5 a 15 minutos de su administración15. No obstante, en las autoridades estadounidenses como la Administración de Alimentos y Medicamentos (FDA) no han aprobado su uso ni comercialización, razón por la cual en las guías JACC 2014 no se recomiendan.
Mención aparte merece el digital o digoxina. Con larga trayectoria en el mercado, durante muchos años ha sido parte del manejo para controlar la frecuencia cardiaca en paciente con fibrilación auricular y falla cardiaca. En múltiples reportes se han dejado en evidencia efectos adversos, complicaciones y desenlaces en el manejo de la fibrilación auricular. Existe evidencia a favor y en contra; estudios con limitaciones metodológicas y otros de población y epidemiológicos. El desenlace más significativo a corto y largo plazo se basa en mortalidad. En el trabajo de Ziff et al. se reúnen más de 600.000 pacientes en 52 estudios, con consumo entre 1 a 3 años de digital, y que tenían deterioro de la función sistólica (FEVI 33 – 42%). Sus resultados sorprenden ya que se halló un efecto neutro en el impacto sobre mortalidad por todas las causas y baja tasa de hospitalizaciones16,17. Sin embargo en los reportes de Chen et al. en el que se incluyeron 408.660 pacientes se asoció con todas las causas de mortalidad (RR: 1,22; IC 95% 1,15–1,30), se notó un aumento del 14% en mortalidad en pacientes con falla cardiaca (RR: 1,14, IC 95% 1,04–1,24), y aumento del 36% de mortalidad en pacientes sin falla cardiaca (RR:1,36, IC 95% 1,18–1,56), de modo que se debe evitar su uso como primer agente antiarrítmico y con precaución en el manejo adyuvante en el control de frecuencia por su estrecho margen terapéutico.
Los episodios de fibrilación auricular de novo, tienden a resolverse espontáneamente hasta en el 70% de los casos. La terapia de cardioversión eléctrica o farmacológica resulta ser el método más efectivo para revertir el evento arrítmico y restablecer el ritmo sinusal cuando este es persistente; sin embargo, en la mayoría de casos, este tiene alta probabilidad de recurrencia (solo 20 a 30% permanecen en sinusal), y el uso de fármacos antiarrítmicos posterior a la cardioversión, es una práctica común y necesaria18. En un metaanálisis de 11 estudios y más de 20.000 pacientes, se evaluaron los desenlaces y la efectividad de los distintos grupos de la clasificación Vaughan–Williams, para mantener el ritmo sinusal posterior a la cardioversión. Los resultados avalan el uso de antiarrítmicos de los grupos IC y III, quienes significativamente reducen la recurrencia (OR 0,19 a 0,70, NNT 3 a 16) y betabloqueadores (OR 0,62, IC 95% 0,44 – 0,88, NNT 9)18. Todos los grupos tuvieron deserción de pacientes por sus efectos adversos; sin embargo propafenona, amiodarona y dronedarona tuvieron efectos proarrítmicos significativos. Los fármacos del grupo IA (disopiramida y quinidina), grupo III (sotalol) se correlacionaron con aumento de la mortalidad (OR 2,39, 95% (IC 95%) 1,03 – 5,59, NNH 109, IC 95% 34 - 4985) y sotalol (OR 2,47, IC 95% 1,2 – 5,05, NNH 166, IC 95% 61 - 1159), mientras que los demás grupos no modificaron este desenlace.
De forma emergente, los estudios a favor de la ablación para el manejo de fibrilación auricular, han comparado eficacia y desenlaces relevantes, principalmente mantenimiento de ritmo sinusal, de esta terapia contra los fármacos antiarrítmicos. Las tasas de recurrencia varían en los reportes. La terapia con ablación recurre alrededor del 28%, mientras que con antiarrítmicos esta alcanza el 65%. Varios estudios reunidos en metaanálisis y revisiones sistemáticas han planteado la terapia de ablación como la primera línea de tratamiento en casos con fibrilación auricular paroxística en pacientes jóvenes y relativamente saludables (RR: 0,63, IC 95% 0,44 - 0,92, p=0,02). La eficacia fue superior para mantener el ritmo sinusal (OR: 9,41; IC 95% 5,00 – 17,71; p<0,01), y logrando control del ritmo a corto (OR, 10,84; IC 95% 5,83 – 20,16; p<0,001) y a largo plazo (OR, 7,65; IC 95% 1,97 – 29,73; p=0,03); pero con complicaciones agudas de mayor impacto en morbilidad en aquellos llevados a ablación dados los riesgos de lesión vascular y cardiaca, además de taponamiento cardiaco19–21. A pesar de ello, es de gran relevancia que los pacientes intervenidos presenten diferencia significativa en la apreciación de la calidad de vida en comparación con los antiarrítmicos en aquellos con fibrilación auricular persistente22.
Con base en las observaciones anteriores, surge la necesidad de determinar si el efecto antiarrítmico de los fármacos tiene la capacidad de reducir las tasas de recurrencia luego del aislamiento de venas pulmonares por ablación. Un metaanálisis publicado en agosto 2015, compara la terapia con antiarrítmicos contra placebo, o no tratamiento y la administración luego de la terapia con ablación. Se evaluaron tres estudios clínicos aleatorizados, que agruparon 814 pacientes. La administración de antiarrítmicos posterior a la ablación redujo la recurrencia temprana de fibrilación auricular (25,3% vs. 39,8%; OR 0,47 IC 95% 0,34 – 0,64; χ2=3,77; p=0,58; I2=0%), sin evidenciar diferencia significativa en la recurrencia tardía (36,5% vs. 42,5%; OR 0,77 IC 95% 0,57 – 1,03; χ2=3,15; p=0,68; I2=0%). Esto sugiere que aunque la administración continua de antiarrítmicos posterior a la ablación para fibrilación auricular puede disminuir la recurrencia temprana de la arritmia, esta práctica no previene las recurrencias de presentación tardía23.
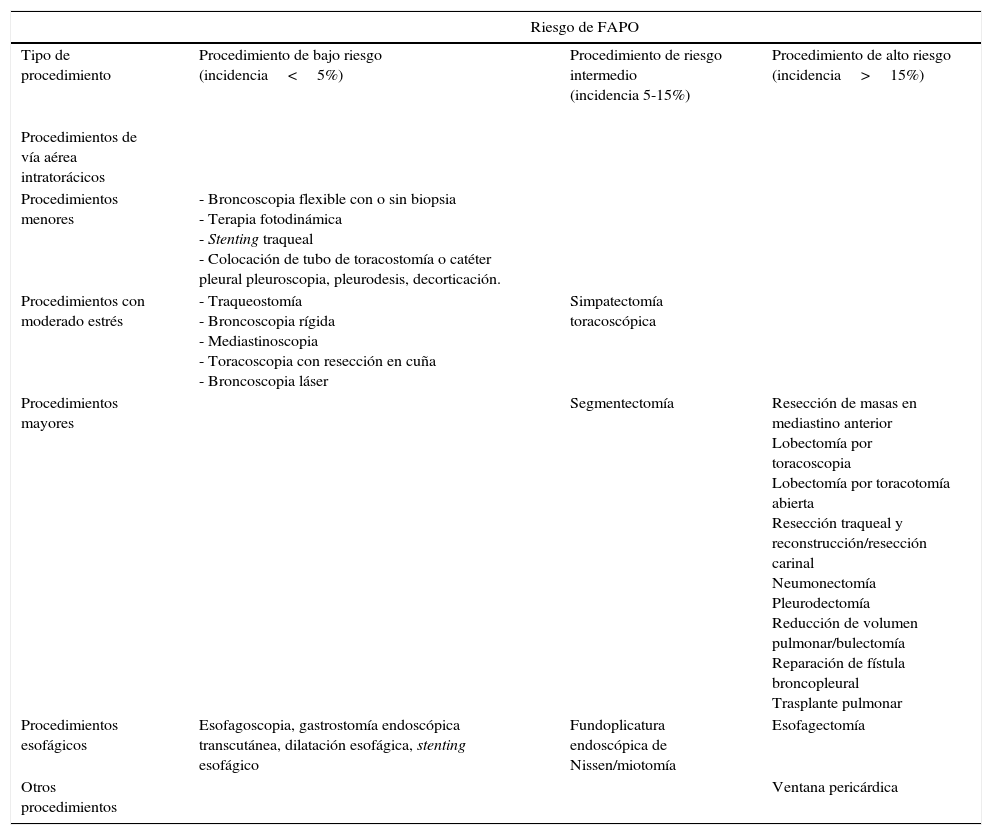
La fibrilación auricular en el escenario peri- y postoperatorio (FAPO) torácico y cardiovascular es 50 – 200% mayor que la cirugía general. Es la arritmia más frecuente, con pico de incidencia entre el segundo y cuarto día de convalecencia, y entre el 90 y el 98% de los eventos suele resolverse en un lapso de hasta 6 semanas24. Es causante de complicaciones e inestabilidad hemodinámica, y por tanto, de aumento del riesgo de morbimortalidad asociado con el procedimiento por sí mismo, hecho que además prolonga la estancia en unidades de cuidado intensivo y por ende los costos al sistema de salud en un 30 a 68%25 (tablas 5 y 6).
Estratificación del riesgo en procedimientos de cirugía torácica y riesgo de fibrilación auricular postoperatoria (FAPO)
| Riesgo de FAPO | |||
|---|---|---|---|
| Tipo de procedimiento | Procedimiento de bajo riesgo (incidencia<5%) | Procedimiento de riesgo intermedio (incidencia 5-15%) | Procedimiento de alto riesgo (incidencia>15%) |
| Procedimientos de vía aérea intratorácicos | |||
| Procedimientos menores | - Broncoscopia flexible con o sin biopsia - Terapia fotodinámica - Stenting traqueal - Colocación de tubo de toracostomía o catéter pleural pleuroscopia, pleurodesis, decorticación. | ||
| Procedimientos con moderado estrés | - Traqueostomía - Broncoscopia rígida - Mediastinoscopia - Toracoscopia con resección en cuña - Broncoscopia láser | Simpatectomía toracoscópica | |
| Procedimientos mayores | Segmentectomía | Resección de masas en mediastino anterior Lobectomía por toracoscopia Lobectomía por toracotomía abierta Resección traqueal y reconstrucción/resección carinal Neumonectomía Pleurodectomía Reducción de volumen pulmonar/bulectomía Reparación de fístula broncopleural Trasplante pulmonar | |
| Procedimientos esofágicos | Esofagoscopia, gastrostomía endoscópica transcutánea, dilatación esofágica, stenting esofágico | Fundoplicatura endoscópica de Nissen/miotomía | Esofagectomía |
| Otros procedimientos | Ventana pericárdica | ||
Traducido de: 2014 AATS guidelines for the prevention and management of perioperative atrial fibrillation and flutter for thoracic surgical procedures. J Thorac Cardiovasc Surg 2014; 148:e153-93.
Factores conocidos y comorbilidades que incrementan el riesgo de fibrilación auricular postoperatoria
| Factores de riesgo y comorbilidades modificables - Hipertensión - Infarto miocárdico - Enfermedad valvular - Falla cardiaca - Obesidad - SAHOS - Tabaquismo - Ejercicio - Consumo de alcohol - Hipertiroidismo - Presión de pulso aumentado - Insuficiencia mitral - Hipertrofia ventricular izquierda - Adelgazamiento de la pared ventricular |
| Factores de riesgo no modificables |
| - Senectud - Afro-americano (factor protector) - Historia familiar - Variantes genéticas - Género masculino - Antecedente de arritmias |
Traducido de: 2014 AATS guidelines for the prevention and management of perioperative atrial fibrillation and flutter for thoracic surgical procedures. J Thorac Cardiovasc Surg, 2014;148:e153-93.
Los fármacos que se han evaluado para la profilaxis en la aparición de FAPO, no difieren de aquellos que controlan el ritmo en otros escenarios25. Para prevenir la aparición de fibrilación auricular en cirugía torácica y cardiovascular, las guías de cirugía torácica proponen recomendaciones para este propósito.
En la tabla 6 se observan todos los factores de riesgo que incrementan el riesgo de aparición de fibrilación auricular postoperatoria.
Diferentes estudios han evaluado el beneficio de no descontinuar el consumo de beta-bloqueador si el paciente estaba consumiéndolo previamente (recomendación clase I, nivel de evidencia A)25,26. Particularmente, en cirugía de revascularización miocárdica, un metaanálisis muestra que comparado con metoprolol, el carvedilol reduce significativamente el FAPO (OR 0,50, IC 95% 0,32 – 0,80)27,28.
Es razonable la administración de sulfato de magnesio preoperatorio para prevenir la aparición de FAPO en aquellos pacientes que tienen déficit sérico de este ion. (recomendación clase IIb, nivel de evidencia C).
No se recomienda el uso de digoxina en el aislamiento total o parcial de las venas pulmonares.
En pacientes con riesgo intermedio – alto para fibrilación auricular postoperatoria se recomienda el uso de diltiazem en quienes no puedan recibir betabloqueador y tengan función sistólica ventricular conservada (recomendación clase IIa, nivel de evidencia B).
Se recomienda la administración de amiodarona en el estado postoperatorio de pacientes llevados a esofagectomía (recomendación clase IIb, nivel de evidencia B). Para otro tipo de intervenciones como la pulmonar, en un metaanálisis de 10 estudios, en el que se evaluó el uso de este agente vs. calcio-antagonistas y sulfato de magnesio, se evidenció una reducción de riesgo relativo de 0,53 (IC 95% 0,42 – 0,67) y NNT de 8,5 (IC 95% 6,4 – 13,3). La amiodarona fue el agente más efectivo, con RR de 0,32 (IC 95% 0,19 – 0,50) y NNT de 4,8 (IC 95% 3,7 – 7,6). La reducción de riesgo en general de presentar fibrilación auricular fue de 25,1% a 13,4% (p<0,001) y la amiodarona como monoterapia logró reducir de 30,4% a 9,6% (p<0,001)27.
En cuanto a la cirugía cardiaca los estudios más recientes, apuntan hacia la efectividad ya comprobada de beta-bloqueadores y la amiodarona en diferentes escenarios. En conclusión, los estudios clínicos aleatorizados concuerdan en que no hay diferencia en la tasa de efectividad de reducción de la fibrilación auricular postoperatoria entre estos dos antiarrítmicos28.
ResumenLa fibrilación auricular es una de las patologías arrítmicas más frecuentes e incidentes en corazones sanos como en aquellos con alteración estructural, con diversas etiologías arrítmicas; representa un gran riesgo de morbimortalidad por lo que la terapia antiarrítmica farmacológica ha demostrado ser una gran herramienta para los médicos en búsqueda de preservar la fisiología cardiaca, control del ritmo o frecuencia para prevenir las complicaciones. No obstante, los beneficios del uso de estos agentes, implícitamente conllevan riesgo de sus efectos adversos incluyendo mortalidad. Por tal motivo es fundamental partir de una base previa al inicio de la terapia, para identificar no solamente la sintomatología sino además los cambios en los paraclínicos que sirvan para la toma de decisiones en cuanto a la suspensión o el cambio de la medicación. En los casos en los cuales esté contraindicada la terapia farmacológica por distintos motivos, bien sea por aquellos estados de intolerancia o de mayor riesgo que beneficio, se ha demostrado que la intervención de ablación por catéter de radiofrecuencia tiene mejores resultados, en especial en personas jóvenes y relativamente sanas. Las intervenciones quirúrgicas en tórax, esencialmente las que involucran el mediastino, conllevan aparición de episodios de fibrilación auricular bien sea de novo o recurrencias, los cuales agregan un riesgo pronóstico en los desenlaces, pudiéndose prevenir de forma efectiva través de recomendaciones para esta práctica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.