La evolución en el intervencionismo estructural percutáneo ha generado un desarrollo paralelo en las técnicas de imagen avanzada. Teniendo en cuenta que este tipo de procedimientos requiere un entendimiento total de la anatomía cardiaca y con el fin de garantizar los mejores resultados y seguridad para el paciente durante procedimientos complejos, se desarrolló un software capaz de fusionar la fluoroscopia y la ecocardiografía 3D en una sola imagen. La tecnología del Echonavigator® integra dos técnicas de imágenes dinámicas de un corazón en movimiento; el adecuado co-registro y visualización de fluoroscopia y ecocardiografía transesofágica 2D/3D es la clave en la obtención de resultados óptimos. La fusión de dos imágenes dinámicas en tiempo real es una herramienta factible y segura en los procedimientos de intervencionismo estructural del corazón; los estudios iniciales han logrado disminuir el tiempo de realización de los procedimientos y las dosis de radiación al paciente. El futuro es prometedor y su progresiva expansión de uso teniendo en cuenta su reciente aparición, aportará más datos en el crecimiento de esta tecnología.
The evolution of percutaneous structural interventionism has led to the simultaneous development of advanced imaging techniques. Taking into account that these types of procedures require a full understanding of cardiac anatomy, and with the aim of ensuring the best results and patient safety during complex procedures, a software program was developed that was capable of fusing and 3D-echocardiography into a single image. The Echonavigator® technology combines two dynamic imaging techniques of a heart in movement. The appropriate co-recording and visualising of fluoroscopy and 2D/3D transoesophageal echocardiography is essential for obtaining optimal results. The fusion of two images in real-time is a feasible and safe tool in structural heart interventionist procedures. Initial studies have managed to decrease the time of performing the procedures, as well as the dose of radiation to the patient. The future is promising, and its gradual expansion of use, taking into account its recent appearance, will provide more data on the growth of this technology.
En la última década, el campo del intervencionismo estructural ha venido en crecimiento rápido y continuo1. Se han introducido numerosas terapias menos invasivas para el tratamiento de enfermedades estructurales del corazón, las cuales han probado en pacientes de alto riesgo quirúrgico ser iguales o más efectivas gracias a la disminución del riesgo perioperatorio2–5.
La evolución en el intervencionismo estructural percutáneo ha generado un desarrollo paralelo en las técnicas de imagen avanzada teniendo en cuenta que este tipo de procedimientos requiere un entendimiento total de la anatomía cardiaca con el fin de garantizar los mejores resultados6. El rol de la imagen durante procedimientos estructurales percutáneos se puede dividir en tres componentes:
- 1.
Selección del paciente y planificación pre-procedimiento.
- 2.
Guía de imagen intraprocedimiento.
- 3.
Evaluación de resultados y seguimiento a largo plazo.
Esta revisión se enfocará en el segundo punto. De manera rutinaria, la fluoroscopia se ha utilizado como guía en tiempo real para los procedimientos de intervención percutánea estructural complementado por ecocardiografía transesofágica 3D en tiempo real7. Sin embargo, las técnicas por sí mismas tienen limitaciones. En el caso de la fluoroscopia, provee información importante como la visualización de estructuras óseas, cables y dispositivos y también mayor campo de visión, pero con una limitación clara en la definición de tejidos blandos y en la visualización de cavidades cardiacas y tejidos adyacentes. Por otro lado, la ecocardiografía tiene un menor campo de visión, con una menor visualización de dispositivos y catéteres pero da una excelente caracterización de tejidos y adicionalmente ofrece información fisiológica durante todo el procedimiento en tiempo real. No obstante, las dos técnicas generalmente se utilizan con diferentes orientaciones o finalidades, lo que añade un grado de dificultad mayor en la interpretación rápida de las imágenes8.
Imágenes de fusiónLas intervenciones estructurales poseen herramientas diseñadas para ser seguras y ofrecer una alta precisión dada la complejidad del procedimiento. Esto se traduce en un reto ya que implica la visualización exacta durante todo el procedimiento de los catéteres en movimiento y el material implantado con un corazón latiente. La identificación de las estructuras en tres dimensiones en múltiples modalidades de imagen y la comunicación efectiva, son piezas fundamentales en el éxito de las intervenciones.
Para facilitar esta tarea, las imágenes de fusión aparecen como una herramienta complementaria en la cual dos o más técnicas se complementan en una sola imagen con el fin de orientar y disminuir tiempo de intervención y complicaciones.
Previamente ya existían imágenes de fusión estáticas como la perfusion miocárdica con tomografía coronaria9, SPECT–ecocardiografía, RMN–CT10, PET-CT11, etc. Sin embargo, en estos estudios de fusión se utilizan imágenes estáticas y no son posibles en un corazón latiendo en intervenciones en tiempo real.
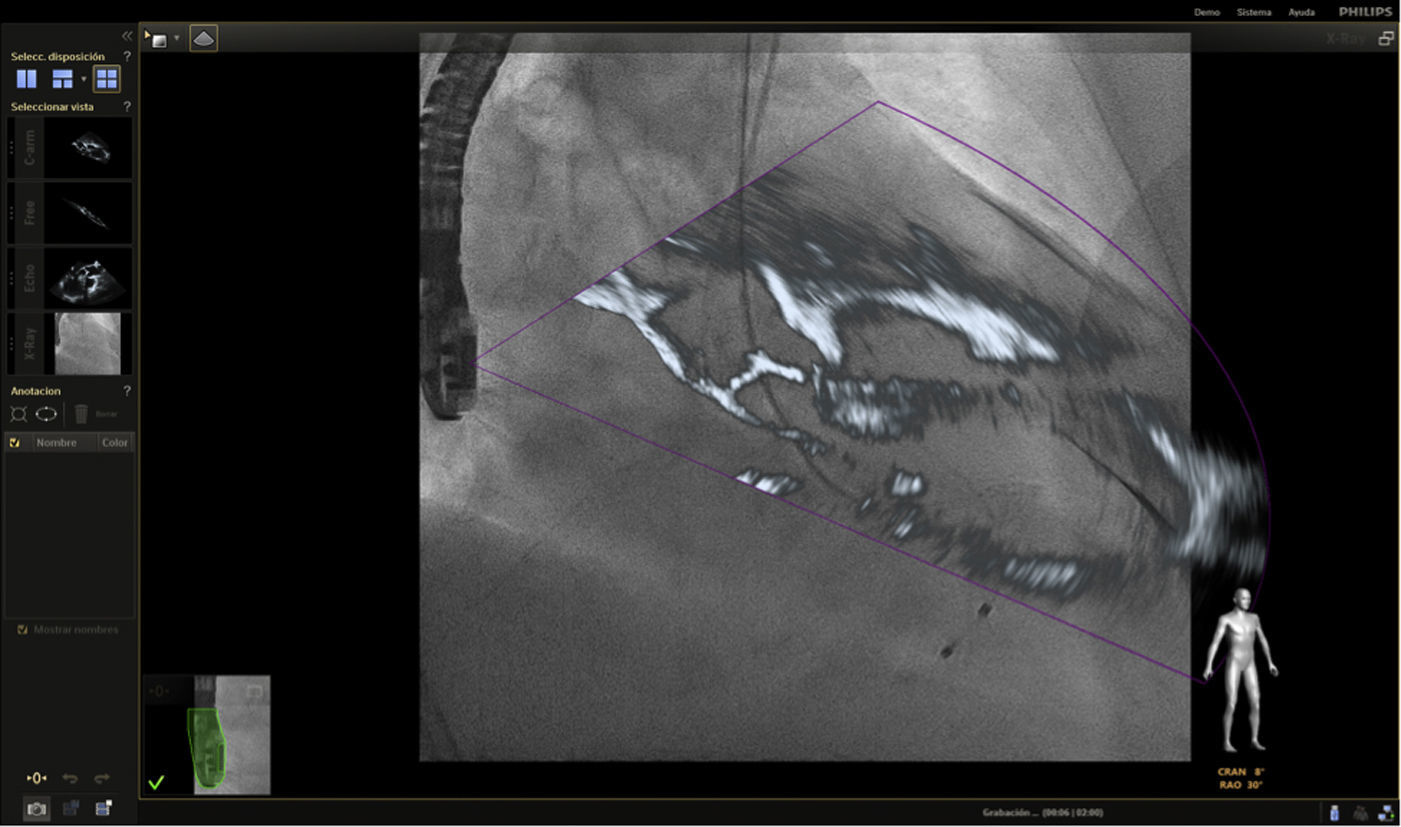
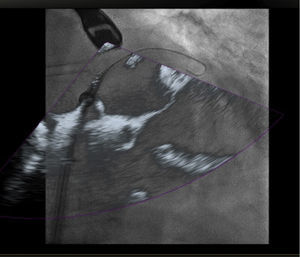
Para procedimientos estructurales cardiacos, más recientemente se desarrolló el uso de imagen de fusión entre tomografía computarizada y fluoroscopia en la cual se utiliza una imagen estática y una dinámica. Esta combinación ofrece una información anatómica adecuada pero no provee imagen en tiempo real y está limitada por el movimiento traslacional del corazón debido a los movimientos respiratorios o cualquier movimiento que el paciente pueda realizar durante el mismo12 (fig. 1).
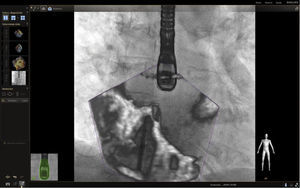
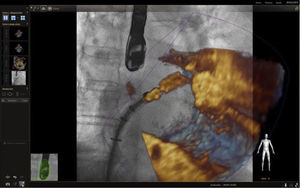
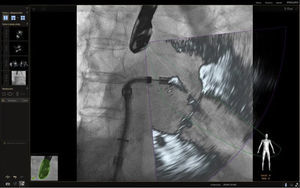
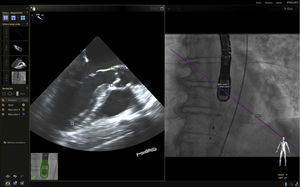
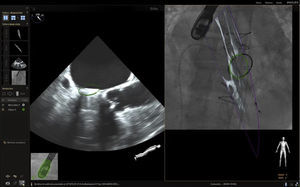
En respuesta a las necesidades de buenos resultados y seguridad para el paciente durante la realización de procedimientos complejos, se desarrolló un software capaz de fusionar la fluoroscopia y la ecocardiografía transesofágica 2D/3D13 en una sola imagen (figs. 2 y 3). Viene utilizándose cada vez con más frecuencia, con múltiples reportes en la literatura, pues ha mostrado sus buenos resultados de eficacia y especialmente de seguridad, dando la posibilidad de su implementación en la rutina diaria.
En esta revisión se dan las pautas de su aplicación actual, así como las utilidades en cada una de las técnicas de intervencionismo empleadas, sus ventajas y limitaciones.
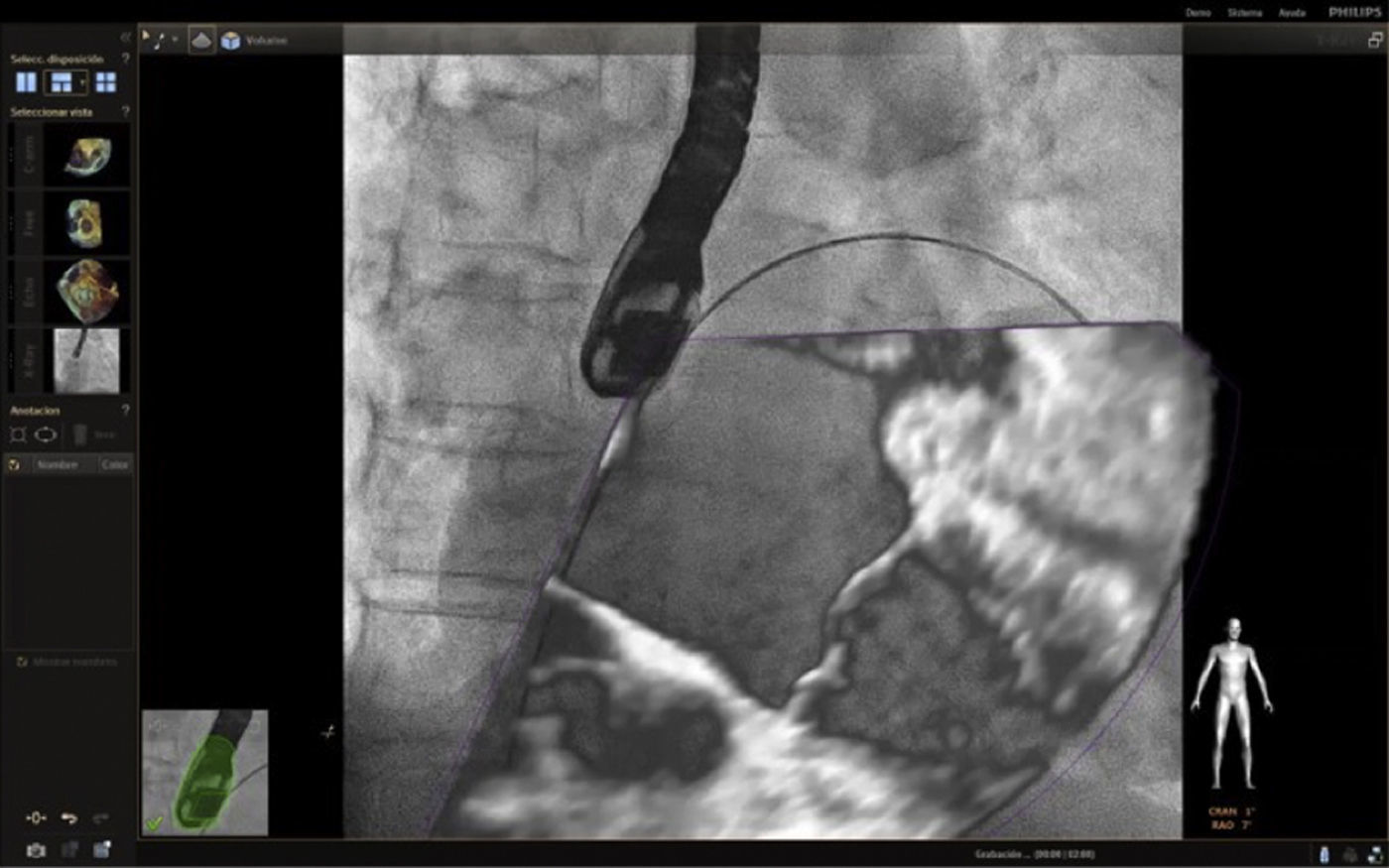
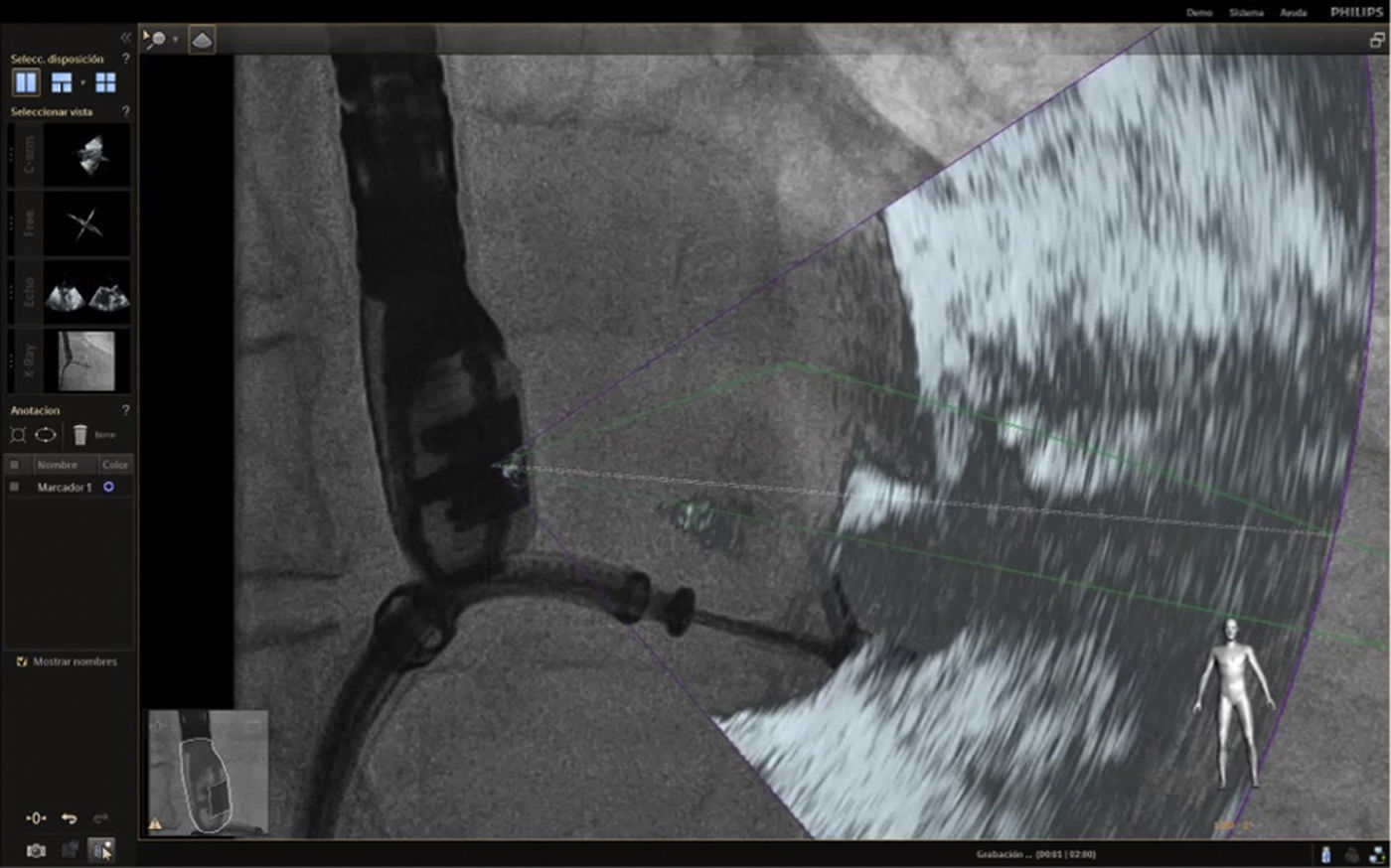
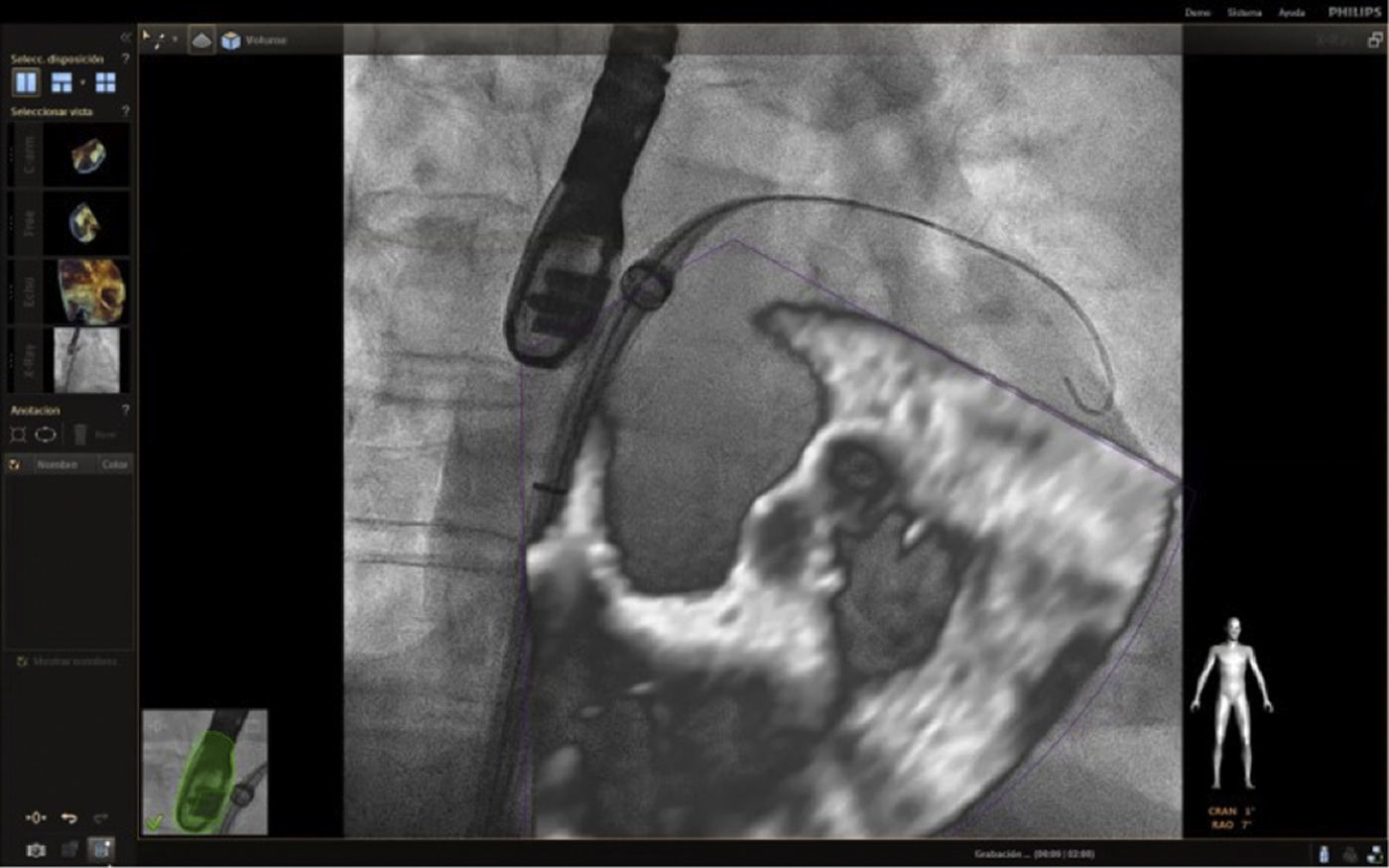
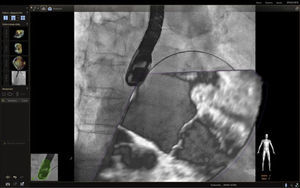
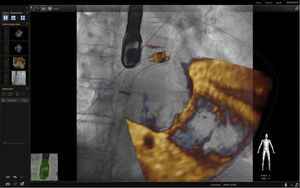
Fusión ecocardiografía 3D/fluoroscopiaTécnicaLa tecnología del Echonavigator® integra dos técnicas de imágenes dinámicas de un corazón en movimiento. El co-registro adecuado y la visualización de fluoroscopia y ecocardiografía transesofágica 2D/3D es la clave en la obtención de resultados óptimos. Esta sincronización se obtiene mediante un algoritmo de calibración entre la sonda transesofágica y el fluoroscopio14, gracias a la que automáticamente el sistema identifica la sonda y genera una imagen sobrepuesta a la previa de fluoroscopio.
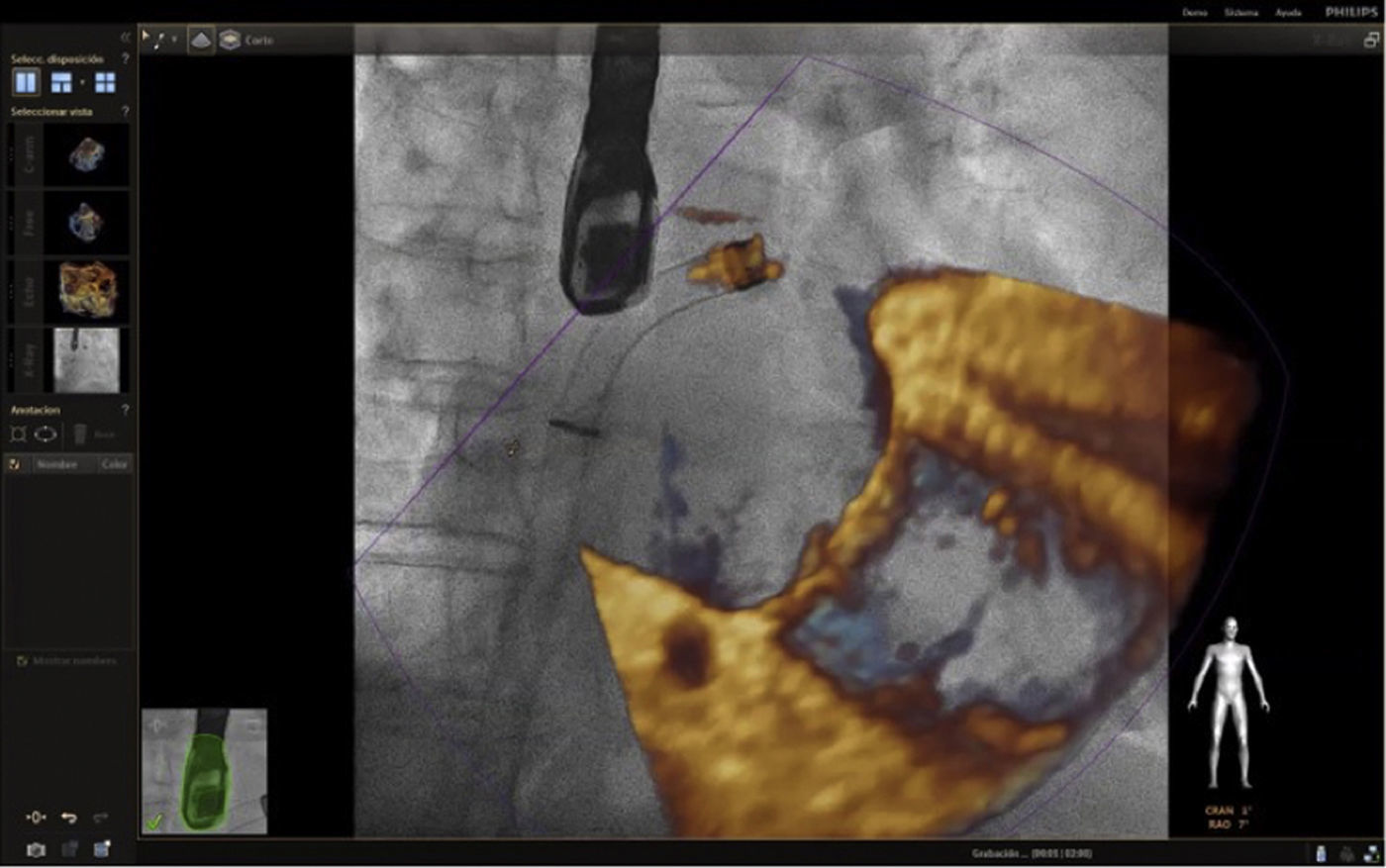
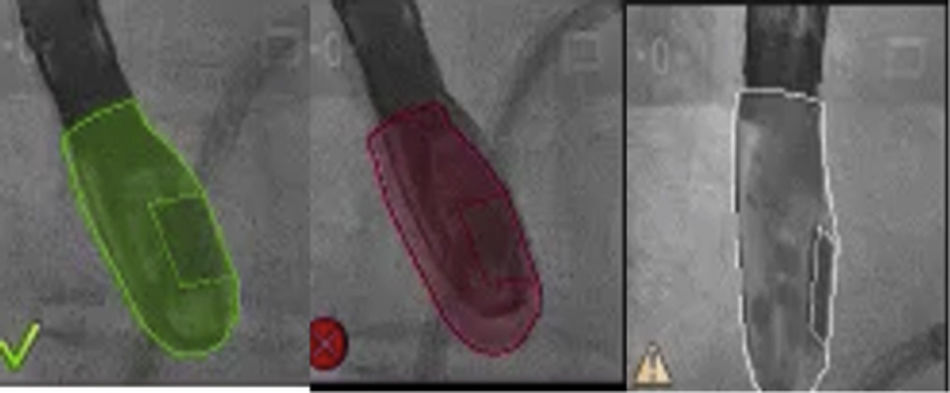
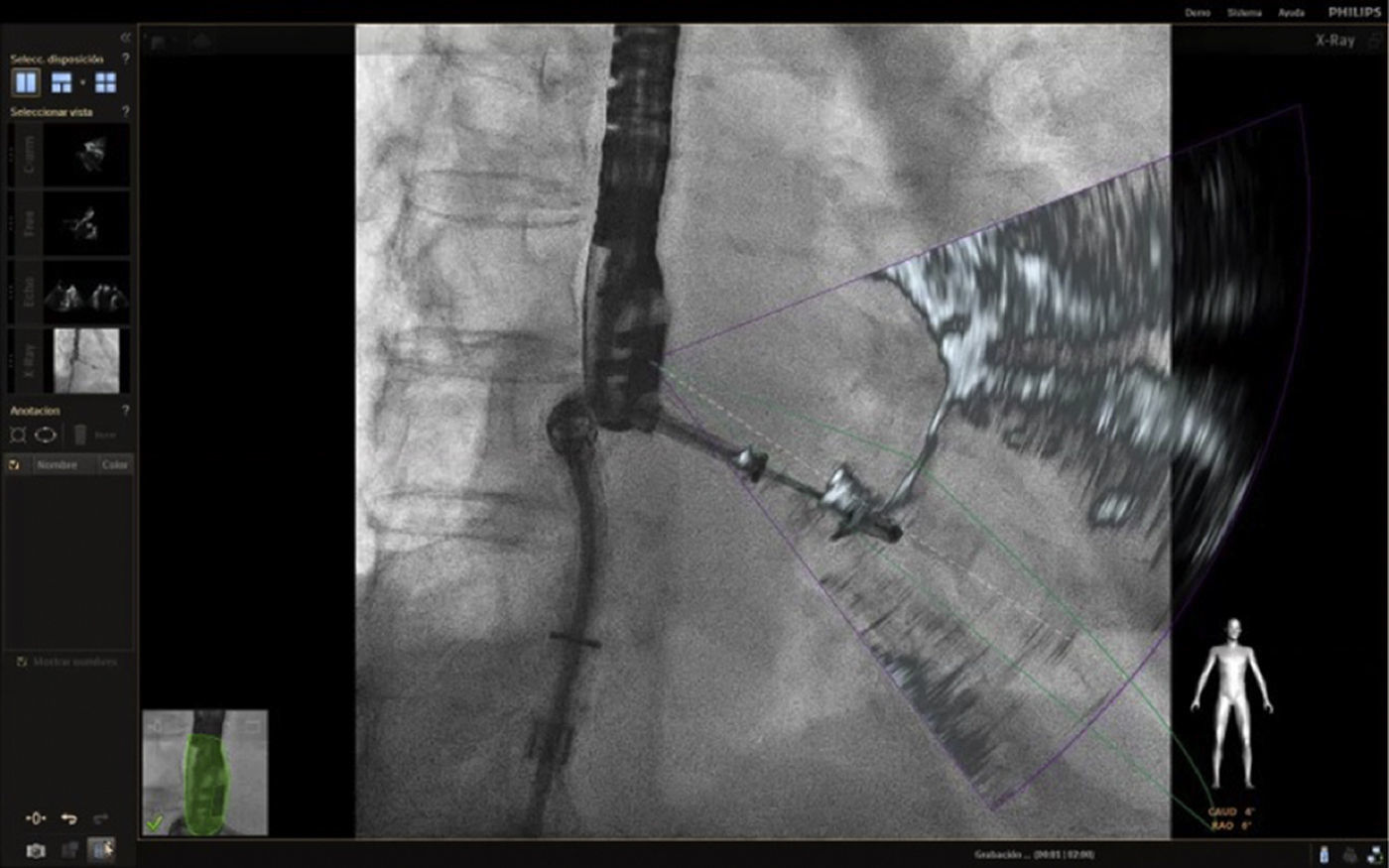
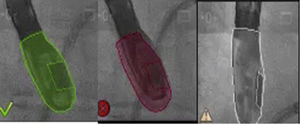
Una vez se da esta fusión, el sistema genera una imagen compuesta que sigue la rotación del brazo del fluoroscopio a discreción del cardiólogo intervencionista. La pantalla dedicada al intervencionista ofrece la posibilidad de cuatro imágenes en simultánea con diferentes funciones. En la primera, las capturas obtenidas por la ecocardiografía transesofágica 2D/3D están a cargo exclusivamente del ecocardiografista; en la segunda la visión del fluoroscopio depende de la angulación del gantry (en esta imagen se debe ubicar la sonda centrada el máximo posible en el campo visual teniendo en cuenta que a partir de allí se obtiene la sincronización del registro). La confirmación de la ubicación del co–registro de la sonda se puede ver representada de dos maneras: color verde si es adecuada o rojo si no lo es (fig. 4); el tercer cuadrante está dedicado a la imagen fusionada (el flujo del haz del transductor está graficado sobre la imagen en la cual todo cambio de posición, angulación o rotación de la sonda inmediatamente es registrado y actualizado en la fluoroscopia); por último, el cuarto cuadrante se encuentra libre para visualizar la imagen de referencia a discreción de los operadores.
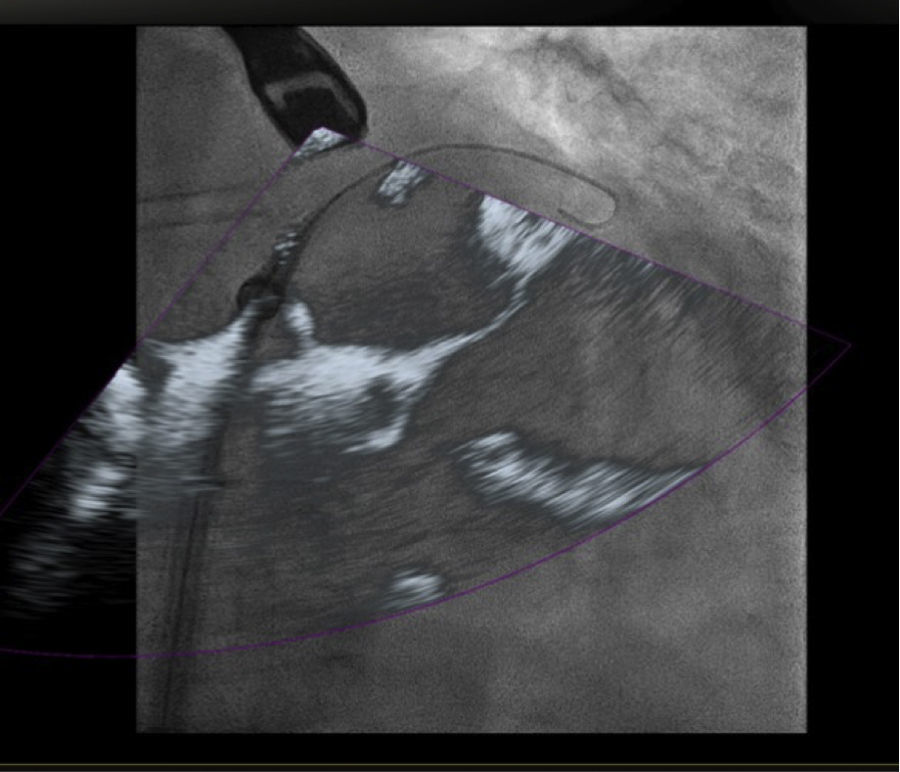
Es importante recalcar que las funciones del ecocardiograma transesofágico se pueden emplear en sus diferentes modalidades tales como 2D, 3D y color Doppler, así como la integración de visualización en X-plane, 3D zoom y 3D Full volumen.
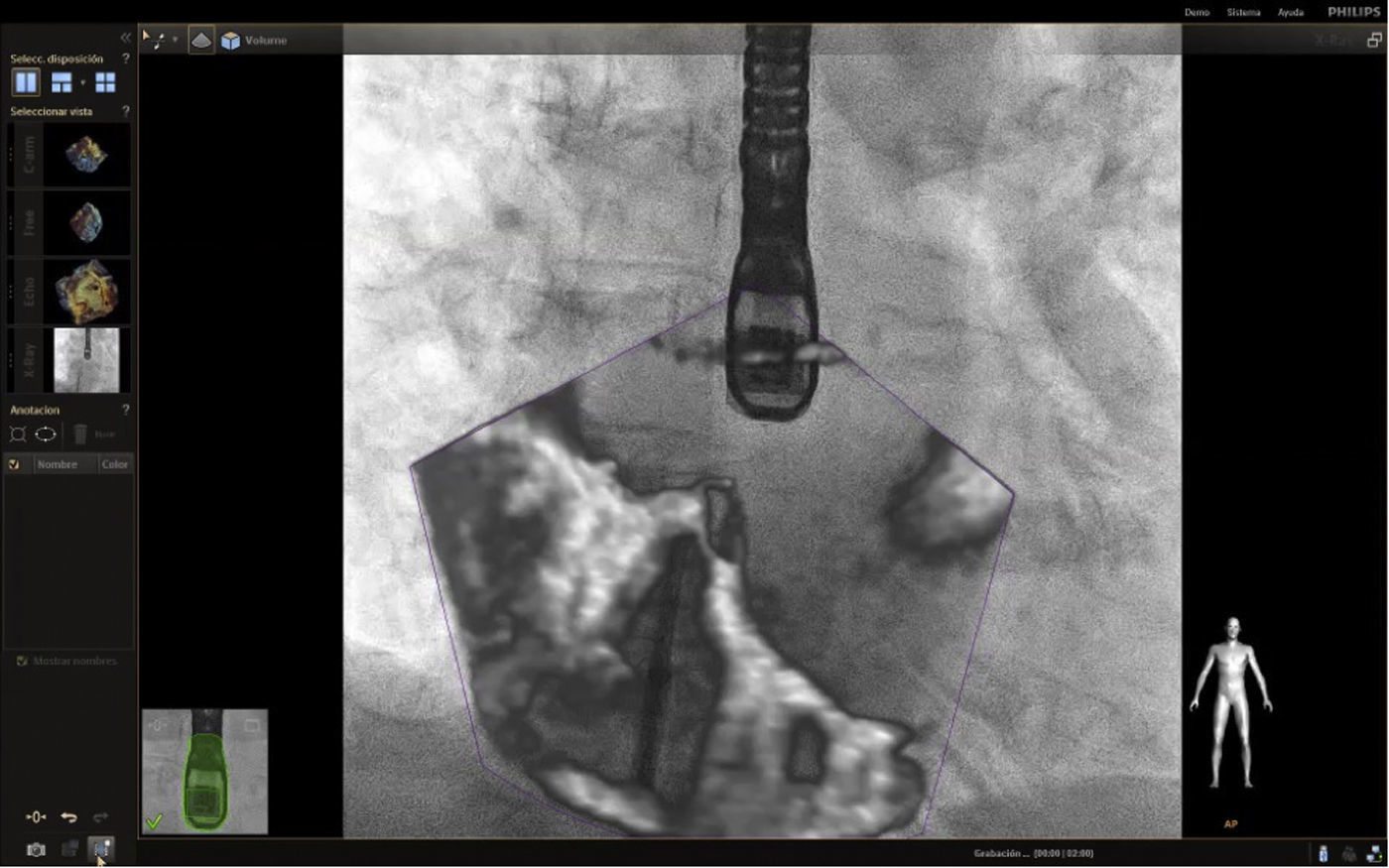
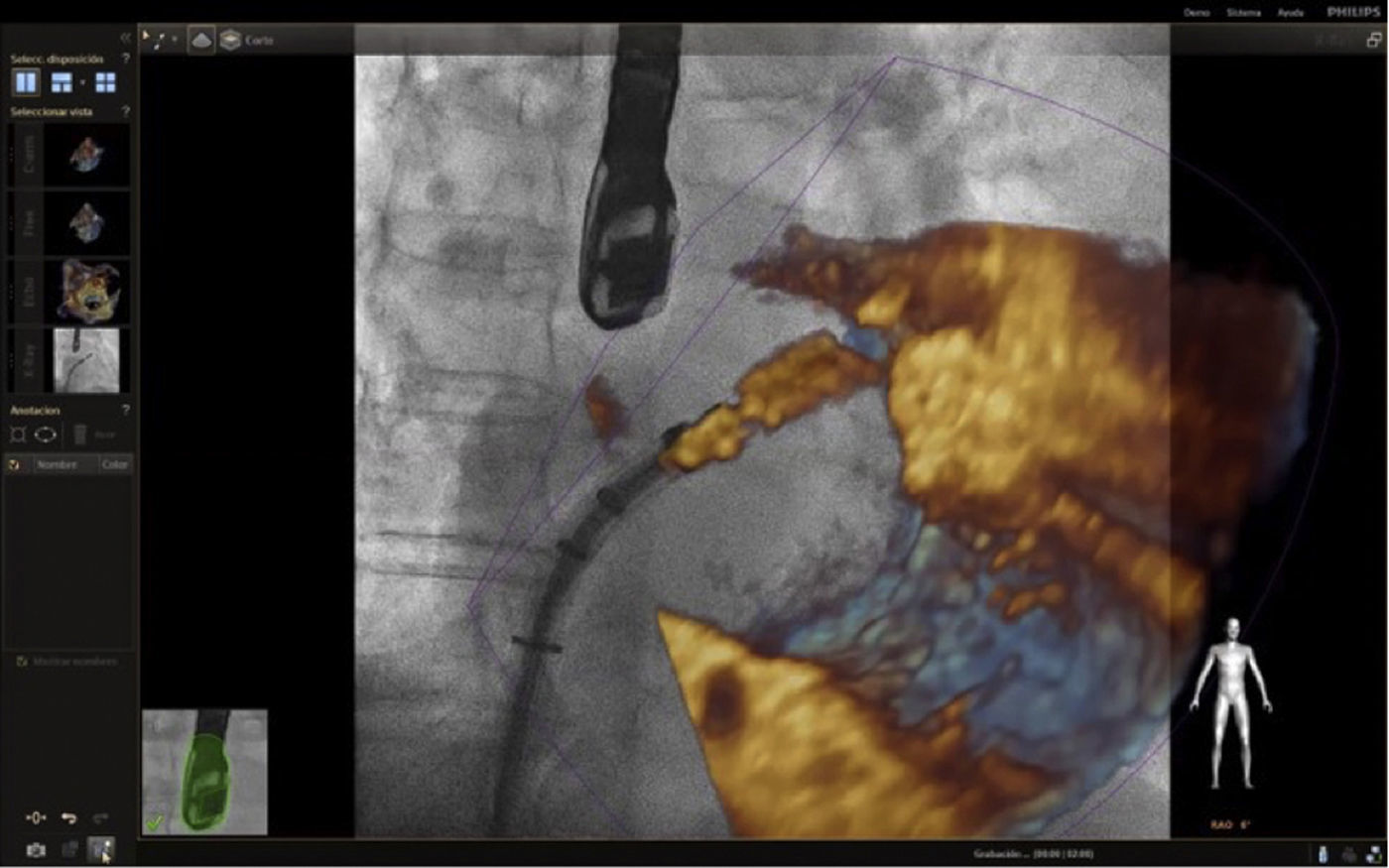
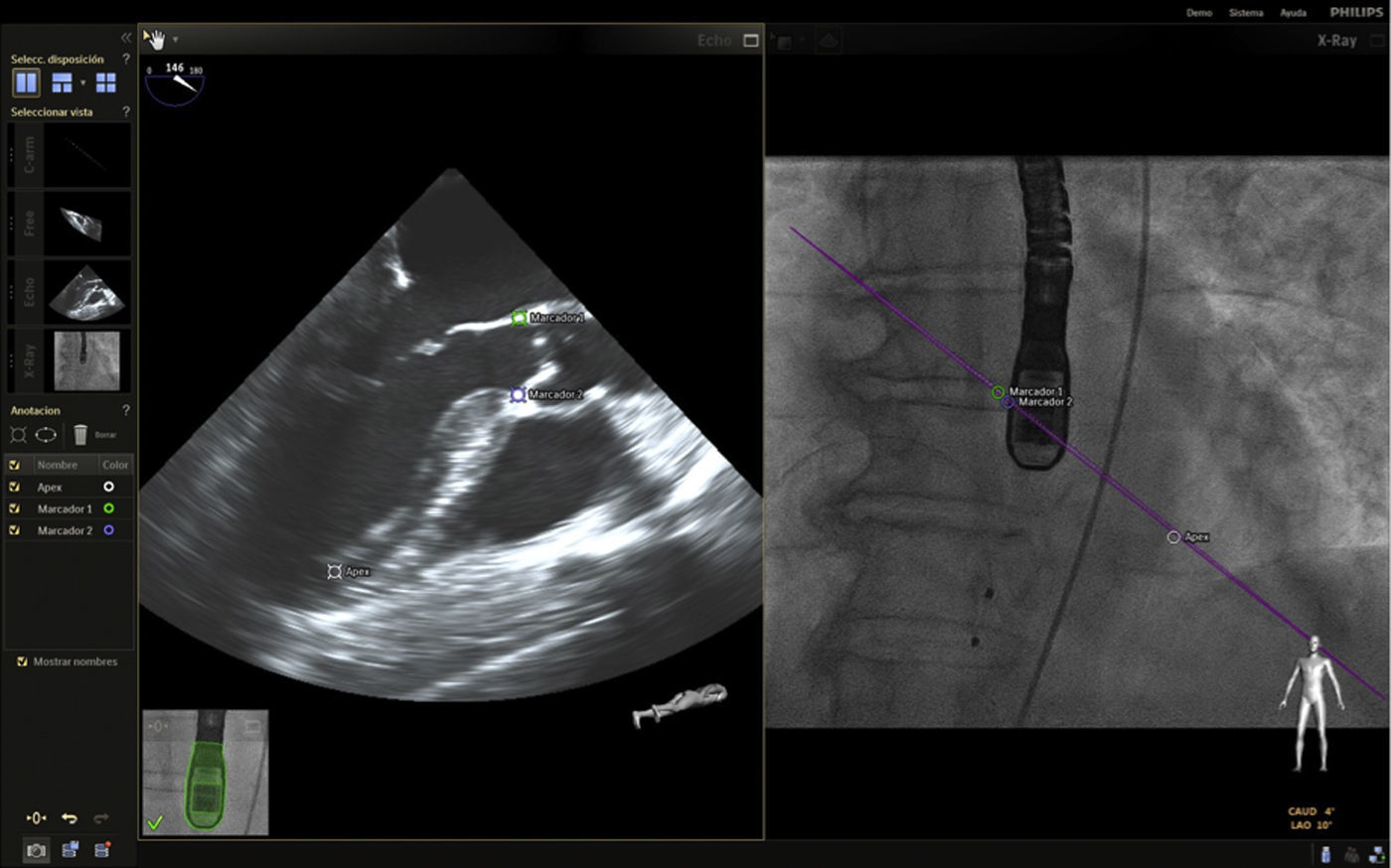
Con el advenimiento del intervencionismo estructural, una de las herramientas más importantes y que hacen de la fusión de imágenes un gran atractivo en la actualidad8, es la posibilidad de ubicar marcadores para identificar puntos o regiones de interés para el intervencionista y al mismo tiempo trasladar la información del ecocardiograma a la imagen de fluoroscopia.
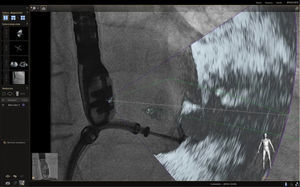
Las imágenes multiplanares en 3D ofrecen una localización precisa, razón por la cual es la modalidad más recomendada en la práctica actual. Una vez se realiza la marcación del sitio de interés este aparecerá en la imagen de fluoroscopia que permanecerá fija sin importar el movimiento de la sonda ni del gantry. No obstante, se debe tener precaución con los movimientos verticales (mesa) influyentes en la pérdida de los marcadores, lo cual llevaría a un reinicio del registro y posicionamiento de la sonda.
Con base en lo anterior es importante mencionar que existen tres posibles causas por las cuales se podría desajustar el registro: cuando la sonda lleva mucho tiempo sin ser registrada (fig. 5.) y debido a algún movimiento del brazo o la mesa se pierden todos los puntos de referencia marcados; otra es la naturaleza estática de los marcadores los cuales no responden a los movimientos traslacionales como la respiración, y por último, pequeños movimientos durante el procedimiento que causan desajustes.
Consideraciones en procedimientos de intervención estructural cardiacaDe acuerdo con las ventajas de la imagen de fusión dinámica Echonavigator® y la utilización de esta en múltiples procedimientos15,16, a continuación se presentan cada uno de los aspectos más importantes y el estado del arte actual, que podría variar en el transcurso de los años a medida que se emplee con mayor frecuencia.
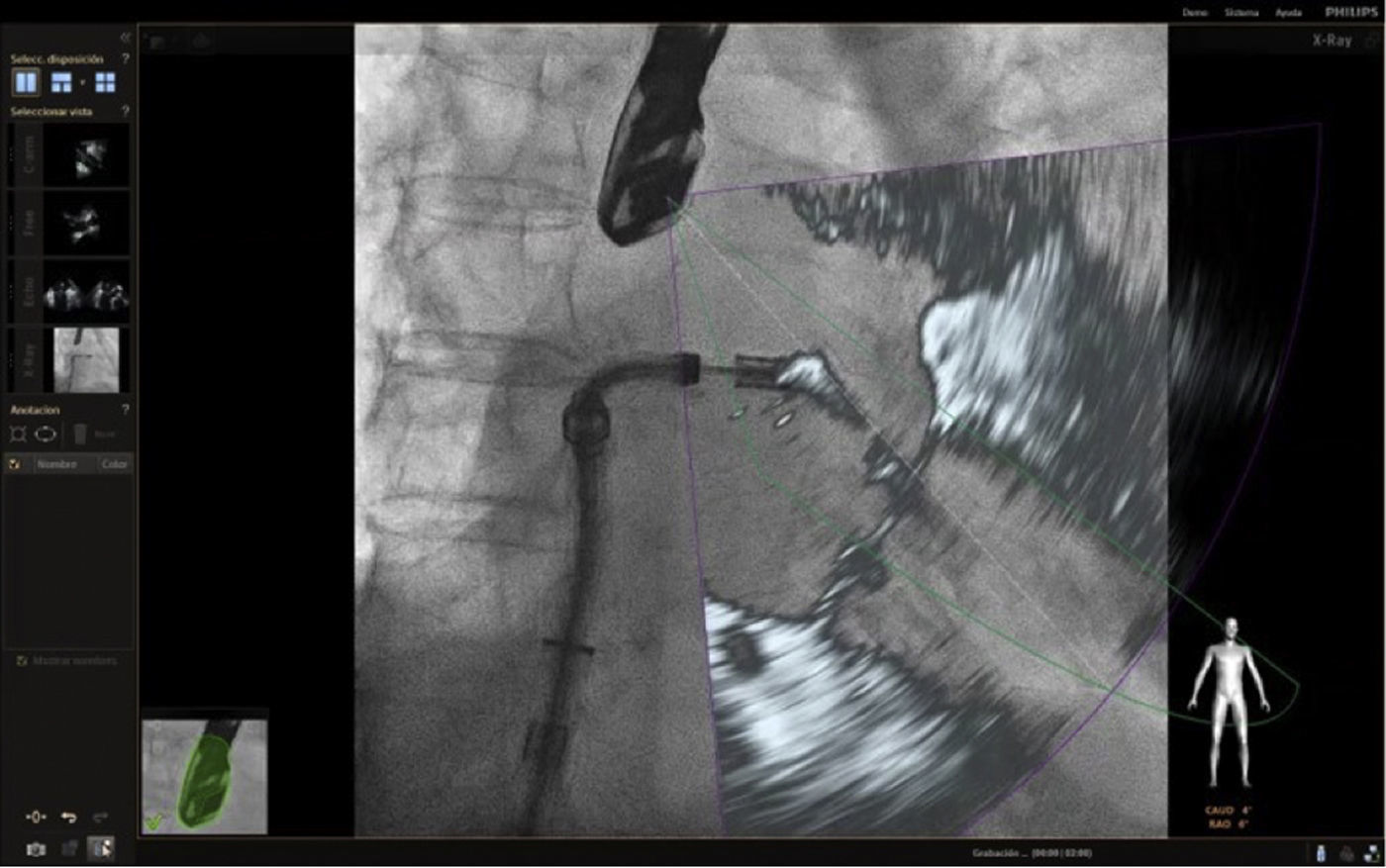
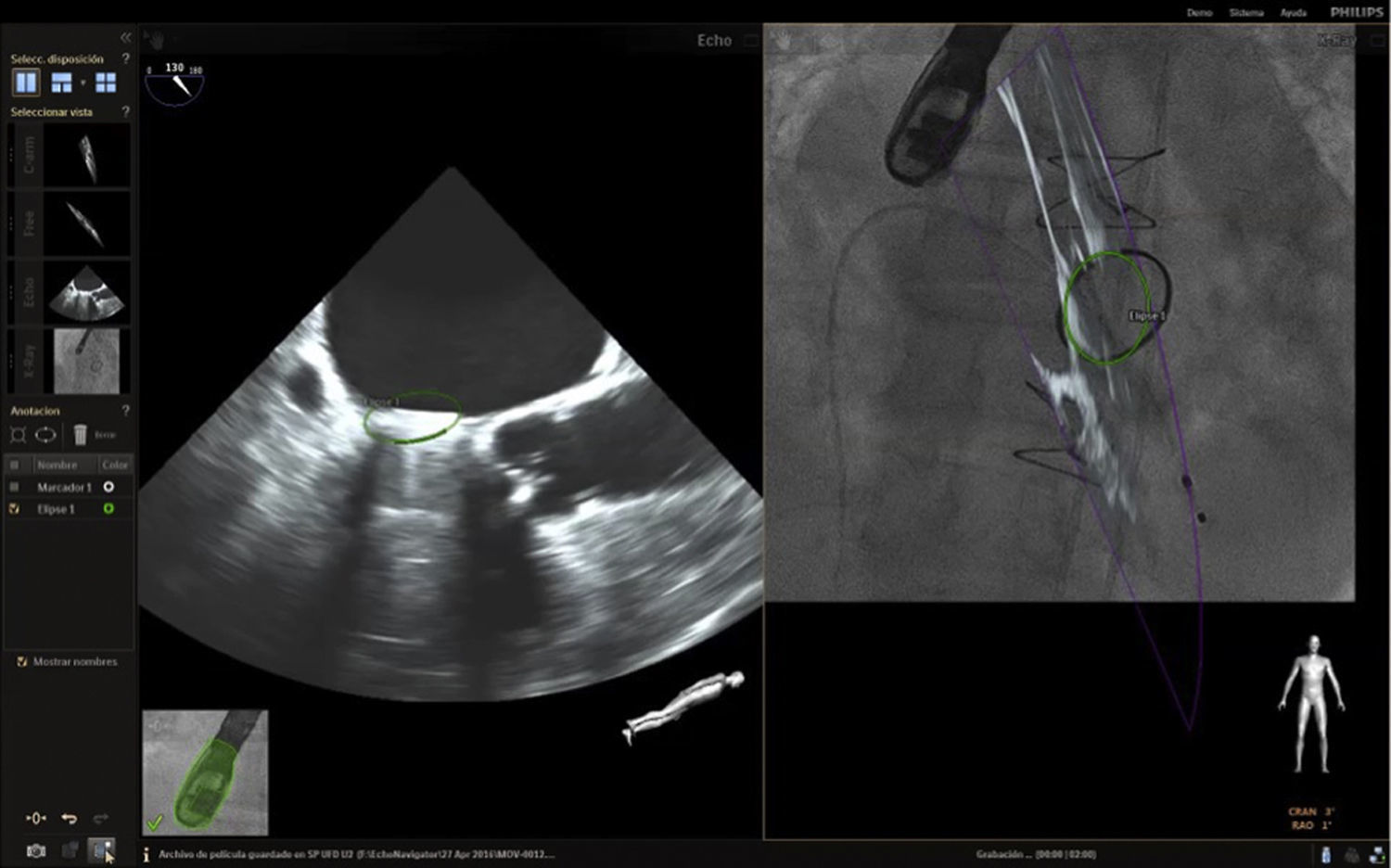
Punción transeptalEs el paso crítico primario en muchas de las intervenciones estructurales. Esta requiere una exactitud milimétrica para evitar complicaciones relacionadas por la proximidad a estructuras vitales8. Para esto se marca un punto de referencia en la imagen de fluoroscopia (fig. 6); de acuerdo con el procedimiento la punción puede ser inferoposterior (cierre de orejuela izquierda) o anterosuperior (4cm por encima del anillo mitral en caso de la implantación de Mitraclip).
Es viable emplear dos opciones de visualización; la vista bicava sobrepuesta en la fluoroscopia, que ofrece una opción rápida y segura en la punción del septo interatrial (figs. 7 y 8), o una imagen de cuatro cámaras a 0° para medir las distancias requeridas según el procedimiento; sin embargo, en el momento de la punción se debe incrementar el ángulo a 45° y activar la función multiplanar para seguimiento. La primera opción es más común y arroja buenos resultados de seguridad2. Recientemente, Afzal et al., evaluaron la seguridad y eficacia de la punción guiada por imagen de fusión e informaron que no hubo efectos adversos en el empleo de la técnica y el tiempo de realización fue significativamente menor en el grupo de fusión17.
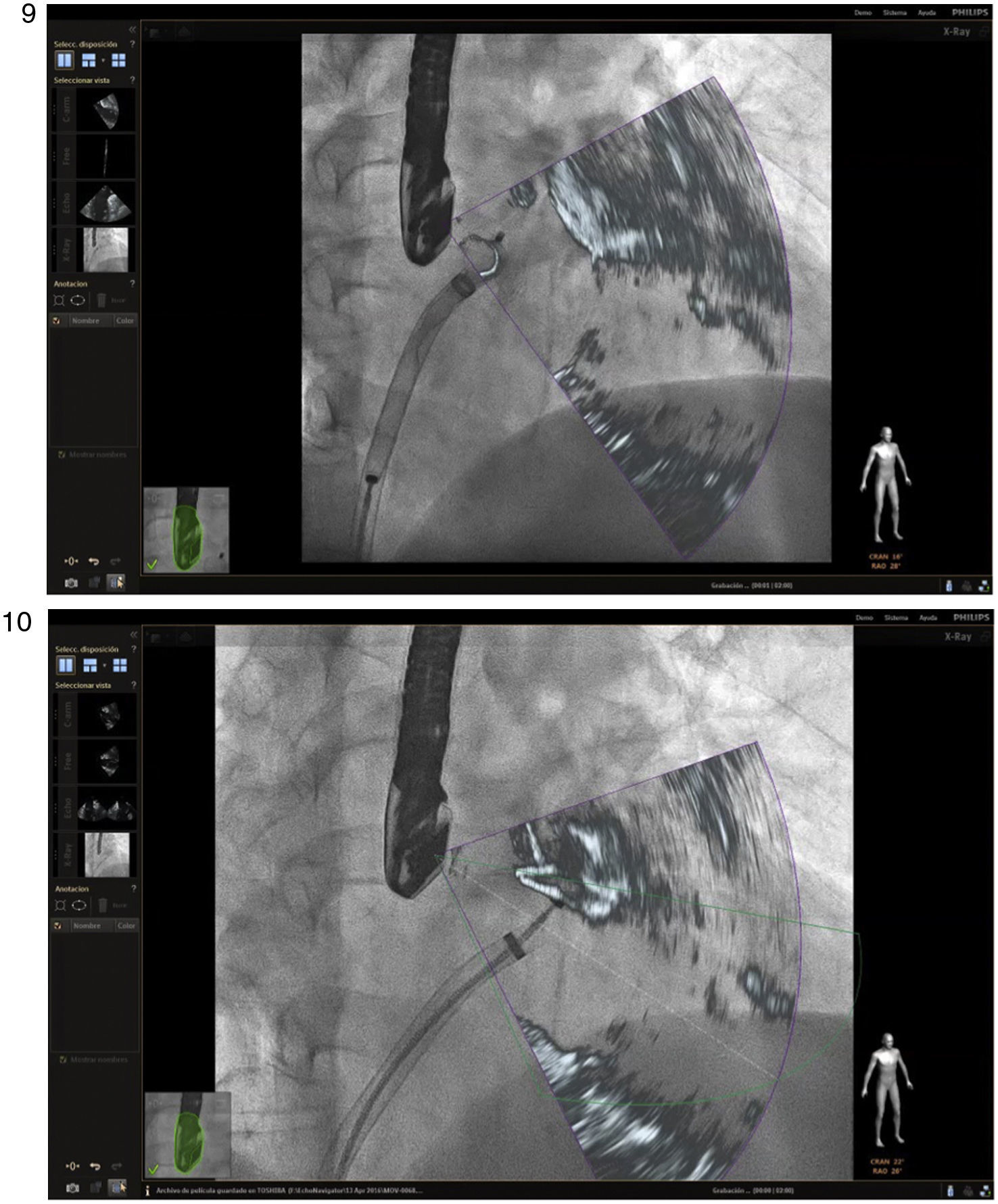
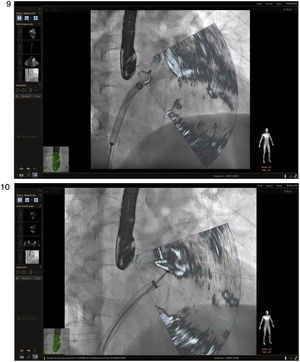
La intervención de cierre de la orejuela izquierda ha mostrado ser una alternativa efectiva a la anticoagulación oral18 y aunque en teoría el procedimiento se puede hacer sin asistencia de imagen, las múltiples ventajas con ecocardiografía transesofágica 3D han sido demostradas en estudios recientes19. Durante este procedimiento, inicialmente se aplica la técnica previa de ubicación de punto de referencia para punción transeptal teniendo en cuenta las potenciales complicaciones derivadas, como la perforación de la orejuela izquierda y la laceración de la arteria pulmonar, que pueden llevar a taponamiento pericárdico y descenlace mortal. La guía de canulación por 2D/3D en visión multiplanar se realiza entre 70° y 90°8 a través de la aurícula izquierda, que lleva al siguiente marcador que va dirigido a localizar el orificio de entrada de la orejuela izquierda, la arteria coronaria circunfleja y/o el orificio de la vena pulmonar superior izquierda, puntos de referencia y seguridad para la realización del procedimiento (figs. 9 y 10). Adicionalmente, ofrece una imagen dinámica para la orientación y posición correcta del dispositivo14,20. Jungen et al., evaluaron un grupo de 34 pacientes a quienes se les implantó un dispositivo mediante la imagen por fusión. Concluyeron que hubo una reducción de la dosis de radiación en un 48% y tiempo de fluoroscopia en un 33% respecto al procedimiento usual; como datos adicionales, la técnica no se vio afectada por aumento de complicaciones o tiempo de ejecución21,22.
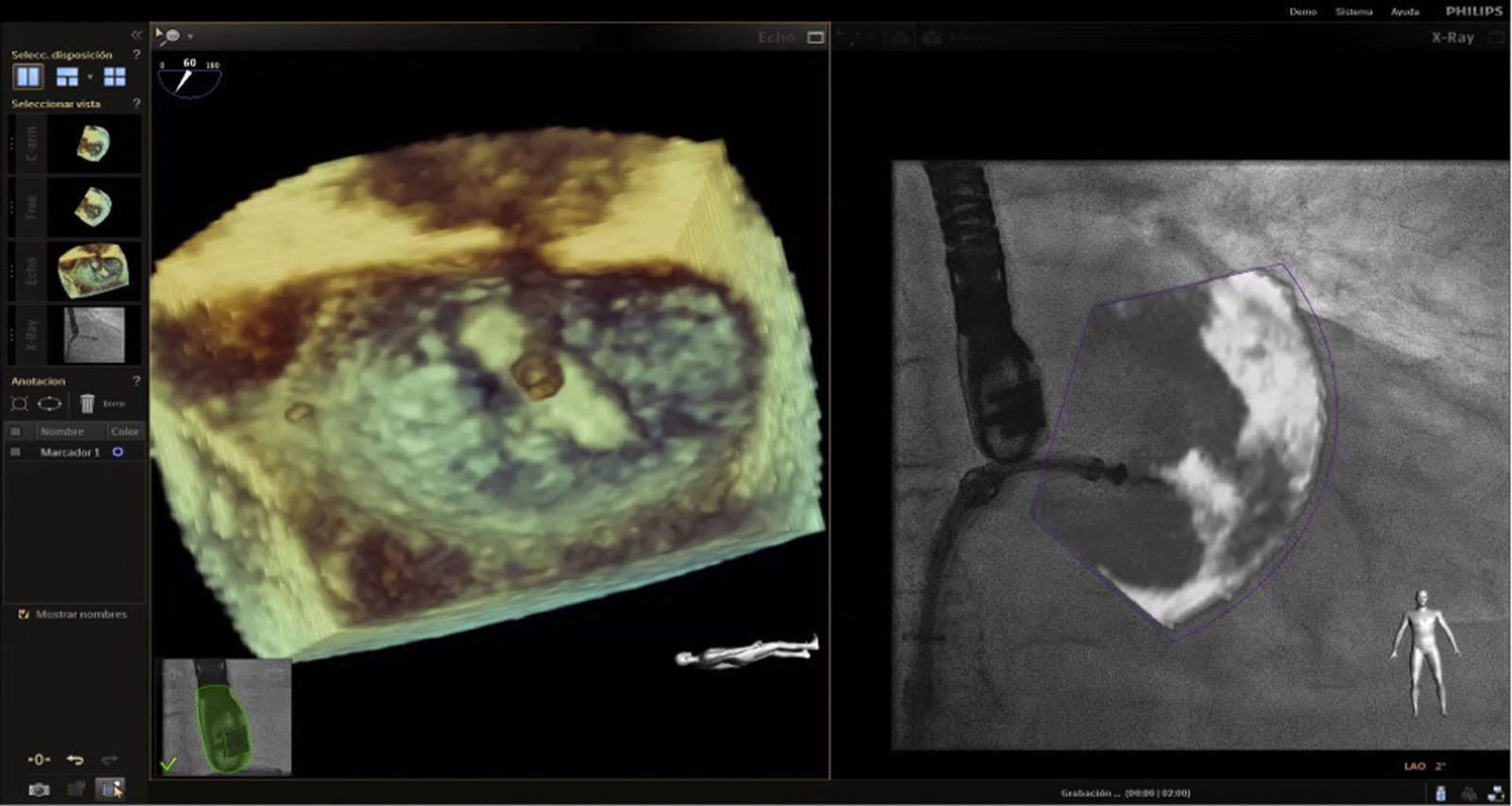
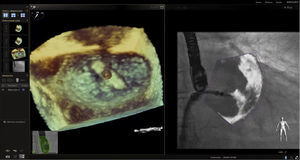
En la actualidad, la implantación de Mitraclip se acepta como una alternativa en el tratamiento de la insuficiencia mitral para pacientes con alto riesgo quirúrgico23. Los pasos críticos en el éxito del procedimiento son la punción transeptal y la colocación del Mitraclip. La ecocardiografía 2D/3D es la modalidad de elección durante el procedimiento. Previamente se mencionó la técnica empleada en la punción septal; en cuanto a su utilidad como guía (fig. 11), la fusión de imagen desempeña un papel fundamental en la trayectoria inicial del clip en la entrada a la aurícula y luego su orientación en el objetivo de alcanzar una posición ideal en la válvula mitral (figs. 12–15).
Imagen de fusión. Procedimiento de colocación del Mitraclip. A la izquierda se observa imagen de ecocardiograma 3D desde la aurícula posicionando Mitraclip, con leve giro antihorario respecto al eje de la comisura mitral. A la derecha, proximidad del dispositivo a la válvula mitral en tiempo real respecto a la imagen de la izquierda.
La designación de tres puntos de orientación (sitio de punción en el septum interatrial, ligamento de Marshall entre la vena pulmonar y la orejuela izquierda y centro de la válvula mitral), puede prevenir lesiones en la aurícula izquierda y un adecuado posicionamiento del clip. Sundermann et al., evaluaron 21 pacientes llevados a Mitraclip midiendo el tiempo de radiación y extensión de procedimiento. Concluyeron menor exposición a radiación y tiempo de procedimiento no menor al comparador24.
Cierre de leak perivalvularSe han propuesto múltiples técnicas como guía de procedimiento en los cierres de leaks perivalvulares25; sin embargo, el ecocardiograma 3D transesofágico ofrece resolución espacial excelente en la ubicación del defecto (o los defectos), que hace de esta la herramienta más útil en este tipo de procedimientos. Adicionalmente, sirve de apoyo en el paso de la guía a través del defecto y logra mostrar cualquier interacción entre la guía y la válvula, con lo cual pueden vigilarse los posibles daños a la misma. Cuando se añade la tecnología de fusión, se emplea la herramienta de marcadores en el sitio exacto de paso de la guía, en especial en defectos muy pequeños. Sin embargo, cuando se trata de leaks aórticos puede llegar a ser un poco más difícil teniendo en cuenta el movimiento traslacional de la raíz aórtica.
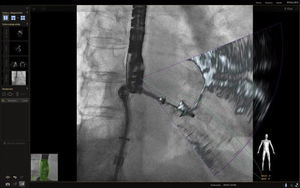
Reemplazo aórtico transcatéter (TAVR)En el implante transcatéter de la válvula aórtica es fundamental el conocimiento exacto de la anatomía de la raíz aórtica, los senos de Valsalva y el ostium de las arterias coronarias. Se ha recurrido en los últimos años a la fusión de imágenes de tomografía computarizada26, fluoroscopia (con el fin de obtener los puntos de referencia antes mencionados a lo largo de todo el procedimiento) (fig. 16) y seguimiento por ecocardiografía transesofágica 2D/3D (que puede ser limitado por la obstrucción parcial en el campo visual de la fluoroscopia).
Sin embargo; debe tenerse en cuenta que la imagen tomográfica es estática, tiene una compensación de movimiento insuficiente la cual es susceptible a errores por movimiento traslacionales del paciente, y puede inducir a errores. En este punto, la fusión en tiempo real de ecocardiografía y fluoroscopia da en todo momento la referencia de los puntos en bisagra de la válvula aórtica alineados, necesarios para una técnica precisa (fig. 17).
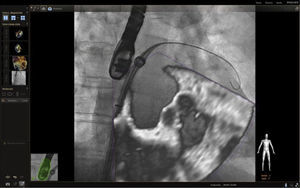
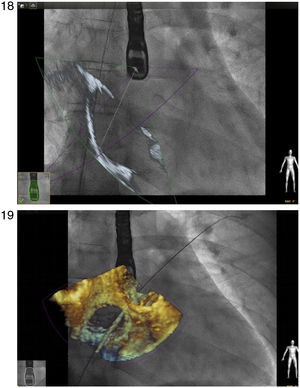
Comunicaciones interauricularesEl procedimiento de cierre de foramen ovale y defectos septales, ha sido guiado tradicionalmente mediante fluoroscopia y ecocardiograma transesofágico como guía de imagen. Más recientemente, Balzer et al.,27 validaron la eficacia y seguridad del uso de imagen en 3D dando mayor calidad de imagen y posicionamiento del catéter respecto a las estructuras subyacentes con menor exposición a radiación que en el procedimiento cotidiano. La experiencia inicial en nuestro grupo y en los grupos que están iniciando la técnica, muestra que ésta ofrece información adicional en los puntos de referencia para el paso de la guía, a la vez que brinda seguridad en el momento de la liberación del dispositivo, ya que hay un control constante del defecto (figs. 18 y 19).
Cardiopatías congénitasRecientemente Jone et al.28, evaluaron una población de pacientes con cardiopatías congénitas susceptibles de intervención percutánea abarcando en su mayoría población infantil (media edad 9 años) con patologías diversas que incluyeron cierre de defectos atriales, cierre de penetración de Fontan, cierre de defectos ventriculares, angioplastias etc, cuyos resultados fueron disminución de tiempo de fluoroscopia y dosis de radiación.
Experiencia actualEn el Servicio de Cardiología del Hospital Clínico San Carlos se han implantado TAVI, dispositivos Mitraclip y dispositivos de cierre de orejuela izquierda y se han llevado a cabo procedimientos de cierre de dehiscencias periprotésicas. Desde 2015 se emplea el Echonavigator® de forma rutinaria en todos estos procedimientos.
LimitacionesLas limitaciones actuales están basadas en la aparición reciente de la tecnología, de modo que los datos de estudios son pocos, aunque todos muestran resultados superiores en cuanto a seguridad, disminución de exposición a radiación y tiempo de realización del procedimiento respecto al procedimiento estándar14,28; otro factor importante es que solo se cuenta con un sistema comercialmente operativo en este momento. No obstante, a medida que su uso se expanda habrá mayor información disponible para corroborar estos datos iniciales.
Puede presentarse un error potencial en el registro en el momento en que el marcador se encuentra en la dirección del fluoroscopio, el cual se puede mitigar con un mejor posicionamiento de la imagen 3D.
Como es usual, en nuevas tecnologías la curva de aprendizaje es importante ya que manipular la imagen de la ecocardiografía y del sistema de función puede llegar a ser un reto para el especialista.
ConclusiónLa fusión de la ecocardiografía 2D/3D con fluoroscopia a través de un software especialmente diseñado (Echonavigator®), ofrece la posibilidad de realizar procedimientos de intervencionismo cardiaco de una forma más segura, rápida y con menor dosis de irradiación. Permite al cardiólogo intervencionista evaluar de forma precisa la intervención con anatomía tridimensional superpuesta en la imagen de fluoroscopia. Todos los procedimientos de intervencionismo cardiaco tienen el potencial de beneficiarse de esta tecnología, y tal vez sean de mayor utilidad en los casos más complejos y demandantes para el intervencionista. La mejor visualización tridimensional y en tiempo real de las relaciones anatómicas, acortará la curva de aprendizaje de los médicos en entrenamiento de intervencionismo estructural. La terapia cardiovascular con intervencionismo cardiaco seguirá presentado un crecimiento exponencial similar al que tuvo la cirugía cardiovascular en sus inicios. El número de pacientes con intervencionismo estructural será cada vez mayor. Hay un gran interés en ensayar nuevos dispositivos percutáneos para el tratamiento de todo tipo de insuficiencia y estenosis valvular. La variedad de nuevas válvulas biológicas para implantación percutánea, ha tenido un crecimiento vertiginoso en los últimos años. Todos estos avances terapéuticos requieren que los métodos de imágenes sean cada vez más ágiles, dinámicos, seguros y de mayor precisión estructural. El futuro de la imagen de fusión posiblemente radicará en desarrollar software de reconstrucción tridimensional con resolución temporal y espacial óptima además de adquisición estándar en un solo latido, en el cual la interferencia por arritmias o por artefactos de movimiento sea mínima o inexistente, o software con algoritmos que corrijan de forma inmediata los artefactos por movimiento o por desfase de los dos métodos de imagen. La imagen de fusión ya está en la arena clínica. Su utilidad está siendo evaluada y sustentada por los grupos de cardiología que la utilizan en su práctica rutinaria.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interésNinguno.