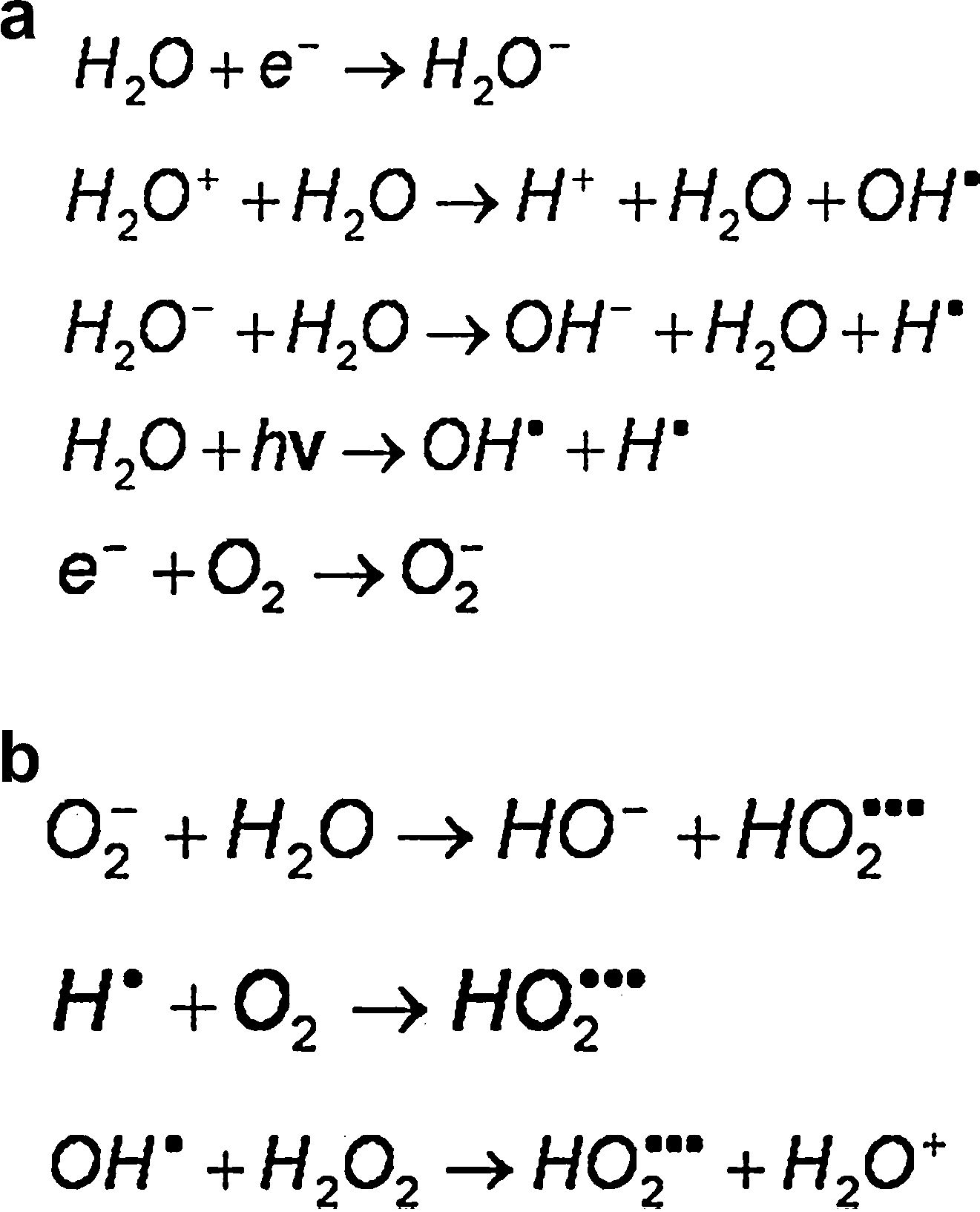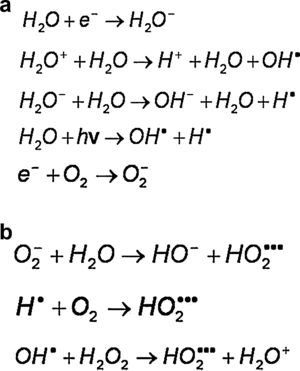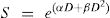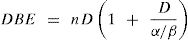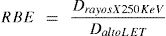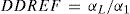Los seres vivos han interactuado desde el inicio de su evolución con las radiaciones ionizantes, las no ionizantes y los agentes químicos provenientes de fuentes naturales. Estas interacciones vienen incrementándose con la aparición de las fuentes artificiales que están siendo usadas en diferentes áreas de la actividad humana: industria, medicina, investigación y hogares. La importancia de conocer cuáles son los efectos biológicos producidos por estos agentes y si ellos son benéficos o no para la salud humana constituye en la actualidad una necesidad primordial. En términos generales con relación a cualquier tipo de radiación, al interactuar con las moléculas, estas ceden parte de su energía. El tipo de radiación y su energía pueden ser suficientes para extraer un electrón, proceso llamado ionización, o excitar un átomo constituyente pasando un electrón a un estado energético superior, o si la energía no es suficiente para transformar su configuración electrónica, puede aumentar la velocidad de translación, rotación o vibración de las moléculas. Como consecuencia, las moléculas constituyentes del material biológico pueden sufrir alteraciones que dan origen a diferentes lesiones. Así, se denominan radiolesiones aquellas que son producidas por las radiaciones ionizantes, y fotolesiones las que son producidas por radiaciones no ionizantes. Entre las lesiones inducidas por diferentes agentes físicos y químicos está la mutagénesis. Son considerados agentes mutagénicos las radiaciones ionizantes y el ultravioleta, como agentes físicos, y los alquilantes, los intercalantes y los productores de radicales libres, como agentes químicos.
En esta revisión se resumen los principales efectos producidos por las radiaciones ionizantes en el ámbito celular y se describe la inactivación celular a través de curvas de sobrevivencia. Posteriormente se hace una descripción de los principales efectos deterministas producidos por las radiaciones ionizantes, efectos que son generados a altas dosis y que, por tanto, son bien conocidos. Finalmente, se discuten los efectos probabilísticos, que son la base fundamental de la protección radiológica.
Since the beginning of time, humans have interacted with ionising, non-ionising radiations, as well as chemical agents from natural sources. These interactions have been increasing with the appearance of the artificial sources that are being used in the different areas of human activity: industry, medicine, research, and in homes. The importance of knowing about the biological effects produced by these agents, and whether or not they are beneficial for humans is essential these days. In general terms, as regards any type of radiation, these transfer part of their energy. The types of radiation and their energy can be sufficient to extract an electron; a process called ionisation, or excite a constituent atom an electron passing to a higher energy state. If this energy is not sufficient to transform its electron configuration, it can increase the speed of travel, rotation, or vibration of the molecules. As a result, the constituent molecules of the biological material can undergo changes that give rise to different lesions. Thus, those lesions produced by ionising radiation are called radiation lesions, and those that are produced by non-ionising radiation are called photo-lesion. Mutagenesis is one of the lesions induced by different physical and chemical agents. Ionising and ultraviolet radiation are considered as mutagenic agents, as physical agents, and the alkylating, intercalating agents, and free radical producers, as chemical agents.
In this review, a summary is presented on the main effects produced by ionising radiation as regards the cell, and cell inactivation is described using survival curves. Later, a description is provided on the deterministic effects produced by ionising radiation. These are generated at high doses, and thus are well-known. Finally, the probabilistic effects, which are the fundamental basis of radiation protection, are discussed.
Una rama especial de la biología es la radiobiología3,10,18, que estudia los efectos biológicos producidos por las radiaciones ionizantes y las relaciones entre los parámetros de la irradiación y la magnitud del efecto. Los efectos nocivos producidos por las radiaciones ionizantes se clasifican en somáticos y hereditarios; son somáticos si se manifiestan en el individuo expuesto y son hereditarios si se presentan en la descendencia del individuo irradiado. Ambos efectos se clasifican en estocásticos y determinísticos (no-estocásticos).
Los estocásticos son aquellos para los cuales la probabilidad del efecto es una función de la dosis y no su gravedad; además, no se conoce si tienen umbral. Los principales efectos estocásticos son los hereditarios y la carcinogénesis; este último es un efecto somático de importancia crítica para la protección radiológica.
Los efectos determinísticos son aquellos en los que la gravedad del efecto es una función de la dosis, y tienen umbral por debajo del cual estos efectos no se manifiestan; por ejemplo, los efectos agudos de la irradiación, la radiodermitis y sus secuelas, los efectos en órganos producidos secundariamente por irradiaciones vasculares, las cataratas en el cristalino. Se conoce este tipo de efecto por estudios realizados en lesiones agudas por irradiaciones en el individuo, como en los casos de Hiroshima y Nagasaki, accidentes con radiaciones, irradiación deliberada con fines terapéuticos y experimentos con animales. Algunos de los efectos determinísticos más importantes en los tejidos y órganos se deben a lesiones celulares y pérdida de capacidad reproductiva. El funcionamiento normal de los órganos y tejidos depende del grado de diferenciación de las células, las cuales dependen del sistema de renovación del cual hacen parte y que representa un equilibrio entre la formación, proliferación, diferenciación y muerte. Los sistemas de renovación rápida son, en general, los primeros en sufrir efectos determinísticos; así, la piel y los tejidos hematopoyéticos se consideran los más radiosensibles, mientras que las células del tejido nervioso y muscular son las más resistentes. Así mismo, el éxito de las radiaciones para el tratamiento de algunos tipos de cáncer está en que las células de estos tumores se reproducen muy rápidamente y, por tanto, son muy radiosensibles.
Los efectos biológicos de las radiaciones ionizantes son la consecuencia de un número de fenómenos desencadenados por el pasaje de radiación a través de un medio. Cada uno de los eventos interactivos entre la radiación y la materia involucra la transferencia de una cantidad de energía al medio; los eventos iniciales son ionizaciones y excitaciones de átomos y moléculas del medio a lo largo de las trayectorias de las partículas ionizantes. A partir del depósito de energía ocurren eventos fisicoquímicos, en particular la radiólisis del agua, que conducen a daños indirectos o convergen con daños directos en el volumen blanco. En resumen, un efecto biológico dado depende del tipo de partícula, de la energía de la radiación incidente, de la transferencia lineal de energía (LET, su sigla en inglés), la dosis y la distribución temporal de la dosis al medio biológico.
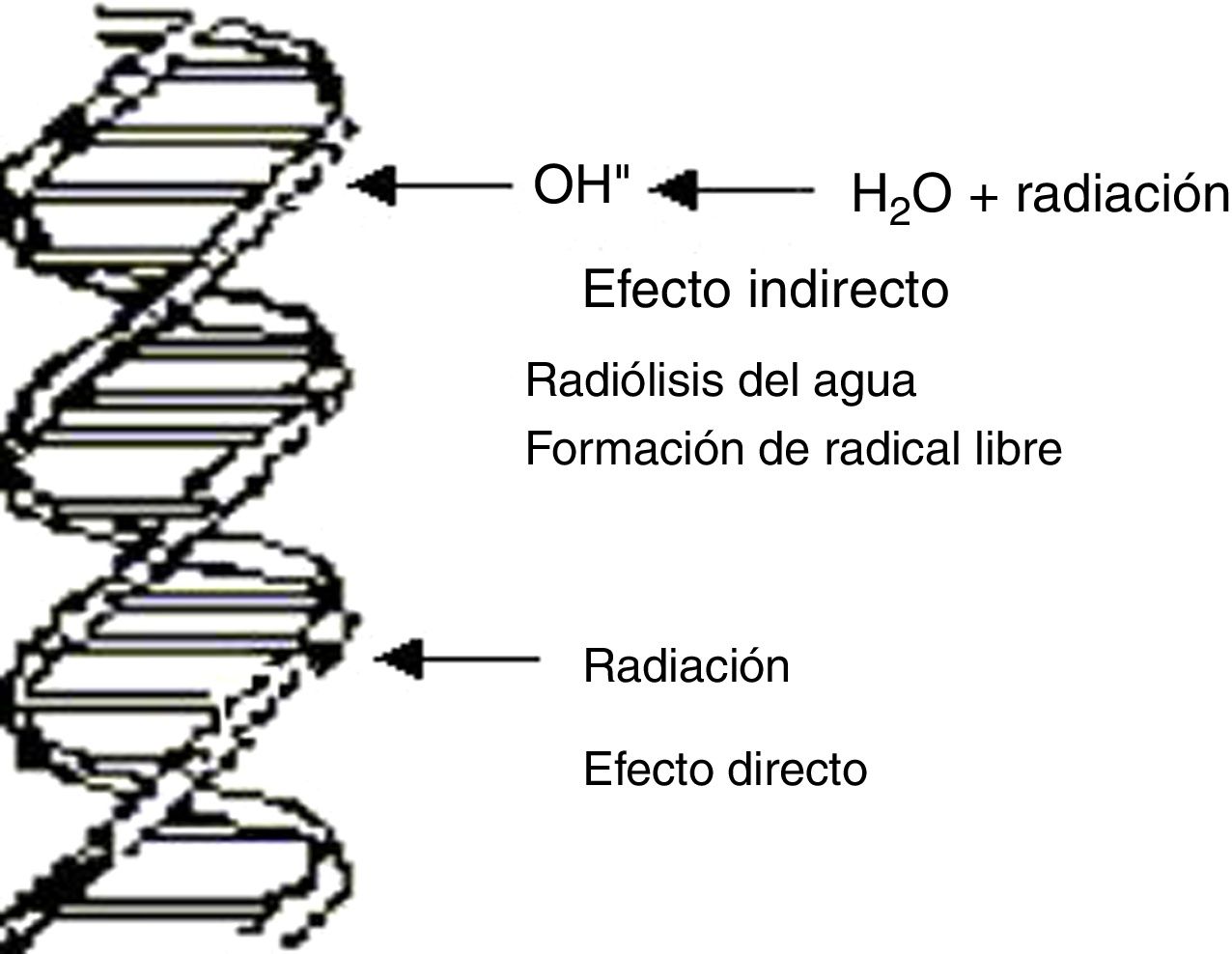
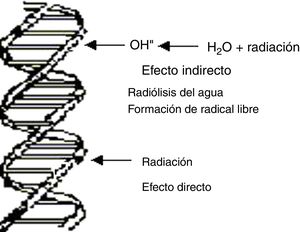
En términos genéricos, el principal blanco de las lesiones producidas por radiaciones ionizantes, no ionizantes y agentes químicos es la macromolécula del ADN1–3, pero no es el único, pues también lo pueden ser otras estructuras celulares, como la membrana plasmática, la mitocondria o cualquier otro organelo de la célula. De la integridad del ADN dependen las principales funciones celulares tales como control de los procesos metabólicos de la célula, replicación y preservación de la información genética. El ADN puede sufrir lesiones en forma directa o indirecta las cuales están esquematizadas en la figura 1. Las lesiones en el ADN pueden ocurrir directamente como consecuencia de la interacción de la radiación con la macromolécula o pueden surgir por efecto indirecto resultante de la interacción de la radiación con moléculas intermedias.
Las radiaciones ionizantes según su transferencia lineal de energía, son clasificadas en alto LET y bajo LET. Son de alto LET las partículas alfa, los protones, los neutrones y las partículas de carga múltiple, y de bajo LET las radiaciones X y gamma, y los electrones. El efecto directo es el principal proceso producido por partículas de alto LET, muy raro para radiaciones de bajo LET. En este proceso la radiación puede transferir su energía directamente al ADN y modificar su estructura. El efecto indirecto es el proceso más probable de las radiaciones de bajo LET en su interacción con la célula, como se verá más adelante.
Las lesiones en el ADN son restauradas por los mecanismos específicos de reparación y pueden impedir la síntesis de proteínas o la muerte de la célula por pérdida de la capacidad reproductiva, debido al bloqueo de la duplicación semiconservativa del ADN o a disturbios durante la mitosis en presencia de aberraciones cromosómicas. Las lesiones en el ADN pueden quedar restringidas a nivel molecular y ser reparadas, o dar origen a células mutadas. De acuerdo con la dosis, las lesiones en el ADN pueden generar un alto porcentaje de muerte celular y causar daño a los tejidos u órganos.
Efectos indirectos4La mayoría del daño causado por las radiaciones de bajo LET en la molécula del ADN se debe a efectos indirectos, principalmente por el proceso de radiólisis del agua, que genera productos altamente reactivos como radicales libres. En procesos experimentales se muestra que la molécula del ADN es más radiosensible cuando es irradiada en solución que cuando se realiza en un ambiente seco; en este último solo prevalece el efecto directo. Existen diferentes métodos para determinar el efecto indirecto: prueba de dilución, prueba de temperatura, adición de capturadores de radicales libres y el efecto oxígeno.
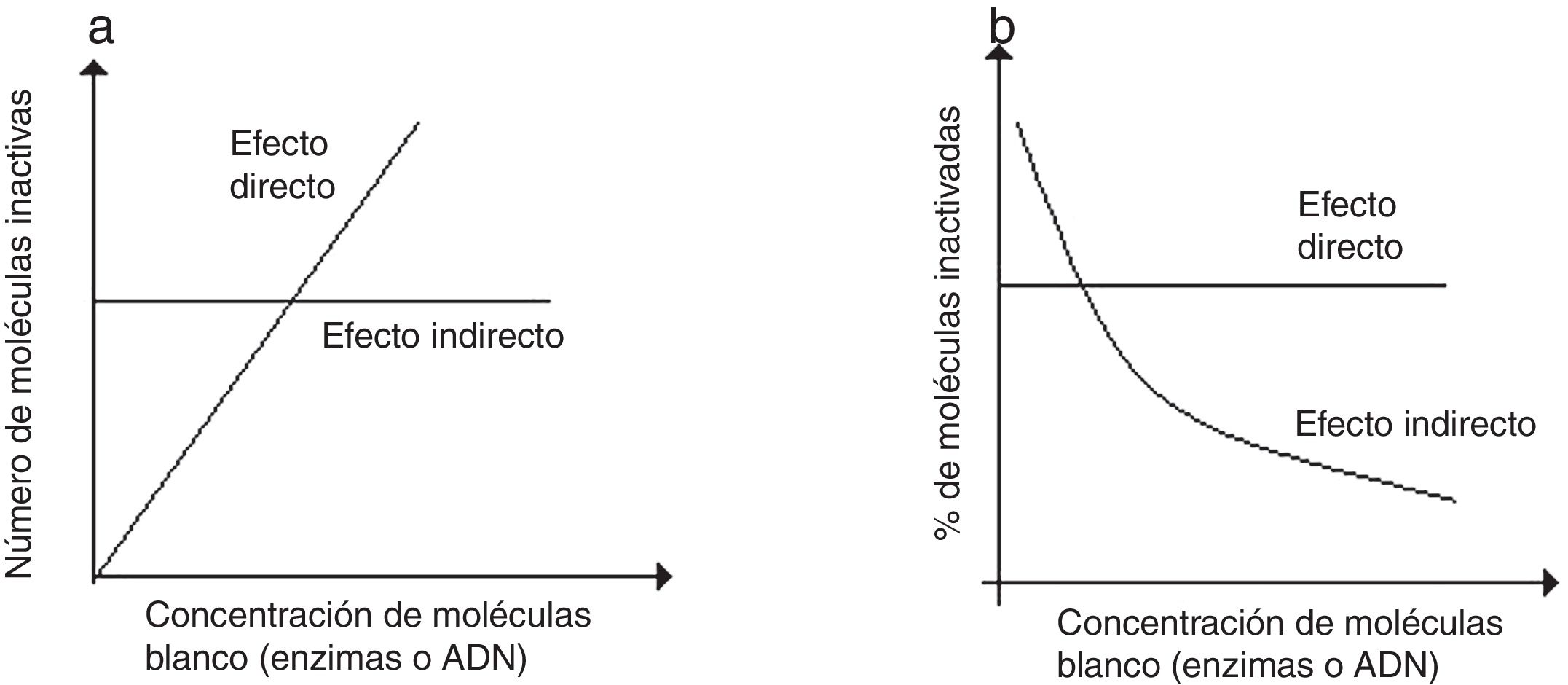
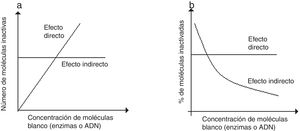
En la prueba de dilución se da una misma dosis a diferentes concentraciones de moléculas blanco (enzimas o ADN) y luego se determina el número de moléculas inactivas y su porcentaje. Si el efecto existente es exclusivamente directo, el número de moléculas inactivadas aumentará con la concentración, pero el porcentaje de moléculas inactivadas será siempre el mismo (fig. 2a y b). Si, por el contrario, el efecto es indirecto exclusivamente, el número de moléculas inactivadas será constante, pero el porcentaje disminuirá en la medida que aumenta la concentración. Otra prueba para diferenciar efectos directos e indirectos es la de temperatura, que consiste en irradiar preparaciones congeladas de las moléculas blanco, y disminuir así la movilidad de los radicales libres, reduciendo los efectos indirectos sin influir en los efectos directos.
La prueba para determinar efectos indirectos se puede mostrar a través del denominado efecto oxígeno, el cual consiste en irradiar preparaciones de enzimas o ADN en un medio como aire o en una atmósfera de oxígeno y comparar el resultado con las mismas dosis dadas a preparaciones similares en atmósfera de nitrógeno o gas inerte. Se muestra que las radiaciones de bajo LET son de 2,5 a 3,5 veces más efectivas en la producción de efectos indirectos en el ADN, cuando el ADN es irradiado en el aire o en atmósfera de oxígeno, que cuando es irradiado en atmósfera de nitrógeno. Este fenómeno se debe a que, en presencia de oxígeno, los radicales libres formados son más reactivos (oxidantes). En el caso de los neutrones la razón de sensibilidad por el oxígeno es del orden de 1,5 y para radiación alfa es aproximadamente 1.
Radiólisis del aguaConsiderando que los sistemas biológicos son acuosos, la absorción de energía a través de moléculas de agua puede producir moléculas de alta reactividad química; este es un mecanismo indirecto muy importante en la interacción de la radiación ionizante con la materia biológica. Un radical libre es un átomo o molécula que posee uno o más electrones no apareados, lo que le da la propiedad de tener una enorme reactividad química, de modo que puede robar electrones del medio y causar reacciones químicas en fracciones de milisegundos. El evento primario para la formación de un radical libre en la radiólisis del agua es la liberación de un electrón en la interacción de la radiación ionizante de bajo LET con la molécula del agua:
En un medio no oxigenado el electrón arrancado es capturado por otra molécula de agua, que queda cargada negativamente. Estos iones formados interactúan con otras moléculas de agua y generan una secuencia de reacciones, como las que se muestran en la figura 3a, que, como balance final de la radiólisis del agua, en ausencia de oxígeno producen un radical hidroxil. En un medio oxigenado el electrón liberado en la interacción puede ser capturado por el oxígeno y el O2− puede interactuar con el agua y producir radical peroxidante (figura 3b). Los radicales peroxidantes formados en presencia de oxígeno son tres veces más reactivos que los radicales hidroxil OH. Estos radicales pueden interactuar con las extremidades libres de las moléculas de ADN quebradas por la radiación impidiendo su reparación. El oxígeno desempeña un papel fundamental en la formación de diversos radicales libres. El oxígeno, por sí mismo, es un radical libre (oxidante).
a)Medio no oxigenado
b) Medio oxigenado
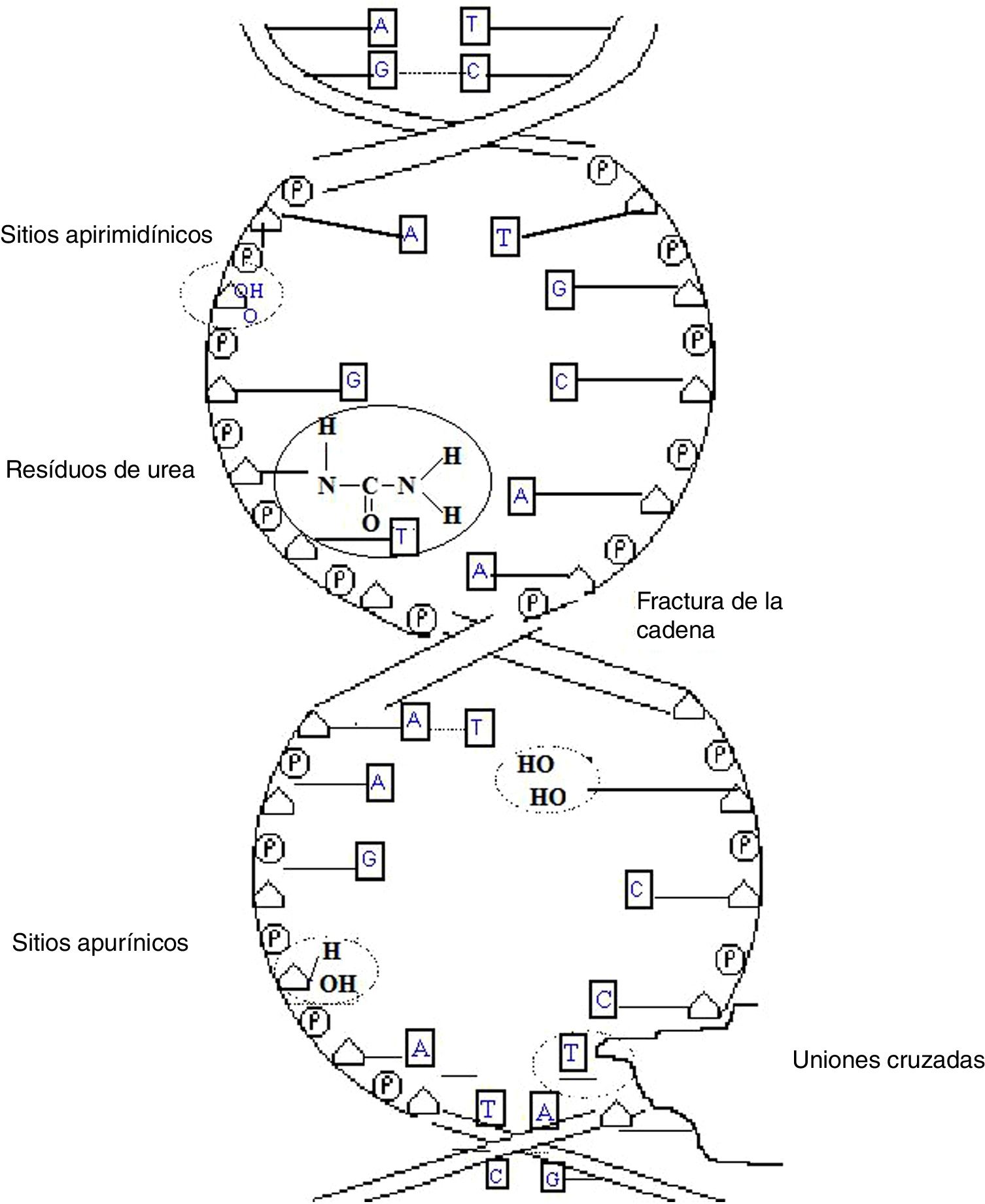
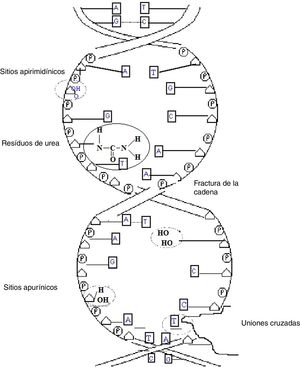
Daños causados por radiaciones ionizantesLos daños causados por las radiaciones ionizantes a moléculas de ADN dependen de factores, como tipo de radiación, condiciones de irradiación, características del ADN y capacidad de reparación. Los efectos de las radiaciones ionizantes en la molécula del ADN son fracturas simples y dobles de la cadena, alteraciones estructurales de las bases, eliminación de las bases generando sitios apurínicos y apirimidínicos (sitios AP), daños en el azúcar, uniones cruzadas entre ADN-ADN o entre ADN-proteína, y rompimiento de los puentes de hidrógeno. Las fracturas dobles resultan de dos fracturas simples en puntos diametralmente opuestos, o con desfase de hasta tres nucleótidos. Las fracturas dobles llevan a la fragmentación de la molécula y dan origen a las aberraciones cromosómicas estructurales; son, además, las principales responsables de los efectos mutagénicos y oncogénicos de las radiaciones ionizantes (fig. 4).
a) Fractura simple.
b) Fractura doble.
c) Ruptura de puentes de hidrógeno.
Cuanto mayor es el LET, mayor es la proporción de fracturas dobles. Las fracturas simples generalmente resultan de la fractura en la unión fosfodiéster (entre el azúcar y el fosfato) y constituyen la mayoría de los daños causados por las radiaciones ionizantes1,2,5. La alteración de la estructura química de las bases nitrogenadas se debe principalmente al ataque de radicales libres, que colocan productos de adición en las bases. Estas alteraciones producen mutaciones que cambian el contenido de la información: las enzimas de reparación pueden remover las bases lesionadas y generar sitios AP, o por depuración espontánea ocurre la formación de sitios AP por el ataque de radicales libres al azúcar o a las bases. Los sitios AP son una lesión en la información y pueden ser reparados o no. Cuando no son reparados pueden generar mutaciones durante la duplicación del ADN. Las uniones cruzadas (“cross-linking”) resultan probablemente del ataque de radicales libres al ADN, formando aglomeraciones moleculares. Pueden ocurrir entre ADN-proteínas o entre ADN-ADN. Las fracturas de puentes de hidrógeno también son consecuencia de las fracturas simples en el ADN (fig. 5).
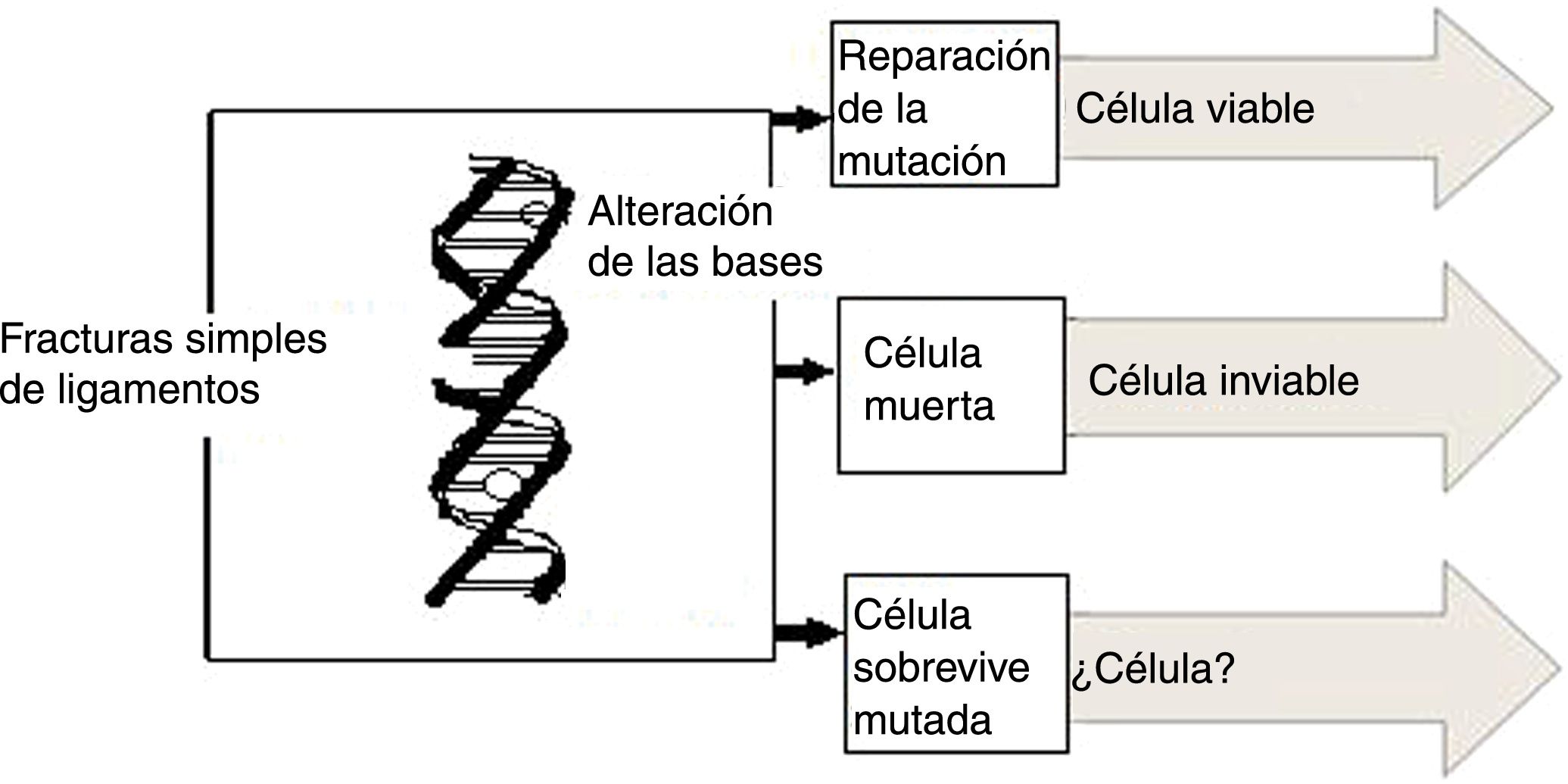
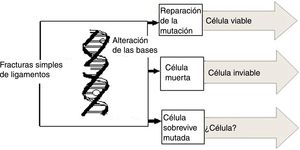
Es posible que, al interactuar con la molécula del ADN, la radiación rompa algunos de sus enlaces y en este caso la célula afectada no se reproduce. Si las células pertenecen al sistema de reproducción, la concepción no es posible. Otra posibilidad que se presenta entre la interacción de las radiaciones ionizantes y la molécula del ADN es que esta sufre como consecuencia algunas mutaciones, pero puede dividirse, lo que conduce a efectos, como desórdenes somáticos y aparición de carcinomas; en el caso de células reproductoras pueden transmitir taras genéticas a sus descendientes (fig. 6). El daño principal a la célula provocado por la radiación es el causado en el núcleo de la misma. Los cromosomas pueden romperse y afectar la capacidad de la célula para reproducirse conduciéndola a su muerte (el estudio de los daños a los cromosomas son el principio fundamental de la dosimetría citogenética)7,8.
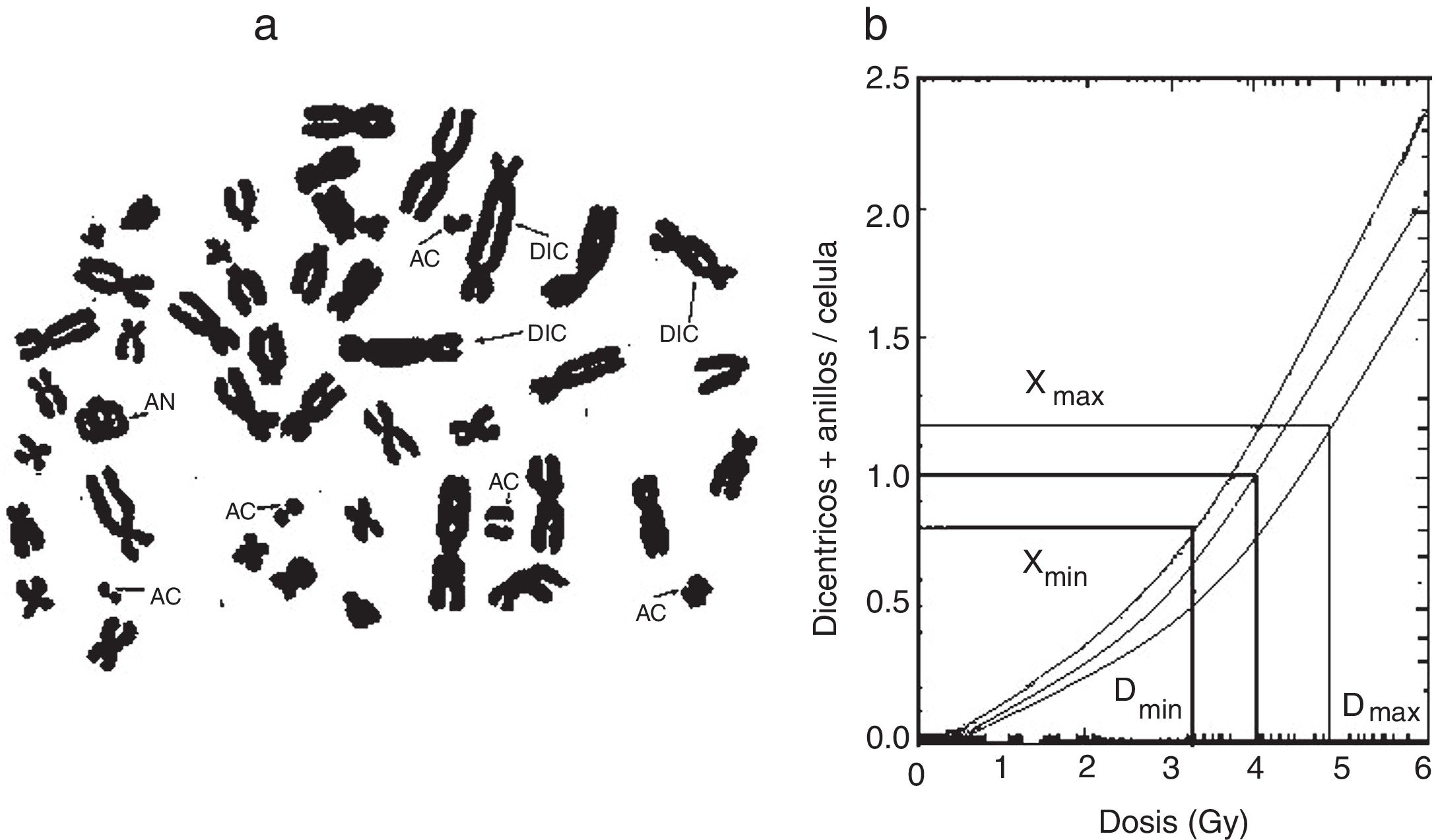
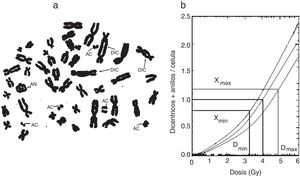
La figura 7 muestra los diferentes tipos de aberraciones cromosómicas y las curvas típicas de este tipo de dosimetría, que son de importancia en los accidentes radiológicos que incluyen una alta exposición. También se vienen utilizando las aberraciones cromosómicas como indicativo indirecto de los estudios de adaptación, lo cual, hasta el momento, no arroja ningún resultado concluyente.
a) Linfocitos en metafase con aberraciones cromosómicas radioinducidas (DIC=dicéntricos, AN=anillo céntrico, AC=acéntrico). b) Curva dosis-respuesta para la producción de aberraciones cromosómicas4,6.
En resumen, las lesiones radioinducidas en el ADN son diversas, como fracturas de la cadena, cambios en las bases, uniones cruzadas, y en algunos casos producen aberraciones cromosómicas. Como respuesta se da la reparación de bases dañadas, con escisión de bases o de nucleótidos, reparación de las fracturas simples o dobles mediante la escisión de bases, recombinación de cromosomas homólogos o uniones de extremos no homólogos. Los mecanismos de reparación varían y dependen de la predisposición genética a la radiosensibilidad o radiorresistencia, lo que explica también la diferencia de respuesta de las distintas poblaciones celulares.
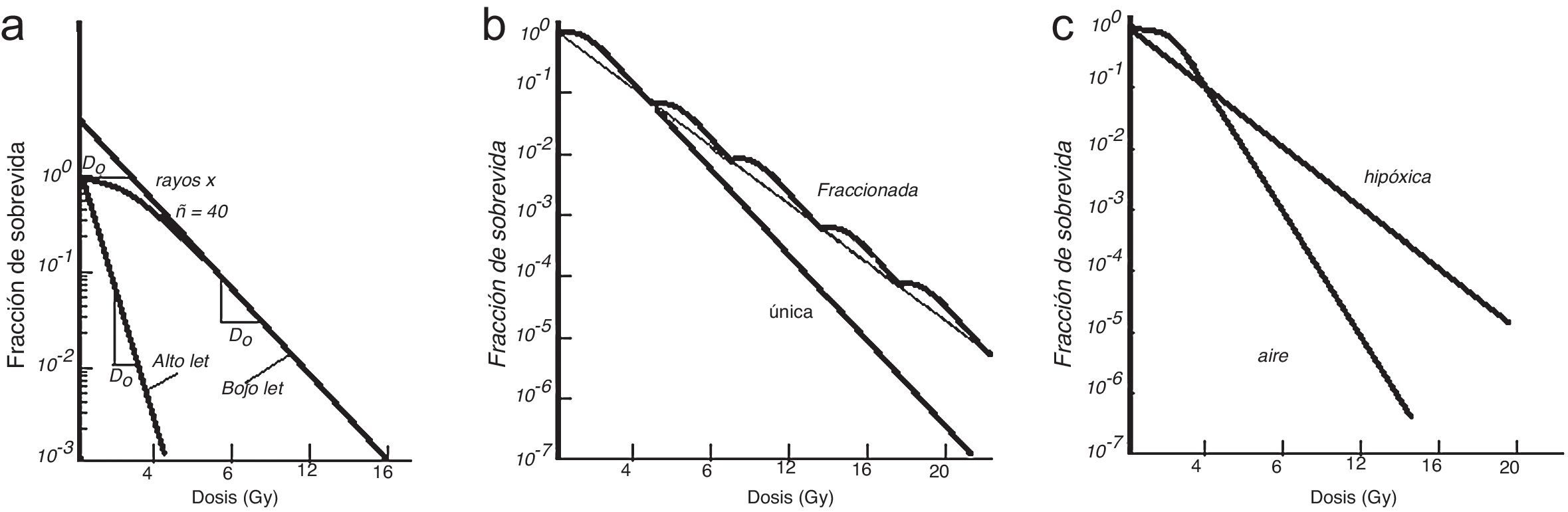
Curvas de sobrevivencia con radiaciones ionizantesLos experimentos con curvas de sobrevivencia son adecuados para examinar los efectos de las radiaciones de alto y bajo LET, altas y bajas tasas de dosis, así como de modificadores celulares (sensibilizadores e radioprotectores). Para radiaciones ionizantes normalmente se usan como radiaciones patrones, rayos x de 250KeV o 60Co. En su libro “Clinical Radiobiology”, Duncan y Nias dan ejemplo de curvas de sobrevivencia9. En la figura 8a se muestra el esquema de curvas de sobrevivencia de células para irradiación única y para radiaciones de bajo LET. En esta curva se puede notar el hombro inicial mostrando cierta resistencia a la radiación hasta una dosis denominada cuasidosis o dosis umbral, Dq, seguido de disminución exponencial caracterizándose por un Do, que es la dosis necesaria para reducir a un 37% la sobrevivencia. En la misma figura se muestra la dependencia con el tipo de radiación, en donde se verifica que las células son más radiosensibles a radiaciones de alto LET; no se presenta el hombro y su respuesta es directamente exponencial. Su representación se muestra en la ecuación 1.
Curva de sobrevivencia celular10.
En donde S es la fracción de sobrevida; D es la dosis; Do, dosis al 37%.
En la figura 8b se muestra la diferencia de respuesta celular si la dosis es única o fraccionada. En esta última forma, se puede ver que existe reparación celular, principio utilizado en la radioterapia clínica, en donde el intervalo de tiempo entre irradiaciones se hace suficientemente largo como para que haya una reparación de los daños subletales. Existen dos componentes del daño celular, el letal en donde se da la muerte directa y el subletal en donde, como se mencionó previamente, puede haber reparación del daño, y dado que la respuesta celular a la radiación ionizante depende de muchos factores, el tipo de partícula, el LET, la energía de la partícula, en el ciclo celular y la distribución de sus constituyentes, un modelo que representa mejor la sobrevida celular es el modelo lineal cuadrático, expresado en la ecuación 2.
En donde α y β representan las pendientes de la curva inicial y terminal de la curva, respectivamente, y cuyo cociente α/β determina la dosis a la cual la contribución lineal es igual a la cuadrática y permite determinar el número de fracciones que debe impartirse para obtener un determinado efecto biológico, lo cual es fundamental en los tratamientos de radioterapia.
Otros parámetros importantes en radiobiología son la dosis biológica efectiva (DBE)11, que depende de la fracción α/β y que es característica del tipo de tejido, del tipo radiación y de la dosis, y el número de fracciones en que se recibe la dosis y que se expresa como:
En DBE es la dosis necesaria para alcanzar el efecto deseado. Otro parámetro es el equivalente biológico relativo, obtenido de curvas de sobrevida celular, y que indica la relación de dosis de un tipo de radiación patrón (rayos – x de 250KeV o radiación debida al decaimiento del 60Co) y la dosis de otros tipos de radiación que producen la misma mortalidad celular y se expresa como:
La RBE cuantifica la influencia de la calidad de la radiación en los sistemas biológicos. Para propósitos de radioprotección, el RBE es considerado función de la calidad de la radiación, y se expresa como una función del LET. Este parámetro no solo depende del tipo de radiación, sino que es función de la dosis, la tasa de dosis, el fraccionamiento de la dosis y el individuo expuesto.
Otro de los efectos importantes que se pueden observar en la obtención de curvas de sobrevida celular es el denominado efecto oxígeno, en el que se muestra la diferencia de si la población celular ha sido irradiada en un medio oxigenado, como aire, o en un medio hipóxico, es decir, en ausencia de oxígeno. Se observa que en un medio hipóxico se requiere más dosis que en un medio oxigenado como el aire para obtener el mismo resultado del efecto biológico, como se esquematiza en la figura 8c y el efecto se cuantifica mediante el coeficiente denominado OER (del inglés oxygen enhancement ratio).
Efectos deletéreosComo se expresó antes, los efectos producidos por las radiaciones ionizantes pueden ser somáticos o hereditarios. Los somáticos se manifiestan en el individuo expuesto, mientras que los hereditarios se manifiestan en los descendientes del individuo irradiado. Los efectos somáticos se clasifican en determinísticos y estocásticos. Los determinísticos se caracterizan por que la gravedad del efecto es una función de la dosis y tienen un umbral por debajo del cual el efecto no se manifiesta. Los probabilísticos o estocásticos son aquellos cuya probabilidad del efecto se incrementa con la dosis y no tienen umbral; por ejemplo, todos los efectos hereditarios son estocásticos.
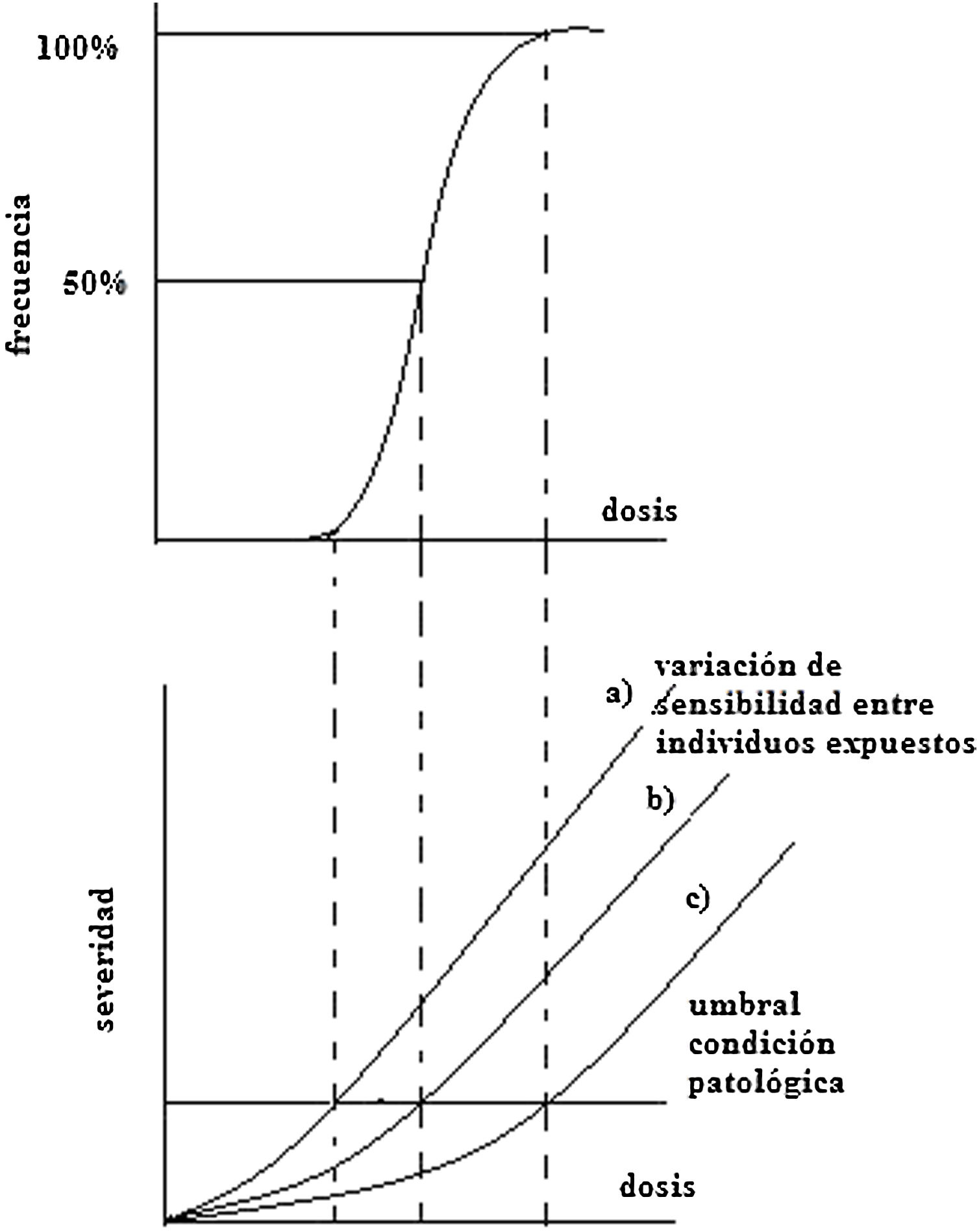
Efectos determinísticosAlgunos de los efectos determinísticos más importantes en los tejidos y órganos se deben a lesiones celulares y pérdida de capacidad reproductiva. El funcionamiento normal de los órganos y tejidos depende del grado de diferenciación de las células, que a su vez dependen del sistema de renovación del cual hacen parte y que representa un equilibrio entre la formación, proliferación, diferenciación y muerte. La frecuencia de un efecto determinístico particular, definido como una condición patológica clínicamente reconocible, se incrementa como una función de la dosis, presentando diferencias entre individuos irradiados según su sensibilidad, como se muestra en la figura 9, en la cual se esquematiza este tipo de respuesta3. El umbral implica que, para una dosis por debajo de este, la muerte celular ocurrida no es suficiente para causar un daño detectable en el órgano o tejido. En este sentido se puede inferir que los efectos determinísticos ocurren en dosis mayores que el umbral y su severidad se incrementa con el aumento de la dosis. A continuación, se muestran ejemplos de efectos determinísticos localizados:
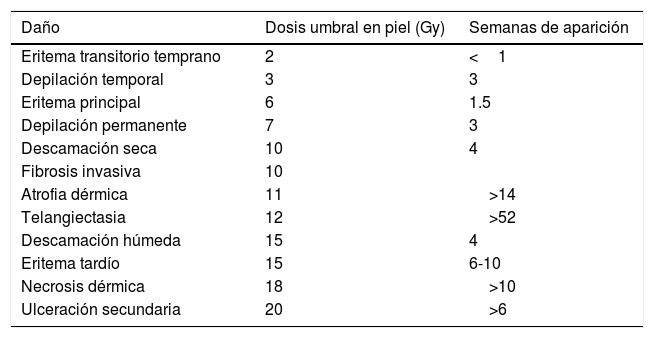
Irradiación de la piel12La mayor parte de la información se tiene de la radioterapia clínica. Los efectos por orden de gravedad son el eritema, la descamación seca, la descamación húmeda y la ulceración crónica, la cual presenta la misma severidad que las quemaduras comunes. En la relación dosis-respuesta, Do es de alrededor de unos 1.35Gy. La manifestación tardía de las lesiones en piel se debe a la lenta renovación de los elementos celulares e intercelulares de la dermis; entre los efectos tardíos se presentan la teleangiectasia, la fibrosis y el cáncer. Con dosis entre 3 a 5Gy aparece eritema y descamación seca, y en dosis por encima de 20Gy en piel se presenta descamación húmeda y ulceración. Los folículos pilosos son radiosensibles, lo cual provoca alopecia temporal a dosis moderadas de 3 a 5Gy, o alopecia permanente a dosis más elevadas, por encima de 7Gy. Con dosis por encima de 25Gy hay necrosis. La tabla 1 resume las reacciones de la piel y muestra el umbral para cada caso y las semanas de aparición. Esta información es fundamental en las aplicaciones clínicas de las radiaciones ionizantes, y son, por tanto, unas de las mayores preocupaciones la fluoroscopia, la angiografía, la tomografía y la digitalización en el diagnóstico con rayos x y el radiodiagnóstico pediátrico.
Reacciones de la piel
| Daño | Dosis umbral en piel (Gy) | Semanas de aparición |
|---|---|---|
| Eritema transitorio temprano | 2 | <1 |
| Depilación temporal | 3 | 3 |
| Eritema principal | 6 | 1.5 |
| Depilación permanente | 7 | 3 |
| Descamación seca | 10 | 4 |
| Fibrosis invasiva | 10 | |
| Atrofia dérmica | 11 | >14 |
| Telangiectasia | 12 | >52 |
| Descamación húmeda | 15 | 4 |
| Eritema tardío | 15 | 6-10 |
| Necrosis dérmica | 18 | >10 |
| Ulceración secundaria | 20 | >6 |
Los daños más graves por irradiación abdominal se registran en el revestimiento epitelial del intestino delgado. Dosis mayores de 15 a 20Gy en abdomen son letales. Tras una dosis menor que este rango la regeneración es rápida y vuelve a su estado normal en 21 días.
Irradiación gonadalExiste información detallada sobre la radiosensibilidad y cinética celular en el testículo para dosis entre 0,08 y 6Gy. Se presenta desde disminución de espermatogonios, hasta disminución de espermatozoos. Luego de una dosis de 6Gy solo aparecen células espermáticas después de 17 meses y su recuperación ocurre hasta los 5 años posteriores. En ovarios, tras una dosis única de 2-6Gy se produce esterilidad temporal. En la medida que la mujer avanza en edad es más susceptible y el umbral para esterilidad permanente disminuye con los años.
Irradiación de la cabezaLa irradiación intensiva de la cabeza causa la muerte al cabo de minutos u horas. La aparición de los síntomas y el periodo de sobrevivencia depende de la dosis, la calidad de la radiación y la intensidad de la irradiación. De 50 a 1.000Gy ocurre lesión del sistema nervioso central y muerte al cabo de 1 a 2 semanas. De 20 a 50Gy hay necrosis cerebral grave, y la muerte sobreviene a los meses o años; el umbral está en 20Gy. De 15 a 20Gy la muerte se presenta a los 14 días, pero si en la región irradiada se encuentra la orofaringe se sugiere la alimentación artificial para que la ulceración de la mucosa desaparezca, lo cual requiere de tres semanas. Con dosis menores a 15Gy hay disminución de la función hipofisiaria, se tiene un nivel bajo de somatotrofina y se llega a los valores normales al cabo de 6 meses a 12 meses; además, aparecen cataratas en el cristalino.
Efectos ocularesDe los tejidos del ojo humano el cristalino es el más sensible a la radiación. Hay dos tipos de efectos básicos: la opacidad, que es la consecuencia del daño sobre las células del epitelio anterior del cristalino, y la producción de cataratas. Con dosis únicas de 0,5 a 2Gy se producen opacidades y con 5Gy en adelante se producen cataratas graves.
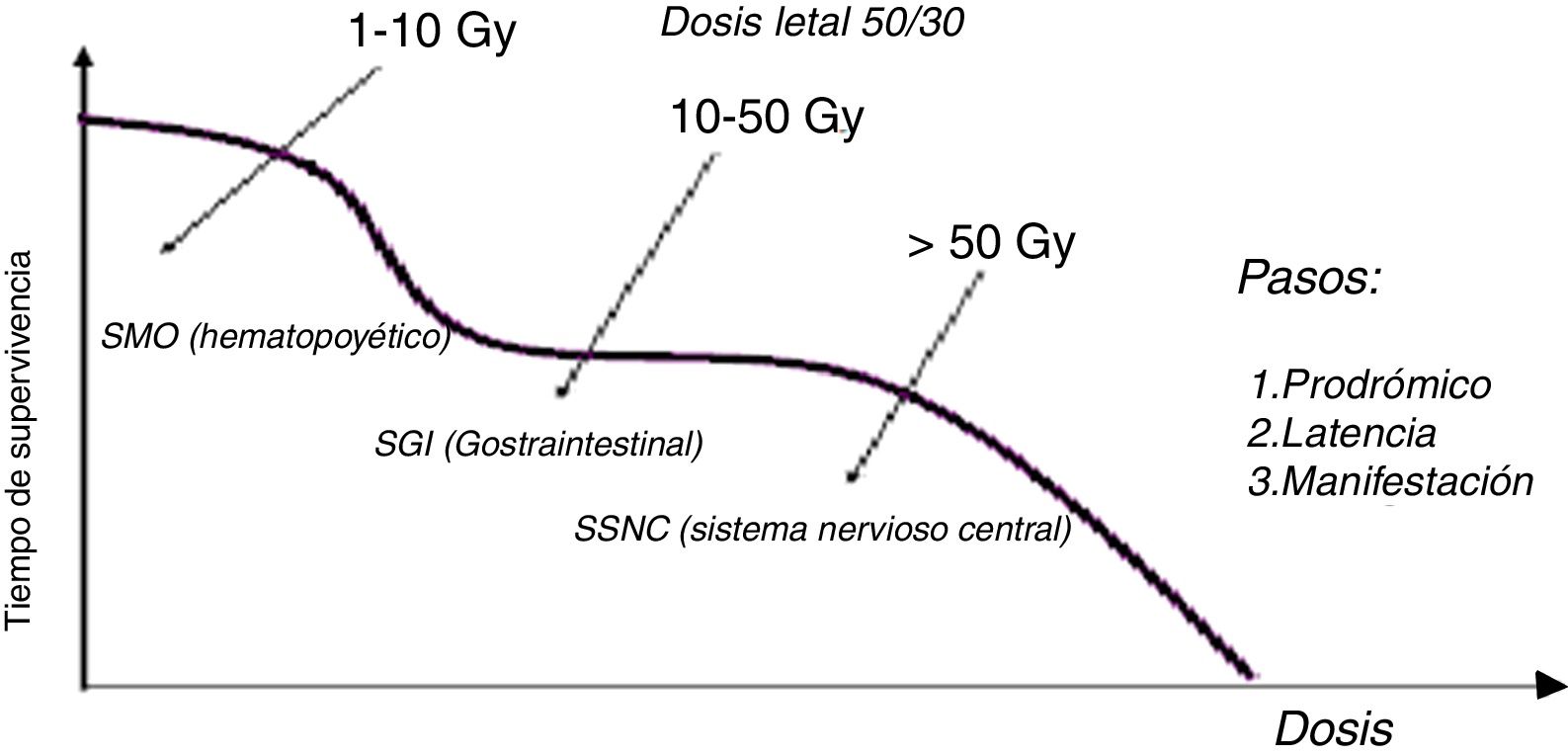
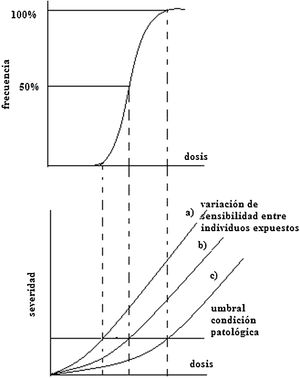
Síndrome de irradiación aguda por sobreexposición de todo el cuerpoConsiste en la respuesta de todo el organismo a la irradiación tras una sobreexposición de todo el cuerpo, y se manifiesta de acuerdo con la dosis en: síndrome de médula ósea (hemopoyético) entre 1 y 10Gy, síndrome gastrointestinal de 10 a 50Gy y síndrome del sistema nervioso central mayor a 50Gy. En todos los casos se presentan cuatro etapas: prodrómica, cuyos síntomas son náuseas, vómito, diarreas, cefaleas, vértigo, taquicardia, irritabilidad e insomnio, y puede durar de minutos hasta días; latente, durante el cual hay ausencia de síntomas y puede durar de horas hasta semanas; crítica, hay enfermedad manifiesta; y finalmente de recuperación o muerte. Los síntomas se manifiestan en función del sistema lesionado. Se denomina la dosis letal 50 / 30 a la “dosis que causaría la muerte al 50% de la población en 30 días” y su valor es alrededor de 2-3Gy para humanos en irradiación del cuerpo entero.
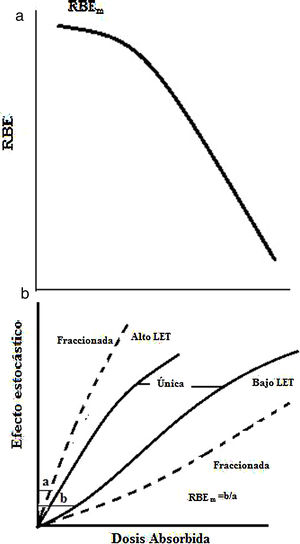
Síndrome de médula óseaCon una dosis mayor a 10Gy la muerte sobreviene al cabo de horas o días; no hay terapia adecuada. Con dosis menor a 1Gy el síndrome de la médula ósea, aun siendo letal, es susceptible de tratamiento.
La etapa prodrómica se manifiesta con náuseas, vómito y diarreas; la latencia se da entre días y tres semanas y luego se presenta pancitopenia, la cual ocurre por disminución de los tres tipos de células sanguíneas: anemia (disminución de glóbulos rojos), leucopenia (disminución de glóbulos blancos) y trombocitopenia (disminución de plaquetas).
Síndrome gastrointestinalSe requieren 10 a 50Gy, y ocurren lesiones irreversibles en dos sistemas: mucosa intestinal y médula ósea. Los síntomas en la etapa prodómica incluyen pérdida de apetito, náuseas, vómito y diarrea; mejora el estado a los dos o tres días (etapa de latencia), luego reaparecen las náuseas, el vómito y la diarrea, y la muerte ocurre a las dos semanas.
Síndrome cerebral del sistema nervioso centralTras una dosis entre 50 a 100Gy en todo el cuerpo, la lesión del sistema nervioso central se presenta con una etapa podrómica a través de síntomas como cefalalgia, fiebre e hipotensión, náuseas, vómito y diarrea. Al cabo de 30 minutos, aparecen síntomas psíquicos, como confusión e irratibilidad, y neurológicos con disminución de la conciencia. La latencia solo se presenta por pocas horas; luego aparecen convulsiones y coma progresivo. La muerte al cabo de uno a dos días. Si la región cefálica está protegida la muerte se debe principalmente a síntomas cardiovasculares y a lesiones intestinales (Figura 10).
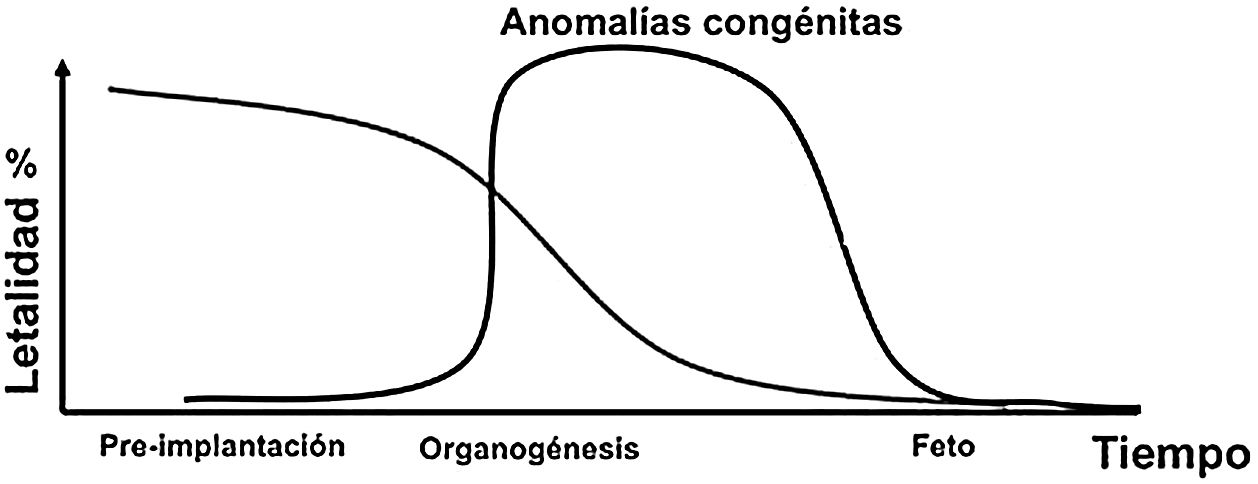
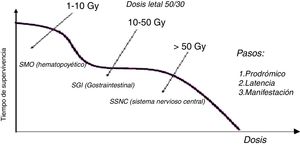
Efectos de la exposición prenatalA medida que aumenta el tiempo posconcepción la radiosensibilidad decrece. No es fácil establecer una relación causa-efecto porque hay muchos agentes teratogénicos; por tanto, los efectos son inespecíficos y no únicos de la radiación. Con relación a las radiaciones ionizantes, hay tres tipos de efectos: letalidad, anomalías congénitas (Figura 11) y efectos muy tardíos (cáncer y efectos hereditarios).
Un dosis fetal de 100 mGy puede disminuir el coeficiente intelectual. Las malformaciones tienen un umbral entre 100 y 200 mGy o mayores y típicamente se asocian con problemas en el sistema nervioso central. La dosis fetal de 100 mGy no es alcanzable con 3 tomografías pélvicas o 20 exámenes de rayos-x convencional. Este nivel es alcanzable con procedimientos de fluoroscopia intervencionista de pelvis o con radioterapia. Los riesgos de la exposición prenatal relacionados con el retraso mental son los siguientes: entre las semanas 8-15 el retraso mental grave se presenta con un factor de riesgo de 0,4/Sv, dado que el sistema nervioso central es particularmente radiosensible y de la semana 15 a la 25 el retraso mental grave se da con un factor de riesgo de 0,1/Sv.
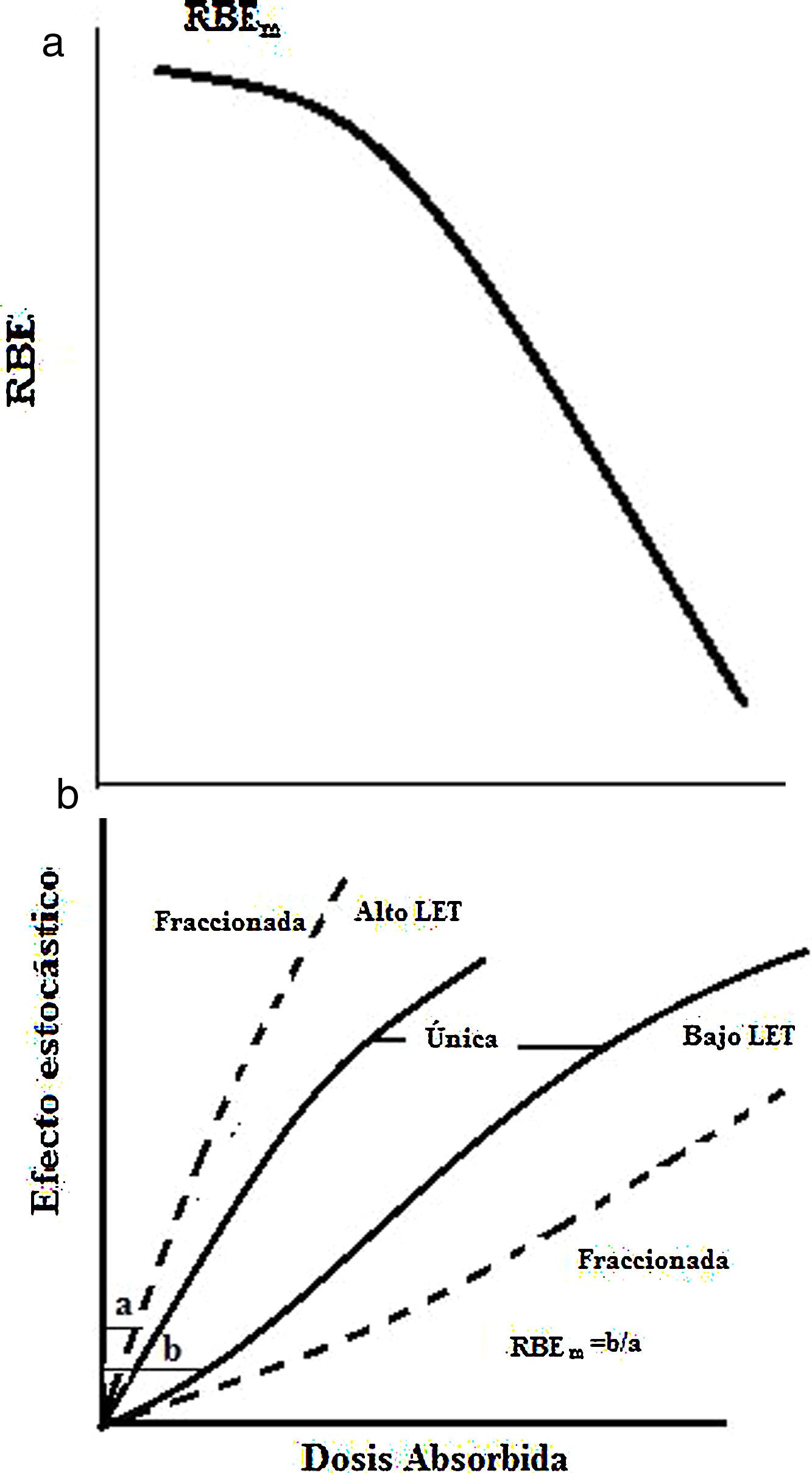
Efectos estocásticosLos efectos estocásticos ocurren tras exposiciones a dosis moderadas o bajas; la probabilidad de aparición de estos efectos aumenta con la dosis, pero a diferencia de los efectos determinísticos, no es su gravedad la que aumenta con la dosis. Los efectos estocásticos no tienen umbral y son consecuencia del daño subletal en una o varias células. Estos efectos pueden ser somáticos o hereditarios. El efecto estocástico somático es el cáncer y depende del tipo de célula irradiada, el mecanismo del carcinógeno que lo induce y el tipo de cáncer que se origine. El conocimiento de estos efectos resulta de los estudios epidemiológicos realizados en poblaciones expuestas, como sobrevivientes de las bombas atómicas, accidentes nucleares y radiológicos, tratamientos médicos o exposición a radiación natural. Para radiaciones de alto LET los efectos determinísticos son similares que los de bajo LET pero la severidad y frecuencia son mayores, por lo que el RBE(D) aumenta con el decrecimiento de D hasta un valor máximo de RBEm para una radiación y un tejido dados; sin embargo, el valor de RBEm(determinísticos) es menor que RBEM(estocásticos) (Figura 12a) y para la muerte celular el RBE es de 2 a 3 veces (Figura 12b). Las mutaciones pueden ser de dos tipos: en células somáticas, que afectan el propio individuo irradiado, y en células germinales, que pueden afectar a la descendencia del individuo expuesto. Las mutaciones se clasifican en tres grupos: mutaciones puntuales (alteraciones en la secuencia del ADN), aberraciones cromosómicas estructurales (quiebra de los cromosomas), aberraciones cromosómicas numéricas (aumento o disminución del número de cromosomas). La mayoría de las transformaciones neoplásicas no progresa a cáncer, lo que se atribuye a que casi todas las células modificadas mueren después de unas pocas divisiones celulares, algunas células se diferencian y paran de dividirse, la secuencia de eventos de promoción y progreso puede no ocurrir en el ambiente de la célula y los mecanismos de defensa del hospedero impiden el desarrollo celular. La probabilidad de una carcinogénesis depende del número de clones modificado inicialmente, de la malignidad que es función de la dosis y de la severidad de un cáncer dado, que está influenciada por su tipo de localización y no por la dosis. El periodo de latencia es de varios años.
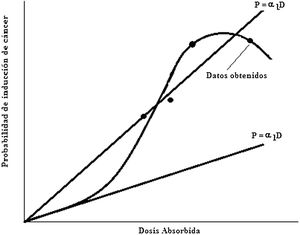
Forma de curvas dosis-respuesta para radiaciones de alto y bajo LET. en la inducción de cáncer3,13
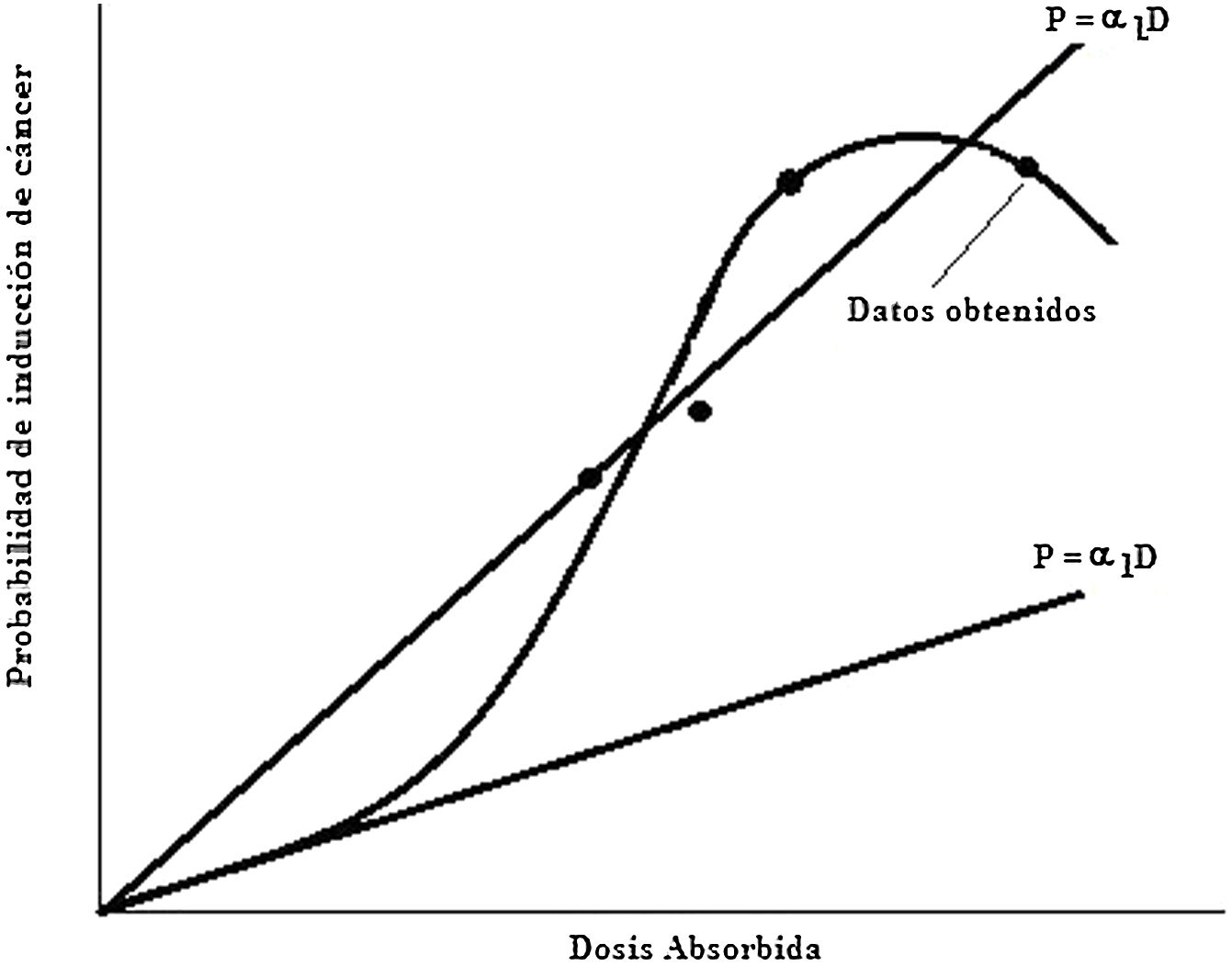
Para fines de protección radiológica la Comisión Internacional de Protección Radiológica, ICRP, recomienda la inclusión de un factor de reducción denominado factor de eficiencia de la dosis y de la alta tasa de dosis, DDREF (del inglés, dose and dose rate effectiveness factor), en los coeficientes de cálculo de probabilidad de inducción de cáncer debido a dosis bajas, menor de 0,2Gy y baja tasa de dosis, menor de 0.19Gy/h con radiación de bajo LET. El valor de DDREF es obtenido de la curva de respuesta-probabilidad de inducción de cáncer versus dosis absorbida para un órgano o tejido dados en el rango de dosis y tasa de dosis de interés. Se considera una curva de respuesta como la que se muestra en la figura 13, y se expresa como:
En donde αL es la pendiente de la recta que ajusta los datos obtenidos a altas dosis y alta tasa de dosis, y α1 es la pendiente de la recta que ajusta los datos a baja dosis y baja tasa de dosis. Para dosis y tasa de dosis bajas es muy improbable que los eventos se combinen antes de que los mecanismos de reparación actúen. La relación debe ser lineal, así como es lineal la porción inicial de la curva para alta dosis. La ICRP considera que para todos los valores de dosis equivalente y dosis efectiva por debajo de los límites recomendados para radiaciones de bajo LET, la relación de la dosis y la probabilidad de cáncer radioinducido es lineal. La ICRP recomienda un valor de 2 reconociendo que es una escogencia arbitraria pero conservativa.
Orientación sobre los principales efectos de la radiación en Cardiología intervencionistaEn la tabla 2, a manera de resumen, se especifican los principales efectos determinísticos y su umbral en aquellos órganos que tienen mayor riesgo de sufrir dosis altas en las prácticas de intervencionismo, cardiología y en general aquellas prácticas clínicas guiadas con imágenes obtenidas con rayos X.
Resumen de las reacciones de la piel y del cristalino14
| Algunos efectos tisulares en piel | Efectos en el cristalino | ||
|---|---|---|---|
| Lesión | Dosis umbral (Gy) | Lesión | Dosis umbral (Gy) |
| Eritema transitorio temprano | 2 | Opacidad estacionaria | Dosis únicas de 0,5 a 2 |
| Depilación temporal | 3 | Cataratas progresivas graves | Dosis únicas> 5 |
| Depilación permanente | 7 | Cataratas progresivas graves | Dosis en forma aguda> 7,5 |
| Radiodermitis exudativa | 15 | Cataratas progresivas graves | Dosis fraccionada ≥ 14 |
Como puede verse en la tabla 2, las dosis umbrales en regiones de la piel y los ojos, que son los órganos más expuestos en la práctica de la Cardiología intervencionista, son considerablemente altas y en la mayoría de los casos en exposiciones agudas.
Existen otro tipo de enfermedades inducidas por radiación, como la cardiopatía isquémica con infarto al miocardio, probadas epidemiológicamente en sobrevivientes de las bombas atómicas y en pacientes sometidos a radioterapia, en las que en el tratamiento se compromete el corazón. Por otro lado, en relación con las enfermedades cardiovasculares inducidas por radiación en dosis bajas la evidencia se complica en los estudios epidemiológicos y habrá que ahondar más en su clasificación14-16.
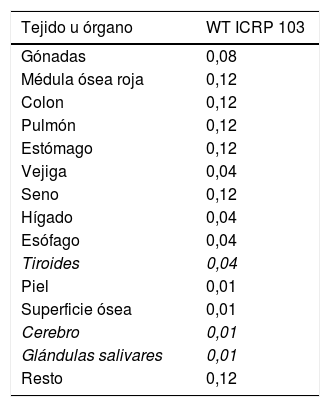
En relación con los efectos estocásticos, los cuales no tienen umbral, en cardiología intervencionista, ya han sido considerados en las recomendaciones de la ICRP publicación 103 del 200717 en los factores de peso por tejido, que se especifican en la tabla 3, en donde se considera el riesgo radiológico en órganos más expuestos en este tipo de práctica clínica, como son la tiroides, las glándulas salivares y el cerebro. En cuanto a este último, hay estudios estadísticos en cardiólogos intervencionistas con tumores cerebrales con mayor probabilidad de incidencia en el lado izquierdo, fenómeno que no se observa en la población en general18,19.
Adicionalmente, los trabajadores ocupacionalmente expuestos en Cardiología intervencionista tienen otros riesgos profesionales que se observan con frecuencia en la práctica, como por ejemplo lesiones ortopédicas producto de largas jornadas utilizando delantales plomados, y lesiones cervicales ocasionadas por los protectores de cabeza diseñados para disminuir el riesgo de cáncer cerebral. Estos aspectos deben ser considerados en los programas de salud ocupacional19,20.
Creative commonsCreative Commons Reconocimiento-No Comercial-Sin Obra Derivada (CC BY-NC-ND).
Conflicto de interesesNinguno.