en pacientes con falla cardiaca aguda es necesario el uso de inotrópicos para lograr su estabilización.
Objetivodefinir cuál de los medicamentos inotrópicos se asocia con menor mortalidad.
Metodologíase realizó un metaanálisis en red con la aproximación frecuentista. La búsqueda sistemática incluyó PUBMED, EMBASE, CENTRAL, DARE, Epistemonikos, SieELO, LILACS y OpenGray. Se incluyeron ensayos clínicos con asignación aleatoria en pacientes con falla cardiaca aguda que recibieron dobutamina, levosimendán o milrinone que reportaran datos de mortalidad.
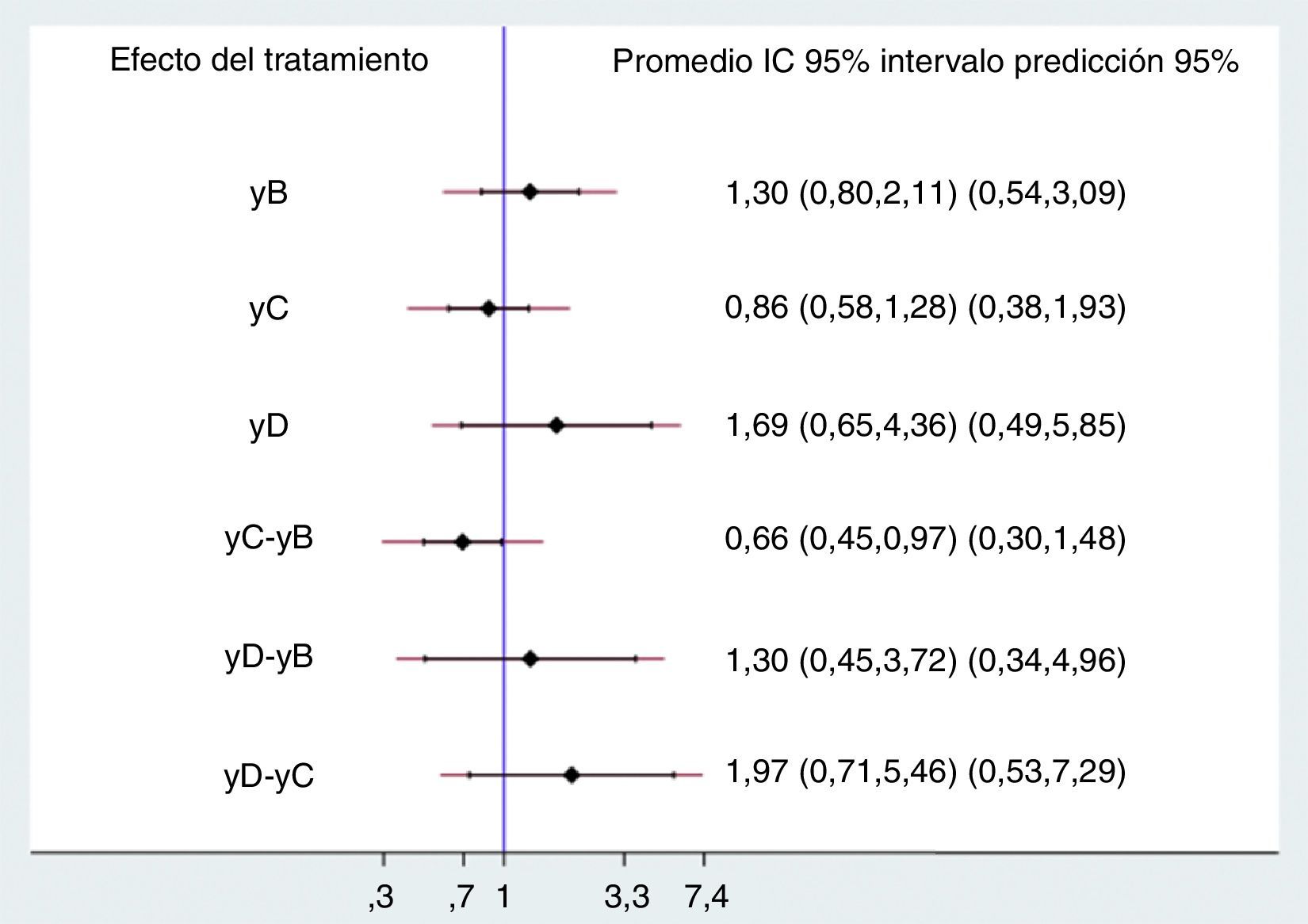
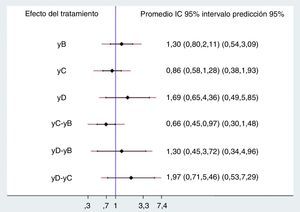
Resultadoslos 20 estudios incluidos asignaron en forma aleatoria 5.315 pacientes a cinco comparaciones. La mayoría de estudios mostró riesgo de sesgos de selección de la población y en el cegamiento de la intervención. Las diferentes comparaciones con placebo, dobutamina (OR 1,30 IP 95% 0,54-3,09), levosimendán (OR 0,86 IP 95% 0,38-1,93) y milrinone (OR 1,69 IP 95% 0,49-5,85), no mostraron diferencias estadísticamente significativas, al igual que las comparaciones entre ellos, dobutamina vs. levosimendán (OR 0,66 IP 95% 0,30-1,48), dobutamina vs. milrinone (OR 1,30 IP 95% 0,34-4,96) y levosimendán vs. milrinone (OR 1,97 IP 95% 0,53-7,29). El análisis por rangos demostró mayor probabilidad para milrinone seguido de dobutamina.
Discusiónno hay diferencias en el uso de inotrópicos como dobutamina, levosimendán o milrinone en términos del desenlace de mortalidad, así que su utilización dependerá de otras consideraciones.
Inotropic drugs are required in order to stabilise patients with acute heart failure.
ObjectiveTo determine which of the inotropic drugs are associated with lower mortality.
Materials and methodA network meta-analysis was performed using the frequentist approach. The systematic search included PUBMED, EMBASE, CENTRAL, DARE, Epistemonikos, ScieELO, LILACS, and OpenGray data bases. Randomised clinical trials were included that provided data on mortality on patients with acute heart failure who received dobutamine, levosimendan or milrinone.
ResultsA total of 5,315 patients in the 20 studies include were randomly assigned to five comparisons. The majority of the studies showed bias risks in population selection and in the blinding of the intervention. The different comparisons with placebo, dobutamine (OR 1.30; 95% probability interval (PI); 0.54-3.09), levosimendan (OR 0.86; 95% PI; 0.38-1.93), and milrinone (OR 1.69; 95% PI; 0.49-5.85), did not show any statistically significant differences. The same applied to the comparisons between themselves, dobutamine vs. levosimendan (OR 0.66; 95%PI; 0.30-1.48), dobutamine vs. milrinone (OR 1.30; 95% PI; 0.34-4.96), and levosimendan vs. milrinone (OR 1.97; 95% PI; 0.53-7.29). The analysis by ranges showed a higher probability for milrinone, followed by dobutamine.
DiscussionThere are no differences in the use of inotropic drugs, such as dobutamine, levosimendan or milrinone in terms of mortality outcomes. Their use, therefore, will depend on other factors.
La falla cardiaca aguda se define como el inicio rápido o empeoramiento gradual del estado clínico que requiere evaluación y tratamiento urgente, generalmente hospitalario1. Desde el punto de vista clínico, incluye tres escenarios diferentes, por lo que puede clasificarse como empeoramiento de una falla cardiaca crónica (70%), falla cardiaca de novo o falla cardiaca avanzada con choque cardiogénico2. Las manifestaciones clínicas pueden variar en forma importante en un espectro que incluye desde formas leves en las que predomina la hipertensión, pasando por sobrecarga de volumen con o sin edema pulmonar, hasta cuadros más severos con choque cardiogénico, que por fortuna representan el 1%3; a pesar de esto, algunos pacientes pueden presentar signos de hipoperfusión con o sin hipotensión asociada y requerir el uso de inotrópicos hasta en el 19% de los casos, como lo demostró el registro ADHERE (Acute Decompensated Heart Failure National Registry)4.
El uso de inotrópicos no ha estado exento de controversia, puesto que se les relaciona con aumento de arritmias ventriculares y mortalidad a pesar de mejorar el estado hemodinámico y los síntomas5; sin embargo, está claro que son necesarios para lograr la estabilización en ese grupo de pacientes y posteriormente definir la introducción de medicamentos que cambian el pronóstico a largo plazo. Entre los medicamentos inotrópicos se dispone de la dobutamina, que es una amina simpáticomimética, y el milrinone, que es un inhibidor de fosfodiesterasa 36; en la última década han aparecido medicamentos inodilatadores potentes, representados básicamente por el levosimendán, el cual sensibiliza las proteínas contráctiles miocárdicas al calcio, como mecanismo de acción diferenciador7.
Aunque se han publicado diversos estudios en los que se avala su utilización, generalmente los diseños son inadecuados por antiguos, con pocos ensayos clínicos con asignación aleatoria (ECA), comparaciones con placebo o con solo dos medicamentos, uso de desenlaces subrogados o intermedios, diversos escenarios clínicos, publicaciones incompletas de estos con solo versiones en resumen y resultados contradictorios. Por ende, los metaanálisis del tema poseen los mismos problemas si no se realizan en forma adecuada y no se establecen comparaciones claras entre los medicamentos comercialmente disponibles a los cuales se enfrenta el clínico8. El metaanálisis en red es una técnica estadística que permite hacer un estimativo global de la comparación de la efectividad de diversos tratamientos combinando evidencia directa e indirecta; es decir, permite realizar comparaciones no hechas en ECA9,10, de modo que se convierte en una herramienta útil en este escenario.
Dentro de la convocatoria 637-2012 del Departamento Administrativo de Ciencia, Tecnología e Innovación (Colciencias) se desarrolló la Guía de Práctica Clínica para la prevención, diagnóstico, tratamiento y rehabilitación de la falla cardíaca en población mayor de 18 años clasificación B, C y D, en una de cuyas preguntas fue necesario realizar un metaanálisis en red de los estudios clínicos con asignación aleatoria, con el objetivo de comparar la morbilidad y mortalidad con el uso de dobutamina, levosimendán y milrinone para el tratamiento de la falla cardiaca aguda.
Materiales y métodosEl diseño del estudio es de revisión sistemática y metaanálisis en red, cuyo reporte se ajusta a las directrices de Preferred Reporting Items for Systematic Reviews and Meta-Analysis (PRISMA) statement (PRISMA-NMA)11,12
ObjetivoLa pregunta PICO precisamente guarda ese orden paciente-intervención-comparador-desenlace; en la forma en que aparece queda desenlace-intervención-comparador-paciente. No cambia el sentido, pero debería dejarse como el original.
Criterios de elegibilidadLa selección de los estudios fue realizada por dos investigadores y las diferencias se resolvieron por consenso o con el concurso de un tercero; se incluyeron ensayos clínicos con asignación aleatoria que compararan el uso intravenoso de los inotrópicos dobutamina, levosimendán, milrinone con placebo o entre ellos, y que reportaran datos de mortalidad, estancia hospitalaria y complicaciones relacionadas con el uso de los medicamentos en estudio. No hubo limitación por estado de publicación (resumen o completo) ni por fecha (hasta enero 2015) ni idioma. Se excluyeron estudios con enoximone porque no está disponible comercialmente en el país. Se envió comunicación a los autores del estudio CASINO para conocer los resultados completos, puesto que solo se dispone de publicación como resumen, a pesar de ser un estudio antiguo; no se obtuvo respuesta. Se extrajo de cada estudio el número de pacientes participantes, el número de muertes en cada grupo de estudio, estancia hospitalaria cuando fue reportada y desenlaces de seguridad como presencia de arritmias y estado hemodinámico, entre otros. El desenlace primario evaluado fue mortalidad.
Estrategia de búsquedaSe realizó una búsqueda sistemática en las bases de datos bibliográficas PUBMED, EMBASE, CENTRAL, DARE, Epistemonikos, SciELO, LILACS y OpenGray; además, se consultaron páginas web de registros de ensayos clínicos como ClinicalTrials. La búsqueda manual incluyó páginas de congresos internacionales de Cardiología como el de la European Society of Cardiology, American Heart Association y American College of Cardiology, así como los estudios primarios incluidos en las guías de práctica clínica de esas sociedades y de la National Institute for Health and Care Excellence (NICE) y meta-análisis.
La búsqueda sistemática estuvo a cargo de una bibliotecóloga con entrenamiento en el centro Cochrane en España y la estrategia incluyó los siguientes términos: “Heart Failure”[MeSH] OR “acute heart failure”[tiab] OR AHF[tiab]) AND (levosimendán[tiab] OR simendan[tiab] OR dextrosimendan[tiab] OR Milrinone[MeSH] OR milrinone[tiab] OR Dobutamine[MeSH] OR dobutamin*[tiab])) AND systematic[sb]) OR (((“Heart Failure”[MeSH] OR “acute heart failure”[tiab] OR AHF[tiab]) AND (levosimendán[tiab] OR simendan[tiab] OR dextrosimendan[tiab] OR Milrinone[MeSH] OR milrinone[tiab] OR Dobutamine[MeSH] OR dobutamin*[tiab])) AND (randomized controlled trial[pt] OR controlled clinical trial[pt] OR randomized[tiab] OR placebo[tiab] OR drug therapy[sh] OR randomly[tiab] OR trial[tiab] OR groups[tiab]) NOT (animals[mh] NOT humans[mh]”.
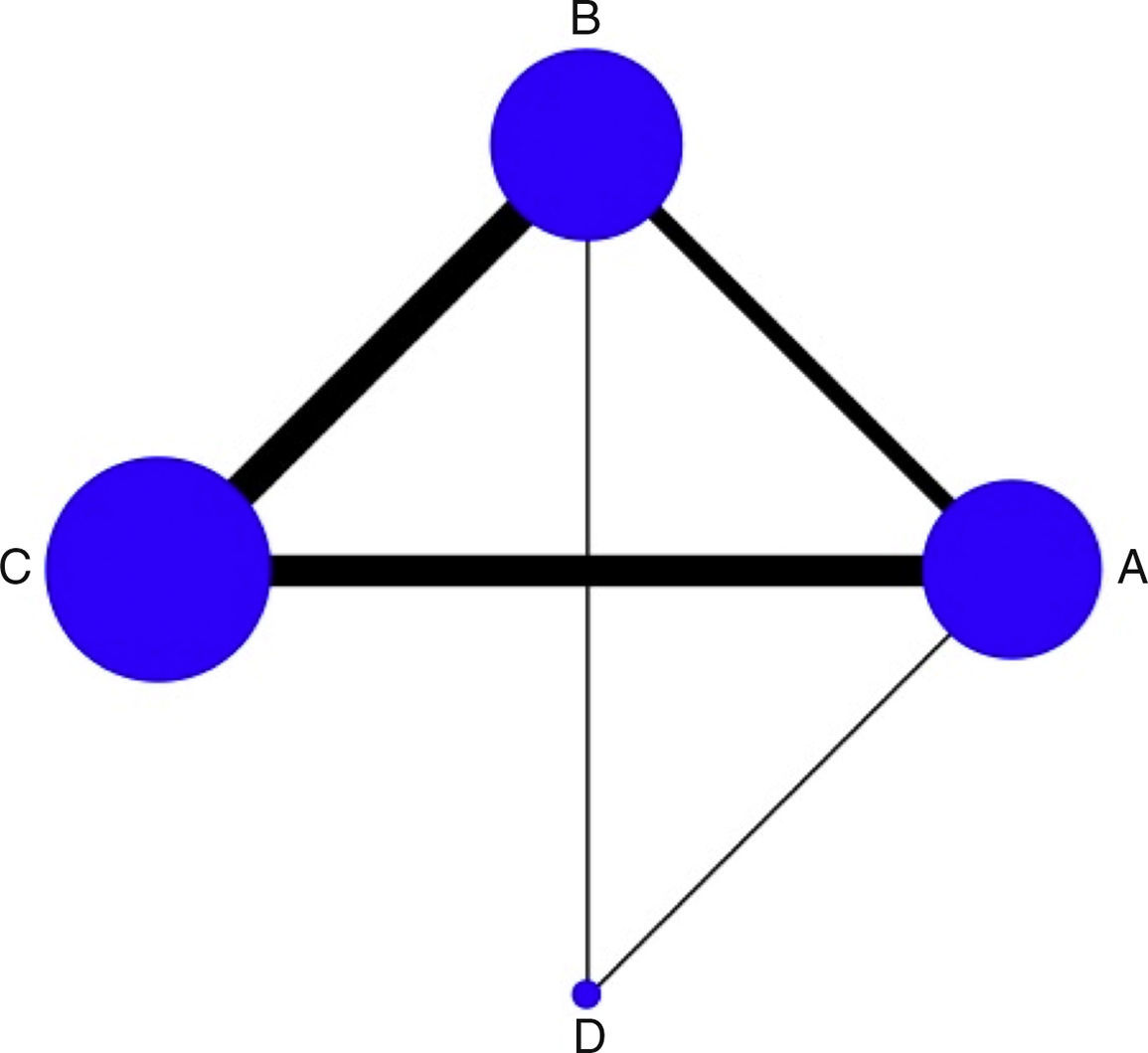
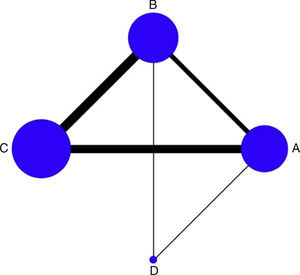
Análisis estadísticoLas comparaciones entre los tratamientos se visualizan por medio de una gráfica estándar que expresa la geometría de la red, en la cual se observa asimetría por la escasa representación de estudios con milrinone (fig. 1). Se realizó un metaanálisis multivariante con el objetivo de sintetizar en forma conjunta los resultados, tanto de las comparaciones directas (versus placebo o cabeza a cabeza), como indirectas (a través de un nodo) y mixtas (corroborando si existe inconsistencia), presentadas como diagrama de bosque (Forrest Plot) con medida de resumen como OR (odds ratio) por efectos aleatorios, utilizando el log OR, con sus respectivos intervalos de confianza y de predicción, y una tabla de resumen; los estudios con cero eventos son artificialmente incluidos al adicionar 0,5. Se evaluó la heterogeneidad clínica o transitividad con base en las características de cada uno de los estudios y la población incluida, y la heterogeneidad estadística por medio de la inconsistencia con una aproximación local por método de Bucher y global por modelo de inconsistencia para toda la red con Chi2 y p>0,05. Adicionalmente, como medida que refleja la clasificación de los diversos tratamientos se utilizó la probabilidad de clasificación acumulada (SUCRA: Surface Under the Cumulative RAnking curve); esta medida permite establecer la probabilidad de que una intervención sea la mejor y es expresada en porcentaje. Todos los análisis fueron hechos con el paquete estadístico STATA 13.
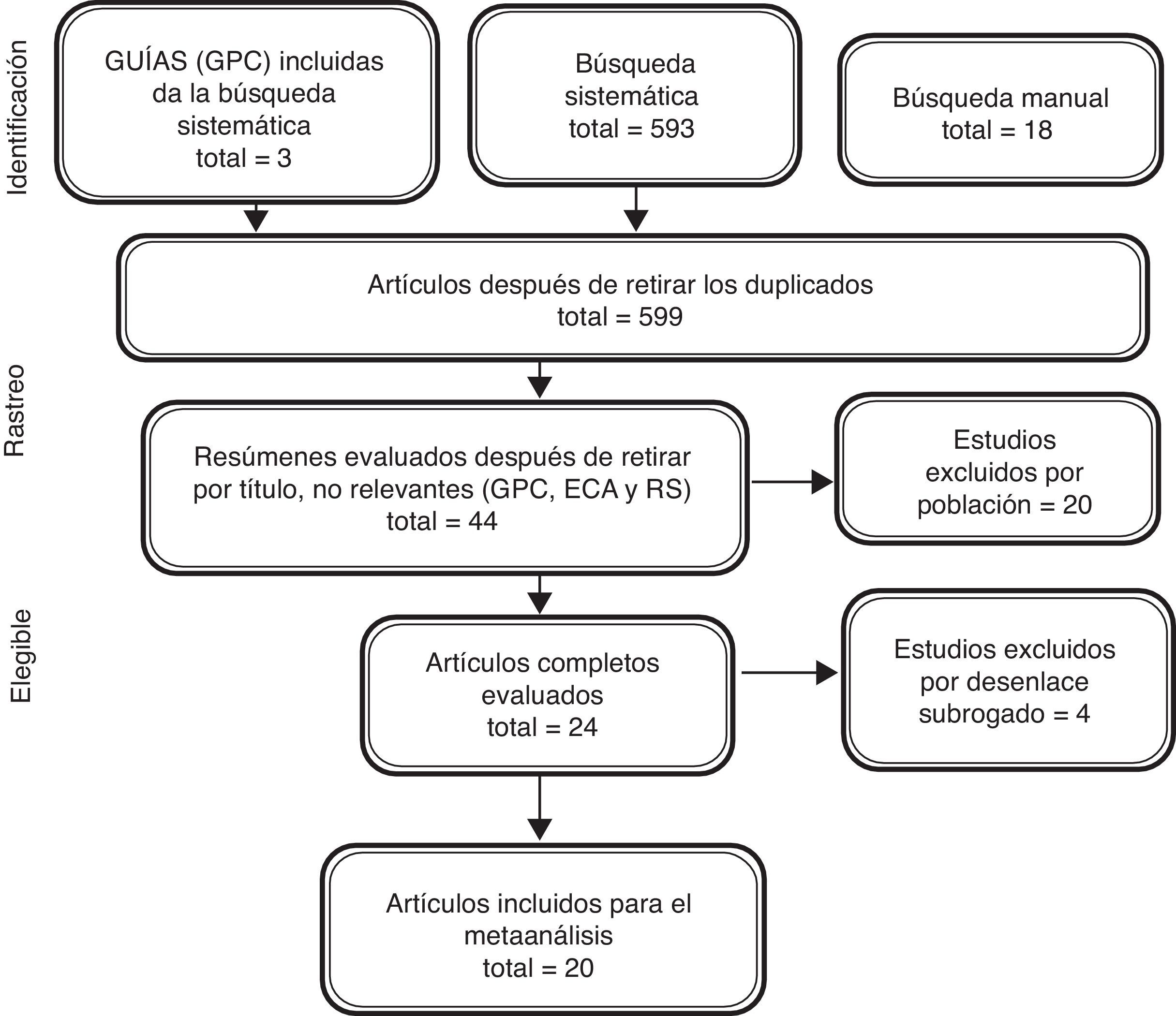
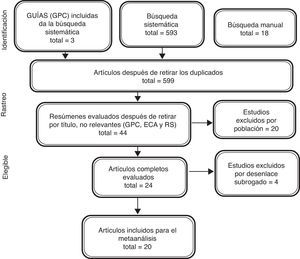
ResultadosLa búsqueda sistemática recuperó 593 referencias y la búsqueda manual en los estudios referenciados en las guías del American College of Cardiology (ACC)/American Heart Association (AHA) del 2013, las guías de la European Society of Cardiology (ESC) de 2012, y las guías del National Institute for Health and Care Excellence (NICE) 2014, donde se encontraron dos referencias adicionales que no aparecían en la búsqueda sistemática. Además, en las referencias de los artículos de revisión se identificaron otras 18 referencias. Después de la revisión de títulos y resúmenes se identificaron 20 estudios primarios de los diferentes inotrópicos a evaluar, que cumplían los criterios de inclusión (fig. 2).
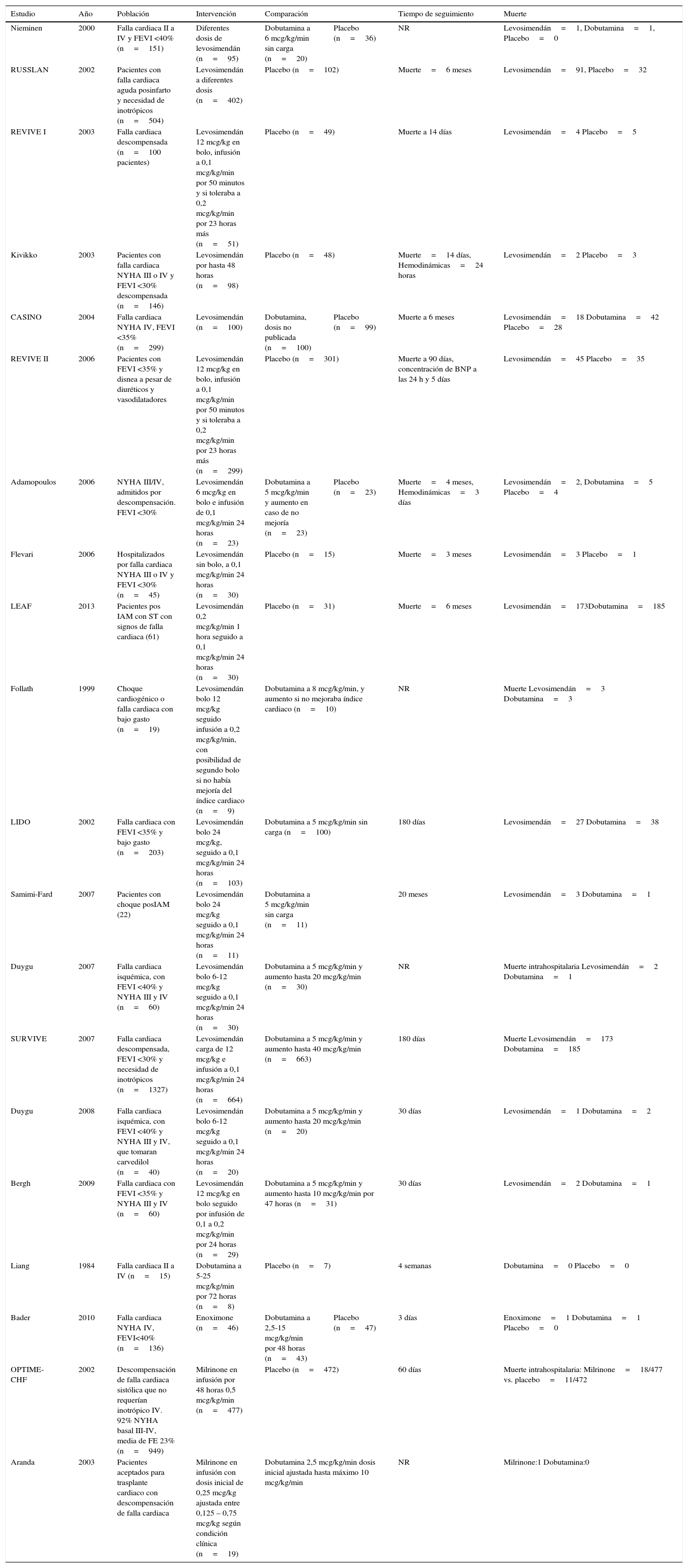
Los 20 estudios incluidos en el análisis final aleatorizaron 5.315 pacientes a grupos de tratamientos así: levosimendán versus placebo (#9) y levosimendán versus dobutamina (#10); dobutamina versus placebo (#5) y dobutamina versus milrinone (#1); milrinone versus placebo (#1). Tres estudios asignaron en forma aleatoria pacientes a tres grupos13–15, mientras que el resto solo compararon dos grupos16–32. El comparador más frecuente fue el levosimendán seguido de la dobutamina. El seguimiento varía entre los estudios. Las características principales se describen en la tabla 1.
Características de los estudios incluidos
| Estudio | Año | Población | Intervención | Comparación | Tiempo de seguimiento | Muerte | |
|---|---|---|---|---|---|---|---|
| Nieminen | 2000 | Falla cardiaca II a IV y FEVI <40% (n=151) | Diferentes dosis de levosimendán (n=95) | Dobutamina a 6 mcg/kg/min sin carga (n=20) | Placebo (n=36) | NR | Levosimendán=1, Dobutamina=1, Placebo=0 |
| RUSSLAN | 2002 | Pacientes con falla cardiaca aguda posinfarto y necesidad de inotrópicos (n=504) | Levosimendán a diferentes dosis (n=402) | Placebo (n=102) | Muerte=6 meses | Levosimendán=91, Placebo=32 | |
| REVIVE I | 2003 | Falla cardiaca descompensada (n=100 pacientes) | Levosimendán 12 mcg/kg en bolo, infusión a 0,1 mcg/kg/min por 50 minutos y si toleraba a 0,2 mcg/kg/min por 23 horas más (n=51) | Placebo (n=49) | Muerte a 14 días | Levosimendán=4 Placebo=5 | |
| Kivikko | 2003 | Pacientes con falla cardiaca NYHA III o IV y FEVI <30% descompensada (n=146) | Levosimendán por hasta 48 horas (n=98) | Placebo (n=48) | Muerte=14 días, Hemodinámicas=24 horas | Levosimendán=2 Placebo=3 | |
| CASINO | 2004 | Falla cardiaca NYHA IV, FEVI <35% (n=299) | Levosimendán (n=100) | Dobutamina, dosis no publicada (n=100) | Placebo (n=99) | Muerte a 6 meses | Levosimendán=18 Dobutamina=42 Placebo=28 |
| REVIVE II | 2006 | Pacientes con FEVI <35% y disnea a pesar de diuréticos y vasodilatadores | Levosimendán 12 mcg/kg en bolo, infusión a 0,1 mcg/kg/min por 50 minutos y si toleraba a 0,2 mcg/kg/min por 23 horas más (n=299) | Placebo (n=301) | Muerte a 90 días, concentración de BNP a las 24 h y 5 días | Levosimendán=45 Placebo=35 | |
| Adamopoulos | 2006 | NYHA III/IV, admitidos por descompensación. FEVI <30% | Levosimendán 6 mcg/kg en bolo e infusión de 0,1 mcg/kg/min 24 horas (n=23) | Dobutamina a 5 mcg/kg/min y aumento en caso de no mejoría (n=23) | Placebo (n=23) | Muerte=4 meses, Hemodinámicas=3 días | Levosimendán=2, Dobutamina=5 Placebo=4 |
| Flevari | 2006 | Hospitalizados por falla cardiaca NYHA III o IV y FEVI <30% (n=45) | Levosimendán sin bolo, a 0,1 mcg/kg/min 24 horas (n=30) | Placebo (n=15) | Muerte=3 meses | Levosimendán=3 Placebo=1 | |
| LEAF | 2013 | Pacientes pos IAM con ST con signos de falla cardiaca (61) | Levosimendán 0,2 mcg/kg/min 1 hora seguido a 0,1 mcg/kg/min 24 horas (n=30) | Placebo (n=31) | Muerte=6 meses | Levosimendán=173Dobutamina=185 | |
| Follath | 1999 | Choque cardiogénico o falla cardiaca con bajo gasto (n=19) | Levosimendán bolo 12 mcg/kg seguido infusión a 0,2 mcg/kg/min, con posibilidad de segundo bolo si no había mejoría del índice cardiaco (n=9) | Dobutamina a 8 mcg/kg/min, y aumento si no mejoraba índice cardiaco (n=10) | NR | Muerte Levosimendán=3 Dobutamina=3 | |
| LIDO | 2002 | Falla cardiaca con FEVI <35% y bajo gasto (n=203) | Levosimendán bolo 24 mcg/kg, seguido a 0,1 mcg/kg/min 24 horas (n=103) | Dobutamina a 5 mcg/kg/min sin carga (n=100) | 180 días | Levosimendán=27 Dobutamina=38 | |
| Samimi-Fard | 2007 | Pacientes con choque posIAM (22) | Levosimendán bolo 24 mcg/kg seguido a 0,1 mcg/kg/min 24 horas (n=11) | Dobutamina a 5 mcg/kg/min sin carga (n=11) | 20 meses | Levosimendán=3 Dobutamina=1 | |
| Duygu | 2007 | Falla cardiaca isquémica, con FEVI <40% y NYHA III y IV (n=60) | Levosimendán bolo 6-12 mcg/kg seguido a 0,1 mcg/kg/min 24 horas (n=30) | Dobutamina a 5 mcg/kg/min y aumento hasta 20 mcg/kg/min (n=30) | NR | Muerte intrahospitalaria Levosimendán=2 Dobutamina=1 | |
| SURVIVE | 2007 | Falla cardiaca descompensada, FEVI <30% y necesidad de inotrópicos (n=1327) | Levosimendán carga de 12 mcg/kg e infusión a 0,1 mcg/kg/min 24 horas (n=664) | Dobutamina a 5 mcg/kg/min y aumento hasta 40 mcg/kg/min (n=663) | 180 días | Muerte Levosimendán=173 Dobutamina=185 | |
| Duygu | 2008 | Falla cardiaca isquémica, con FEVI <40% y NYHA III y IV, que tomaran carvedilol (n=40) | Levosimendán bolo 6-12 mcg/kg seguido a 0,1 mcg/kg/min 24 horas (n=20) | Dobutamina a 5 mcg/kg/min y aumento hasta 20 mcg/kg/min (n=20) | 30 días | Levosimendán=1 Dobutamina=2 | |
| Bergh | 2009 | Falla cardiaca con FEVI <35% y NYHA III y IV (n=60) | Levosimendán 12 mcg/kg en bolo seguido por infusión de 0,1 a 0,2 mcg/kg/min por 24 horas (n=29) | Dobutamina a 5 mcg/kg/min y aumento hasta 10 mcg/kg/min por 47 horas (n=31) | 30 días | Levosimendán=2 Dobutamina=1 | |
| Liang | 1984 | Falla cardiaca II a IV (n=15) | Dobutamina a 5-25 mcg/kg/min por 72 horas (n=8) | Placebo (n=7) | 4 semanas | Dobutamina=0 Placebo=0 | |
| Bader | 2010 | Falla cardiaca NYHA IV, FEVI<40% (n=136) | Enoximone (n=46) | Dobutamina a 2,5-15 mcg/kg/min por 48 horas (n=43) | Placebo (n=47) | 3 días | Enoximone=1 Dobutamina=1 Placebo=0 |
| OPTIME-CHF | 2002 | Descompensación de falla cardiaca sistólica que no requerían inotrópico IV. 92% NYHA basal III-IV, media de FE 23% (n=949) | Milrinone en infusión por 48 horas 0,5 mcg/kg/min (n=477) | Placebo (n=472) | 60 días | Muerte intrahospitalaria: Milrinone=18/477 vs. placebo=11/472 | |
| Aranda | 2003 | Pacientes aceptados para trasplante cardiaco con descompensación de falla cardiaca | Milrinone en infusión con dosis inicial de 0,25 mcg/kg ajustada entre 0,125 – 0,75 mcg/kg según condición clínica (n=19) | Dobutamina 2,5 mcg/kg/min dosis inicial ajustada hasta máximo 10 mcg/kg/min | NR | Milrinone:1 Dobutamina:0 | |
En conjunto, los estudios incluidos demuestran heterogeneidad clínica, aunque la mayoría se centra en pacientes con falla cardiaca descompensada, con fracción de eyección reducida y estado funcional NYHA III-IV (New York Heart Association), lo que podría asegurar el supuesto de transitividad; sin embargo, en algunos de ellos las dosis de los medicamentos varían, al igual que el tiempo de infusión, la evaluación de los parámetros hemodinámicos y su consideración para cambiar la dosis (aumentar o disminuir), el tiempo de seguimiento al cual se definía el desenlace, y por último, que la estrategia fuese considerada como utilización de rutina (particularmente en el estudio OPTIME-CHF) o de acuerdo con variables que sugirieran la necesidad del inotrópico.
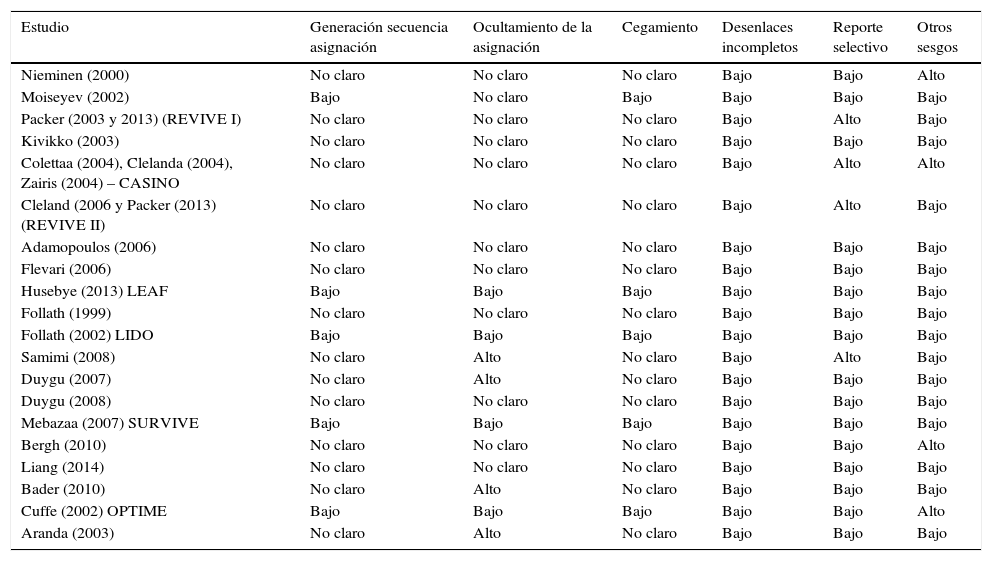
Los estudios incluidos son de moderado a alto riesgo de sesgos según la recomendación Cochrane, resaltando que muchos de los ítems fueron calificados como No Claro, a excepción de los estudios LEAF, LIDO y SURVIVE. En 15 de ellos [(Nieminen (2000), Packer (2003 y 2013) (REVIVE I), Kivikko (2003), Colettaa (2004), Clelanda (2004), Zairis (2004) – CASINO, Cleland (2006 y Packer (2013) (REVIVE II), Adamopoulos (2006), Flevari (2006), Follath (1999), Samimi (2008), Duygu (2007), Duygu (2008), Bergh (2010), Liang (2014), Bader (2010) y Aranda (2003)] no fue claro el mecanismo para la asignación aleatoria. El ocultamiento de la asignación presentó alto riesgo de sesgo en 4 estudios [(Samimi (2008), Duygu (2007), Bader (2010) y Aranda (2003)], bajo riesgo de sesgo en 4 [(Husebye (2013) LEAF, Follath (2002) LIDO, Mebazaa (2007) SURVIVE y Cuffe (2002) OPTIME)] y no fue claro en los demás. El enmascaramiento de los participantes presentó bajo riesgo de sesgos en 4 estudios [(Husebye (2013) LEAF, Follath (2002) LIDO, Mebazaa (2007) SURVIVE y Cuffe (2002) OPTIME)] y en los demás no estaba descrito, pero por tratarse del desenlace mortalidad se calificó como no claro. No hubo estudios con desenlaces incompletos, pero sí 4 estudios con alto riesgo de reporte selectivo de resultados [(Packer (2003 y 2013) (REVIVE I), Colettaa (2004), Cleland (2004), Zairis (2004) – CASINO, Cleland (2006 y Packer (2013) (REVIVE II) y Samimi (2008)]. En 3 de ellos [(Packer (2003 y 2013) (REVIVE I), Colettaa (2004), Cleland (2004), Zairis (2004) – CASINO Cleland (2006 y Packer (2013) (REVIVE II)] se encontraron diferencias entre varias publicaciones del mismo estudio y en otro [Samimi (2008)] el desenlace no se había planteado en la publicación inicial. Finalmente, 4 estudios [(Nieminen (2000), Colettaa (2004), Cleland (2004), Zairis (2004) – CASINO, Bergh (2010) y Cuffe (2002)] se consideraron con alto riesgo de otros sesgos. En 2 de ellos [(Nieminen (2000), y Cuffe (2002) OPTIME)] solo se incluyeron pacientes con falla cardiaca estable o se excluyeron aquellos con indicación de soporte vasopresor o inotrópico, 1 [Bergh (2010)] fue suspendido antes de reclutar el tamaño de muestra planeado y el otro [(Colettaa (2004), Cleland (2004), Zairis (2004)] fue suspendido de manera prematura por beneficio.
En conclusión, la mayoría de estudios mostró riesgo de sesgos de selección de la población y enmascaramiento de la intervención. Solo 3 estudios [(Husebye (2013) LEAF, Follath (2002) LIDO, Mebazaa (2007) SURVIVE)] se consideraron con bajo riesgo de sesgos mientras otros 3 con alto riesgo de sesgos [(Packer (2003 y 2013) (REVIVE I) Kivikko (2003), Colettaa (2004), Cleland (2004), Zairis (2004) – CASINO, Cleland (2006 y Packer (2013) (REVIVE II)] (tabla 2).
Clasificación del riesgo de sesgos en los estudios incluidos
| Estudio | Generación secuencia asignación | Ocultamiento de la asignación | Cegamiento | Desenlaces incompletos | Reporte selectivo | Otros sesgos |
|---|---|---|---|---|---|---|
| Nieminen (2000) | No claro | No claro | No claro | Bajo | Bajo | Alto |
| Moiseyev (2002) | Bajo | No claro | Bajo | Bajo | Bajo | Bajo |
| Packer (2003 y 2013) (REVIVE I) | No claro | No claro | No claro | Bajo | Alto | Bajo |
| Kivikko (2003) | No claro | No claro | No claro | Bajo | Bajo | Bajo |
| Colettaa (2004), Clelanda (2004), Zairis (2004) – CASINO | No claro | No claro | No claro | Bajo | Alto | Alto |
| Cleland (2006 y Packer (2013) (REVIVE II) | No claro | No claro | No claro | Bajo | Alto | Bajo |
| Adamopoulos (2006) | No claro | No claro | No claro | Bajo | Bajo | Bajo |
| Flevari (2006) | No claro | No claro | No claro | Bajo | Bajo | Bajo |
| Husebye (2013) LEAF | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo |
| Follath (1999) | No claro | No claro | No claro | Bajo | Bajo | Bajo |
| Follath (2002) LIDO | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo |
| Samimi (2008) | No claro | Alto | No claro | Bajo | Alto | Bajo |
| Duygu (2007) | No claro | Alto | No claro | Bajo | Bajo | Bajo |
| Duygu (2008) | No claro | No claro | No claro | Bajo | Bajo | Bajo |
| Mebazaa (2007) SURVIVE | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo |
| Bergh (2010) | No claro | No claro | No claro | Bajo | Bajo | Alto |
| Liang (2014) | No claro | No claro | No claro | Bajo | Bajo | Bajo |
| Bader (2010) | No claro | Alto | No claro | Bajo | Bajo | Bajo |
| Cuffe (2002) OPTIME | Bajo | Bajo | Bajo | Bajo | Bajo | Alto |
| Aranda (2003) | No claro | Alto | No claro | Bajo | Bajo | Bajo |
Se hicieron comparaciones directas de los tres tratamientos activos contra placebo, dos comparaciones directas de tratamientos activos cabeza-cabeza (levosimendán-dobutamina y dobutamina-milrinone) y una comparación indirecta (levosimendán-milrinone) (tabla 3).
La comparación de los tratamientos debe ser leída de izquierda a derecha y su correspondiente OR está en la celda respectiva que cruza la columna con la fila.
No se demostraron diferencias significativas en el desenlace evaluado entre los diversos tratamientos ni contra placebo ni entre ellos, excepto cuando se comparó levosimendán contra dobutamina, en el que hay reducción del 34% del riesgo de muerte; sin embargo, el efecto se pierde al evaluar los intervalos de predicción, por lo que la conclusión no cambia. Los rangos de los intervalos de confianza y de predicción son bastante amplios, a pesar del aumento del número de pacientes con la combinación de estudios (fig. 3).
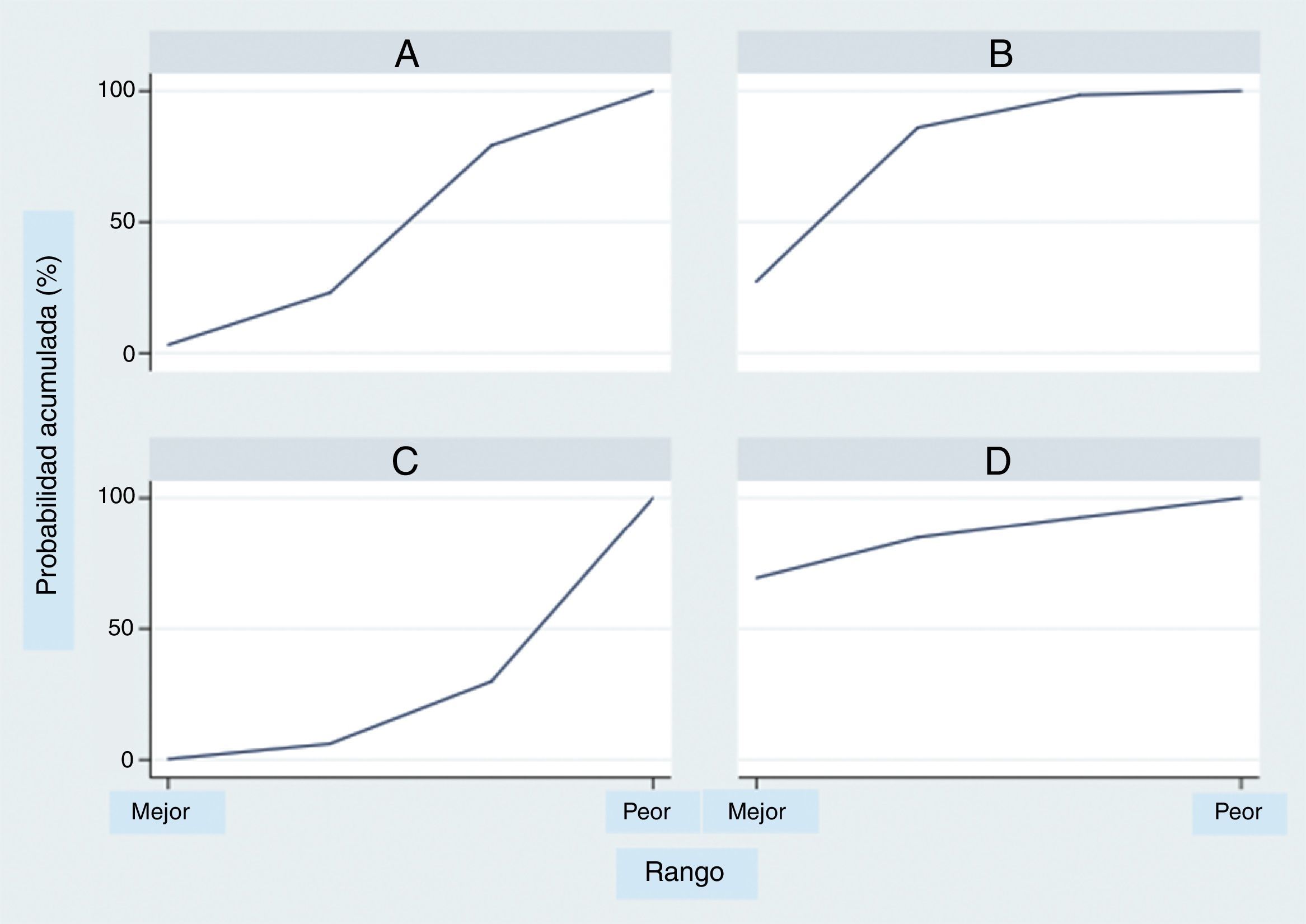
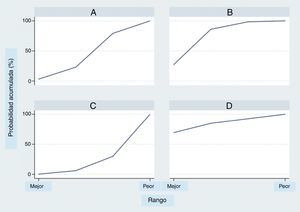
El análisis por rangos de la probabilidad de clasificación acumulada (SUCRA) demuestra que entre los tratamientos evaluados el milrinone muestra la mayor probabilidad de ser el mejor (80%), seguido por la dobutamina (70%) (fig. 4).
No se demostró inconsistencia en el modelo global, en las comparaciones realizadas (chi2=6,61; p=0,15).
DiscusiónEl principal hallazgo de este metaanálisis es que la utilización de medicamentos inotrópicos como levosimendán, dobutamina o milrinone no demuestra ningún beneficio sobre la mortalidad en pacientes con falla cardiaca aguda con fracción de eyección reducida al compararse con placebo o entre ellos, aunque se debe tener en cuenta la heterogeneidad clínica detectada entre los ensayos incluidos; se demostró menor mortalidad al comparar levosimendán contra dobutamina (OR 0,66 IC 95% 0,45-0,97); no obstante, la significancia desaparece al utilizar los intervalos de predicción (IP 95% 0,30-1,48). El intervalo de predicción es un concepto diferente al del intervalo de confianza en la estadística frecuentista y al intervalo de credibilidad en la estadística bayesiana; el intervalo de confianza está asociado con un parámetro y predice la distribución del estadístico, el intervalo de credibilidad se asocia con la posterior distribución del parámetro y el intervalo de predicción es el estimado de un intervalo en el cual caerán futuras observaciones, o sea, el rango de futuros ensayos.
Hasta el momento no son muchos los metaanálisis publicados que evalúen el efecto de los inotrópicos sobre la mortalidad en este grupo de pacientes, especialmente con el levosimendán como principal intervención33, aunque sigue siendo escasa la información en cuanto a comparaciones con diseño de metaanálisis en red34. Los metaanálisis disponibles poseen dificultades metodológicas, básicamente por combinar los escenarios de utilización del medicamento (cirugía cardiovascular, falla cardiaca aguda, sepsis), lo que se conoce como mezclar “peras con manzanas” (manzanas con naranjas)35–37, inclusión de estudios retractados posteriormente36,38 y la incertidumbre de los resultados del estudio CASINO15,39–42.
Este último fue un ensayo con asignación aleatoria a tres grupos de tratamiento: uno con levosimendán, otro con dobutamina y otro con placebo, en el que se buscó evaluar la mortalidad a 1 y 6 meses. Estaba planeado para incluir 600 pacientes, pero se suspendió en forma temprana cuando tenían una muestra de 299 pacientes (100 en el grupo de levosimendán, 100 en el de dobutamina y 99 en el placebo), debido a diferencias marcadas en mortalidad que favorecían al levosimendán; se encontró según lo reportado, mortalidad a 1 mes de 6,1% con levosimendán, 12,8% con dobutamina y 8,2% para placebo (p=0,1 vs. placebo y 0,04 vs. dobutamina); y mortalidad a 6 meses de 15,3% con levosimendán, 39,6% con dobutamina y 24,7% para placebo (p=0,0001 vs. dobutamina y 0,04 vs. placebo); sin embargo, el estudio solo se publicó en formato de resumen, por lo cual se desconocen detalles de su diseño, incluyendo los parámetros definidos para la suspensión temprana con solo la mitad de la población calculada inicialmente, hecho que puede afectar los resultados43, y discrepancias en los resúmenes disponibles, dado que en una publicación se menciona que se extrajeron 8 pacientes del análisis, pero en la siguiente se reporta el dato de 100% de seguimiento.
Infortunadamente, esta no ha sido la excepción en los grandes estudios con levosimendán, puesto que los resultados completos de los estudios REVIVE se conocieron mucho tiempo después de su terminación44. En los REVIVE I y II se evaluaron los cambios en el estado clínico en los primeros 5 días después de la aleatorización (se evaluaban a las 6 y 24 horas y a los 5 días), definidos como mejoría, sin cambio o empeoramiento18. En el REVIVE I se encontró que numéricamente más pacientes del grupo de levosimendán mejoraron y menos empeoraron en comparación con el placebo, tanto a 6 y 24 horas como a 5 días, pero este hallazgo no fue estadísticamente significativo (p=0,134 para todas las diferencias entre los grupos). En el REVIVE II las diferencias siempre fueron significativas a favor de levosimendán (p=0,015 con criterios estrictos y <0,001 con criterios menos estrictos para todas las diferencias entre los grupos). En cuanto a la mortalidad total a 90 días, si bien numéricamente se presentó una cifra mayor en los pacientes asignados al grupo de levosimendán, no fue estadísticamente significativa, con un HR de 1,26 (IC: 0,83-1,91) y p=0,29 para ambos estudios combinados18.
A pesar de la evidencia que demuestra pobre impacto sobre la mortalidad y el aumento de algunos efectos secundarios potencialmente peligrosos, los inotrópicos son necesarios en el manejo de pacientes con falla cardiaca aguda con reducción severa del gasto cardiaco que produce hipoperfusión generalmente con hipotensión, siempre y cuando se haya descartado hipovolemia u otras causas corregibles1,45. Los inodilatadores producen aumentos variables del gasto cardiaco y reducción de la resistencia vascular periférica y de la presión en cuña de la arteria pulmonar46–48. Los datos hemodinámicos favorecen el efecto del levosimendán y del milrinone, especialmente en presencia del efecto de betabloqueadores49,50. Sin embargo, se debe tener precaución con el uso de milrinone en pacientes con cardiopatía isquémica, puesto que un subanálisis del estudio OPTIME CHF demostró mayor mortalidad con su uso, en ese grupo específico51.
El uso del análisis por rangos de la probabilidad de clasificación acumulada (SUCRA) debe hacerse con precaución, ya que aunque es de más fácil acceso para el clínico, posee algunos problemas importantes al interpretarlos52. Esta evaluación puede ser inestable por los supuestos estadísticos53, se afectan por el número de tratamientos y estudios incluidos54 y por la estructura de la red55; por lo tanto, aunque el presente análisis demuestra una probabilidad mayor de ser el mejor tratamiento para el milrinone seguido por la dobutamina y en último lugar el levosimendán, debe interpretarse con cautela, máxime cuando no se demostraron diferencias estadísticamente significativas entre los tres tratamientos evaluados.
LimitacionesLa mayor limitación, inherente a todos los metaanálisis publicados hasta el momento en este escenario, es la inevitable heterogeneidad clínica observada en los estudios incluidos, aunque se pueda presumir transitividad dadas las características de la población. Para controlarlo se incluyeron solamente los estudios en falla cardiaca aguda, con fracción de eyección reducida, que reportaron el desenlace de interés, y solo en las comparaciones definidas. No fue posible hacer análisis de otros desenlaces, incluyendo los de seguridad, por inadecuado reporte en los ensayos clínicos. Medicamentos con eficacia limitada o pequeñas diferencias entre los tratamientos podrían, en teoría, requerir un número mayor de participantes en los estudios y en el global. Hay una diferencia marcada en el año de inicio de muchos de estos estudios que implica cambios tecnológicos y de tratamiento concomitante utilizados en ellos, que pueden influir en los resultados. A pesar de estas consideraciones, era importante establecer una aproximación que generara la menor incertidumbre posible para la toma de decisiones en la práctica diaria y sustentara una recomendación emitida por una guía de práctica clínica en la pregunta considerada, en la cual toma relevancia el aspecto de costo-efectividad.
ConclusionesEn pacientes con falla cardiaca aguda no hay diferencias en el uso de inotrópicos como el levosimendán, la dobutamina o el milrinone, en términos de reducción del desenlace de mortalidad. Por lo tanto, su indicación dependerá de otros aspectos como hipoperfusión, características basales de los pacientes y costo-efectividad de cada uno de ellos.
FinanciaciónGrupo para la Investigación de las Enfermedades Cardiovasculares.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflictos de interés y aspectos éticosLa investigación fue financiada con recursos propios del Grupo para la Investigación de las Enfermedades Cardiovasculares, de la sección de Cardiología de la Universidad de Antioquia y no hay conflictos de interés por declarar.
Los aspectos éticos se ajustan a los principios éticos fundamentales y a las directrices de la Declaración de Helsinki y similares, emanados de la Asociación Médica Mundial, y sigue las pautas del Ministerio de la Protección Social de la República de Colombia según la resolución 8430 de 1993 por la cual se dictan las normas científicas, técnicas y administrativas para la investigación en salud.