La miocardiopatía hipertrófica es un desorden genético, caracterizado por la hipertrofia del ventrículo izquierdo no explicada por causas secundarias, entre las que se encuentra ventrículo no dilatado y fracción de eyección preservada o aumentada1. Desde el punto de vista histológico se observan miocitos cardiacos hipertrofiados, desorganizados, perdiendo el alineamiento paralelo por una orientación al azar y separados por amplias áreas de fibrosis.
Se estima una prevalencia en población adulta de 1:625 – 1:344, no se observan patrones étnicos, geográficos o de distribución por sexo2. La hipertrofia ventricular es la piedra angular en el diagnóstico de la miocardiopatía hipertrófica. La presencia de una pared ventricular mayor a 15mm, es inicialmente suficiente para considerar la posibilidad de miocardiopatía hipertrófica.
Las diferentes modalidades de imagen en cardiología como el ecocardiograma y la resonancia cardiaca son fundamentales en el diagnóstico de la entidad, así como también al momento de establecer el pronóstico y evaluar la respuesta al tratamiento.
Hypertrophic cardiomyopathy is a genetic disorder, characterised by left ventricular hypertrophy not explained by secondary causes, including non-dilated ventricle and preserved or augmented ejection fraction.1 Histologically, hypertrophic cardiac myocytes are observed that are disorganised, losing parallel alignment due to random orientation, and separated by wide areas of fibrosis.
The estimated prevalence in the adult population is 1:625 – 1:344, no ethic, geographic or sex distribution patterns have been observed.2 Ventricular hypertrophy is the cornerstone in the diagnosis of hypertrophic cardiomyopathy. The presence of a ventricular wall greater than 15mm, suffices initially to consider the possibility of hypertrophic cardiomyopathy.
The different imaging modalities in cardiology such as echocardiogram and cardiac resonance are fundamental in the diagnosis of the entity, and when determining prognosis and assessing response to treatment.
La miocardiopatía hipertrófica es un desorden genético, caracterizado por hipertrofia del ventrículo izquierdo no explicada por causas secundarias, entre las que se encuentra un ventrículo no dilatado, con fracción de eyección preservada o aumentada1. Comúnmente, involucra al septum en la porción basal, pero pueden encontrarse diferentes fenotipos. Desde el punto de vista histológico, se observan miocitos cardiacos hipertrofiados y desorganizados, que pierden el alineamiento paralelo por una orientación al azar, y separados por amplias áreas de fibrosis. La extensión de esta última tiene un valor pronóstico ya que está relacionada con eventos clínicos adversos como falla cardiaca, muerte súbita y arritmias no fatales. Las arterias coronarias tienen paredes gruesas y lúmenes delgados embebidos en la porción fibrosa, característica que puede contribuir a la posibilidad de isquemia miocárdica3. A nivel bioquímico se ha documentado gran cantidad de productos de degradación del metabolismo del colágeno y niveles elevados de citoquinas, troponina cardiaca T y biomarcadores de inflamación que son reflejo de la necrosis y la fibrosis miocárdica.
GeneralidadesEn la población adulta, la miocardiopatía hipertrófica tiene una prevalencia alrededor de 1:625 a 1:344, pero no se ha documentado una distribución por etnia, relación geográfica o género de los pacientes2. Se ha establecido que casi el 60% de los casos tienen una expresión familiar, considerándolo un desorden genético, en la mayoría con compromiso de un único gen y un patrón de penetración autosómico dominante. Independiente de la presentación genética la variabilidad en la presentación fenotípica se debe a, que la mutación actúa en concierto con otros factores4.
Los pacientes con miocardiopatía hipertrófica pueden estar asintomáticos durante largos periodos de tiempo y posteriormente presentar síntomas secundarios a disfunción ventricular diastólica, obstrucción dinámica a nivel del tracto de salida del ventrículo izquierdo y arritmias. Los síntomas principales son disnea de esfuerzo, intolerancia al ejercicio, ortopnea, edema periférico y falla cardiaca con fracción de eyección conservada. Algunos pueden debutar con síncope, secundario a la obstrucción dinámica a nivel del tracto de salida del ventrículo izquierdo, en ausencia de arritmias. Otra causa común de consulta es el dolor torácico que puede ser explicado por un disbalance entre la oferta y la demanda de oxígeno. Cabe anotar también las palpitaciones, el presíncope y el síncope debido a arritmias que en su mayoría pueden obedecer a taquicardia ventricular no sostenida5.
EcocardiografíaEs el método de estudio inicial en los pacientes con sospecha de miocardiopatía hipertrófica, dada su capacidad para obtener imágenes no invasivas del corazón batiente en tiempo real y con alta resolución temporal-espacial. Es, además, un estudio costo-efectivo, ampliamente disponible, portátil y de fácil adquisición que proporciona excelente información acerca de la estructura y función del corazón6.
Un grosor de pared localizado o generalizado, mayor a 15mm, en ausencia de hipertensión u otra causa de sobrecarga de presión sobre el ventrículo, debe hacer sospechar la posibilidad de miocardiopatía hipertrófica, una vez se descarte también la posibilidad de enfermedades infiltrativas7. El uso de medio de contraste intracavitario ayuda a identificar aun mejor el reborde subendocárdico, permitiendo así una mejor medición del espesor de la pared. Adicionalmente, el contraste puede facilitar la visualización del compromiso de los segmentos apicales en la miocardiopatía hipertrófica apical, así como también permitir el diagnóstico de aneurismas apicales y trombos que pueden presentarse en estos pacientes8.
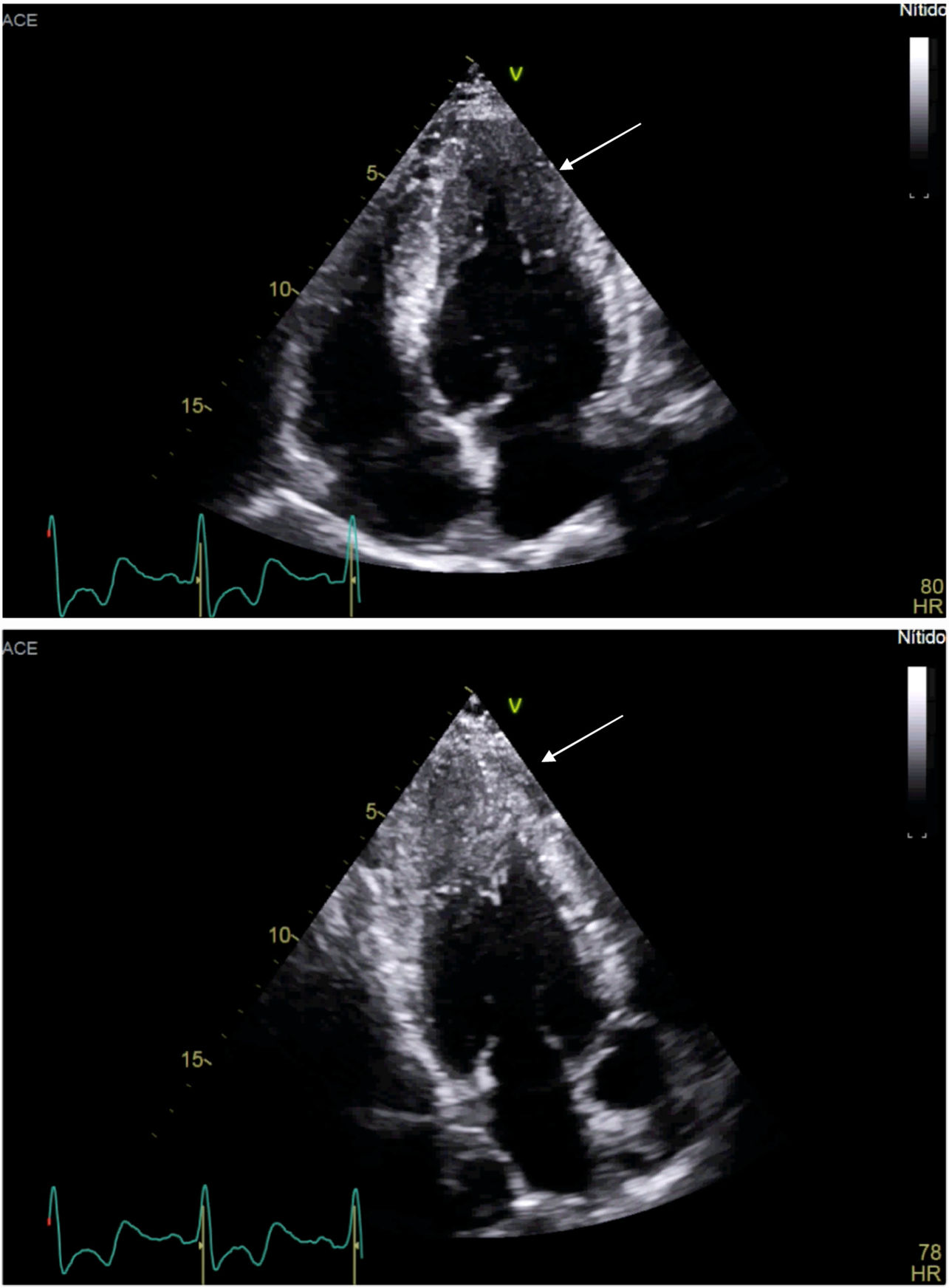
En la variedad más común, que es la septal asimétrica, se afecta principalmente el septum anterior, con una relación de grosor de este respecto a la pared libre del ventrículo (medidas tomadas en diástole) ≥ 1,3:1,02. En ocasiones se compromete sólo el ápex y se le denomina miocardiopatía hipertrófica apical (fig. 1). En esta última, un diámetro de 13mm de pared apical es un claro indicador de la enfermedad, más aún si hay relación familiar, genotipificación o características electrocardiográficas típicas asociadas.
En ocasiones menos frecuentes se evidencia compromiso de la pared posterior y lateral. Como hallazgo comúnmente asociado se observa elongación de la valva anterior de la válvula mitral, que podría estar acompañada de una implantación anormal de los músculos papilares. De manera infrecuente se puede ver comprometido el ventrículo derecho.
El volumen de fin de diástole de los pacientes con miocardiopatía hipertrófica es usualmente normal con fracción de eyección normal o elevada y volumen de fin de sístole disminuido. El tracto de salida del ventrículo izquierdo está invadido por la porción basal del septum interventricular. Se puede observar un movimiento sistólico anterior de la valva anterior de la válvula mitral (SAM) o de su aparato subvalvular, que puede estar favorecido por diferentes mecanismos, dentro de los que se encuentran la hipertrofia del septum, la implantación anterior y apical de los músculos papilares, los músculos papilares bifurcados y superumerarios, entre otros. Este movimiento sistólico anterior de la válvula mitral produce aceleración en las velocidades de flujo a nivel del tracto de salida del ventrículo izquierdo y así, un gradiente dinámico que en reposo se puede observar hasta en un tercio de los pacientes9.
La disfunción diastólica es frecuente y se debe a la fibrosis que produce alteración en la relajación del ventrículo y disminución de su compliance. El volumen auricular izquierdo, por tanto, como marcador indirecto de la presión de fin de diástole del ventrículo, está aumentado y se considera como predictor de fibrilación auricular y falla cardiaca10.
De otro lado, se deben tener en cuenta diagnósticos diferenciales como hipertensión arterial, estenosis valvular aórtica, enfermedad renal crónica (especialmente en diálisis), amiloidosis, corazón de atleta, enfermedades metabólicas (síndrome de Hurler y Hunter) y otras cardiopatías infiltrativas (Anderson-Fabry o enfermedad de Pompe). Se ha descrito miocardiopatía hipertrófica como parte del síndrome de Noonan y su variante, el síndrome de Leopard, y la ataxia de Friedreich2 (tabla 1).
Evaluación por ecocardiografía de pacientes con miocardiopatía hipertrófica
| Hipertrofia y distribución (incluyendo las dimensiones del ventrículo izquierdo y paredes ventrículo) |
| Fracción de eyección del ventrículo del izquierdo |
| Hipertrofia del ventrículo derecho y obstrucción |
| Volumen auricular izquierdo indexado a la superficie corporal |
| Función diastólica |
| Estimación de la presión de la arteria pulmonar |
| Obstrucción dinámica en reposo y con maniobra de Valsalva en el tracto de salida del ventrículo izquierdo, reportando el sitio de la obstrucción. |
| Evaluación de la válvula mitral y del aparato subvalvular, incluyendo la dirección, el mecanismo y la severidad de la insuficiencia mitral. |
| Consideración de eco trasesofágico como guía de la miectomía o ablación septal. |
| Como pesquisa en familiares de pacientes con miocardiopatía hipertrófica. |
Adaptada de: American Society of Echocardiography. Clinical recomendations for multimodality cardiovascular imaging of patients with hypertrophic cardiomyopathy. J Am Soc Echocardiogr. 2011;24:473-98.
La ecocardiografía 3D es útil en la medición de los volúmenes del ventrículo izquierdo, así como en la mejor cuantificación de la masa del ventricular. En fases avanzadas de la enfermedad, puede presentarse deterioro de la función sistólica del ventrículo izquierdo con fracción de eyección menor del 50%, aunque esto es infrecuente y solo ocurre en un 2% a un 5% de los pacientes, empeorando el pronóstico.
Ecocardiografía espectral y de doppler tisularLa evaluación hemodinámica por ecocardiografía es indispensable e incluye la evaluación de la función diastólica y la presión de la arteria pulmonar y de la aurícula derecha e izquierda, todo esto adicional a la evaluación morfológica con eco 2D y 3D. A través del Doppler tisular se miden las velocidades del movimiento miocárdico en sístole (reflejo del acortamiento miocárdico longitudinal) y diástole, encontrando que incluso antes de que se haga manifiesta la hipertrofia se puede observar disminución tanto en la velocidad sistólica como en la velocidad e’ diastólica. La alteración en los patrones de llenado y, por ende, la disfunción diastólica asociada, tienen valor pronóstico en la aparición de síntomas, la tolerabilidad al ejercicio y la aparición de desenlaces fuertes como falla cardiaca y muerte8. Así mismo, el seguimiento y la valoración de las presiones de llenado son útiles para evaluar la respuesta al tratamiento.
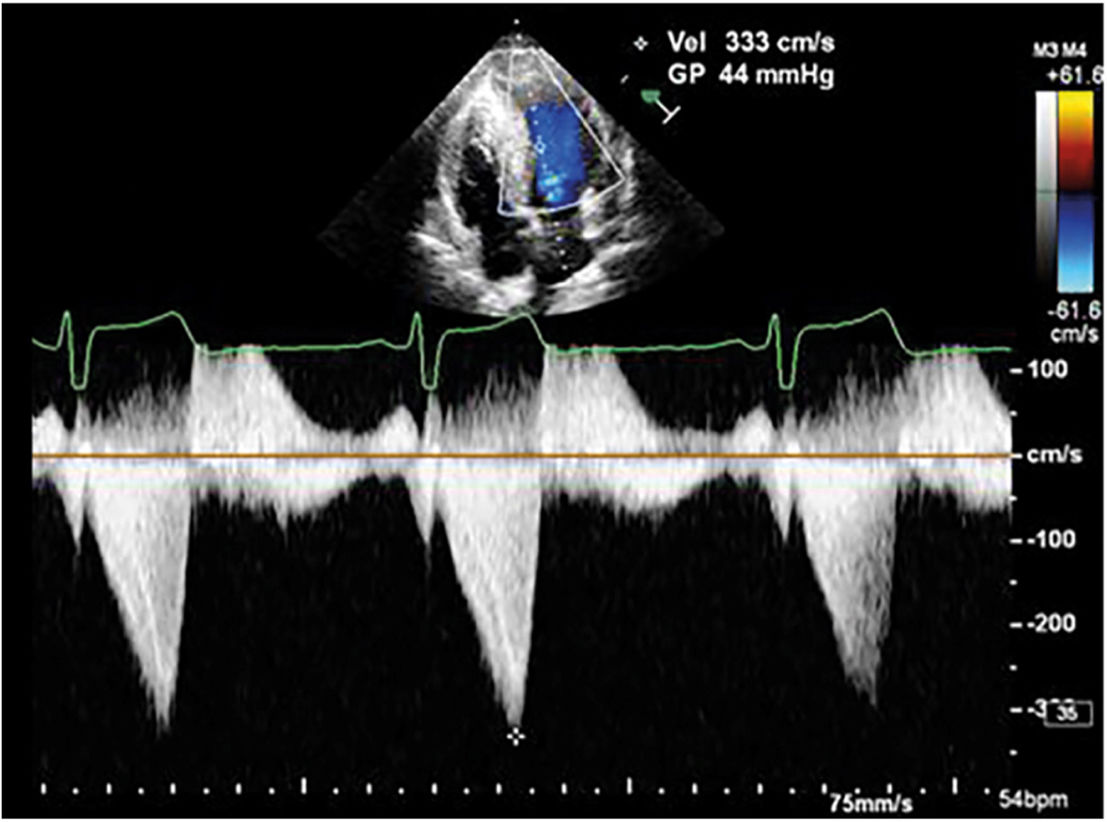
El doppler continuo a través del tracto de salida del ventrículo izquierdo, permite identificar el gradiente dinámico que se produce a ese nivel como consecuencia del movimiento sistólico anterior de la válvula mitral. La aceleración de las velocidades de flujo comienza hacia la mitad de la sístole y alcanza su máxima expresión al finalizar esta fase del ciclo cardiaco, con una concavidad a la izquierda del espectro doppler, comúnmente en forma de daga (fig. 2). La severidad del gradiente dinámico a través del tracto de salida del ventrículo izquierdo define a la miocardiopatía hipertrófica como obstructiva cuando este es mayor a 30mm Hg y es considerado como marcador de riesgo de muerte súbita.
Cuando hay obstrucción medio-ventricular se observa un patrón doppler característico, producido por una pequeña cantidad de sangre atrapada a nivel del ápex, que se hace evidente sólo hasta que comienza la diástole y se relaja el ventrículo, con un flujo en dirección hacia la mitral en diástole, conocido como flujo paradójico.
Válvula mitralLa insuficiencia mitral que comúnmente se observa en la miocardiopatía hipertrófica se debe al movimiento sistólico anterior de la valva anterior de la válvula mitral, que produce un defecto de coaptación y, secundario a eso, un jet de insuficiencia que es excéntrico y se dirige hacia la pared posterior y lateral de la aurícula izquierda5, especialmente hacia el tercio medio y final de la sístole6. La severidad de la insuficiencia dependerá de las características de la valva posterior. Si la valva posterior es redundante y móvil, acompañará a la valva anterior hacia el tracto de salida del ventrículo izquierdo, y por consiguiente, la insuficiencia será menor5. La ecocardiografía 2D ayuda a descartar cambios propios de la válvula y del aparato subvalvular que podrían contribuir al mecanismo de la insuficiencia mitral y generar jets con una dirección diferente.
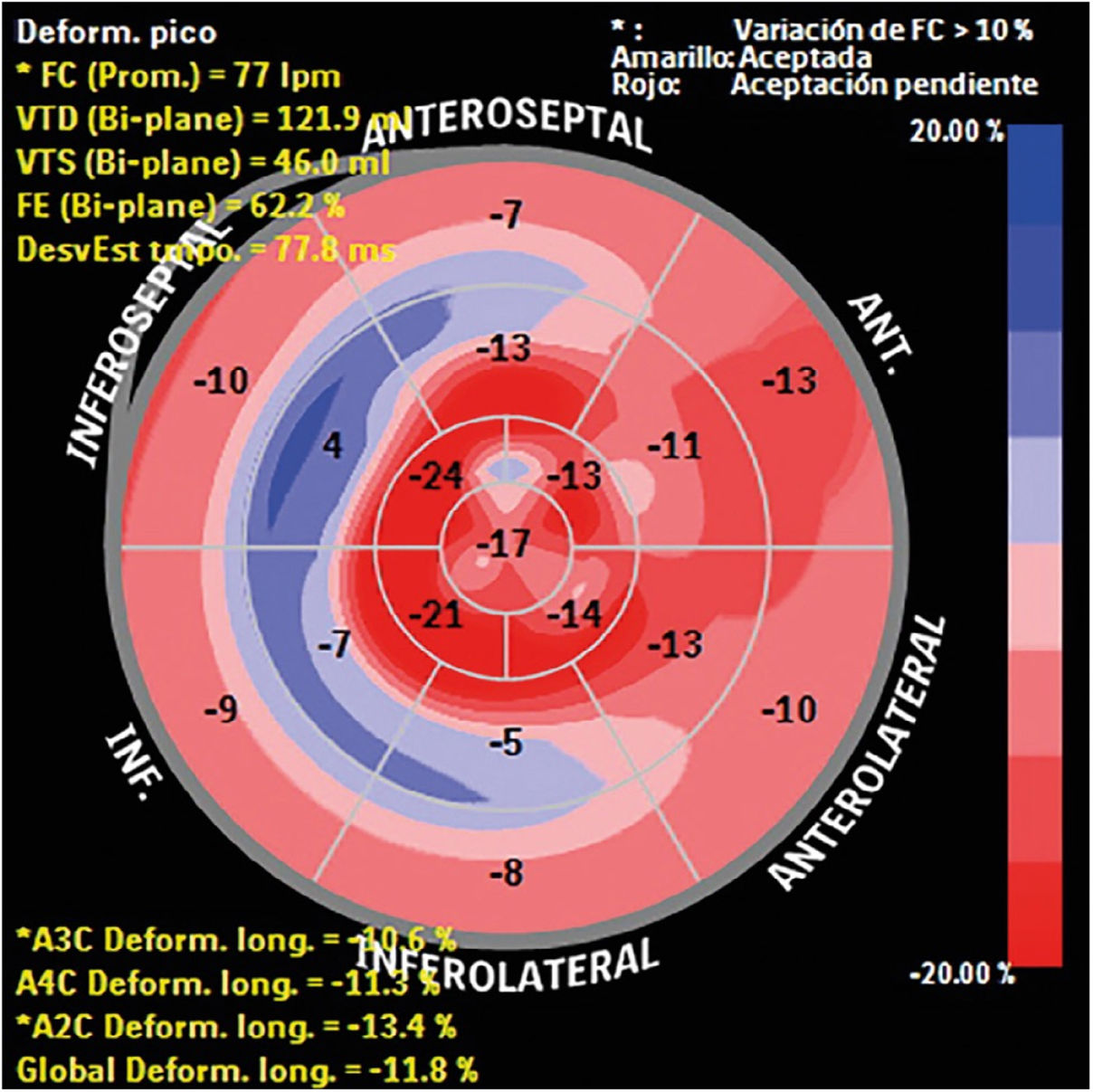
Strain – deformidad miocárdicaEl strain permite diferenciar la miocardiopatía hipertrófica de la hipertrofia inducida por hipertensión arterial, las miocardiopatías infiltrativas (amiloidosis) y otras de depósito. En la miocardiopatía hipertrófica, particularmente, se evidencia disminución en el strain longitudinal y un strain circunferencial reforzado que está en relación con la extensión de la hipertrofia y el desarreglo de las fibras miocárdicas en la capa más interna del miocardio7 (fig. 3).
Imágenes de torsiónDebido a la composición del miocardio en fibras miocárdicas organizadas en hélices, con fibras subendocárdicas con hélice hacia la derecha y fibras subepicárdicas en hélice hacia la izquierda, durante la sístole se observa superposición de movimiento y acumulación de energía liberada abruptamente en diástole, traduciéndose en un movimiento resultante de torsión. La velocidad de torsión se calculan a nivel apical y basal de ventrículo, así como también la dirección absoluta, la tasa y la magnitud de la torsión ventricular. En los pacientes con miocardiopatía hipertrófica la torsión dependerá del sitio y la extensión de la hipertrofia y la presencia o ausencia de obstrucción al flujo. La torsión está atenuada en estados tempranos de la miocardiopatía hipertrófica no obstructiva y claramente reducida cuando se acompaña de obstrucción8 (figs. 4-7).
Debido a la complejidad y las limitaciones de la evaluación clínica de la miocardiopatía hipertrófica, las técnicas de imagen multimodal adicionales a la ecocardiografía, como lo son la resonancia cardiaca magnética (CMR) y la tomografía computarizada de corazón (CCT), proveen un rango de información amplia, que va desde el diagnóstico inicial, hasta información útil en la estratificación de riesgo de muerte súbita11.
Aunque el diagnóstico de la miocardiopatía hipertrófica se puede establecer inicialmente por ecocardiografía 2D, en los últimos años el uso adicional de la resonancia magnética cardiaca ha venido en aumento, dado que es una modalidad de imagen avanzada 3D tomográfica, que provee imágenes con alta resolución espacial y temporal en cualquier plano, y sin la utilización de radiación ionizante, capaz de proveer información precisa del espesor de pared, estimación de volúmenes y función de ambos ventrículos, así como también caracterización tisular, que permite la detección de fibrosis12.
La resonancia magnética cardiaca está recomendada en pacientes con sospecha de miocardiopatía hipertrófica, con una ventana acústica ecocardiográfica inadecuada que impida confirmar el diagnóstico (Recomendación IB)13,14. También en aquellos que ya tengan diagnóstico confirmado de miocardiopatía hipertrófica, en quienes se requiera información adicional que pueda impactar el manejo o la decisión de intervención invasiva, como la distribución de la hipertrofia y la anatomía del aparato valvular mitral y de los músculos papilares. El estudio con resonancia es razonable en aquellos pacientes con miocardiopatía hipertrófica conocida cuando la estratificación de muerte súbita no esté bien definida con los factores de riesgo convencionales (Recomendación IIb C)13,14.
Antes de realizar la CMR, es de suma importancia obtener información clínica sobre las condiciones y evolución del paciente, teniendo en cuenta que estos elementos pueden cambiar considerablemente el protocolo del estudio. Por ejemplo, conocer la presencia de alteraciones en el electrocardiograma (EKG) como complejos QRS de baja amplitud, que sugieran enfermedad infiltrativa (amiloidosis específicamente), puede facilitar la interpretación de las secuencias de realce tardío con hallazgos que son usuales en esa enfermedad, así como también definir la necesidad de secuencias de mapeo T1 y T2 (cuando esté disponible) que pueden ser útiles en esos casos. En situaciones menos frecuentes, como en casos con un eje izquierdo extremo y fenotipo facial que sugiera síndrome de Noonan, será necesario evaluar con mucha precaución el tracto de salida del ventrículo derecho y la válvula pulmonar12.
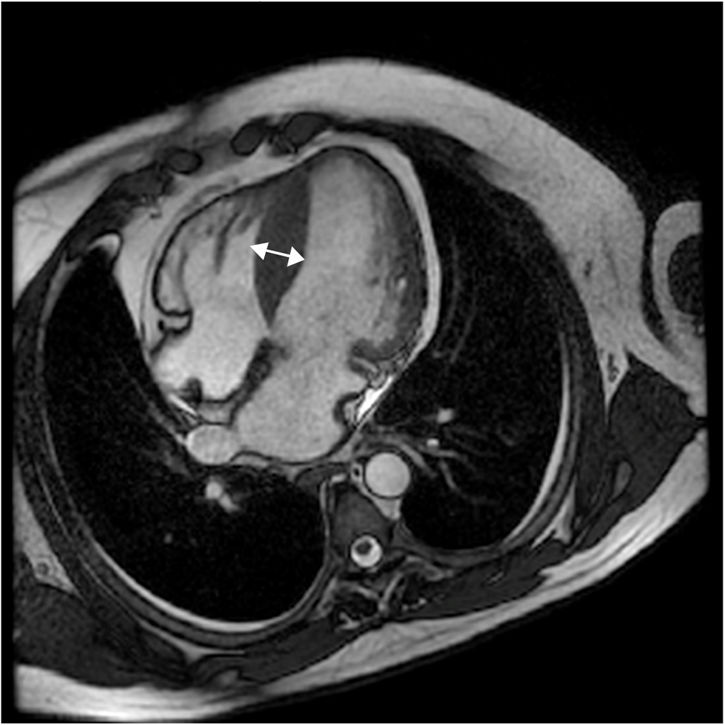
Técnicas utilizadas durante resonancia magnética cardiaca en miocardiopatía hipertróficaCine SSFP (steady-state free precession)La secuencia de cine se usa para la evaluación de la función cardiaca y la morfología por su alto contraste entre el miocardio y la sangre, al igual que por su alta resolución temporal15. Esta secuencia es capaz de definir todos los fenotipos de la miocardiopatía hipertrófica porque no tiene limitación visual, como aquellas miocardiopatías hipertróficas apicales o localizadas (inferior o lateral) que pueden no ser identificadas por ecocardiografía16. En CMR el hallazgo de grosor de la pared mayor a 30mm es un factor de riesgo para muerte súbita, por lo cual este hallazgo, sumado a los factores de riesgo, puede ser útil en la estratificación de estos pacientes17.
La resonancia cardiaca es el patrón de oro para la evaluación del grosor del ventrículo izquierdo y la medición de los volúmenes cardiacos, por su alta resolución espacial y temporal. Detecta con mayor frecuencia la hipertrofia ventricular que el ecocardiograma18, ya que el este subestima el grosor de la pared, en un 20%19.
La extensión de la hipertrofia ventricular izquierda se define como: focal (1-2 segmentos hipertrofiados), intermedia (3-7 segmentos hipertrofiados) y difusa (8-16 segmentos hipertrofiados)12.
Realce tardío con gadolinioEs la secuencia más valiosa de la CMR, porque identifica la fibrosis miocárdica como marcador pronóstico en este grupo de pacientes, ya que existe una relación entre fibrosis y taquicardia ventricular y muerte súbita asociada a miocardiopatía hipertrófica20. También el realce tardío es útil en la diferenciación de miocardiopatía hipertrófica de otras miocardiopatías con similares síntomas, como lo son la amiloidosis cardiaca, la enfermedad de Fabry, la cardiopatía hipertensiva o la estenosis aórtica15.
Secuencias potenciadas en T2Evidencia edema miocárdico, que puede estar en relación con dolor torácico, síncope o elevación de biomarcadores. El edema puede estar en la misma zona en la que se identifica el realce tardío; sin embargo, no es un hallazgo frecuente15.
Contraste de faseLa secuencia cine de fase de contraste puede usarse para cuantificar la velocidad de flujo del gradiente dinámico a través del tracto de salida del ventrículo izquierdo; no obstante, por dificultad técnica que requiere experticia en la codificación de velocidad y posicionamiento, no la hacen una herramienta útil en la rutina clínica, siendo superior la evaluación por ecocardiografía15 (tabla 2).
Rol de la imagen en la estratificación de riesgo en miocardiopatía hipertrófica21
| Factor de riesgo | Indicador pronóstico |
|---|---|
| Grosor de pared del ventrículo izquierdo | Mayor o igual de 30 mm |
| Gradiente a través de LVOT | Mayor o igual a 30mm Hg |
| Realce tardío de gadolinio | Fibrosis |
| Fracción de eyección | Menor al 50% |
| Otros | Aneurisma apical del ventrículo izquierdo |
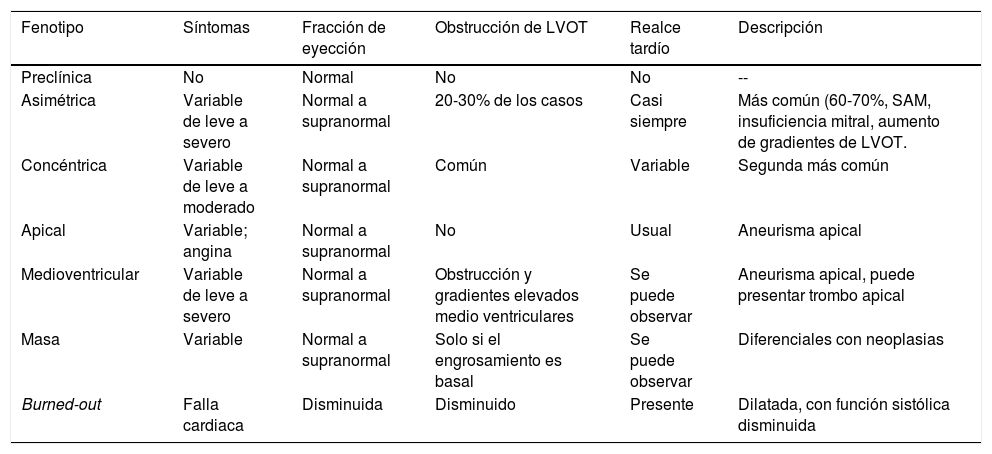
La caracterización precisa de la morfología de la miocardiopatía hipertrófica es valiosa para establecer la mejor opción de terapia invasiva, la cual incluye la miectomía septal o la ablación septal con alcohol. Los fenotipos permiten definir la localización y la magnitud de la hipertrofia y la caracterización del aparato mitral y submitral, así como de los músculos papilares (tabla 3).
Espectro de fenotipos en miocardiopatía hipertrófica18
| Fenotipo | Síntomas | Fracción de eyección | Obstrucción de LVOT | Realce tardío | Descripción |
|---|---|---|---|---|---|
| Preclínica | No | Normal | No | No | -- |
| Asimétrica | Variable de leve a severo | Normal a supranormal | 20-30% de los casos | Casi siempre | Más común (60-70%, SAM, insuficiencia mitral, aumento de gradientes de LVOT. |
| Concéntrica | Variable de leve a moderado | Normal a supranormal | Común | Variable | Segunda más común |
| Apical | Variable; angina | Normal a supranormal | No | Usual | Aneurisma apical |
| Medioventricular | Variable de leve a severo | Normal a supranormal | Obstrucción y gradientes elevados medio ventriculares | Se puede observar | Aneurisma apical, puede presentar trombo apical |
| Masa | Variable | Normal a supranormal | Solo si el engrosamiento es basal | Se puede observar | Diferenciales con neoplasias |
| Burned-out | Falla cardiaca | Disminuida | Disminuido | Presente | Dilatada, con función sistólica disminuida |
Actualmente existen nuevas secuencias y aplicaciones que están usándose ampliamente en investigación y se encuentran en validación. Una de ellas es la marcación (tagging), la cual evalúa el strain de manera cuantitativa, que se halla disminuido en zonas con realce tardío. Otra técnica es el mapeo (mapping) T1 y T2, que permite la identificación de fibrosis y edema, sin la necesidad de administrar medio de contraste. Pese e ello, la correlación clínica de esta última técnica aun no se ha confirmado con estudios actuales15.
Criptas miocárdicasSon anormalidades en la fibra miocárdica descritas en adultos sanos y también asociadas a pacientes con miocardiopatía hipertrófica en menos del 5% de los casos. Estas invaginaciones se encuentran perpendiculares al endocardio del ventrículo izquierdo y penetran más del 50% del miocardio compacto al final de la diástole, generalmente localizadas en la cara inferior o basal inferoseptal22.
Elongación de las valvas mitralesMúltiples estudios han reportado la elongación de los folletos de la válvula mitral, particularmente en la forma obstructiva. Se ha observado en pacientes sin hipertrofia, pero portadores de la mutación genética, como marcador preclínico fenotípico23.
Estratificación de riesgoLa muerte súbita en miocardiopatía hipertrófica es infrecuente (0,5-1% al año)22; pese a ello, es necesaria una estratificación de riesgo que permita definir qué pacientes se beneficiarán del implante de un cardiodesfibrilador como prevención primaria. Los modelos actuales de estratificación son muy eficaces para identificar a los pacientes que más se benefician; sin embargo, ninguna de las escalas actuales incluye realce tardío, el cual ha demostrado en múltiples publicaciones, ser el sustrato arritmogénico de las taquiarritmias ventriculares24,25, considerándose especialmente relevante cuando su extensión es mayor al 15% de la masa del ventrículo izquierdo26,27.
La tomografía computarizada cardiaca (CCT) debe considerarse en pacientes con limitaciones en la ventana ecocardiográfica y que tengan contraindicación para la realización de resonancia cardiaca (Recomendación IIa C)12. Así mismo, se recomienda en la detección de enfermedad coronaria en pacientes con miocardiopatía hipertrófica y dolor torácico con probabilidad intermedia/alta, cuando el diagnóstico de la misma cambie las estrategias de manejo (Recomendación I C)13.
ConclusionesLa ecocardiografía y la resonancia magnética cardiaca desempeñan un rol complementario. La ecocardiografía es la modalidad inicial utilizada en el estudio de los pacientes con sospecha de miocardiopatía hipertrófica, es de fácil realización, accesibilidad y bajo costo. La resonancia cardiaca estima mejor el espesor de las paredes, especialmente en casos en los que la visualización del reborde subendocárdico no es adecuado. De igual forma, permite caracterizar el tejido para así poder hacer el diagnóstico diferencial con otras enfermedades que también pueden aumentar el espesor del miocardio, como la amiloidosis. Las secuencias de realce tardío permiten identificar fibrosis, importante en la estratificación del riesgo de muerte súbita. La tomografía cardiaca se reserva solo en aquellos casos en los que el ecocardiograma no permite estimar de manera adecuada el espesor de las paredes y cuando el paciente tenga alguna contraindicación para la resonancia cardiaca (tablas 4 y 5).
Ventajas y desventajas de la cardiorresonancia en miocardiopatía hipertrófica12
| Indicaciones | Ventajas | Desventajas |
|---|---|---|
| Fibrosis | Excelente resolución espacial | Dispositivos médicos implantados que contraindiquen. |
| Evaluación anatómica previa a terapia de reducción invasiva | Excelente resolución temporal | La claustrofobia puede limitar su uso |
| Diagnósticos diferenciales | Contraste | Reacciones adversas a medios de contraste |
| Complementarias a ecocardiograma | Fibrosis |
Ventajas y desventajas de la tomografía cardiaca en miocardiopatía hipertrófica12
| Indicaciones | Ventajas | Desventajas |
|---|---|---|
| Arterias epicárdicas | Resolución espacial | Radiación |
| Puentes miocárdicos | Arterias coronarias | Baja resolución temporal |
| Arterias septales preprocedimiento | No hay protocolos | |
| Imágenes subóptimas en ecocardiograma y cardiorresonancia. | Uso de medios de contraste ionizantes |
Ninguna.
Conflicto de interesesNinguno.