La definición más actualizada de falla cardiaca avanzada incluye síntomas refractarios al tratamiento convencional, independiente de la fracción de eyección del ventrículo izquierdo, acompañados de elevación de péptidos natriuréticos. En esta nueva definición se destacan condiciones específicas como son la necesidad usual de diurético intravenoso, hospitalizaciones o consultas frecuentes por falla cardíaca, medicación inotrópica intermitente y arritmias malignas recurrentes.
Esta condición está presente en aproximadamente 4 a 6% de los pacientes con falla cardiaca y se asocia a más síntomas, más comorbilidades y mayor mortalidad (hasta 75% a un año). En este punto, las terapias convencionales han fallado o son refractarias y se requiere la toma de decisiones para instaurar tratamientos más avanzados (p. ej.: inotrópicos, asistencia ventricular, trasplante cardiaco, cuidado paliativo, entre otras).
El tratamiento representa un reto para los sistemas de salud de Colombia por la necesidad de optimizar y racionalizar el uso de estos recursos; por esto se debe considerar que estos pacientes, en algún momento de su evolución, que sean remitidos para valoración en las Clínicas de Falla Cardíaca ya que estos servicios cuentan con personal altamente calificado y una estructura administrativa, logística y tecnológica que garantizan el acceso a un tratamiento integral y multidisciplinario con estándares de calidad internacionales que es lo que finalmente se requiere en estas condiciones.
En el “Consenso colombiano de falla cardiaca avanzada” se presentan diferentes opciones de tratamiento a considerar y un modelo de atención integral que inicia desde el momento del diagnóstico hasta etapas refractarias y avanzadas.
The most up-to-date definition of advanced heart failure includes symptoms refractory to conventional treatment (regardless of the left ventricular ejection fraction), accompanied by an elevation in natriuretic peptides. Specific conditions are highlighted in this new definition, such as the usual need of an intravenous diuretic, hospital admissions, or frequent consultations due to heart failure, intermittent inotropic medication, and recurrent malignant arrhythmias.
This condition is present in approximately 4 to 6% of patients with heart failure and is associated with more symptoms, more comorbidities, and higher mortality (up to 75% at one year). On this point, the conventional treatments have failed, or are refractory, and decisions need to be taken to introduce more advanced treatments (for example: inotropic, ventricular assistance, palliative care, among others).
The treatment represents a challenge for the Health Systems of Colombia due to the need to optimise and rationalise the use of these resources. For this reason, it must be considered that these patients, at any time during its course, may be sent for assessment in Heart Failure Clinics, as these services have highly qualified staff and an administrative, logistics, and technological structure that ensures access to an integral and multidisciplinary treatment with standards of international quality, which is what is finally required in these conditions.
Different treatment options to consider are presented in the “Colombian consensus on advanced heart failure”, as well as an integral care model that begins from the time of the diagnosis until the refractory and advanced stages.
American Heart Association/American College of Cardiology
antiinflamatorios no esteroideos
antagonista de receptor de angiotensina
inhibidor de neprilisina y del receptor de angiotensina
membrana de oxigenación extracorpórea
fracción de eyección del ventrículo izquierdo
Heart Failure Survival Score
inhibidor de la enzima convertidora de angiotensina
International Mechanically Assisted Circulatory Support
Interagency Registry for Mechanically Assisted Circulatory Support
The International Society of Heart and Lung Transplantation
New York Heart Association
Seattle Heart Failure Model; VO2 consumo de oxígeno
El tratamiento de la falla cardiaca (FC) representa un gran reto para los sistemas de salud de Colombia, dada la imperiosa necesidad de optimizar y racionalizar el uso de recursos especializados.
Teniendo en cuenta la complejidad del tratamiento de los pacientes con falla cardiaca avanzada, estos deben ser remitidos en algún momento de su evolución para su valoración en las Clínicas de falla cardiaca y en las Clínicas de falla cardiaca y trasplante cardiaco, ya que estos servicios cuentan con personal altamente calificado y una estructura administrativa, logística y tecnológica que garantizan el acceso a un tratamiento integral y multidisciplinario con estándares de calidad internacionales, que es lo que finalmente se requiere en estas condiciones1,2.
DefiniciónLa falla cardiaca es un síndrome clínico que se caracteriza por síntomas y signos derivados de un compromiso funcional y estructural del corazón, o ambos, representados en reducción del gasto cardíaco y aumento de las presiones intracavitarias. Estas anormalidades se traducen en congestión e hipoperfusión sistémica, elementos que conducen a ineficiencia del corazón para hacer llegar los suficientes nutrientes y elementos necesarios a los diferentes órganos. Desde el punto de vista clínico, se caracteriza por síntomas como dificultad respiratoria y fatigabilidad fácil, que usualmente se acompañan de signos como ingurgitación yugular, estertores pulmonares y edema de miembros inferiores, entre otros3,4.
La definición actual de falla cardiaca está determinada también por los diferentes estadios en los cuales aparecen los signos y síntomas (estadios ACC/AHA). Sin embargo, hay que tener en cuenta que en etapas iniciales el paciente puede estar asintomático, pero poseer cambios estructurales o anormalidades en el funcionamiento cardíaco (disfunción sistólica asintomática). Por consiguiente, el reconocimiento de estos estadios es fundamental para el inicio oportuno del tratamiento de las condiciones precursoras y de esta forma prevenir la progresión hasta falla cardiaca. Se reconocen cuatro etapas o estadios en falla cardiaca: estadio A (factores de riesgo para padecer falla cardiaca), estadio B (alteración estructural y/o funcional asintomática), estadio C (alteración estructural y/o funcional sintomática), y estadio D (paciente refractario al tratamiento instaurado)5. Asimismo, es crucial determinar la etiología (valvular, isquémica, hipertensiva, inflamatoria...) para poder iniciar un tratamiento específico y modificar el pronóstico de la enfermedad6.
La definición más actualizada de falla cardiaca avanzada incluye síntomas refractarios al tratamiento convencional, independiente de la fracción de eyección del ventrículo izquierdo, acompañados de elevación de péptidos natriuréticos. En esta nueva definición se destacan condiciones específicas, como la necesidad frecuente de diurético intravenoso, hospitalizaciones o consultas frecuentes por falla cardiaca, medicación inotrópica intermitente y arritmias malignas recurrentes7.
Con base en lo anterior, se tendrán presentes todos los siguientes criterios para considerar falla cardiaca avanzada7:
- 1.
Síntomas severos y persistentes (clase funcional de la New York Heart Association –NYHA– III avanzada - IV).
- 2.
Disfunción cardíaca severa definida como FEVI ≤ 30%, falla cardíaca derecha aislada, anormalidades congénitas o valvulares inoperables y disfunción diastólica severa con elevación de péptidos natriuréticos (BNP o NT-proBNP).
- 3.
Hospitalizaciones recurrentes o consultas no planeadas en el último año por episodios de congestión (pulmonar o sistémica), bajo gasto o arritmias ventriculares malignas.
- 4.
Necesidad de ciclos intermitentes de soporte inotrópico.
- 5.
Capacidad limitada de ejercicio de origen cardiovascular (prueba de caminata de 6 minutos<300 m, VO2 <14ml/kg/min o menor al 50% del predicho para la edad).
La falla cardiaca se clasifica en tres grupos según la FEVI (tabla 1). Esta clasificación incluye además los péptidos natriuréticos (PN), la función diastólica (flujo transmitral) y el volumen auricular izquierdo4. También se puede clasificar de acuerdo con estadios (ACC/AHA), clase funcional o síntomas con base en la propuesta de la NYHA (tabla 2)8.
Clasificación de la falla cardiaca según fracción de eyección del ventrículo izquierdo
| Tipo de insuficiencia cardiaca | FEVI reducida | FEVI en rango medio, intermedio o levemente reducida | FEVI preservada o conservada |
|---|---|---|---|
| Criterios | |||
| 1 | Signos y/o síntomas | Signos y/o síntomas | Signos y/o síntomas |
| 2 | FEVI <40% | FEVI 40 - 49% | FEVI> 49% |
| 3 | PN elevado | PN elevado | |
| a. Anormalidad estructural relevante o | a. Anormalidad estructural relevante o | ||
| b. Disfunción diastólica | b. Disfunción diastólica | ||
Clasificación de la falla cardiaca según clase funcional
| Clase funcional | Definición |
|---|---|
| NYHA I | Sin limitación. Las actividades físicas habituales no causan disnea, cansancio o palpitaciones. |
| NYHA II | Ligera limitación de la actividad física. El paciente está bien en reposo, la actividad física habitual le causa disnea, cansancio, palpitaciones o angina. |
| NYHA III | Limitación marcada de la actividad física. El enfermo está bien en reposo, pero actividades menores le causan síntomas. |
| NYHA IV | Incapacidad de cualquier actividad física sin síntomas. Los síntomas están presentes incluso en reposo. Con cualquier actividad se incrementan. |
La falla cardiaca avanzada se presenta en aproximadamente 4 a 6% de los pacientes con falla cardiaca y se asocia a más síntomas, más comorbilidades y mayor mortalidad (hasta 75% a un año). En este punto las terapias convencionales han fallado o son refractarias y se requiere la toma de decisiones para instaurar tratamientos más avanzados (p. ej.: inotrópicos, dispositivo de asistencia ventricular, trasplante cardiaco, cuidado paliativo). Aunque no hay una definición uniforme de falla cardiaca avanzada, hay algunas características que son sugestivas de esta etapa (tabla 3)4,5,9–11.
Características de la falla cardiaca avanzada
| • Necesidad de soporte inotrópico para alivio sintomático o perfusión de órganos |
| • Consumo pico <14 ml/kg/min o menos del 50% del predicho |
| • Test de caminata 6 minutos: <300 metros |
| • 2 Hospitalizaciones o visitas no planeadas por falla cardiaca en los últimos doce meses. |
| • Disfunción ventricular derecha, empeoramiento de la insuficiencia cardiaca derecha e hipertensión pulmonar. |
| • Refractariedad al diurético y/o empeoramiento de la función renal. |
| • Limitación circulatoria (hipotensión arterial) para el uso de medicamentos bloqueadores neurohormonales. |
| • Clase funcional avanzada III/IV. |
| • Incremento de la mortalidad con escalas de modelos de sobrevida. |
| • Hiponatremia persistente. |
| • Arritmia ventricular refractaria (manejo farmacológico o múltiples descargas de cardiodesfibrilador implantable) |
| • Caquexia cardíaca |
| • Incapacidad para realizar actividades de la vida diaria |
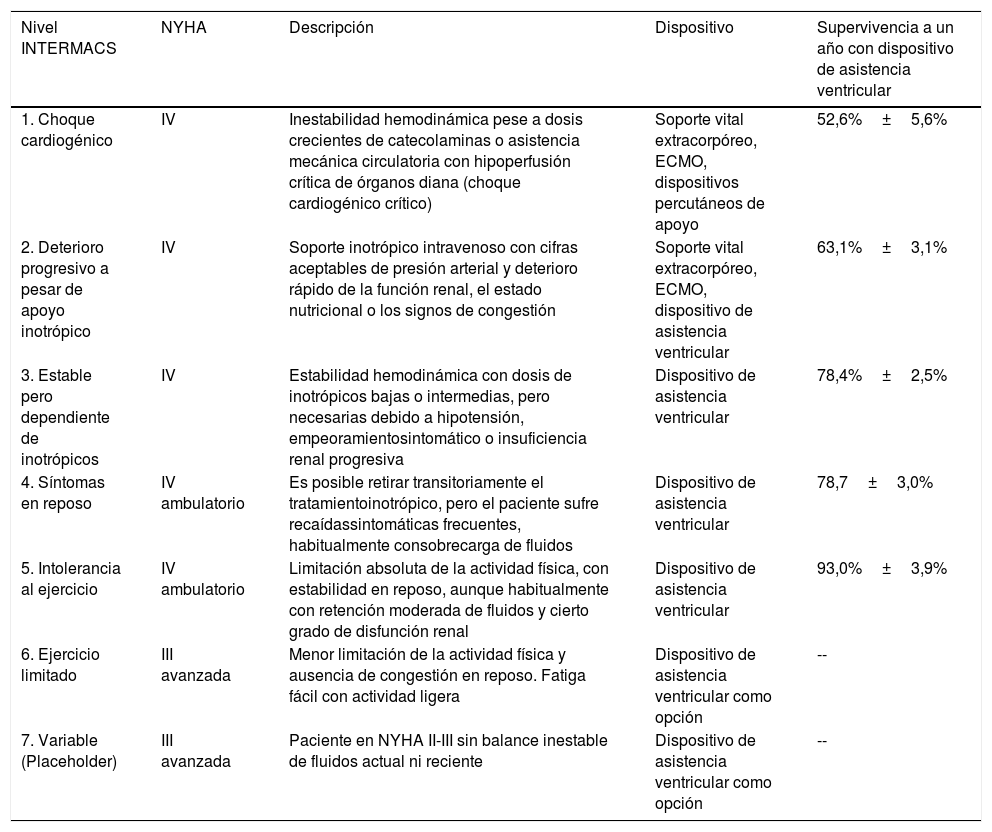
La clasificación de la falla cardiaca avanzada más utilizada es la derivada del registro INTERMACS, que también sirve para guiar el tratamiento de acuerdo con el nivel donde se clasifique el paciente (tabla 4)4,5,11–13.
Clasificación INTERMACS
| Nivel INTERMACS | NYHA | Descripción | Dispositivo | Supervivencia a un año con dispositivo de asistencia ventricular |
|---|---|---|---|---|
| 1. Choque cardiogénico | IV | Inestabilidad hemodinámica pese a dosis crecientes de catecolaminas o asistencia mecánica circulatoria con hipoperfusión crítica de órganos diana (choque cardiogénico crítico) | Soporte vital extracorpóreo, ECMO, dispositivos percutáneos de apoyo | 52,6%±5,6% |
| 2. Deterioro progresivo a pesar de apoyo inotrópico | IV | Soporte inotrópico intravenoso con cifras aceptables de presión arterial y deterioro rápido de la función renal, el estado nutricional o los signos de congestión | Soporte vital extracorpóreo, ECMO, dispositivo de asistencia ventricular | 63,1%±3,1% |
| 3. Estable pero dependiente de inotrópicos | IV | Estabilidad hemodinámica con dosis de inotrópicos bajas o intermedias, pero necesarias debido a hipotensión, empeoramientosintomático o insuficiencia renal progresiva | Dispositivo de asistencia ventricular | 78,4%±2,5% |
| 4. Síntomas en reposo | IV ambulatorio | Es posible retirar transitoriamente el tratamientoinotrópico, pero el paciente sufre recaídassintomáticas frecuentes, habitualmente consobrecarga de fluidos | Dispositivo de asistencia ventricular | 78,7±3,0% |
| 5. Intolerancia al ejercicio | IV ambulatorio | Limitación absoluta de la actividad física, con estabilidad en reposo, aunque habitualmente con retención moderada de fluidos y cierto grado de disfunción renal | Dispositivo de asistencia ventricular | 93,0%±3,9% |
| 6. Ejercicio limitado | III avanzada | Menor limitación de la actividad física y ausencia de congestión en reposo. Fatiga fácil con actividad ligera | Dispositivo de asistencia ventricular como opción | -- |
| 7. Variable (Placeholder) | III avanzada | Paciente en NYHA II-III sin balance inestable de fluidos actual ni reciente | Dispositivo de asistencia ventricular como opción | -- |
Los pacientes que cumplan la definición de falla cardiaca deberán ser enviados para evaluación y manejo integral por una Clínica de falla cardiaca. La remisión de los pacientes deberá contener2,14:
- -
Resumen detallado de la historia clínica que incluya:
- ∘
Identificación
- ∘
Antecedentes cardiovasculares
- ∘
Tipo y respuesta a intervenciones en falla cardiaca realizadas previamente
- ∘
Fecha y duración de hospitalizaciones
- ∘
Tratamiento farmacológico recibido
- ∘
Información de dispositivos implantados (terapia de resincronización cardiaca, cardiodesfibrilador implantable)
- ∘
- -
Examen físico
- -
Anexar todos los estudios imagenológicos (radiografías, electrocardiogramas, ecocardiogramas, cateterismos…), de laboratorio y todas las pruebas cardiovasculares realizadas
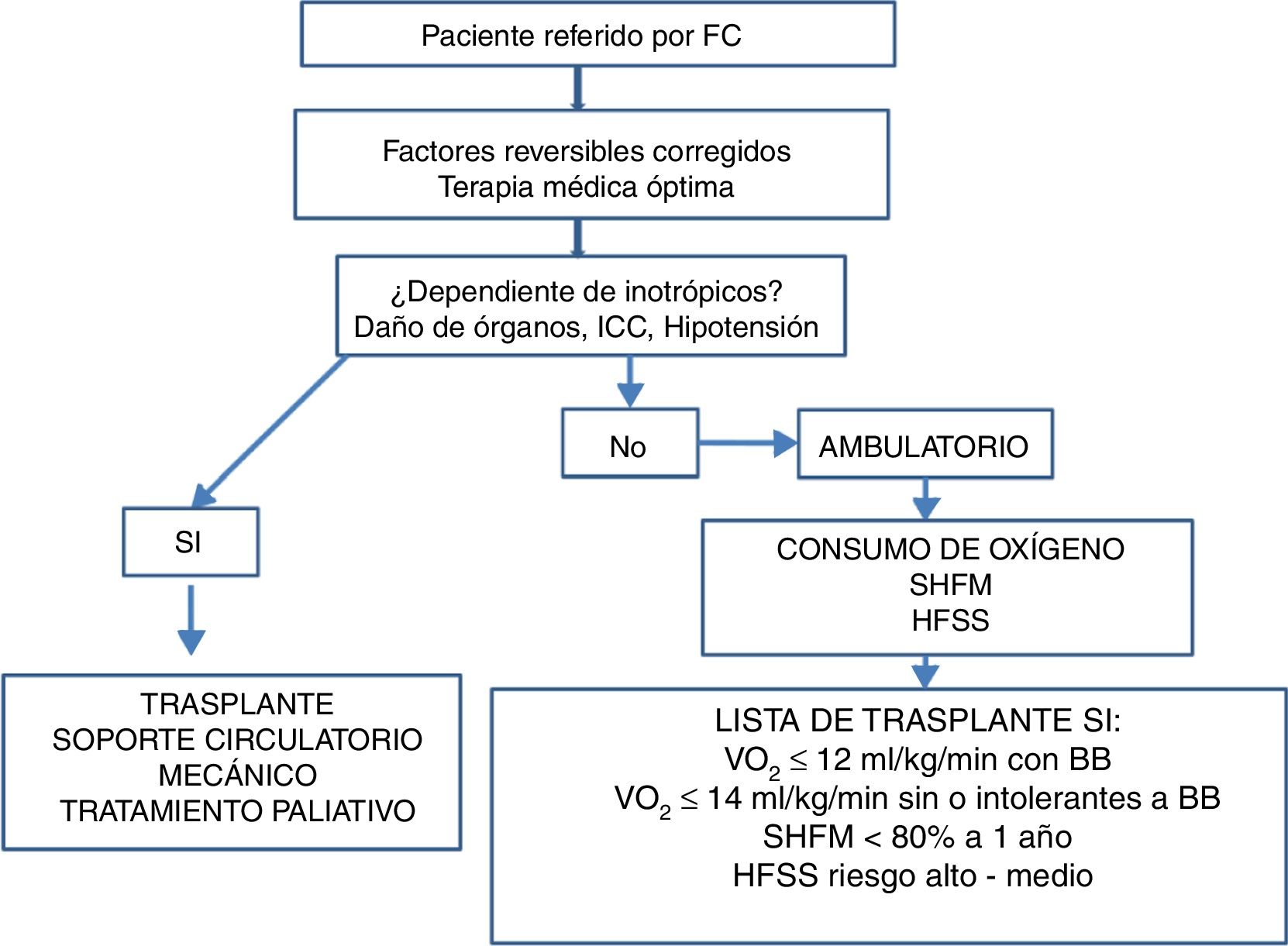
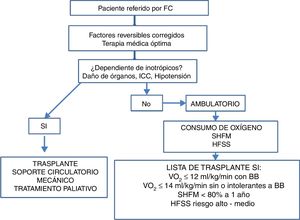
Una vez completada la revisión del historial médico y luego de las evaluaciones clínica inicial, pronóstica, nutricional, social y psicológica, y posterior al ajuste de tratamiento farmacológico, los pacientes podrán ser candidatos a una o varias de las siguientes opciones (fig. 1)2,14–16:
- -
Ajuste de manejo farmacológico, seguimiento clínico, rehabilitación cardíaca y valoración periódica.
- -
Evaluación multidisciplinaria para corrección estructural, funcional o anatómica cardíaca o posibilidad de implante de dispositivos de estimulación eléctrica cardíaca.
- -
Evaluación para trasplante cardiaco.
- -
Evaluación para dispositivo de asistencia ventricular.
- -
Inotropía intermitente.
- -
Manejo integral con intención paliativa y cuidados de fin de vida.
Se deberá educar e informar al paciente, sus cuidadores y familia sobre los objetivos, el tratamiento y el plan de seguimiento en cualesquiera de las opciones mencionadas, así como sobre la necesidad obligatoria de un seguimiento estricto con el fin de garantizar los mejores resultados posibles en los escenarios previstos.
Se recomienda también la aplicación de escalas de riesgo junto con la prueba de esfuerzo cardiopulmonar para calcular la supervivencia de los pacientes con falla cardiaca avanzada y guiar la decisión de intervenciones más evolucionadas. Las dos escalas más utilizadas son la Heart Failure Survivor Score y el Seatle Heart Failure Model (HFSS y SHFM sus siglas en inglés, respectivamente)14,16,17.
El modelo HFSS incluye siete variables: etiología isquémica, trastornos de la conducción intraventricular, frecuencia cardíaca en reposo, presión arterial media, FEVI, consumo de oxígeno y sodio sérico. A cada una de ellas se le asigna un valor derivado del análisis multivariado, mediante el cual se obtiene la siguiente puntuación18,19:
- -
Riesgo bajo HFSS ≥ 8,10: supervivencia al año 88%.
- -
Riesgo moderado HFSS 7,20 a 8,09: supervivencia al año 60%.
- -
Riesgo alto HFSS ≤ 7,19: supervivencia al año 35%.
El SHFM identificó veintiuna variables en la población del estudio PRAISE y posteriormente ha sido validado en más de 10 000 pacientes con falla cardiaca. La supervivencia estimada puede calcularse con base en variables clínicas, de tratamiento, bioquímicas e implante de dispositivos. Este modelo tiende a infravalorar la gravedad, así que se recomienda combinarlo con el modelo HFSS y con el consumo de oxígeno18,19. Una supervivencia a un año menor a 80% estimada por el SHFM o un score de riesgo en el rango alto o intermedio estimado por el HFSS, justificarían valorar opciones avanzadas de tratamiento como dispositivo de asistencia ventricular o trasplante cardiaco18–20.
El VO2 obtenido con la prueba de esfuerzo cardiopulmonar es uno de los datos más importantes para ayudar a definir qué pacientes pueden requerir terapias especializadas (como trasplante cardiaco). Se debe considerar trasplante cardiaco si en presencia de betabloqueador se obtiene un VO2 ≤ 12ml/kg/min o si hay intolerancia al betabloqueador y se obtiene un VO2 ≤ 14ml/kg/min. Ante prueba de esfuerzo cardiopulmonar submáxima (RER: relación de intercambio respiratorio <1,05), el uso del equivalente ventilatorio de dióxido de carbono (VE/VCO2) con una pendiente mayor a 35, puede indicar la necesidad de trasplante cardiaco (tabla 5) 18,19.
Contraindicaciones para medicamentos orales
| Medicamento | Contraindicaciones |
|---|---|
| Betabloqueador | Bloqueo auriculoventricular de segundo o tercer grado en pacientes sin marcapaso, isquemia crítica de miembros inferiores y asma no controlada |
| IECA/ ARNI/ ARA II/Antialdosterónico | Potasio > 5,5 meq/l, depuración de creatinina <30 ml/min. |
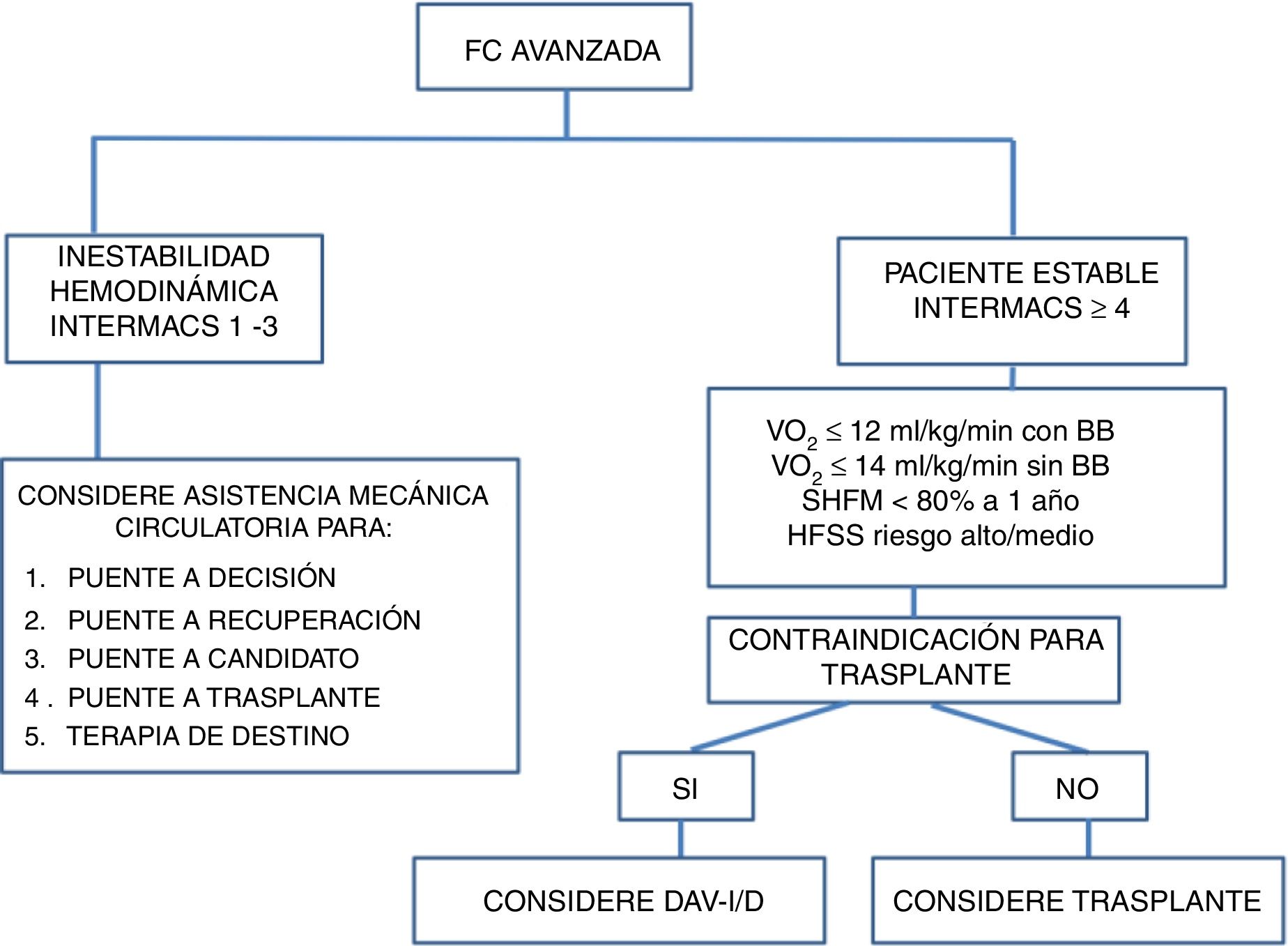
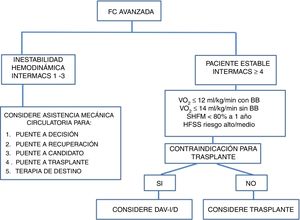
En los pacientes agudos o con inestabilidad hemodinámica, puede tenerse en cuenta el trasplante cardiaco, utilizando o no previamente un dispositivo de asistencia ventricular. Para realizar la estratificación de estos pacientes con falla cardiaca avanzada se utiliza la clasificación INTERMACS (tabla 4). Esta clasificación tiene utilidad clínica y pronóstica respecto al tipo y la necesidad de asistencia circulatoria. El pronóstico es peor en los pacientes que se trasplantan en INTERMACS 1 – 2 versus los trasplantados en INTERMACS 3 – 4. De acuerdo con lo anterior, se recomienda conseguir una estabilidad hemodinámica con tratamiento médico óptimo y asistencia circulatoria de corta duración antes de decidir un trasplante cardiaco (fig. 2)16,17,21.
Tratamiento farmacológico oralEn general, puede controlar los signos y síntomas y modificar la mortalidad de la falla cardiaca; sin embargo, en pacientes con falla cardiaca avanzada representa un reto porque con frecuencia los pacientes son intolerantes y/o refractarios a estas intervenciones. La falla cardiaca avanzada también se puede asociar a síndrome cardiorrenal, que puede ser una limitación para el uso de IECA, ARA II, ARNI y/o antialdosterónicos22. Adicionalmente, en estos pacientes se presenta comúnmente el fenómeno de resistencia a los diuréticos, lo cual implica la necesidad del uso de diferentes estrategias para controlar los signos y síntomas de sobrecarga de volumen (tabla 5)4,23.
La resistencia a los diuréticos se define como24:
- -
Congestión persistente a pesar de dosis adecuadas y crecientes de diurético con más de 80mg por día de furosemida.
- -
Fracción excretada de sodio menor a 0,2%.
- -
Incapacidad de excretar al menos 90 mmol de sodio dentro de las 72 horas posteriores a una dosis oral de 160mg de furosemida dos veces al día.
La necesidad de uso de dosis altas de diuréticos se asocia a mayor mortalidad en falla cardiaca, es por esto que por sí sola, la resistencia a los diuréticos puede ser un indicador de mal pronóstico24–26.
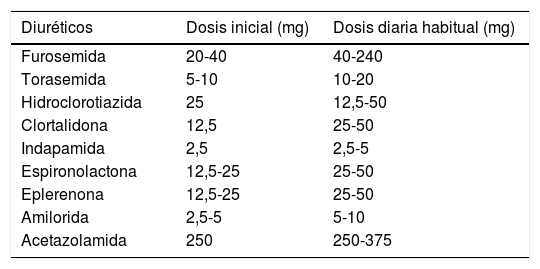
La base de las estrategias para vencer la resistencia a los diuréticos es la intensificación y el escalonamiento de la terapia depletiva. Una de las estrategias más efectivas es remplazar los diuréticos de asa administrados por vía oral, a la vía la parenteral (tabla 6).
Dosis de diuréticos
| Diuréticos | Dosis inicial (mg) | Dosis diaria habitual (mg) |
|---|---|---|
| Furosemida | 20-40 | 40-240 |
| Torasemida | 5-10 | 10-20 |
| Hidroclorotiazida | 25 | 12,5-50 |
| Clortalidona | 12,5 | 25-50 |
| Indapamida | 2,5 | 2,5-5 |
| Espironolactona | 12,5-25 | 25-50 |
| Eplerenona | 12,5-25 | 25-50 |
| Amilorida | 2,5-5 | 5-10 |
| Acetazolamida | 250 | 250-375 |
Las causas más frecuentes de la resistencia a diuréticos son: diagnóstico incorrecto, falta de adherencia terapéutica, dosis bajas, mala absorción, tasa de filtración glomerular baja, disminución del volumen intravascular efectivo a pesar de volumen de líquido extracelular total elevado, activación del sistema renina-angiotensina, adaptación / hipertrofia de la nefrona y uso concomitante de AINE.
Para mejorar el efecto de los diuréticos se deben evaluar los factores que pueden influir en su acción; es necesario restringir la ingesta de agua, tener un aporte adecuado de potasio, mejorar la anemia, vigilar la función renal, usar de forma crónica la dosis mínima necesaria, incrementar la frecuencia de administración de los diuréticos, optimizar el tratamiento de la falla cardiaca con el bloqueo neurohormonal y confirmar la ausencia de medicación concomitante como AINE e inotrópicos negativos27.
La hipoalbuminemia dificulta la captación y secreción de furosemida activa y mejora la conversión a su forma inactiva; la administración concomitante de albúmina y furosemida mejora la respuesta diurética en pacientes con cirrosis, síndrome nefrótico o enfermedad renal crónica, pero no hay datos disponibles en personas con falla cardiaca28.
La eficacia de altas dosis de diuréticos orales comparada con dosis menores no se ha probado en ensayos de gran poder estadístico29,30; sin embargo, aplicando el concepto de aumento del umbral de respuesta y la absorción errática en estados congestivos, como estrategia se acepta un incremento en la dosis oral25,29.
Con el cambio de diuréticos pueden vencerse algunas barreras farmacocinéticas. Bumetanida y torasemida tienen una biodisponibilidad oral de 80 a 100%. Furosemida tiene un 40% de biodisponibilidad y exhibe absorción oral errática. Torasemida puede proporcionar el beneficio adicional de la disminución de la retención de sodio postdiurético por su vida media más prolongada de 3 a 6 horas. La vida media de la furosemida es 1,5 a 3 horas y la de la bumetanida de 1 a 2 horas27.
No hay datos sobre la eficacia comparativa de las combinaciones de diuréticos, por lo que la elección de éstas debe ser basada en factores específicos del paciente teniendo en cuenta los perfiles de efectos secundarios de las diferentes combinaciones. Los diuréticos tiazídicos pueden ayudar a superar la resistencia de los diuréticos de asa debida a la hipertrofia tubular distal, pero como efecto a considerar también limitan la excreción de agua libre y deben ser retirados en casos de hiponatremia severa31.
Acetazolamida es un inhibidor de la anhidrasa carbónica que bloquea la reabsorción de bicarbonato de sodio en el túbulo proximal. Un estudio observacional en pacientes con falla cardiaca aguda y marcada sobrecarga de volumen encontró que la adición de acetazolamida mejora la eficacia del diurético del asa, así como la eficacia diurética de los tiazidas, ya que regula negativamente y en forma potente la expresión de la pendrina en la nefrona distal. Por tanto, desde la perspectiva fisiopatológica, la adición de acetazolamida podría tener un efecto sinérgico benéfico, pero estudios pequeños reportan empeoramiento de la función renal y en general, la experiencia con su uso en falla cardiaca es limitada29,31.
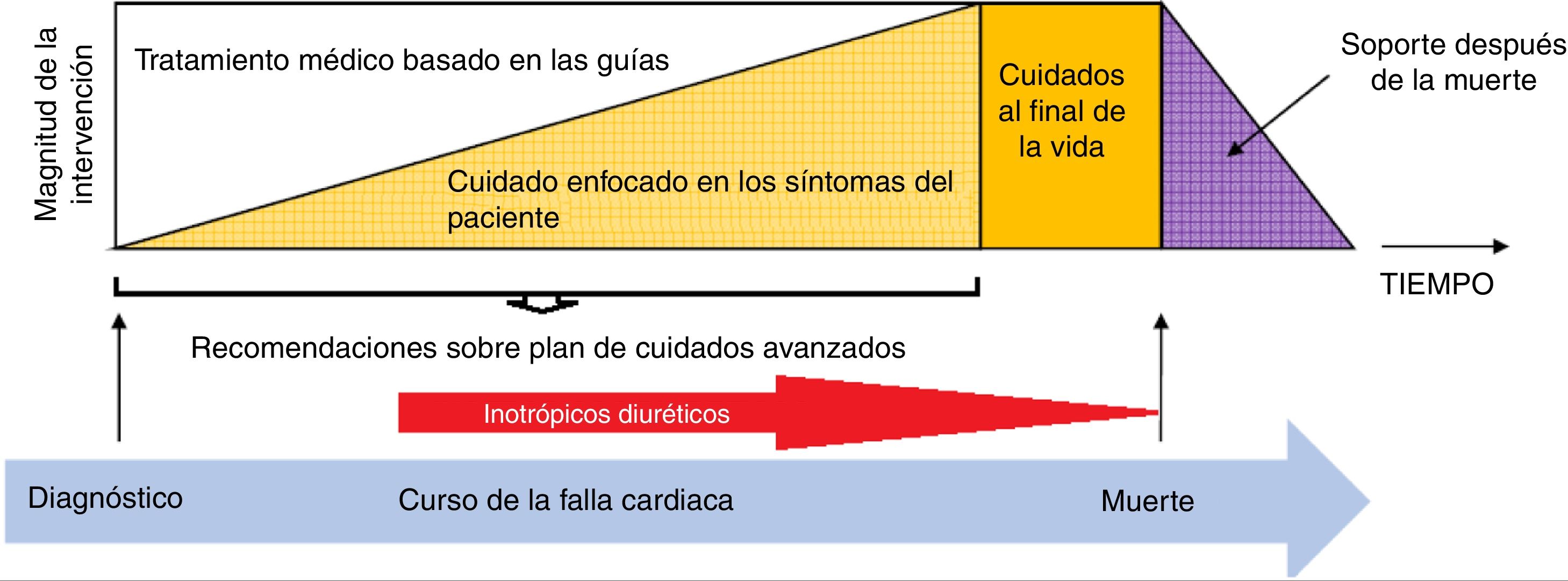
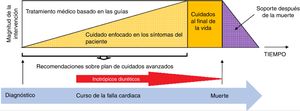
Manejo farmacológico parenteralLa magnitud del tratamiento de la falla cardiaca avanzada debe ser proporcional a la progresión de la enfermedad y la imposibilidad de manejo con dispositivo de asistencia ventricular y/o trasplante cardiaco, situación en la que durante todo el curso de la progresión de la enfermedad, el uso de soporte inotrópico intermitente conjuntamente con el uso de diuréticos desempeña un papel fundamental especialmente cuando el cuidado se enfoca más a los síntomas del paciente que a las estrategias orales inicialmente utilizadas para el tratamiento de la enfermedad en búsqueda de la mejoría pronóstica (fig. 3).
Manejo de inotrópicosEl uso de inotrópicos intravenosos en falla cardiaca avanzada está limitado fundamentalmente a pacientes con choque cardiogénico, pacientes en lista de espera para dispositivo de asistencia ventricular o trasplante cardiaco o como infusión continua para cuidados paliativos de pacientes no elegibles para otras opciones de tratamiento.
Clásicamente se ha considerado contraindicado el uso de inotrópico intravenoso intermitente ambulatorio en un contexto diferente al de cuidado paliativo, de ahí su carácter “potencialmente nocivo”. Sin embargo, los estudios que evaluaron la seguridad y eficacia de esta estrategia de manejo tienen limitaciones importantes, incluido el uso de agentes inotrópicos que actualmente no se usan (enoximona, xamoterol, vesnarinona e ibopamina), y la evaluación de esta modalidad de terapia en un entorno desactualizado, es decir antes del uso rutinario de cardiodesfibrilador implantable en pacientes con falla cardiaca avanzada32.
Estudios previos que sugerían mayor mortalidad en el tratamiento con dobutamina intermitente, no utilizaban un protocolo riguroso para minimizar los riesgos de su administración: los niveles de electrolitos no se monitorizaban de forma rutinaria, las concentraciones de dobutamina no se ajustaban por el peso corporal y la mayoría utilizaron dosis relativamente altas de dobutamina32.
Se han descrito en la literatura varios modelos que integran los cuidados cardiovasculares y los paliativos. Los modelos más favorables en la actualidad recomiendan una transición gradual desde el tratamiento curativo/terapéutico (sostenimiento) al cuidado paliativo (fig. 3). Los pacientes con falla cardiaca avanzada que se acercan al final de la vida son una población especial que merece mucha atención; estos experimentan un deterioro clínico progresivo y son hospitalizados con frecuencia33.
El uso de medicamentos por vía intravenosa, especialmente inotrópicos, en pacientes con falla cardiaca en cuidados paliativos, ha perdurado más de cuatro décadas. Aunque no se ha demostrado que estos agentes tengan un beneficio significativo en la supervivencia en estos pacientes, sí se ha demostrado que las infusiones continuas de medicamentos como el milrinone o la dobutamina mejoran los síntomas y disminuyen las hospitalizaciones34. Mientras que varias sociedades científicas cardiovasculares abogan por la terapia inotrópica continua como una medida paliativa, solo algunos países (p. ej.: Canadá) ofrecen programas de infusión inotrópica en casa. Un pequeño ensayo recientemente publicado sugiere que la terapia con infusión inotrópica domiciliaria podría ser efectiva tanto en términos de costo como de control de síntomas; no obstante, se necesita más información que avale esta opción de manejo para pacientes con falla cardiaca avanzada en fase terminal cuya mortalidad es bastante alta, cercana al 50% a un año35.
Los inotrópicos intravenosos pueden ayudar entonces a mejorar los síntomas en pacientes con falla cardiaca avanzada, mejorar su calidad de vida y facilitar su estancia en casa. Sin embargo, un estudio reciente que evaluó la efectividad de un programa inotrópico intravenoso domiciliario para la paliación de la falla cardiaca avanzada informó una mediana de supervivencia de nueve meses36.
Aunque algunos metaanálisis con estudios pequeños muy heterogéneos con levosimendan en infusiones repetidas han mostrado efectos positivos en sobrevida y disminución de las hospitalizaciones, ningún estudio prospectivo con adecuada muestra ha reproducido este efecto sobre la mortalidad. Recientemente, el estudio LION-HEART aleatorizó 69 pacientes ambulatorios con falla cardiaca avanzada en una razón de 2:1 a levosimendán (0,2 microgramos/kilogramo/minuto) por 6 horas cada 2 semanas por 12 semanas versus placebo en un hospital de día - Clínica de falla cardiaca. Al final del estudio los niveles de NT proBNP, hospitalizaciones y deterioro de la calidad de vida fueron estadísticamente menos frecuentes en el grupo asignado a levosimendan. Los efectos adversos fueron similares en los dos grupos y no hubo mayor número de arritmias en el grupo de levosimendan37.
Es importante anotar que en los programas especializados de falla cardiaca avanzada, al utilizar la terapia inotrópica ambulatoria (ya sea en el hogar o en programas de hospital de día), los pacientes deben comprender que el papel de este soporte inotrópico intravenoso es el de mejorar su calidad de vida y tratar de reducir las hospitalizaciones y no el de prolongar la supervivencia. Aunque en estos programas paliativos con infusión inotrópica intermitente y ambulatoria la efectividad está por definirse completamente, se considera que estos abordan las necesidades de los pacientes permitiendo que pasen sus últimos días, semanas o meses en casa7,38. Por consiguiente, es imprescindible discutir los objetivos de la atención y la viabilidad del tratamiento en curso con pacientes y familias antes del inicio de la terapia inotrópica intermitente. Esto se debe apoyar en un consentimiento informado y el conocimiento por parte del paciente y su familia de que el curso de la calidad de vida del paciente podría verse alterado tras el inicio de esta terapia.
Manejo de la congestiónMuchas Clínicas de falla cardiaca usan en forma rutinaria furosemida intravenosa con el objetivo de corregir al máximo la sobrecarga de volumen y reducir las hospitalizaciones. Otras, tienen un programa colaborativo con servicios de urgencias de atención domiciliaria para proporcionar la opción del uso de furosemida intravenosa domiciliaria. También hay datos que respaldan el uso de furosemida subcutánea, que tiene la ventaja de no requerir acceso vía intravenosa; esta opción es particularmente importante en los pacientes resistentes a los diuréticos orales, pero que desean permanecer en casa y no ser hospitalizados para su manejo intravenoso, especialmente en el curso de una enfermedad progresiva terminal39.
Se conoce una nueva formulación amortiguada de furosemida con pH neutro que parece ser particularmente adecuada para administración subcutánea. Un estudio documentó que el grupo que recibió esta furosemida subcutánea obtuvo similar resultado que el grupo que la recibió por vía intravenosa en el contexto del paciente ambulatorio descompensado. La dosis del estudio fue de 80mg de furosemida subcutánea, administrados durante 5 horas (30mg en la primera hora, seguidos de 12,5mg/h durante las siguientes 4 horas) mediante un sistema de bomba de infusión (bomba de infusión espacial, perfusor, B. Braun Medical, Bethlehem, Pennsylvania). Se encontró que la infusión de 80mg de furosemida subcutánea en 5 horas logró una diuresis y un cambio efectivo y similar de peso que el del tratamiento intravenoso a una dosis media 50% más alta, sin diferencias en los eventos adversos asociados40. Los pacientes con persistencia de síntomas congestivos a pesar de dosis elevadas de furosemida, espironolactona a dosis diuréticas (más de 50mg) y tiazidas, podrían beneficiarse de ultrafiltración o diálisis peritoneal (ver más adelante)7.
Asistencia ventricularLos pacientes con falla cardiaca avanzada tienen mal pronóstico a corto plazo. Por ello, el trasplante cardiaco es una de las opciones que se debe considerar; sin embargo, la escasez de donantes, los largos periodos en lista de espera y un número creciente de pacientes inestables han llevado a que desde la década de los 70 se busquen alternativas para el soporte circulatorio mecánico y trasplante cardiaco. Este es el caso de los dispositivos de asistencia ventricular, los cuales han permitido que algunos pacientes puedan recuperar su función ventricular, puedan permanecer más tiempo en lista de espera para trasplante cardiaco, o incluso se puedan manejar en forma definitiva (terapia destino) con estos dispositivos cuando se contraindica el trasplante cardiaco1.
Desde 2003, cuando la Administración de Drogas y Alimentos autorizó como terapia destino el HeartMate XVE, ha habido un desarrollo tecnológico acompañado de una mejoría sustancial en los resultados clínicos. El estudio REMATCH demostró una sobrevida al año de 52% en pacientes con dispositivo de asistencia ventricular-I comparada con 25% en los pacientes con manejo médico óptimo, lo cual permitió la aprobación del primer dispositivo de asistencia ventricular y desde entonces su uso ha aumentado de forma exponencial, permitiendo que para diciembre de 2016 el registro mundial IMACS (International Mechanically Assisted Circulatory Support) reporte 14 062 pacientes de 35 países con un dispositivo de asistencia ventricular implantado y con sobrevida a uno y dos años del 79 y 70% respectivamente41,42.
El registro ISHLT (The International Society of Heart and Lung Transplantation) muestra que entre 2009 y 2016, el 40,6% de los pacientes que se trasplantaron habían recibido previamente un dispositivo de asistencia ventricular17,43.
CaracterísticasEl soporte circulatorio mecánico está conformado por una variedad de dispositivos que permiten brindar asistencias parciales o totales de uno o los dos ventrículos o inclusive del corazón y los pulmones y están diseñados para dar soporte en diferentes escenarios:
- -
Puente a decisión: Situación clínica incierta que no permite conocer datos clave (parada cardíaca previa, sedación e intubación).
- -
Puente a recuperación: Ante un insulto agudo potencialmente reversible.
- -
Puente a trasplante cardiaco: Pacientes en lista de espera para trasplante cardiaco que se deterioran.
- -
Puente a considerar trasplante cardiaco: Pacientes que aún no han sido evaluado para esta indicación o cuando existe una contraindicación potencialmente reversible (hipertensión pulmonar, obesidad, entre otros).
- -
Puente a destino: Alternativa al trasplante cardiaco en pacientes no candidatos.
La inserción de un dispositivo de asistencia ventricular-I está indicada en pacientes con falla cardiaca avanzada refractaria al manejo médico óptimo, que requieren trasplante cardiaco o en los que el riesgo de muerte en lista de espera para trasplante cardiaco es alto o existen contraindicaciones. Estos son pacientes con dependencia de inotrópicos (INTERMACS 2 y 3) o pacientes que no toleran la titulación de la terapia médica, comprometen la función renal y requieren hospitalizaciones por descompensación (INTERMACS 4 y 5). La evaluación de los candidatos incluye las siguientes áreas:
- -
Evaluación clínica de la severidad de la falla cardiaca: presentación clínica, pruebas cardiopulmonares y estudios hemodinámicos.
- -
Consideraciones cardíacas: función ventricular derecha, arritmias, valvulopatías y anatomía cardíaca.
- -
Consideraciones no-cardíacas: coexistencia de enfermedades terminales, edad y valoración psicosocial.
- -
Evaluación de riesgos del implante del dispositivo de asistencia ventricular: principalmente el riesgo de falla ventricular derecha y la reversibilidad de la disfunción renal y hepática.
En todos los candidatos se debe descartar una etiología reversible de falla cardiaca y deben evaluarse como posibles candidatos a trasplante cardiaco antes de la colocación de un dispositivo de asistencia ventricular-I. Adicionalmente, deben determinarse la clase funcional NYHA y su estadio INTERMACS17.
La mayoría de pacientes con falla cardiaca tienen un grado variable de disfunción ventricular derecha; sin embargo, pueden ser tratados exitosamente con un dispositivo de asistencia ventricular-I. Aquellos que desarrollan falla cardiaca derecha después de un dispositivo de asistencia ventricular-I tienen un incremento de mortalidad entre el 19 al 43%44, por esto es clave determinar el riesgo de falla derecha para definir si éste se considera aceptable y qué medidas se pueden tomar para mitigarlo. En general, los predictores clínicos y hemodinámicos como la presencia de disfunción hepática o renal preoperatoria, son más importantes que los ecocardiográficos. Los pacientes con presiones altas de la aurícula derecha (>15mm Hg), índices de trabajo ventricular derecho bajos, resistencias vasculares pulmonares muy elevadas y valores bajos de TAPSE (<7,5mm) se asocian a mayor incidencia de falla derecha posdispositivo de asistencia ventricular-I2.
El 51% de los dispositivos de asistencia ventricular registrados en IMACS son implantados en estadios INTERMACS 1 y 2 (17% en INTERMACS 1 y 34% en INTERMACS 2), sin embargo, la hipoperfusión orgánica y el choque previos al implante son predictores de mayor morbilidad y mortalidad, por lo que se sugiere que en general no se considere el implante de dispositivo de asistencia ventricular en pacientes que se clasifiquen en estos estadios clínicos42 (tabla 7).
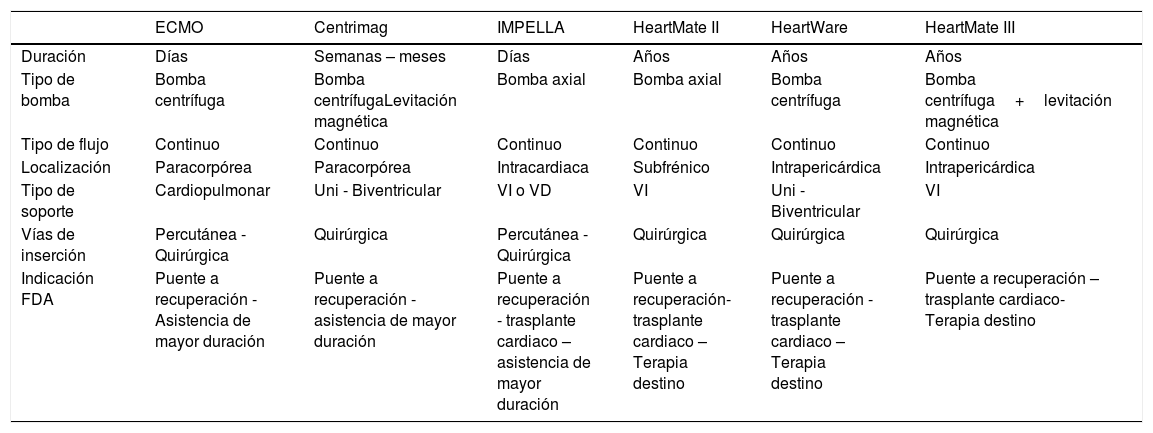
Sistemas de soporte circulatorio mecánico disponibles en Colombia
| ECMO | Centrimag | IMPELLA | HeartMate II | HeartWare | HeartMate III | |
|---|---|---|---|---|---|---|
| Duración | Días | Semanas – meses | Días | Años | Años | Años |
| Tipo de bomba | Bomba centrífuga | Bomba centrífugaLevitación magnética | Bomba axial | Bomba axial | Bomba centrífuga | Bomba centrífuga+levitación magnética |
| Tipo de flujo | Continuo | Continuo | Continuo | Continuo | Continuo | Continuo |
| Localización | Paracorpórea | Paracorpórea | Intracardiaca | Subfrénico | Intrapericárdica | Intrapericárdica |
| Tipo de soporte | Cardiopulmonar | Uni - Biventricular | VI o VD | VI | Uni - Biventricular | VI |
| Vías de inserción | Percutánea - Quirúrgica | Quirúrgica | Percutánea - Quirúrgica | Quirúrgica | Quirúrgica | Quirúrgica |
| Indicación FDA | Puente a recuperación - Asistencia de mayor duración | Puente a recuperación - asistencia de mayor duración | Puente a recuperación - trasplante cardiaco – asistencia de mayor duración | Puente a recuperación- trasplante cardiaco – Terapia destino | Puente a recuperación -trasplante cardiaco – Terapia destino | Puente a recuperación – trasplante cardiaco- Terapia destino |
Algunas escalas han sido desarrolladas para predecir el riesgo de mortalidad asociado al implante de dispositivo de asistencia ventricular-I. La más conocida es el DTRS (Destination Therapy Risk Score), en la que se estima la mortalidad intrahospitalaria a 90 días con una buena discriminación en sus resultados entre lo observado y lo estimado (tabla 8)45.
¿Qué sucede luego del implante del dispositivo de asistencia ventricular?Con frecuencia, los pacientes con dispositivo de asistencia ventricular-I requieren continuar los medicamentos para el tratamiento de la falla cardiaca, aunque casi siempre los diuréticos pueden disminuirse o suspenderse. Se debe intentar titular el tratamiento neurohormonal hasta las dosis máximas recomendadas y mantener una presión arterial media < 90mm Hg (ideal < 85mm Hg).
Todos requieren anticoagulación con warfarina para mantener un INR de 2 a 3, más antiagregación plaquetaria con Aspirina.
Las complicaciones más serias asociadas al uso de estos dispositivos son las siguientes46–48:
- -
Trombosis de la bomba: 7 a 16% en HeartMate II, 5 a 8% en HeartWare y hasta ahora 0% en HeartMate III.
- -
Accidente cerebrovascular isquémico o hemorrágico: HeartWare: 29% a 2 años, HeartMate II: 10% a 2 años y HeartMate III: 7% a 2 años.
- -
Infección del punto de entrada de la línea de acceso (driveline): 10 a 15% a dos años en todos los dispositivos.
- -
Hemorragia gastrointestinal: 15% a 2 años en todos los dispositivos.
Los pacientes con dispositivo de asistencia ventricular-I tienen mejoría notable en su calidad de vida y disminución o eliminación de los síntomas de falla cardiaca. Requieren control y seguimiento a cargo de un grupo multidisciplinario de falla cardiaca avanzada para prevenir y manejar las complicaciones.
Evidencia actual en dispositivos de asistencia ventricular a largo plazoEl estudio ENDURANCE comparó HeartMate II con HeartWare en un grupo de pacientes con falla cardiaca avanzada no candidatos para trasplante cardiaco. No se demostró inferioridad respecto al objetivo primario, el cual consistía en sobrevida libre de evento neurológico discapacitante (55,4 vs. 59,1%, respectivamente), pero sí se encontró una diferencia significativa en la necesidad de cambió del dispositivo, mal funcionamiento y requerimiento de explante con el HeartWare en un 16,2% en comparación con un 8,8% en el HeartMate II46.
Un estudio comparativo entre HeartMate II y HeartMate III (MOMENTUM 3) en pacientes con falla cardiaca avanzada a quienes se le implantó uno de estos dispositivos como puente a trasplante cardiaco o terapia destino, encontró una leve superioridad del HeartMate III en el objetivo primario consistente en sobrevida libre de evento neurológico discapacitante (86,2 vs. 76,8%, respectivamente) y menor necesidad de explante, cambio del dispositivo y mal funcionamiento (7,7 vs. 1%, respectivamente)47. El seguimiento a dos años de este mismo estudio, demostró superioridad del HeartMate III respecto al objetivo primario de sobrevida libre de evento neurológico discapacitante del 79,5% con el HeartMate III y del 60,2% para el HeartMate II y sobrevida sin requerimiento de cirugía para reemplazar o remover un dispositivo disfuncionante 3 vs. 17%48.
Trasplante cardíacoA pesar de los avances en el tratamiento de la falla cardiaca, la mortalidad continúa siendo elevada y para un grupo seleccionado de pacientes, que presenten síntomas persistentes o refractarios pese a manejo médico óptimo o mejor tolerado, el trasplante cardiaco se convierte en una alternativa de tratamiento que proporciona mejoría en la sobrevida y calidad de vida, desenlaces que dependen, en forma estrecha, de la adecuada selección del potencial receptor6.
Los estudios y la estratificación de riesgo de los pacientes con falla cardiaca avanzada son esenciales para identificar aquellos que poseen mayores probabilidades de beneficiarse del trasplante cardiaco, especialmente, porque el número de donantes para Colombia aún es insuficiente para satisfacer por completo la creciente demanda de órganos49,50.
El proceso para llevar a un paciente a trasplante cardiaco no es sencillo, así que el estudio pretrasplante ha de ser riguroso y exhaustivo. La elección correcta del candidato se apoyará en la valoración adecuada del pronóstico de la falla cardiaca avanzada y la identificación de los factores de riesgo que puedan aumentar la mortalidad tras el trasplante (tabla 9)19.
Indicaciones para trasplante cardiaco
| Edad menor a 70 años |
| Falla cardiaca avanzada irreversible, en clase funcional NYHA IV, que no sea posible manejar médica o quirúrgicamente con alternativas terapéuticas diferentes al trasplante cardiaco y que presenten síntomas refractarios a terapia médica máxima. |
| Choque cardiogénico dependiente de soporte inotrópico, soporte circulatorio con balón de contrapulsación intraaórtica o dispositivo de asistencia ventricular. |
| Angina persistente/refractaria: síntomas severos de isquemia a pesar de manejo médico óptimo máximo tolerado, que limitan en forma permanente las actividades diarias y que no tienen posibilidad de revascularización (quirúrgica o percutánea). |
| Arritmias ventriculares recurrentes, malignas o tormenta arrítmica, refractaria a todas las terapias aceptadas (manejo médico, ablación, cirugía o cardiodesfibrilador implantable). |
| VO2 por prueba de esfuerzo cardiopulmonar < 12 ml/kg/min en manejo con betabloqueador y < 14 ml/kg/min en pacientes intolerantes a betabloqueador. |
| Pacientes en clase funcional NYHA III con factores asociados a mayor mortalidad a corto plazo: |
| • Ingresos repetidos en el hospital por progresión de los síntomas en los últimos meses. |
| • Deterioro inicial de la función renal o hepática. |
| • Factores de riesgo hemodinámicos asociados a mortalidad precoz elevada: |
| 1. FEVI < 25%. |
| 2. Presión capilar pulmonar> 24mm Hg. |
| 3. VO2 < 50% del predicho para edad y género durante ejercicio anaeróbico (RER ≥ 1,05). |
| 4. Riesgo de mortalidad elevado según score de sobrevida HFSS. |
La selección del receptor consiste en aplicar unos criterios que excluyen los pacientes que tengan condiciones clínicas, mentales o socio-económicas que no garanticen una supervivencia adecuada posterior al procedimiento. Para ello se debe seguir un proceso de aplicación de criterios de exclusión definidos con precisión con el fin de disminuir la morbilidad o mortalidad postrasplante (tabla 10)51.
Contraindicaciones para trasplante cardiaco
| Absolutas |
| Edad mayor a 70 años. |
| Hipertensión pulmonar no reactiva: gradiente transpulmonar> 15mm Hg y/o resistencia vascular pulmonar> 5 Unidades Wood. |
| Neoplasia activa o con posibilidad de recidiva (se evaluará en conjunto con Oncología). |
| Infección activa no controlada (se evaluará en conjunto con Infectología). |
| Relativas |
| • Enfermedad sistémica: se evaluará en conjunto con el (los) especialista(s) de cada área. |
| • Enfermedad renal crónica o irreversible: creatinina basal> 2 mg/dl o depuración renal < 30 ml/min (se evaluará en conjunto con Nefrología). |
| • Diabetes mellitus con afectación multiorgánica severa: se evaluará en conjunto con Endocrinología: |
| – Insuficiencia renal severa (considerar trasplante renal asociado). |
| – Retinopatía diabética severa no susceptible de fotocoagulación, con riesgo de ceguera a corto plazo. |
| – Neuropatía periférica diabética severa. |
| – Vasculopatía periférica difusa severa, distal y de pequeño vaso. |
| – Soporte psicosocial inadecuado (se evaluará en conjunto con Trabajo social). |
| – Consumo de sustancias tóxicas (se evaluará en conjunto con Trabajo social y Psiquiatría). |
| – Período mínimo de seis meses sin consumo de alcohol documentado por especialista o institución especializada y pertenecer a un programa de rehabilitación. |
| – Período mínimo de seis meses sin consumo de sustancias psicoactivas documentado por especialista o institución especializada y estar en un programa de rehabilitación. |
| – El consumo de cigarrillo requiere evaluación por especialista o institución especializada y en programa de apoyo a fumadores. |
| • Obesidad mórbida: índice de masa corporal mayor a 35 (peso seco). Se recomienda la pérdida de peso hasta alcanzar un índice de masa corporal < 30. |
| • Embolia pulmonar aguda: dentro de los primeros 30 días posteriores al evento. |
| • Ataque cerebrovascular isquémico/hemorrágico: dentro de los primeros 30 días posteriores al evento (se evaluará en conjunto con Neurología). |
| – Hipersensibilización o presencia de autoanticuerpos en rangos elevados (LSA> 10-30%) |
Una vez se considera que hay indicación de trasplante cardiaco (tabla 9), el paciente será sometido a una serie de exámenes de laboratorio, estudios complementarios y valoraciones médicas especializadas. Todo esto se conoce como evaluación o protocolo pretrasplante cardíaco, con el cual se identifican comorbilidades o condiciones que requieren tratamiento previo al trasplante cardíaco, que puedan contraindicarlo o que tengan implicaciones en el manejo postoperatorio (tabla 10)52. Una vez completado el protocolo pretrasplante cardíaco, el paciente es evaluado nuevamente por el equipo multidisciplinario con experiencia en trasplante cardiaco, determinándose su inclusión en lista de espera, previa firma de consentimiento informado. La priorización de los receptores en lista de espera se categoriza de acuerdo con la gravedad de la condición clínica y la necesidad de trasplante cardiaco (urgencia vs. electiva).
El proceso de evaluación y estudio del potencial donante de corazón (y demás órganos y tejidos) es coordinado por la Red Nacional de Donación y Trasplante de Colombia de acuerdo con la normatividad legal vigente y al documento de la Comisión del Corazón. Una vez se comunica a la Red la existencia de un paciente con escala de Glasgow < 5 o diagnóstico de muerte cerebral (en cualquier IPS del país), se inicia un proceso logístico multidisciplinario para la identificación, la evaluación y el manejo del donante potencial, y según el resultado de este proceso, se avanza en la selección y preparación del receptor (paciente que se encuentra en lista de espera). Si el proceso de donación de corazón se completa de forma satisfactoria, desde la Red se coordina el proceso de extracción, preservación y transporte del corazón del donante hasta el sitio (IPS trasplantadora) donde se hará el trasplante cardiaco51. La asignación del corazón del donante compatible tiene prioridad para los receptores compatibles en lista de espera en categoría de urgencia cero, que son los pacientes que tienen soporte circulatorio mecánico (dispositivo de asistencia ventricular, ECMO, balón de contrapulsación intraaórtica) y aquellos dependientes de infusión continua o intermitente de inotrópicos o que presentan arritmia ventricular maligna o refractaria. La categoría electiva incluye el resto de los pacientes en lista de espera. La prioridad en este grupo dependerá de la sensibilización, la compatibilidad grupo sanguíneo A, B, AB y O (ABO), la compatibilidad antropométrica y el tiempo acumulado en lista de espera19.
Las diferencias inmunológicas (antigénicas) entre donante y receptor condicionan la necesidad de un tratamiento inmunosupresor para que el corazón trasplantado no sea rechazado. La intensidad del tratamiento inmunosupresor se debe supervisar, monitorizar y balancear: los niveles elevados condicionan mayor riesgo de infección, así como de otras complicaciones (insuficiencia renal, hipertensión arterial, diabetes mellitus, osteoporosis, neoplasias, entre otras) mientras que los bajos condicionan mayor riesgo de rechazo del órgano. Teniendo en cuenta que en las primeras horas a días de realizado el trasplante cardiaco el riesgo de rechazo del injerto es muy elevado, se puede considerar una mayor inducción de inmunosupresión con el uso de anticuerpos monoclonales antilinfocitarios, anticuerpos policlonales y altas dosis de corticoides por vía parenteral. Posteriormente, la terapia inmunosupresora se continúa por vía oral y generalmente incluye: anticalcineurínicos (tacrolimus, ciclosporina), antiproliferativos (micofenolato mofetil, micofenolato sódico, azatioprina) y corticosteroides. Los niveles plasmáticos o las dosis de dichos fármacos van disminuyendo progresivamente conforme pasan los meses. De acuerdo con la evolución clínica se considera el retiro tempano de los corticosteroides (primeros 9 a 12 meses). En los últimos años se han introducido los inhibidores de la señal de proliferación o mTOR (everolimus, sirolimus), los cuales tendrían un papel en pacientes con insuficiencia renal, enfermedad vascular del injerto o neoplasias, pero no se recomienda iniciarlos en los primeros meses postrasplante por su mayor riesgo de alteración de cicatrización e infecciones bacterianas22,51.
La supervivencia tras el trasplante cardíaco ha mejorado con los años y según los datos del último registro internacional la vida media alcanza actualmente los once a trece años. El periodo de mayor riesgo es el primer año, con una mortalidad cercana al 20%. Entre los pacientes que sobreviven al primer año, la supervivencia media es de catorce años. En Colombia, la causa más frecuente de muerte en trasplante cardíaco es la disfunción primaria del injerto, seguida de complicaciones infecciosas, enfermedad vascular del injerto, tumores y rechazo agudo. Cuando se analiza la mortalidad por periodos, se aprecia que la disfunción primaria del injerto es la principal causa de muerte en el primer mes post-trasplante, las infecciones lo son del primer mes al primer año y la vasculopatía del injerto y los tumores a partir del primer año53.
Tratamiento paliativoLa Sociedad Europea de Cuidados Paliativos define el tratamiento paliativo como el cuidado activo y total de pacientes cuya enfermedad no responde a un tratamiento curativo. Es primordial ocuparse del control del dolor y del resto de síntomas, pero también de los problemas sociales, psicológicos y espirituales. Los cuidados paliativos son interdisciplinarios en su aplicación y abarcan al paciente, su familia y su entorno22,54.
En 2002, La Organización Mundial de la Salud lo definió como un abordaje que mejora la calidad de vida de los pacientes y familiares que se están enfrentando a problemas asociados a una enfermedad potencialmente mortal, a través de la prevención y el alivio del sufrimiento, realizando una identificación temprana, una evaluación adecuada y aplicando tratamientos para el dolor y otros problemas físicos, psicosociales y espirituales55.
El tratamiento paliativo a través de los años ha cambiado su definición y ha abarcado todos los aspectos que lo han ido caracterizando. Su nacimiento se dio en asociación con enfermedades oncológicas en los años 60 como respuesta a la falta de evaluación y manejo de los síntomas físicos y psicosociales de los pacientes oncológicos con evolución al campo de enfermedades crónicas no oncológicas dentro de las cuales se incluyen la falla cardiaca, sin dejar de lado enfermedades respiratorias o neurológicas degenerativas56–58.
Las siguientes son algunas características primordiales del tratamiento paliativo:
- 1.
Proporciona alivio del dolor y otros síntomas.
- 2.
Afirma la vida y considera la muerte como un proceso normal.
- 3.
No pretende adelantar ni aplazar la muerte.
- 4.
Integra los aspectos psicológicos y espirituales de la atención del paciente.
- 5.
Ofrece un sistema de apoyo para que el paciente viva del modo más activo posible hasta el momento de su muerte.
- 6.
Brinda un sistema de apoyo para que las familias puedan sobrellevar la enfermedad del paciente y durante su propio duelo.
- 7.
Utiliza un enfoque de equipo para abordar las necesidades de los pacientes y sus familias, incluyendo ayuda en el duelo, si procede.
- 8.
Mejora la calidad de vida y también puede influir positivamente en el transcurso de la enfermedad.
- 9.
Se puede aplicar en los primeros momentos de la enfermedad junto con otras terapias que pretenden prolongar la vida, como la quimioterapia, la radioterapia, o terapias específicas de enfermedades crónicas.
- 10.
Incluye investigaciones necesarias para comprender y manejar mejor las complicaciones clínicas.
En el ámbito de las enfermedades que requieren tratamiento paliativo, aproximadamente un 40% de la mismas corresponde a enfermedades cardiovasculares, de las cuales la primordial es la falla cardiaca.
En estudios prospectivos comparativos en pacientes con cáncer, enfermedad pulmonar obstructiva crónica y falla cardiaca se concluyó que los pacientes con falla cardiaca presentaban peor cuidado en salud, entorno social, información en cuanto a diagnóstico y pronóstico y control de síntomas, así como menor participación en la toma de decisiones clínicas y mayor obstinación terapéutica59,60.
En el campo de la falla cardiaca, la inclusión del tratamiento paliativo se ha dado tardíamente en las diferentes sociedades y sólo desde 2010 hay algunas recomendaciones y niveles de evidencia que se han solidificado a partir de la generación de terapias avanzadas, específicamente de los dispositivos de asistencia ventricular, de cara a la terapia destino56,61.
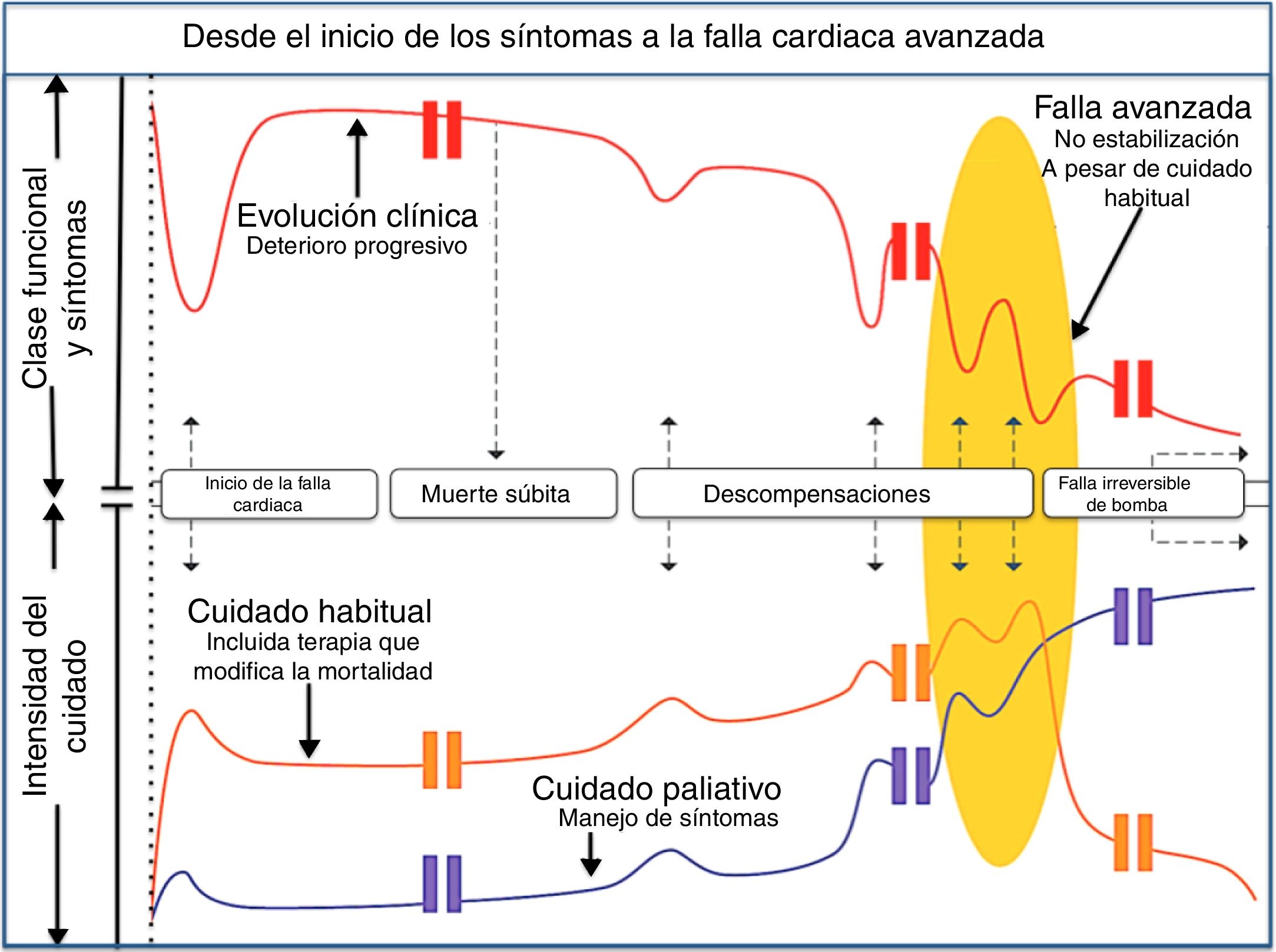
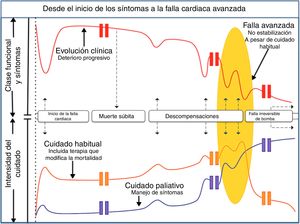
El tratamiento paliativo está dirigido a pacientes con falla cardiaca avanzada (estadio D) quienes, por comorbilidades o criterios de exclusión, no se han considerado tributarios a terapias avanzadas (trasplante cardiaco o dispositivo de asistencia ventricular) o también a aquellos pacientes que no aceptan estas mismas terapias. Recuérdese que la introducción al tratamiento paliativo debe iniciar desde que se conoce el diagnóstico, así que los primeros encargados de la paliación son los cardiólogos asignados a cada caso. En general, las estrategias de manejo basadas en evidencia y los beneficios esperados del tratamiento paliativo, aplican a la población altamente sintomática y limitada funcionalmente, y es claro que la falla cardiaca no es una entidad aislada, por lo cual se enfrentan grupos de edad avanzada, múltiples comorbilidades y pacientes frágiles. Esta inclusión del tratamiento paliativo en el cuidado cardiovascular ha sido opacada por la dificultad de reconocer el momento adecuado en el cual se debe encarar este tema. Sin embargo, teniendo en cuenta que la falla cardiaca presenta varias trayectorias, es y sería ideal que al encarar el diagnóstico de falla cardiaca se discutieran aspectos que atañen a su tratamiento y pronóstico y se entendiera que, de no tener el resultado esperado o no poder acceder a las terapias avanzadas por múltiples causas, la muerte no sería el fracaso de la vida sino el fin de la misma (fig. 4).
El tratamiento paliativo en pacientes con falla cardiaca avanzada comprende dos pilares estrechamente ligados: disminuir el sufrimiento y tener una comunicación asertiva con el paciente y su grupo familiar. Para el primer pilar debemos enfocarnos en aspectos claves como manejo y control de los síntomas, así como del grupo familiar, además de soporte espiritual y sicológico. Para el segundo pilar, es clave tomar decisiones y planear la ejecución de las decisiones aceptadas57,58.
Las principales manifestaciones sintomáticas de estos pacientes incluyen disnea, fatiga y labilidad emocional con tendencia en mayor proporción a los síntomas de depresión y dolor. Para estas manifestaciones se cuenta con manejo farmacológico y no farmacológico para cada una de ellas62–67.
- -
Dolor: para orientar su manejo se utiliza la escalera analgésica o el recientemente llamado “ascensor analgésico”, que permite mayor inmediatez en control sintomático. Hay algunas opciones invasivas que pudieran considerarse para el dolor de determinadas etiologías, como el caso de pacientes con cardiopatía isquémica y presencia de cuadros anginosos de difícil control.
- -
Depresión: es indispensable poder identificarla para iniciar su tratamiento y controlar algunos de sus desencadenantes, como el dolor y la disnea. Comúnmente, se utilizan inhibidores de la recaptación de serotonina.
- -
Disnea: es claro que en estos pacientes aún se utilizan algunas de las medidas que la disminuyen al mejorar ciertos parámetros hemodinámicos; sin embargo, cuando es refractaria también es posible utilizar otras medidas como las infusiones intermitentes de inotrópicos (hay varios protocolos utilizados en múltiples ensayos clínicos pequeños; algunos se asocian con mejoría de parámetros funcionales como los PN relacionados con disminución de presiones de fin de diástole). Existen otras medidas referenciadas en estudios clínicos menos robustos, como la aplicación de aire directo sobre la zona facial y el uso de opioides.
Así mismo, es clave que en los pacientes en fase de cuidados paliativos que portan cardiodesfibrilador implantable, se lleve a cabo la discusión con el propio paciente y su grupo familiar en relación con el momento de desactivar el dispositivo68.
El tortuoso camino hacia la falla avanzada: ruta habitual de un paciente con insuficiencia cardiaca desde el inicio de los síntomas hasta las hospitalizaciones frecuentes dependiendo de la intensidad del bloqueo neuromodulador. La persistencia de las descompensaciones y la imposibilidad de mantener una clase funcional adecuada marcan el inicio de la refractariedad (fig. 4).
Otras opciones de tratamientoSolución salina hipertónicaSe usa de forma irregular desde hace aproximadamente quince años, en concentraciones desde 1,4 hasta 4,6%. Se ha encontrado pérdida ponderal adicional de 3kg, reducción del tiempo de hospitalización en un promedio de 3,5 días, disminución del riesgo de descompensación del 35% y aumento de diuresis en 600ml por día vs. pacientes con falla cardiaca manejados únicamente con diuréticos; no muestra cambios en la concentración de ácido úrico, pero sí reducción del riesgo de lesión renal aguda en comparación con dosis alta de furosemida intravenosa69,70.
Diálisis peritonealUn 20% de los pacientes con falla cardiaca avanzada desarrollan síndrome cardiorrenal y no logran depleción adecuada de volumen con el manejo diurético convencional. Para este grupo se puede indicar la diálisis peritoneal como tratamiento complementario independiente del grado de uremia. Dentro de sus beneficios se incluyen disminución de días de hospitalización (promedio de 5 días) y mejoría de la clase funcional y de la función ventricular (promedio del 4%). Dentro de las complicaciones se incluye peritonitis asociada a catéter (2-37%) y mortalidad anual cercana al 20%71,72.
Terapia genéticaEn los ensayos clínicos iniciales de pacientes con cardiopatía isquémica, respecto al daño miocárdico, se dan fenómenos de reparación y remodelación ventricular que inician con la línea monocito-macrófago y con la reparación tisular subsecuente con fenómenos de remodelado con hipertrofia excéntrica y expresión de genotipos fetales que normalmente están silenciados. Se ha tratado de hacer manipulación genética a través de plásmidos o vectores virales (adenovirus) con mayor efectividad en la última técnica con infusión intracoronaria (con pruebas de seguridad y no carcinogenicidad a corto y mediano plazo). Así mismo, se ha buscado modificar la expresión proteica SERCA, factor de crecimiento endotelial, factor de crecimiento fibroblástico y de expresión de la óxido nítrico sintetasa endotelial. También se estudia la manipulación de miRNA involucrados en procesos celulares como apoptosis, metabolismo graso, diferenciación celular, carcinogénesis, cardiogénesis y angiogénesis. De igual forma, se están desarrollando modelos fisiopatológicos que buscan alterar la respuesta de miocitos, células endoteliales, músculo estriado y células inflamatorias a fin de alterar la respuesta tisular al remodelado cardíaco y la expresión del fenotipo fetal que se presenta con dicha remodelación. Todos se están probando en estudios in vitro con el objetivo de realizar intervenciones en modelos in vivo. Solo algunos superado la fase 2 de ensayos clínicos y han pasado a la 373.
Células madreSe han propuesto tres mecanismos de acción en el uso de células madre como estrategia terapéutica: 1) Asumiendo que las células madre se pudieran diferenciar en cardiomiocitos, la investigación ha demostrado que muy pocas células pueden hacerlo. 2) A través de un mecanismo de acción basado en la angiogénesis o vasculogénesis, se cree que esto lo logran con la activación de células progenitoras endoteliales, cuya existencia tampoco se ha demostrado. 3) Las células madre tienen un efecto paracrino que secreta factores cardioprotectores. Estos factores pueden disminuir la fibrosis, estimular el crecimiento vascular y la remodelación, modular la inflamación, regular la sobrevida y la diferenciación celular y reclutar células progenitoras. Es el campo en el que existe mayor evidencia74.
Las células madre utilizadas en los estudios de investigación son células mononucleares derivadas de la médula ósea, células mesenquimales y células aisladas de tejido cardíaco. Se han reportado células madre obtenidas de corazón que se diferencian en cardiomiocitos al trasplantarlas en corazones después de infarto de miocardio. Por último, hay fragmentos de tejidos que migran de fuera del corazón, forman esferas y son llamadas cardioesferas y dan origen a cardiomiocitos “in vivo” e “in vitro”.
Se han realizado estudios en infarto de miocardio, isquemia crónica, angina intratable, cardiomiopatía isquémica y no isquémica. Una revisión interesante en pacientes con enfermedad isquémica y falla cardiaca crónica para evaluar la seguridad y la eficacia de células madre de médula ósea, encontró evidencia de baja calidad en cuanto a reducción de mortalidad e infarto no fatal, y mejoría de FEVI y clase funcional. Sin embargo, ante la baja presentación de eventos, estos resultados deben tomarse con precaución. El futuro puede ser promisorio para este tipo de terapia75.
Neuromodulación cardíacaLa disregulación del sistema nervioso autónomo en falla cardiaca ha sido estudiada en los últimos años y el tratamiento actual de los pacientes con esta enfermedad incluye bloqueadores del sistema nervioso simpático. El estudio ATRAMI (Autonomic Tone And REflexes After Myocardial Infarction), el primer gran estudio que examinó la actividad vagal como marcador pronóstico, llevó al desarrollo de terapias basadas en dispositivos que pretenden mejorar el desequilibrio autonómico76.
Los resultados de los estudios clínicos no han sido favorables; sin embargo, se espera que con el tiempo se logre mayor conocimiento acerca del uso de la neuromodulación como tratamiento complementario en pacientes con falla cardiaca.
La mitocondria como objetivo terapéuticoDesde hace varios años se ha reconocido que la alteración mitocondrial tiene un papel en la hipertrofia ventricular y que la alteración energética del miocito es parte fundamental de la patogénesis de la falla cardiaca. Se tienen expectativas en cuanto a mantener la biogénesis de las mitocondrias, disminuir la producción de especies reactivas de oxígeno (ROS) producidas por la mitocondria y por último regular el metabolismo del hierro mitocondrial77.
El elamipretide (MTP-131, Bendavia®) tiene como blanco terapéutico la mitocondria. En tal sentido, se han obtenido efectos positivos en diferentes estudios en falla cardiaca aguda, observándose aumento de la producción de ATP, así como de la función sistólica ventricular izquierda, con resultados que muestran cambios dependientes de la dosis78.
Intervenciones percutáneasLa restauración ventricular percutánea es un procedimiento que se lleva a cabo con un dispositivo percutáneo cuyo objetivo es restaurar la forma del ventrículo, aislando el ápex aneurismático del ventrículo izquierdo. Los estudios PARACHUTE han mostrado más del 90% de éxito en el procedimiento de implante y mejoran parámetros hemodinámicos, caminata de seis minutos y volúmenes ventriculares. A futuro, se esperan dispositivos más durables79.
Reemplazo valvular aórtico transcatéterEste es el único procedimiento para estenosis aórtica que disminuye la mortalidad. Es, por consiguiente, el estándar de cuidado actual para muchos pacientes con muy alto riesgo o considerados inoperables para cirugía de reemplazo valvular aórtico80.
Este tipo de pacientes cumplen en algunos casos las características de falla cardiaca avanzada. En los estudios PARTNER se encontraron hasta 15% de pacientes con estenosis aórtica de bajo gradiente, bajo flujo y FEVI reducida, así como pacientes con falla cardiaca con FEVI preservada81.
El procedimiento ha demostrado ser seguro y ha mejorado la clase funcional y de escalas de calidad de vida. Dentro de los criterios de selección se debe considerar una expectativa de vida mayor a un año, además de características de fragilidad y función renal, entre otras, aunado a que el Equipo Cardiovascular tome decisiones individualizadas82.
Intervenciones percutáneas en válvula mitral y tricúspideEl clip mitral es un procedimiento similar a la técnica de Alfieri. Múltiples estudios han mostrado seguridad en el implante, mejoría en la clase funcional y disminución de morbilidad, y han hecho énfasis en la importancia de la decisión individualizada por parte del Equipo Cardiovascular. Su eficacia ha sido evaluada en los estudios MITRA FR y COAPT83,84. Estos dos estudios compararon la estrategia del implante del clip mitral vs. terapia farmacológica óptima en pacientes con insuficiencia cardiaca e insuficiencia mitral funcional. Los resultados del estudio MITRA FR no mostraron beneficio de la intervención; sin embargo, en el grupo asignado a la implantación del clip mitral, el estudio COAPT demostró una reducción absoluta en la mortalidad del 17%por todas las causas, cifra que se traduce en un número necesario a tratar de seis para evitar una muerte en un periodo de tiempo de dos años. Las diferencias en los resultados de estos dos estudios se explican en la selección de los candidatos a la intervención. En el estudio MITRA FR se evaluaron pacientes más enfermos, con mayor dilatación del ventrículo izquierdo, mientras que en el COAPT los pacientes se seleccionaron cuando aún no estaban tan dilatados, en el momento ideal de la enfermedad para poder beneficiarse de la intervención.
Respecto a los estudios sobre dispositivos usados para la insuficiencia tricúspide, son pocos los que utilizan el clip mitral en posición tricúspide y el sistema FORMA, que se coloca sobre un riel que se adosa a la pared del ventrículo derecho reduciendo la insuficiencia. Estas terapias pudieran considerarse como una opción de manejo avanzado.
Papel de EnfermeríaEl proceso de enfermería en la práctica asistencial es una herramienta metodológica que permite suministrar cuidados de forma racional, lógica y sistemática. Se centra en las respuestas humanas y proporciona al profesional de Enfermería una oportunidad de identificar las necesidades del paciente y su familia, a fin de establecer el plan de cuidado; en este contexto, el personal de enfermería participa en el proceso salud/enfermedad del paciente con falla cardiaca con un gran impacto en la adherencia al tratamiento y calidad de vida del paciente y su familia85.
Los pacientes con falla cardiaca estadio D presentan síntomas múltiples y refractarios, variadas comorbilidades, reingresos tempranos y complicaciones asociadas a falla cardiaca y sus comorbilidades. Dado el curso de la enfermedad se hacen necesarios los controles continuos, además del seguimiento estricto de las pautas de tratamiento y cuidado, al igual que de enfermería86.
La valoración a cargo de Enfermería desempeña un papel significativo en la identificación de necesidades del paciente y del grupo familiar o cuidadores, limitantes del entorno psicosocial tales como disponibilidad o no de un cuidador permanente, condiciones de la vivienda, acceso a los servicios de salud y acceso a sistemas de comunicación en la opción de tratamiento que se ha analizado, discutido y aprobado por todo el equipo de falla cardiaca, el paciente y su familia ya sea trasplante cardiaco, dispositivo de asistencia ventricular o paliación87.
Para la valoración de pacientes con falla cardiaca avanzada se han identificado diferentes instrumentos (cuestionario, escala o prueba funcional) que pueden aplicarse y relacionarse con la valoración de Enfermería y con una encuesta sociodemográfica88.
La herramienta de Enfermería que permite identificar las necesidades de pacientes es la valoración por dominios de la NANDA (su sigla en inglés por North American Nursing Diagnosis Association), que incluye promoción de la salud, nutrición, eliminación, actividad y reposo, percepción, autopercepción, afrontamiento, principios vitales, rol y relaciones, sexualidad, confort y seguridad en cada una de las fases del proceso / enfermedad.
El plan de cuidado con las intervenciones de enfermería depende de la opción seleccionada para el paciente, teniendo en cuenta las siguientes actividades:
- 1.
Seguimiento y monitorización del tratamiento médico óptimo, especialmente cuando se inicie un nuevo fármaco.
- 2.
Educación y entrenamiento del paciente en el conocimiento de su diagnóstico, signos y síntomas, tratamiento, autocuidado, signos de alarma y medicamentos.
- 3.
Control periódico presencial o por telemedicina (vía telefónica o vía web)89.
- 4.
Liderazgo del hospital de día con una respuesta proactiva a la descompensación del paciente y vigilancia del tratamiento (ciclos de inotropía, terapia diurética, hierro parenteral)90.
- 5.
Cuidado sobre el uso e interpretación de los dispositivos implantados o externos.
- 6.
Cuidados en el manejo de tratamiento paliativo91.
- 7.
Cuidados en el manejo del paciente trasplantado (inmunosupresión, reintegración social, entre otros)92.
- 8.
Cuidados en el manejo de dispositivo de asistencia ventricular I/D (anticoagulación, alarmas de dispositivo, curaciones, entre otros)87.
- 9.
Ser el puente para la intervención de otros profesionales del equipo multidisciplinario4.
Una vez recogidos los datos más relevantes de la evaluación de enfermería, se plantean los diagnósticos de enfermería relacionados con el proceso de la enfermedad en el estadio D de la falla cardiaca y los ejes temáticos a desarrollar (tabla 11).
Proceso de enfermería
| Diagnóstico de Enfermería (NANDA) | Intervenciones de Enfermería (NIC) | Resultados esperados (NOC) |
|---|---|---|
| Gestión ineficaz de la propia salud (00078)Déficit de conocimientos (126) | Enseñanza proceso de la enfermedadIdentificación de riesgos (6610) | Conocimiento proceso de la enfermedad (1803) |
| Exceso del volumen de líquidos (026) | Manejo de líquidos y electrolitos (2080)Administración de medicación (2300) | Severidad de la sobrecarga de líquidos (0603) |
| Patrón respiratorio ineficaz (032) | Monitorización de los signos vitales (6608)Mejoría del sueño (1850)Administración de medicación (2300)Técnicas de relajación (5880) | Estado respiratorio (0415)Conservación de la energía (002) |
| Deterioro de la movilidad física (085) | Terapia de ejercicios (221)Ayuda con el autocuidado (1800) | Movilidad (208) |
| Riesgo de disminución de la perfusión tisular cardíaca (0200) | Administración de medicación (2300)Manejo de líquidos y electrolitos (2080)Oxigenoterapia (3320)Vigilancia (6650) | Perfusión tisular cardíaca (405) |
| Intolerancia a la actividad (092) | Cuidados cardíacos: Rehabilitación (4046) | Tolerancia a la actividad (005) |
| Desesperanza (0124) | Apoyo emocional (5270)Asesoramiento (5240)Disminución de la ansiedad (5820) | Aceptación del estado de salud (1300)Esperanza (1201) |
El profesional de enfermería debe tener en cuenta los siguientes ejes temáticos93: curso de la falla cardiaca, pronóstico y riesgo, monitorización de síntomas y autocuidado, tratamiento farmacológico y no farmacológico, dispositivos implantables, monitorización del peso, calidad de vida y estado funcional, factores psicosociales, actividad sexual y final de vida94.
Las intervenciones de Enfermería se deben enfocar en proporcionar herramientas de autocuidado para permitir la participación activa del paciente y su familia en el proceso de favorecer su calidad de vida, así como la sobrevida, minimizando los reingresos por descompensación y las consultas tardías, de acuerdo con la opción de tratamiento seleccionada en los pacientes con falla cardiaca avanzada93–95.
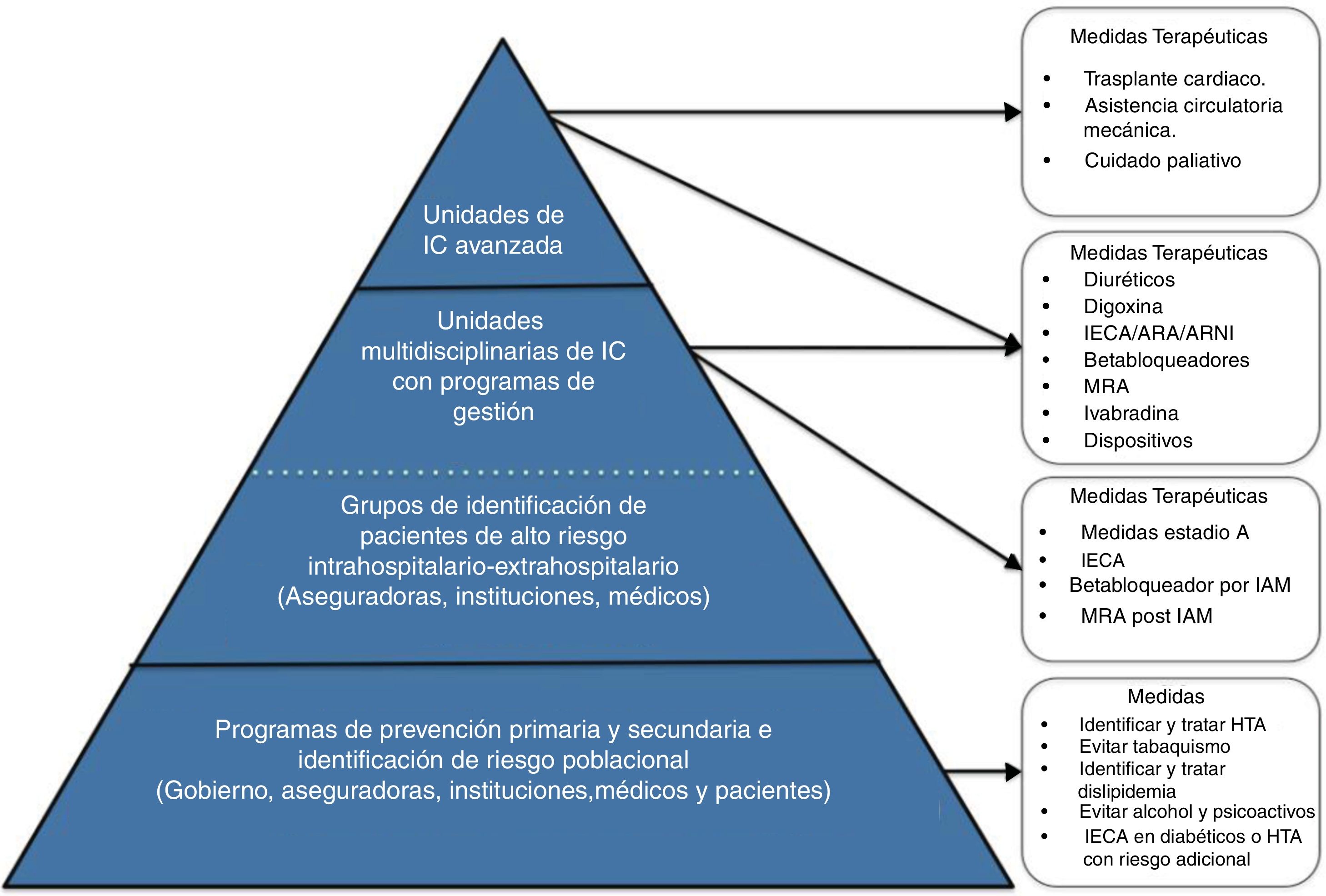
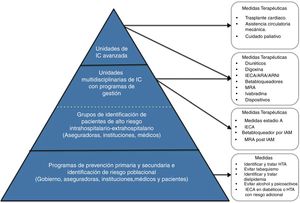
Unidades de falla cardíaca en Colombia: estructura organizacionalLa falla cardiaca avanzada es una enfermedad que plantea un reto para los sistemas de salud, de ahí que su manejo requiera un sistema integrado para lograr el éxito de su tratamiento. El capítulo de Falla Cardíaca, Trasplante Cardíaco e Hipertensión Pulmonar de la Sociedad Colombiana de Cardiología y Cirugía Cardiovascular ha realizado un trabajo continuo desde hace más de diez años para estandarizar el seguimiento y tratamiento de estos pacientes. A continuación, se describe el modelo de atención en tres niveles de complejidad (fig. 5) para el sistema de salud colombiano93. Este esquema se basa en el modelo Kaiser permanente96 y en el concepto de Redes Integradas de Servicios de Salud97,98.
Nivel de atención 1: atención básicaPoblación objetivo: está dirigido a los pacientes que se encuentran en riesgo de sufrir falla cardiaca (estadios ACC/AHA A y B) y al seguimiento de aquellos con falla cardiaca estable bajo un protocolo de búsqueda establecido y en un programa de redes integradas de atención en salud.
Actividades: el nivel básico de atención será clave en las estrategias de promoción y prevención para la aparición de nuevos casos de falla cardiaca y para el mantenimiento de la estabilidad clínica de los pacientes con falla cardiaca que hayan sido dados de alta por mejoría clínica o recuperación de los centros de atención de segundo o tercer nivel.
En este nivel de atención 1 se continuará el manejo instaurado y se vigilarán los signos o síntomas de deterioro o de alarma que impliquen remisión nuevamente a una atención en niveles especializados o de mayor complejidad.
Personal: médicos generales, médicos familiares, médicos internistas y enfermeras capacitadas para manejo de programas integrados de atención en salud que realizan la consulta de alto riesgo cardiovascular en las diferentes entidades e instituciones de salud del país.
Nivel de atención 2: atención intermediaProgramas de atención ambulatoria que, en estrecha relación con el área hospitalaria y la red de atención primaria, cumplen con la atención integral del paciente con falla cardiaca a través de citas prioritarias, seguimiento estrecho presencial y telefónico, educación y participación en la toma de decisiones multidisciplinarias para definir intervenciones complejas y/o de alto costo.
Población objetivo: pacientes con diagnóstico de falla cardiaca confirmada (estadio ACC/AHA C) que tengan la capacidad por sí mismos o por sus cuidadores de continuar un tratamiento estructurado y especializado.
Actividades:
- •
Estandarización del manejo médico óptimo con metas basadas en guías
- •
Programa de educación para los pacientes y sus familias
- •
Citas de optimización de manejo médico
- •
Acceso a la atención a través de consultas prioritarias
- •
Opciones de manejo temprano de descompensaciones (hospital de día, atención domiciliaria, observación en urgencias)
- •
Seguimiento telefónico o telemedicina
- •
Trabajo conjunto con el grupo de Electrofisiología para seleccionar y optimizar los candidatos a terapia de resincronización cardiaca o cardiodesfibrilador implantable
- •
Acceso a opciones de tratamiento avanzadas en la propia unidad o en conexión con una unidad de nivel de atención 3
Personal: Cardiología, Enfermería, Nutrición, Psicología y Rehabilitación cardíaca.
Nivel de atención 3: atención avanzadaSon unidades que se encuentran siempre en hospitales de cuarto nivel y cuentan con terapias avanzadas para falla cardiaca con capacidad de trasplante cardiaco, dispositivo de asistencia ventricular o cuidados paliativos. Para que un paciente acceda a este nivel de atención, generalmente debe haber sido evaluado y tratado en el nivel 2.
Población objetivo: pacientes con diagnóstico de falla cardiaca avanzada persistente y refractaria.
Actividades:
- •
Evaluación de los criterios de elegibilidad o contraindicaciones para trasplante cardiaco y dispositivo de asistencia ventricular y valoración pronóstica
- •
Discusión de casos individuales en comité de trasplante cardiaco
- •
Clasificación del paciente como candidato para terapias avanzadas (trasplante cardiaco o dispositivo de asistencia ventricular); la unidad realizará el seguimiento previo, durante y posterior a la intervención
- •
Seguimiento por el programa complementario de cuidados paliativos en caso de que el paciente no sea candidato a terapias avanzadas (trasplante cardiaco o dispositivo de asistencia ventricular)
Personal: cardiólogos especializados en falla cardiaca, cirujanos cardiovasculares certificados en trasplante cardiaco, personal de enfermería, perfusionistas especializadas en dispositivo de asistencia ventricular y grupo de cuidados paliativos.
El cuidado de los pacientes con falla cardiaca requiere de un sistema integrado en red, en el que sea posible brindar una referencia rápida y apropiada desde el diagnóstico (nivel 1) hasta el tratamiento farmacológico, dispositivos de alto voltaje y seguimiento multidisciplinario en Clínica de falla cardiaca (nivel 2), y que ofrezca la opción de terapias avanzadas, como dispositivo de asistencia ventricular, trasplante cardiaco o cuidados paliativos (nivel 3).
Editor principalJuan Esteban Gómez-Mesa - Colombia
Comité editorClara Saldarriaga – Colombia
Héctor Ventura – Estados Unidos
José R. González Juanatey - España
Luis Eduardo Echeverría - Colombia
Manuel Gómez Bueno – España
Marisa Crespo Leiro - España
Nicolás Manito – España
Conflicto de interesesNinguno.